Presión arterial y flujo sanguíneo
Resumen breve
La sangre es el componente esencial para el aporte de oxígeno a los distintos órganos. Su movimiento es el flujo sanguíneo (Q) y se define como la cantidad de sangre (volumen) por unidad de tiempo. Sin embargo, este no es uniforme en todo el organismo ya que, como norma general, se modificará conforme a las demandas circunstanciales de cada tejidoÍndice de contenidos
Introducción
La sangre es el componente esencial para el aporte de oxígeno a los distintos órganos. Su movimiento es el flujo sanguíneo (Q) y se define como la cantidad de sangre (volumen) por unidad de tiempo. Sin embargo, este no es uniforme en todo el organismo ya que, como norma general, se modificará conforme a las demandas circunstanciales de cada tejido
El flujo sanguíneo se rige por las leyes de la hidrodinamia y se direcciona desde un lugar de mayor presión a uno de menor presión, es decir, a través de un diferencial de presión (P). Esto funciona de forma muy parecida a la apertura de los grifos de una casa, donde accionando instrumentos de apertura o cierre se producen diferentes P permitiendo que el agua fluya hacia el lavabo, la bañera o el inodoro. En el organismo, estos instrumentos se denominarán resistencias vasculares y serán discutidos más adelante.
La sangre se mueve desde la aorta hacia las cavas, pero para que los tejidos puedan establecer eficientemente los cambios de Q y, consecuentemente, el acople consumo-entrega de oxígeno, la sangre debe estar con una presión lo suficientemente alta como para asegurar la autorregulación propia de cada órgano. De manera similar, si la reserva de agua de una casa no estuviese en altura o presurizada, difícilmente se podría modificar la intensidad de una ducha.
Desde el punto de vista de la física, la presión es la fuerza distribuida sobre un área (P= f/A). Si el volumen sanguíneo no se modifica, de esta fórmula se puede desprender que la presión podrá aumentar si la fuerza se incrementa (aumento de la contractilidad cardíaca) y/o si el área disminuye (vasoconstricción). El mecanismo de vasoconstricción produce un incremento de la resistencia al Q, promoviendo la disminución del mismo; caso contrario, la vasodilatación disminuye la resistencia y aumenta el Q. De esta manera se puede aplicar la ley de Poiseuille, según la cual, en un tubo con flujo laminar, la resistencia viene determinada por la longitud del tubo, la viscosidad de la sangre y la inversa del radio del tubo elevado a la cuarta potencia. Así pues, el radio del vaso (área vascular) es el factor más determinante de la resistencia y que, además, puede cambiar significativamente con rapidez y eficiencia.
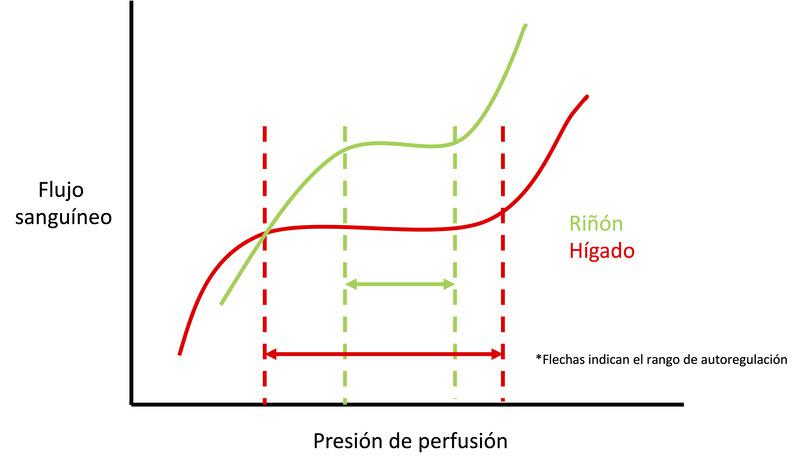
Las resistencias varían de un lecho vascular a otro y los factores son el tamaño del lecho y la densidad de vasos. Los lechos esplácnico y muscular presentan en general resistencias bajas. Sin embargo, cuando los Q se relacionan con la masa de tejido, el tejido muscular tiene una resistencia de base alta porque el Q por masa es bajo. La importancia de esto es que el cambio en el Q en diferentes lechos vasculares con una caída de la presión arterial depende de la pendiente de la línea presión-flujo en esa región (Figura 1). Cuanto más pronunciada sea la pendiente de la relación, mayor será la caída del flujo para una disminución determinada de la presión. El riñón comienza con una relación presión-flujo muy pronunciada, ya sea evaluada por la masa o como proporción del gasto cardíaco total.
Presión arterial
La presión debe medirse en relación con un valor de referencia que se define como cero. En la mayoría de los casos, la referencia es la presión atmosférica, ya que es la que rodea al cuerpo. La presión en el interior de un recipiente en relación con la presión exterior resulta en la presión que distiende la pared de ese recipiente y se denomina presión transmural. Por ejemplo, si la presión atmosférica exterior se denomina cero y la presión dentro de la aorta es de 120/80 mmHg, la presión transmural es simplemente 120/80 mmHg. Sin embargo, como la presión atmosférica (nivel del mar) es de 760 mmHg, la presión a través de la pared arterial en relación con la presión cero absoluta (no real) sería de 880/840 mmHg.
El sistema arterial, a lo largo de su trayecto, no presenta variaciones relevantes en lo concerniente a la presión arterial media (PAM). Esto ocurre, principalmente, porque no se generan grandes modificaciones en la resistencia de este sistema. De esta manera se puede medir la presión en la arteria metatarsiana dorsal como un estimador fehaciente de la presión arterial media general (incluso aórtica). Por el contrario, a nivel arteriolar y precapilar, la disminución o el incremento del área vascular son quienes gobiernan la resistencia local y sistémica. Por lo tanto, la microcirculación es considerado el factor área de la fórmula P= f/A. Como resultado final, se puede decir que la microcirculación será quien modificará el Q dentro de cada tejido, siempre y cuando la presión de ingreso a ese tejido sea la adecuada. Es aquí donde nace el concepto de presión de perfusión (Ppf), que no es ni más ni menos que el P en el tejido de interés.
Fisiológicamente existe un P muy alto entre la presión arterial y venosa, a tal punto que este paso arterio-venoso se ha dado a llamar cascada vascular, dando a entender que la sangre “se vuelca” sobre el lecho venoso. Por lo tanto, se puede asumir tal cual ocurre entre una cascada y el río, que la altura (presión arterial) no influye de manera significativa sobre la corriente del río, simplemente mantiene su caudal.
Se planteará entonces que el retorno venoso hacia el corazón se rige por un P propio que se da entre las venas y la aurícula derecha, sin injerencia relevante de la presión arterial. El sistema venoso posee una presión definida como presión media de llenado sistémico (pmlls) que es más alta que la presión en aurícula derecha, estimada a partir del valor de presión venosa central (PVC).
Si se analiza la relación del flujo con la presión arterial en cada tejido y a partir de la extrapolación al flujo 0 de esta relación, se puede ver que existe una presión mínima donde el flujo cesará (“cascada sin agua”) y se ha dado a llamar presión crítica de cierre (pcc). En un caso hipotético de incremento generalizado y severo de las necesidades de oxígeno, existirá una disminución notable de las resistencias vasculares en búsqueda de mayor Q que, si no se acompañan de una presión arterial normal, se puede llegar a alcanzar valores de pcc y, por ende, una complicación hemodinámica muy seria. Los estudios en animales sugieren que la pcc media para toda la circulación es de unos 30-45 mmHg, aunque pareciera ser que esta difiere entre los lechos vasculares.
Si bien la PVC o mejor dicho la pmlls, tal como se mencionó anteriormente, pareciera no ser un factor muy relevante a la hora de estimar la presión de perfusión, hay que ser consciente que en caso de PAM muy bajas y PVC muy altas, podría acercarse a la pcc. Sin embargo, esto no suele ser lo más común. Por el contrario, existe una situación que se debe considerar más allá del P, que son las condiciones del intersticio o cavidades (torácica, abdominal, craneana, etc.). Aquí se retoma el concepto de transmuralidad, donde la presión interna debe ser relacionada a la presión que existe en el exterior del vaso sanguíneo. De esta manera, cuando se quiere evaluar la Ppf a nivel cerebral se debe considerar la presión intracraneana o, lo mismo, en el lecho esplácnico en caso de hipertensión abdominal (laparoscopia, ascites, etc.). De esta manera, si nuestra PAM es normal y no hay aumentos en la PVC, aun así, puede acercarse a la pcc por un incremento de la presión intersticial y por ende por una caída de la presión transmural.
Tres tipos de energía se producen con la presión arterial: elástica, cinética y gravitatoria
La resistencia al estiramiento de una sustancia se denomina elastancia y su inversa, la facilidad de estiramiento, distensibilidad. La energía elástica es, con mucho, el componente más importante en la presión arterial. El volumen del interior de las estructuras vasculares estira las paredes elásticas y produce una fuerza de retroceso que, en función de la elastancia del vaso, genera una presión determinada. Los materiales que componen las estructuras vasculares no son homogéneos, por lo que la relación volumen-presión de los vasos arteriales no es lineal y presenta una curvilinealidad y, a su vez, se va modificando conforme al paso de los años.
La segunda fuerza que determina la presión arterial es la energía cinética, que se debe a la velocidad de la sangre que fluye. La energía cinética es igual a la mitad de la masa de la sangre (calculada a partir del volumen por la densidad), multiplicada por el cuadrado de la velocidad. El producto de la velocidad de la sangre y la sección transversal de un vaso resulta en el Q. Cabe mencionar que la energía cinética representa sólo un 3 % de la fuerza total en el pico de presión sistólica normal, pero constituye una proporción mayor en las grandes venas y en la presión pulmonar, donde la tensión de pared es menor.
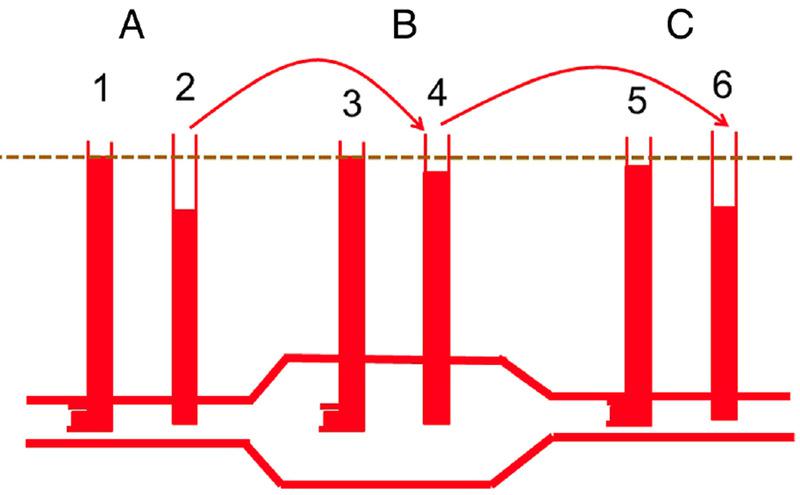
La energía cinética puede producir algunos resultados confusos, como que la sangre parezca fluir de una presión más baja a una más alta. Esto ocurre porque el flujo se basa en la diferencia total de energía a través de un sistema, y no sólo en la diferencia de energía elástica. Ejemplos de ello se producen cuando las secciones de los vasos se ensanchan o se estrechan. La Figura 2 muestra un ejemplo de dilatación aneurismática de un vaso. La presión se mide con un catéter orientado hacia el flujo, como es habitual en la mayoría de los catéteres arteriales, y otro catéter con una abertura perpendicular al flujo (presión lateral). El flujo en L/min debe ser el mismo en cada sección del vaso, ya que lo que entra debe salir para mantener la conservación de la masa. Sin embargo, en la región de la dilatación del aneurisma, donde el diámetro es mucho mayor, la velocidad es menor porque el área de la sección transversal cambia con el cuadrado del radio. La energía no puede crearse ni destruirse, por lo que la disminución de la energía cinética se convierte en energía elástica. Esto aumenta la presión en la pared de la zona dilatada y conduce a una mayor dilatación y a un mayor aumento de la presión en la pared ya debilitada hasta que se estira a un valor crítico y se rompe. En el segmento del vaso distal al aneurisma, la velocidad vuelve a ser mayor y la energía elástica se convierte de nuevo en energía cinética, de modo que parece que la sangre fluye de una zona de menor presión a una de mayor presión cuando se utiliza un catéter orientado hacia el flujo.
Es probable que la energía cinética desempeñe un papel más importante en los pacientes sépticos con un gasto cardíaco elevado (fase hiperdinámica), ya que hay un mayor componente cinético y, al mismo tiempo, menor energía elástica debido a la vasodilatación, lo que producirá una diferencia entre la presión medida con catéteres arteriales (presión invasiva) y la presión medida con un dispositivo oscilométrico (no invasivo), el cual sólo mide el componente elástico lateral de la energía.
Además, la disminución de la fuerza elástica lateral podría alterar las respuestas miogénicas, mientras que el aumento de la velocidad las respuestas endoteliales (“shear stress”) y por lo tanto, cambios en la adecuación del flujo a las necesidades metabólicas del tejido. Ambos conceptos se desarrollarán más adelante.
El componente de energía gravitacional es importante cuando la presión se mide en sitios anatómicos de distinta altura en relación a un punto de referencia, por esto es que es esencial que el nivel de referencia esté estandarizado. Como norma general se plantea que el sitio de medición de presión se encuentre a la altura del corazón. Cuando los animales están anestesiados es probable que esto sea despreciable siempre y cuando el decúbito alinee corazón y sitios de medición.
Autorregulación de la presión arterial y el flujo
La presión arterial se obtiene a partir del gasto cardíaco y la resistencia vascular sistémica. El organismo, tal como se mencionó al comienzo del artículo, debe asegurar un intervalo de presión de perfusión que permita autorregular el Q. Debido a los posibles cambios en la presión arterial existen cuatro mecanismos generales que tienden a mantener el Q, siempre a través del control de la resistencia vascular y las presiones críticas de cierre regionales. Estos mecanismos son metabólicos, neuro-humorales, miogénicos y procesos mediados por el Q. Debe aclararse que estos difieren entre los lechos vasculares y por lo tanto no pueden generalizarse.
La resistencia vascular sistémica domina la regulación normal de la presión arterial. Esta se produce en primer lugar a través de mecanismos neuronales que proporcionan retroalimentación aferente a las regiones cardio-inhibitorias y cardio-estimuladoras del sistema nervioso central que regulan el tono vascular enviando señales eferentes por vías parasimpáticas/simpáticas, y en cierta medida a través de señales humorales, para mantener la presión establecida centralmente (mecanismo neuro-humoral).
Por otro lado, el mecanismo miogénico hace que el músculo liso arteriolar se contraiga o relaje en base a la tensión de la pared vascular. Se caracteriza por una disminución del diámetro del vaso tras un aumento de la presión transmural y por un aumento del diámetro del vaso tras una disminución de esta presión.
La relación del flujo sanguíneo con las necesidades metabólicas de todo el organismo está dominada por los tejidos que pueden aumentar en gran medida sus necesidades de oxígeno, como son el músculo esquelético y el cardíaco. En estos tejidos, al igual que en todo el organismo, existe una relación lineal entre el flujo sanguíneo y el consumo de oxígeno, lo que indica que el principal regulador sea la actividad metabólica. Incluso, pudiendo anular la vasoconstricción neuro-humoral. Sin embargo, las dos variables cardiovasculares dominantes, la presión arterial sistémica y el gasto cardíaco en relación con las necesidades metabólicas, pueden entrar en conflicto. Una caída de la presión arterial con un gasto cardíaco normal requiere un aumento de la resistencia vascular sistémica para restablecer la presión arterial, aunque esto aumentaría la poscarga del ventrículo izquierdo, y por ende una disminución del gasto cardíaco. De esta manera, la presión se restablecerá, pero no así la perfusión tisular. Aún peor, si la vasoconstricción incluye al lecho venoso este aumentaría su resistencia, consecuentemente disminuiría la precarga y, por ende, el gasto cardíaco.
Por el contrario, si la caída de la presión arterial se debe a una disminución del gasto cardíaco, un aumento de la resistencia arterial en todos los lechos vasculares nuevamente restablecerá la presión arterial, pero no los flujos sanguíneos de los órganos regionales. La expectativa cuando se utiliza un fármaco vasoconstrictor puro (por ejemplo, fenilefrina) es que la actividad metabólica local anule el efecto constrictor del fármaco en los lechos vasculares críticos, como el cerebro y el corazón, de modo que estas regiones conserven un adecuado flujo. El grado en que esto ocurra dependerá probablemente de la capacidad de estas regiones para modificar el tono vascular a través de sus señales locales.
En este contexto, la estrategia clínica más adecuada ante la caída de la perfusión tisular, sería aumentando el gasto cardíaco, sin un cambio indiscriminado de la resistencia sistémica y sin sobrecarga de los mecanismos regionales que ajustan el flujo a las necesidades tisulares. De manera fisiológica, la vasoconstricción inducida por barorreceptores es mayor en los lechos vasculares periféricos, principalmente tejido muscular, que en los centrales como el esplácnico, redireccionado el flujo sanguíneo justamente hacia este lecho (mecanismo de P). Si esto quedara así, se provocaría una disminución del gasto cardíaco y un empeoramiento de la presión arterial, ya que la volemia se acumularía en la vasculatura esplácnica. Sin embargo, el efecto de esta redistribución se compensa con una disminución de la capacitancia en el lecho esplácnico (reclutamiento de volumen no estresado en volumen estresado) produciendo un aumento de la pmlls, y por ende un aumento del P para el retorno venoso. Pareciera ser que el uso de las drogas vasoconstrictoras también afecta a la vasculatura periférica más que al lecho esplácnico, aunque a dosis altas la diferencia puede dejar de ser funcional y alterar la distribución normal de las resistencias.
Si el vasoconstrictor no puede reclutar más volumen no estresado porque no hay reservas suficientes, y contrae la resistencia venosa, el gasto cardíaco y la perfusión tisular disminuirán.
El mecanismo mediado por flujo se trata de un proceso de retroalimentación positiva que disminuye la resistencia aguas abajo cuando aumenta el flujo. Está mediada principalmente por la liberación de óxido nítrico (NO) a través del efecto de la tensión tangencial (shear stress) en las células endoteliales vasculares. Este mecanismo se descontrolaría si no ocurriera algo más, porque la disminución de la resistencia aguas abajo provocaría más flujo, más liberación de NO, más flujo, y así sucesivamente. Es típico de la naturaleza conducir con el pie en el acelerador y en el freno al mismo tiempo; como por ejemplo en las actividades nerviosas simultáneas parasimpática y simpática y los centros cardio-inhibitorios y estimuladores en el cerebro. En este caso, los frenos son los mecanismos miogénicos locales y neuro-humerales centrales, así como las necesidades metabólicas locales. La ventaja de este proceso es que permite una adaptación rápida al aumento de las necesidades de flujo y un ajuste preciso a la actividad metabólica local. La dilatación mediada por flujo se pierde cuando el endotelio se daña en la enfermedad vascular.
Para finalizar, se debe mencionar que existen otros componentes muy relevantes a la hora de caracterizar a la presión y el flujo arterial, como la serie de variables relacionadas con la elastancia de la pared aórtica, el volumen de sangre en la aorta, la frecuencia cardíaca y la proporción de tiempo en sístole y diástole.
Conclusión
La presión arterial es una variable fundamental para el correcto establecimiento de la autorregulación del flujo en los distintos órganos y, por lo tanto, para el acople de las necesidades metabólicas. Los conceptos generales vertidos en este artículo buscan comprender la relación presión y flujo sanguíneo para luego poder diseñar estrategias que permitan mantener los sistemas fisiológicos activos en los tejidos. Es fundamental reconocer las condiciones propias de cada paciente para amoldar la presión arterial y por ende la presión de perfusión en los tejidos. Comprender que no existen números mágicos permitirá individualizar los objetivos terapéuticos de cada uno de los pacientes.
Bibliografía
- Acierno MJ, Brown S, Coleman AE, Jepson RE, Papich M, Stepien RL, Syme HM. ACVIM consensus statement: Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. J Vet Intern Med. 2018 Nov;32(6):1803-1822.
- Kato R, Pinsky MR. Personalizing blood pressure management in septic shock. Ann Intensive Care. 2015 Dec;5(1):41.
- Magder S. The meaning of blood pressure. Crit Care. 2018 Oct 11;22(1):257.
- Magder S. Volume and its relationship to cardiac output and venous return. Crit Care. 2016;20:271.
- Maas JJ, de Wilde RB, Aarts LP, Pinsky MR, Jansen JR. Determination of vascular waterfall phenomenon by bedside measurement of mean systemic filling pressure and critical closing pressure in the intensive care unit. Anesth Analg. 2012;114:803–10.
 by Multimédica
by Multimédica