Interpretación de resultados en el laboratorio veterinario: consejos para los auxiliares
Resumen breve
Esta guía práctica ofrece consejos claros orientados a ayudar a comprender cómo aspectos tan sencillos como el calibre de la aguja, el tipo de tubo, el volumen mínimo o la precisión al aplicar gotas de orina en la tira reactiva, pueden alterar resultados clave en los análisis de sangre, orina y heces, y a interpretar los resultados obtenidos en caso de incidencia.Índice de contenidos
Resumen
En el día a día de un centro veterinario, el auxiliar es el hilo conductor entre el paciente y el informe de laboratorio. Desde la toma de muestra hasta la interpretación de cifras y gráficos, cada paso influye en el diagnóstico final.
Esta guía práctica ofrece consejos claros orientados a ayudar a comprender cómo aspectos tan sencillos como el calibre de la aguja, el tipo de tubo, el volumen mínimo o la precisión al aplicar gotas de orina en la tira reactiva, pueden alterar resultados clave en los análisis de sangre, orina y heces, y a interpretar los resultados obtenidos en caso de incidencia.
Se describen las tres etapas del proceso: preanalítica, control de interferentes más comunes, analítica y posanalítica. Se incluyen además consejos prácticos para resolver estas interferencias habituales, desde lipemia hasta alteraciones por transporte inadecuado. Se repasan los perfiles más habituales como son el de función hepática, renal, metabólico y hormonal y se presentan en formato de consulta rápida.
Asimismo, se detallan otros procedimientos laboratoriales, con recomendaciones de conservación y buenas prácticas. Numerosos artículos científicos sobre patología clínica, medicina interna veterinaria, hematología exótica y nefropatías avalan cada sección, así como otros estudios recientes para convertir esta guía en una herramienta de referencia.
Introducción
A menudo oímos por parte de los veterinarios que se ha enviado una muestra al laboratorio clínico de referencia, pero el resultado obtenido ha sido diferente al esperado: animales sanos con alteraciones en las pruebas bioquímicas, anemia grave no confirmada por la evaluación de las membranas mucosas, trombocitopenia improcedente, y varios otros resultados divergentes que pueden comprometer el diagnóstico final del paciente.
Ante esta situación, se concluye que el análisis clínico es soberano. De hecho, lo es. Cuando un veterinario solicita análisis clínicos, confía en el auxiliar veterinario para obtener muestras de calidad y transformar datos brutos en información útil para realizar un buen diagnóstico de nuestros pacientes. Como un instrumento afinado en manos expertas, un laboratorio veterinario ofrece mejores resultados si el proceso en clínica es riguroso y se trabaja siguiendo unas pautas de buenas prácticas. Se debe tener en cuenta que algunos de los errores que podrían provocar discrepancias en los resultados, tal vez han sido causados en la propia clínica: en el momento de la recolección de la muestra, durante el almacenamiento o bien el transporte de esta.
Esta guía describe las tres fases del flujo de trabajo –preanalítica, analítica y posanalítica– e integra consejos prácticos y ejemplos reales para asegurar la fiabilidad del informe final de resultados.
Fase preanalítica
Para empezar, es importante dejar un punto claro: aproximadamente el 70 % de los resultados inconsistentes se deben a errores en esta fase, por lo tanto, una muestra de baja calidad en origen dará lugar a resultados dudosos. El esquema desde que llega un paciente a la clínica o al hospital incluye su preparación inicial, la toma de muestra y el posible transporte a laboratorio externo, donde se procesan las muestras si no se analizan en el propio centro veterinario. El tipo de tubo, la identificación clara y el método de envío condicionan notablemente la calidad de los datos obtenidos. Una toma de muestra bien ejecutada garantiza la integridad y funcionalidad de las muestras.
- Toma de muestra: elegir la aguja adecuada según el paciente y el tipo de vía: amarilla 24 G para felinos, animales pequeños y aves; azul 21 G para perros pequeños y medianos; verde 18 G para perros grandes o extracción en vena yugular; y rosa 16 G en caso de animales mayores o cuando se requiera un flujo alto de sangre. Evitar calibres grandes en pacientes pequeños para prevenir hemólisis o colapso vascular. Recordar el uso del tubo contenedor apropiado (suero, plasma, sangre entera). Se recomienda evitar exceso de alcohol en la punción para prevenir hemólisis de la muestra y mezclar el contenido invirtiendo suavemente el tubo. Utilizar siempre puntas monodosis en pipetas automáticas para evitar contaminaciones.
- Volúmenes mínimos recomendados: el volumen dependerá del tamaño de nuestro paciente, del tipo de vía seleccionada, del tipo de análisis que vayamos a realizar, y de nuestro analizador; pero por norma general se aconseja obtener al menos 1 ml de suero o plasma en perros y gatos y 0.3-0.5 ml en exóticos. Si tenemos poca muestra o resulta de difícil obtención y sospechamos que se requiere realizar análisis posteriores, es posible congelarla, pero se recomienda siempre evitar hacer muchos ciclos de congelación-descongelación de estas para evitar su degradación. Por lo que, para almacenarlas, es conveniente hacer alícuotas de trabajo y así evitar tener que descongelar toda la muestra de una vez y volver a congelarla posteriormente, ya que algunos resultados podrían verse alterados.
- Interferentes más comunes: lipemia, hemólisis, formación de coágulos, son las principales alteraciones encontradas en muestras recogidas en clínica veterinaria. También aparece como efecto negativo la ictericia, que más que ser debida a un error de preanalítica, depende de la patología de paciente, pero es un factor para tener en cuenta cuando se analicen sus muestras (Figura 1). A continuación, se analizan de forma individual con detenimiento:
- Hemólisis: provocada por diferentes causas, como manipulación brusca al obtener la muestra, torniquete prolongado o calibre de aguja inapropiado, entre otros. Atención porque es posible tener hemólisis por causas in vitro e in vivo. En el primer caso, son algunas de las ya mencionadas, pero en el caso de in vivo, se debe tener en cuenta que ciertas patologías provocadas por enfermedades de transmisión vectorial, entre otras, pueden causar anemias hemolíticas y, por tanto, hemólisis en las muestras una vez extraídas.
- Lipemia: frecuente en pacientes que no acuden a la clínica en ayunas, lo cual es habitual; muestra una turbidez que eleva falsamente algunos analitos. También puede provocar hemólisis por fractura de los eritrocitos, que desprenden la hemoglobina contenida al suero, así, existiría doble interferente.
- Ictericia: signo clínico que colorea la muestra con tonos amarillentos y altera mediciones ópticas, variando los resultados finales.
- Drogas: algunos anestésicos, como el halotano, y antibióticos o medicamentos como los corticoides pueden interferir con los reactivos de análisis de las muestras, dando resultados no esperados o incoherentes.
- Coágulos: se recomienda siempre mezclar suavemente y descartar la muestra si se observan microcoágulos, ya que estos además de retener plaquetas, atrapan también otras células, como los glóbulos rojos y leucos. Importante: nunca extraer los coágulos de forma manual, y respetar el ratio de muestra/anticoagulante que marca cada fabricante y trabajar con tubos apropiados para el volumen de muestra que se recolectará.

Figura 1. Ejemplo de la realidad de una clínica veterinaria en el día a día: muestras ictéricas, hemolizadas e incluso lipémica y hemolizada a la vez (imagen cedida por Salceda Vetpatogenius).
- Almacenamiento: la conservación de la muestra incluye el periodo comprendido entre la obtención de esta y su análisis en el laboratorio, ya sea el del centro veterinario o bien el laboratorio externo de referencia. Muestras sanguíneas almacenadas por un largo periodo de tiempo presentan alteraciones como disminución de plaquetas, hemólisis y otros cambios que afectan de forma severa al hematocrito, así como a la medición de algunos analitos bioquímicos, entre otros. En lo que se refiere a muestras de orina y/o heces, la descomposición de las muestras es un aspecto crítico. Ambas muestras deben ser procesadas lo más rápido posible una vez el tutor la entregue en la clínica. Si se retrasa su análisis, los resultados pueden verse afectados por la descomposición bacteriana, especialmente en orinas que no se conservan a temperatura adecuada. En el caso de las heces, un retraso puede alterar la forma y/o la viabilidad de los parásitos presentes.
- Orina y heces: durante la fase preanalítica, es fundamental garantizar que ambos tipos de muestra sean adecuadamente recogidas y transportadas por parte de los tutores de los pacientes. Un problema común en estos análisis es la contaminación de la muestra. En el caso de la orina, si no se recolecta en condiciones de higiene adecuadas, pueden introducirse impurezas que alteren los resultados, como restos o polvo del entorno. En el análisis coprológico, las muestras pueden estar contaminadas por elementos externos como pelos, fragmentos de semillas o restos de alimentos, lo que puede generar falsas interpretaciones, como la confusión con parásitos.
Fase analítica
Aunque en la actualidad los errores analíticos han disminuido gracias a la automatización del proceso, siguen existiendo limitaciones en las fases manuales:
- Hemograma y frotis: se recomienda realizar frotis manual en todas las muestras, especialmente en aves, conejos y reptiles se hace necesario para evaluar morfología celular y detectar parásitos si existieran (Figura 2).
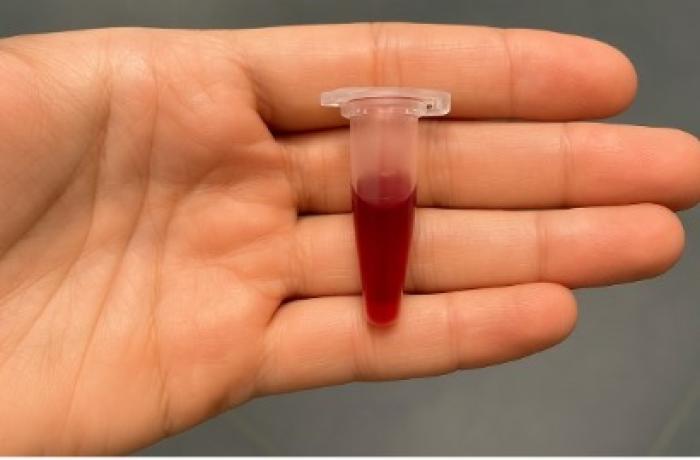
Figura 2. Imagen cedida por Salceda Vetpatogenius.
- Bioquímica clínica: habitualmente en clínica veterinaria se procesan las muestras con analizadores automatizados. Por otra parte, se remiten ciertas muestras para su análisis a laboratorios externos de referencia. Los análisis bioquímicos se pueden realizar mediante diferentes métodos: bioquímica líquida o bien bioquímica seca. Las diferencias entre ambas técnicas a la hora de obtener resultados son mínimas, pero se debe tener en cuenta que en ocasiones puede haber ciertas discrepancias con relación a los valores de referencia o resultados obtenidos.
- Serologías y test rápidos: son dispositivos que proporcionan resultados inmediatos, especialmente utilizados en la detección rápida de enfermedades vectoriales como la leishmaniosis, ehrlichiosis, entre otras. Es importante leer siempre con detenimiento las instrucciones, ya que existen diferencias entre marcas a pesar de diagnosticar la misma enfermedad. Se recomienda siempre realizar los análisis con muestras de suero o plasma, ya que, a pesar de las instrucciones de los fabricantes, es posible trabajar con sangre entera; pueden darse uniones inespecíficas y obtener como resultado un falso positivo. De todos modos, si al obtener el resultado del test rápido existen dudas, confirmar siempre con un análisis serológico en laboratorio veterinario de confianza. En el caso de la leishmaniosis, que es una enfermedad muy común en el día a día en la clínica, se recomienda evitar la congelación porque destruye amastigotes. También, es importante tener en cuenta que, en el caso de obtener un resultado de serología de PCR negativa por parte del laboratorio de referencia, ello no excluye infección, por lo que el facultativo deberá tener en cuenta la anamnesis y todos los signos clínicos del paciente. Interesante remarcar que en el caso de que la muestra que se remita sea para su análisis en PCR, el/la veterinaria seleccionará probablemente aspirado medular, bazo o conjuntiva para obtener una mayor sensibilidad en los resultados obtenidos.
- Manejo de diluciones: se recomienda evitar esta práctica al mínimo. En exóticos, a veces inevitable por bajo volumen, en tal caso, se requerirá anotar la dilución y tenerlo en cuenta a la hora de entregar los resultados finales. Es necesario tener en cuenta que diluir las muestras puede ocasionar una pérdida de sensibilidad del ensayo. También hay que tener en cuenta que, si la dilución es debida a una diferencia entre los valores de referencia de cierto analito para una especie en concreto, por ejemplo, AST en equinos suele ser muy elevada y es necesaria su dilución, o bien, si es debido a la presencia de un interferente o a que tenemos poco volumen de muestra.
- Muestras de orina y/o heces: habitualmente, en las clínicas el procesamiento de estos especímenes es eminentemente mediante métodos manuales y no automatizados. Por ello, durante el análisis de estas muestras, es crucial evitar los artefactos, como partículas que no forman parte de la muestra biológica. En el coprológico, semillas o fragmentos de alimentos pueden confundirse con parásitos o residuos orgánicos. Para evitarlo, es fundamental usar técnicas de concentración, como la flotación, que permiten separar correctamente los elementos biológicos de los no biológicos. Además, el uso de reactivos adecuados y el correcto manejo del equipo de análisis de sedimento de orina son esenciales. En el análisis de orina, el uso de tiras reactivas debe realizarse con precisión, evitando la interpretación incorrecta por falta de tiempo o el uso de tiras caducadas.
En síntesis, recordar siempre verificar el tipo de muestra, las condiciones de conservación y utilizar los métodos adecuados para cada tipo de análisis (Figura 3).
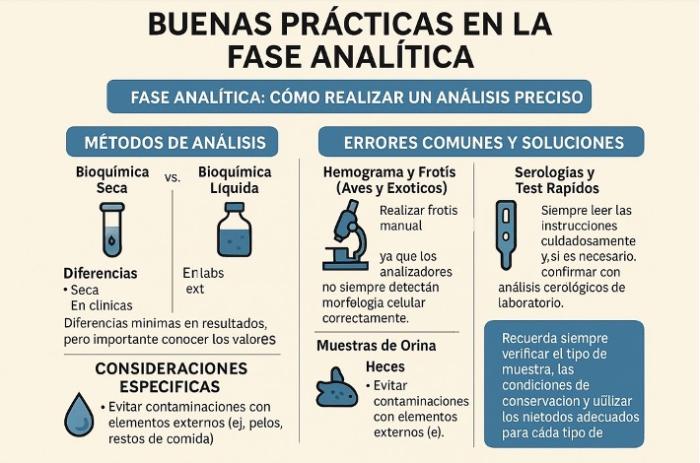
Figura 3. Infografía de resumen de buenas prácticas en la fase analítica.
Fase posanalítica. Interpretación de perfiles clave
Esta sección muestra cómo unir los números con la clínica de nuestros pacientes.
Perfil hepático
- ALT y AST: valores superiores al valor de referencia nos indican en daño hepatocelular.
- FAL y GGT: cuando presentan aumentos aislados sugieren colestasis o inducción farmacológica.
- Bilirrubina: estará elevada en caso de daño hepatocelular y nuestro paciente probablemente presente ictericia.
- Ácidos biliares: niveles normales en ayunas descartan shunt portosistémico, y niveles posprandiales elevados confirman disfunción hepática.
- Amonio: elevado en shunts portosistémicos.
Perfil renal
- SDMA: detecta insuficiencia renal de forma precoz al detectar la disfunción glomerular antes que la creatinina.
- Urea y creatinina: estiman filtración glomerular en caso de sospecha de insuficiencia renal.
- Densidad urinaria: refleja el estado de hidratación del paciente.
- UPC: evidencia proteinuria renal (> 0.5 perro; > 0.4 gato).
- Prestar atención siempre a los estadios definidos por IRIS (1-4), ya que ayudan a clasificar la gravedad de la insuficiencia renal de los pacientes teniendo en cuenta los parámetros mencionados.
- Potasio: presenta niveles altos en estadios avanzados de insuficiencia renal.
Perfil pancreático y metabólico
- Amilasa/lipasa: un aumento > 3 sugiere pancreatitis, pero confirmar siempre con signos clínicos del paciente y TLI.
- Glucosa: en caso de elevación, solicitar un análisis de fructosamina para diferenciar si se trata de diabetes crónica o bien de hiperglucemia por estrés. Este analito refleja los valores de glucosa 2-3 semanas previas.
Perfil orina y coprológico
En este tipo de muestras, para una correcta interpretación de los resultados se deben tener en cuenta posibles incidencias acontecidas en fases anteriores. En tal caso, deberá ser comunicado al equipo veterinario. Es esencial que los auxiliares registren de manera detallada los resultados obtenidos y mantengan un ambiente en el laboratorio organizado para evitar errores de transcripción. Además de seguir siempre los protocolos establecidos y asegurar que todas las muestras sean correctamente almacenadas y destruidas si es necesario, siguiendo las normativas de seguridad propias del centro.
En definitiva, para asegurar la interpretación correcta, siempre considerar el contexto clínico del paciente y los resultados analíticos en conjunto y seguir las indicaciones especificadas en la Figura 4.
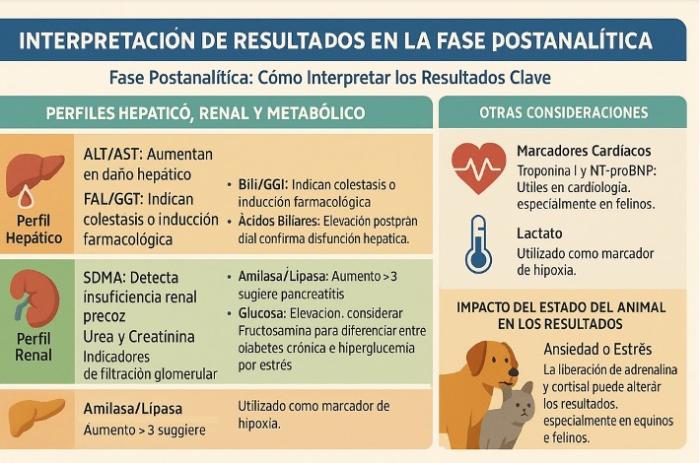
Figura 4. Interpretación de resultados en la fase posanalítica. Para asegurar la interpretación correcta, siempre considerar el contexto clínico del paciente y los resultados analíticos en conjunto.
Conclusiones
La interpretación de los resultados en el laboratorio veterinario es un proceso crítico que depende de la calidad de las muestras, el manejo adecuado en cada fase del análisis y la precisión en la interpretación de los datos obtenidos.
Los auxiliares veterinarios desempeñan un papel fundamental en cada uno de estos pasos, desde la recolección de muestras hasta la interpretación final de los resultados.
El cuidado en la fase preanalítica, la correcta ejecución de las pruebas en la fase analítica y la rigurosa revisión de los resultados en la fase posanalítica son esenciales para garantizar diagnósticos precisos y un tratamiento efectivo para los pacientes.
Las buenas prácticas en la toma, almacenamiento y transporte de muestras, junto con la implementación de métodos adecuados en el análisis, minimizan los riesgos de interferencias y errores.
Es crucial mantener una comunicación fluida entre el equipo veterinario para informar sobre cualquier incidente que pueda afectar la validez de los resultados. De este modo, los auxiliares veterinarios no solo optimizan el uso de los recursos disponibles, sino que también contribuyen significativamente a la salud y bienestar de los animales que se atienden.
El seguimiento de procedimientos estandarizados y la constante actualización en técnicas y conocimientos científicos son claves para ofrecer un servicio de calidad.
Esta guía es solo el inicio de una práctica constante de mejora, cuyo fin último es siempre el bienestar animal.
Bibliografía
- Brooks MB, Catalfamo JL. Current diagnostic trends in coagulation disorders among dogs and cats. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1349-72, vii.
- Daniels JB. Molecular diagnostics for infectious disease in small animal medicine: an overview from the laboratory. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1373-84, vii.
- von Dehn B. Pediatric clinical pathology. Vet Clin North Am Small Anim Pract. 2014 Mar;44(2):205-19.
- Hodges J. Using cytology to increase small animal practice revenue. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1385-408, vii-viii.
- Mansfield C. Practical interpretation and application of exocrine pancreatic testing in small animals. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1241-60, v-vi.
- Monnig AA. Practical acid-base in veterinary patients. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1273-86, vi.
- de Morais HA, Bach JF, DiBartola SP. Metabolic acid-base disorders in the critical care unit. Vet Clin North Am Small Anim Pract. 2008 May;38(3):559-74, x-xi.
- Oyama MA. Using cardiac biomarkers in veterinary practice. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1261-72, vi.
- Sharkey LC, Wellman ML. Use of lactate in small animal clinical practice. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1287-97, vi.
- Allenspach K. Diagnosis of small intestinal disorders in dogs and cats. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1227-40, v.
- Djajadiningrat-Laanen S, Galac S, Kooistra H. Primary hyperaldosteronism: expanding the diagnostic net. J Feline Med Surg. 2011 Sep;13(9):641-50.
- Gilor C, Graves TK. Interpretation of laboratory tests for canine Cushing's syndrome. Top Companion Anim Med. 2011 May;26(2):98-108.
- Graves TK. When normal is abnormal: keys to laboratory diagnosis of hidden endocrine disease. Top Companion Anim Med. 2011 May;26(2):45-51.
- Greco DS. Endocrine causes of calcium disorders. Top Companion Anim Med. 2012 Nov;27(4):150-5.
- Greco DS. Feline acromegaly. Top Companion Anim Med. 2012 Feb;27(1):31-5.
- Greco DS. Hyperadrenocorticism associated with sex steroid excess. Clin Tech Small Anim Pract. 2007 Feb;22(1):12-7.
- Greco DS. Pituitary deficiencies. Top Companion Anim Med. 2012 Feb;27(1):2-7.
- Gunn-Moore D. Feline endocrinopathies. Vet Clin North Am Small Anim Pract. 2005 Jan;35(1):171-210, vii.
- Peterson ME, Gamble DA. Effect of nonthyroidal illness on serum thyroxine concentrations in cats: 494 cases (1988). J Am Vet Med Assoc. 1990 Nov 1;197(9):1203-8.
- Peterson ME, Graves TK, Cavanagh I. Serum thyroid hormone concentrations fluctuate in cats with hyperthyroidism. J Vet Intern Med. 1987 Jul-Sep;1(3):142-6.
- Peterson ME, Melián C, Nichols R. Measurement of serum concentrations of free thyroxine, total thyroxine, and total triiodothyronine in cats with hyperthyroidism and cats with nonthyroidal disease. J Am Vet Med Assoc. 2001 Feb 15;218(4):529-36.
- Rand JS. Pathogenesis of feline diabetes. Vet Clin North Am Small Anim Pract. 2013 Mar;43(2):221-31.
- Scott-Moncrieff JC. Thyroid disorders in the geriatric veterinary patient. Vet Clin North Am Small Anim Pract. 2012 Jul;42(4):707-25, vi-vii.
- Van Lanen K, Sande A. Canine hypoadrenocorticism: pathogenesis, diagnosis, and treatment. Top Companion Anim Med. 2014 Dec;29(4):88-95.
- Index, In Veterinary Clinics of North America: Exotic Animal Practice, Volume 18, Issue 1, 2015, Pages 157-186.
- Campbell TW. Evaluation of the blood film. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):117-35.
- Campbell TW. Exotic animal hematology. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):xi-xii.
- Cray C. Reference intervals in avian and exotic hematology. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):105-16.
- Doneley B. Clinical technique: techniques in the practice diagnostic laboratory: a review. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):137-46.
- Grant KR. Fish hematology and associated disorders. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):83-103.
- Jones MP. Avian hematology. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):51-61.
- Lindstrom NM, Moore DM, Zimmerman K, Smith SA. Hematologic assessment in pet rats, mice, hamsters, and gerbils: blood sample collection and blood cell identification. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):21-32.
- Moore DM, Zimmerman K, Smith SA. Hematological assessment in pet rabbits: blood sample collection and blood cell identification. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):9-19.
- Smith SA, Zimmerman K, Moore DM. Hematology of the domestic ferret (Mustela putorius furo). Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):1-8.
- Sykes JM 4th, Klaphake E. Reptile hematology. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):63-82.
- Vap L, Bohn AA. Hematology of camelids. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):41-9.
- Zimmerman K, Moore DM, Smith SA. Hematological assessment in pet guinea pigs (Cavia porcellus): blood sample collection and blood cell identification. Vet Clin North Am Exot Anim Pract. 2015 Jan;18(1):33-40.
- De Loor J, Daminet S, Smets P, Maddens B, Meyer E. Urinary Biomarkers for Acute Kidney Injury in Dogs.
- Bartges JW. Chronic kidney disease in dogs and cats. Vet Clin North Am Small Anim Pract. 2012 Jul;42(4):669-92, vi.
- Chapman SE, Hostutler RA. A Laboratory Diagnostic Approach to Hepatobiliary Disease in Small Animals. Clin Lab Med. 2015 Sep;35(3):503-19.
- Foster JD. Update on Mineral and Bone Disorders in Chronic Kidney Disease. Vet Clin North Am Small Anim Pract. 2016 Nov;46(6):1131-49.
- Holowaychuk MK. Hypocalcemia of critical illness in dogs and cats. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1299-317, vi-vii.
- Klosterman ES, Pressler BM. Nephrotic syndrome in dogs: clinical features and evidence-based treatment considerations. Top Companion Anim Med. 2011 Aug;26(3):135-42.
- Pressler BM. Clinical approach to advanced renal function testing in dogs and cats. Vet Clin North Am Small Anim Pract. 2013 Nov;43(6):1193-208, v.
 by Multimédica
by Multimédica