Manejo mínimamente invasivo de la estenosis uretral en pequeños animales
Resumen breve
Las principales etiologías obstructivas a nivel uretral descritas en pequeños animales son las estenosis cicatriciales, las estenosis secundarias a procesos neoplásicos que afectan a la mucosa uretral, la urolitiasis, la obstrucción por coágulos de sangre, la obstrucción por tapones uretrales, así como la existencia de anomalías anatómicas congénitas. En este artículo se desarrollará el manejo mínimamente invasivo de las estenosis uretrales, independientemente de su naturaleza.Índice de contenidos
Introducción
La incidencia de patologías urinarias en la especie canina y felina que requieren de intervención quirúrgica ha aumentado constantemente en los últimos años, e históricamente se han encontrado múltiples desafíos al tratar el sistema urinario en estas especies. Estos serían, básicamente, una anatomía delicada y de reducido diámetro, la dificultad para obtener un diagnóstico preciso sin el empleo de técnicas de imagen avanzada, así como las altas tasas de morbilidad y mortalidad asociadas con varias técnicas quirúrgicas convencionales.
Esto convierte a las técnicas de endourología en una alternativa a las distintas opciones terapéuticas existentes, ya sean por sí mismas o en asociación con otras terapias, e incluso con un fin paliativo, lo que puede ayudar a sortear muchos de estos desafíos quirúrgicos que plantea el manejo terapéutico de muchas patologías de la vía urinaria baja en pequeños animales. Concretamente, la endourología se refiere al uso de técnicas mínimamente invasivas con fines diagnósticos y terapéuticos en la vía urinaria, combinando tanto técnicas de radiología intervencionista como de endoscopia intervencionista en comparación con los procedimientos quirúrgicos tradicionales, p. ej., la resección uretral y anastomosis o las técnicas de diversión urinaria en los casos de afectación del trígono.
La estenosis uretral es una condición patológica que se caracteriza por el estrechamiento anormal del lumen de la uretra por causas que afecten directamente a la pared de la uretra, a diferencia de compresiones extramurales secundarias a la presión de otras estructuras anejas, lo que conlleva a una obstrucción, total o parcial, del flujo de orina hasta el exterior. Aunque las principales etiologías obstructivas a nivel uretral descritas en pequeños animales sean las estenosis cicatriciales, las estenosis secundarias a procesos neoplásicos que afecten a la mucosa uretral, la urolitiasis, la obstrucción por coágulos de sangre, la obstrucción por tapones uretrales, así como la existencia de anomalías anatómicas congénitas, en el presente artículo se desarrollará el manejo mínimamente invasivo de las estenosis uretrales, independientemente de su naturaleza.
Presentación clínica
Aunque la estenosis uretral en pequeños animales se manifiesta clínicamente con una sintomatología que se caracteriza por la existencia de disuria, estranguria e incluso en ocasiones hematuria, cabe destacar que existen dos tipos de estenosis a nivel uretral en función de su etiología.
Las estenosis uretrales benignas son aquellas que no tienen una etiología neoplásica, pudiendo ser provocadas por distintas otras etiologías como traumatismos, infecciones recurrentes, inflamaciones crónicas y urolitiasis (Tabla 1) (Figura 1).
| Etiología | Posibles causas |
|---|---|
| Traumática | Caídas, golpes, atropellos, mordeduras. |
| Infecciosa | Infecciones urinarias crónicas y recurrentes pueden causar inflamación crónica de la uretra, desarrollando uretritis proliferativa e incluso tejido cicatricial. |
| Inflamatoria | Desarrollo de uretritis proliferativa secundaria a urolitos impactados a nivel del urotelio, prostatitis crónica e inflamaciones crónicas de la vía urinaria baja. Se ha descrito que algunos procesos autoinmunes pueden causar inflamación crónica en la uretra, llevando a la formación de tejido cicatricial y estenosis. |
| Iatrogénica | Formación de tejido cicatricial tras manejo del tracto urinario (p. ej., uretrostomía, sondajes traumáticos, etc.) En la especie felina más comúnmente a nivel de la porción media o distal de la uretra. |
| Síndrome urológico felino | Formación de tejido cicatricial tras episodios recurrentes de obstrucción uretral por tapones mucosos o cristales. |
Tabla 1. Resumen de las principales etiologías de la estenosis uretral benigna en pequeños animales.
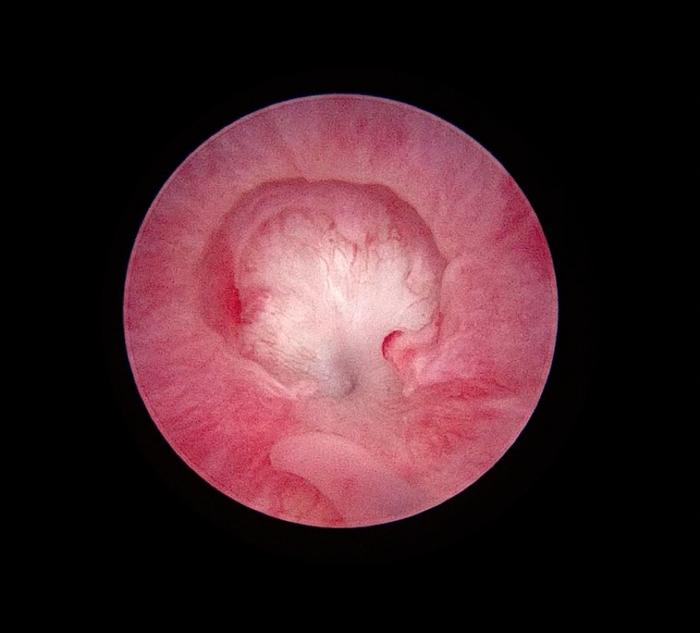
Figura 1. Estenosis uretral benigna en paciente canino secundaria a uretritis severa.
Aunque menos común, algunas estenosis uretrales benignas pueden tener un origen congénito en ambas especies, especialmente en aquellos casos en los que existan malformaciones asociadas o no a hipoplasia uretral. Cabe destacar que la uretritis proliferativa es una patología inflamatoria relativamente frecuente asociada a procesos infecciosos crónicos recurrentes, así como en el caso de lesión secundaria a urolitos impactados de forma crónica a nivel del urotelio. Endoscópicamente se caracteriza por la existencia de una lesión a menudo difusa a lo largo de una gran porción de la uretra en el caso de etiología infecciosa (Figura 2) o focal en el caso de ser secundaria a la impactación crónica de urolito/s (Figura 3), que puede provocar una estenosis circunferencial de la uretra.
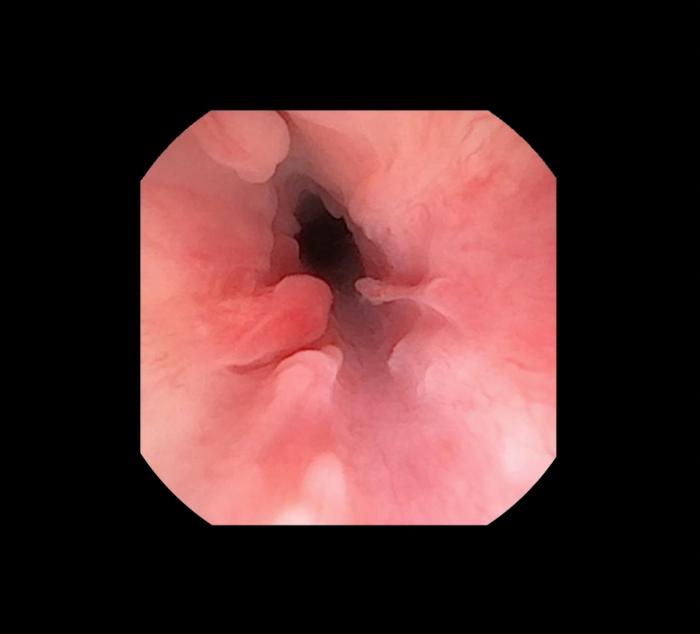
Figura 2. Uretritis proliferativa secundaria uretritis crónica.
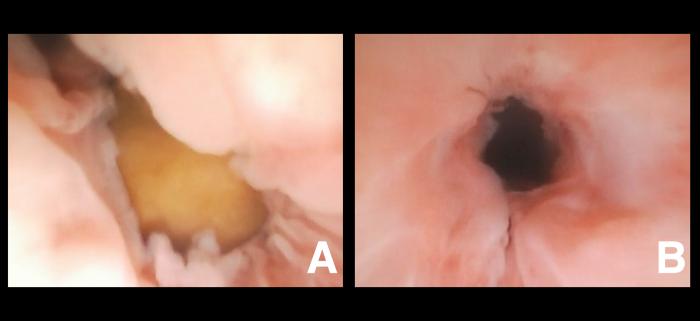
Figura 3. Uretritis proliferativa secundaria a (A) urolito impactado , responsable de (B) la disminución del diámetro uretral.
Cabe destacar que esta afección a menudo se diagnostica erróneamente como neoplasia del tracto urinario debido a su apariencia proliferativa y naturaleza obstructiva, pero se ha demostrado en estudios recientes que más de la mitad de las muestras histológicas de pacientes con uretritis proliferativa, además de componente inflamatorio, fueron positivas a la presencia de bacterias.
Por otro lado, las estenosis uretrales malignas son aquellas que son secundarias a una causa neoplásica a nivel del esfínter vesical o de la uretra, afectando a su pared y responsable de la obstrucción de su lumen (Tabla 2).
| Especie | Etiología |
|---|---|
| Canina | Carcinoma de células de transición Carcinoma de células escamosas Sarcoma Adenocarcinoma |
| Felina | Carcinoma de células de transición Linfoma Carcinoma de células escamosas Sarcoma |
Tabla 2. Neoplasias responsables de estenosis uretral maligna en pequeños animales.
El carcinoma de células transicionales (CCT) es la etiología neoplásica más frecuente en la especie canina (Figura 4A), mientras que en la especie felina es la segunda tras el linfoma renal (Figura 4B).
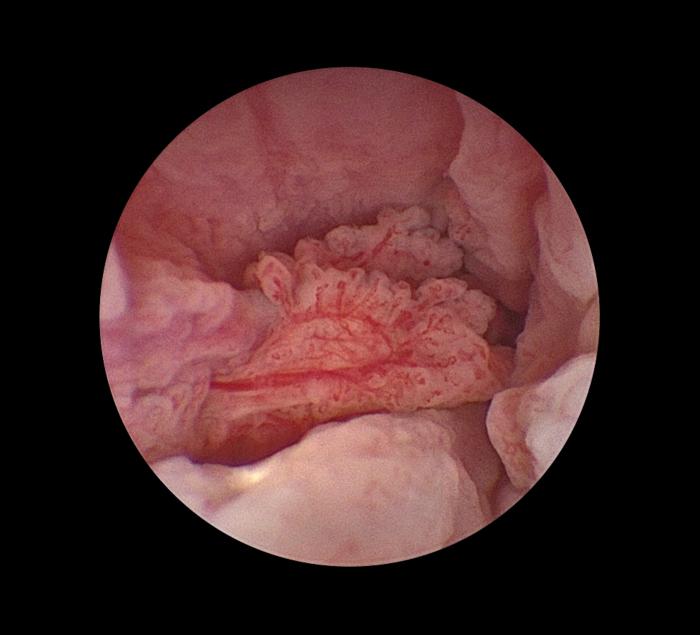
Figura 4. Imagen endoscópica de CCT uretral en paciente (A) canino y (B) felino.
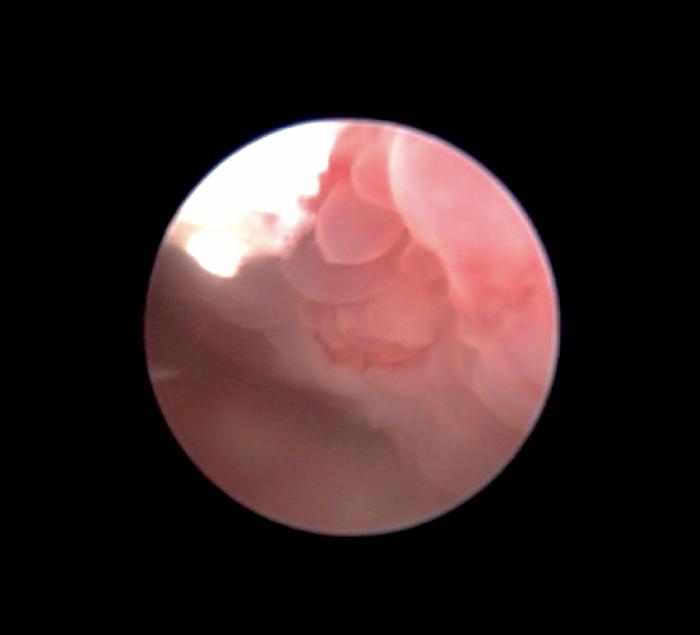
Aun así, la localización del CCT parece ser más variable en la especie felina que en la canina, aunque el trígono vesical sea la ubicación más común en ambas especies, ya que mientras que la afección a nivel del trígono se reporta en la mayoría de los perros con CCT, se describe afección a nivel del trígono en la especie felina en alrededor del 30 % de los casos.
En cuanto a los signos clínicos, estos son similares independientemente de la naturaleza de la estenosis uretral, variando de un cuadro caracterizado únicamente por cierto grado de estranguria a cuadros más severos caracterizados por letargo, anorexia, pérdida ponderal, disuria asociada a estranguria, tenesmo, distensión abdominal e incluso hematuria en los casos en los que se sospeche de componente maligno asociado a la estenosis uretral.
Diagnóstico
El correcto diagnóstico de la estenosis uretral en pequeños animales requiere de la combinación de distintos métodos de diagnóstico, con el fin de determinar la causa, la ubicación, la extensión y la naturaleza de dicha estenosis a nivel uretral. Dicho proceso diagnóstico debe comenzar con una exploración física detallada junto a una buena anamnesis, para determinar la existencia o no de los signos clínicos anteriormente detallados, así como su intensidad. Se debe llevar a cabo una palpación abdominal para valorar la vejiga, ya que una vejiga distendida puede ser compatible con la existencia de una obstrucción uretral completa o parcial, así como un tacto rectal en machos para evaluar la próstata y otras estructuras pélvicas que podrían estar afectando externamente a la uretra. Además, la exploración del periné puede mostrar signos de inflamación o trauma secundarios a lamido persistente.
El estudio ecográfico del abdomen es una herramienta de diagnóstico no invasiva crucial para evaluar la anatomía del tracto urinario. Permite visualizar la vejiga, la uretra y los tejidos circundantes. La ecografía puede detectar masas, cálculos, inflamaciones y otros cambios estructurales que pueden estar contribuyendo a la estenosis. Cabe destacar que alteraciones del segmento uretral a nivel del canal pélvico pueden pasar desapercibidas a la exploración ecográfica o ser imposible su valoración debido a la sombra acústica secundaria al hueso del pubis, por lo que generalmente se recomienda ser complementada con otros métodos de diagnóstico como el uretrograma de contraste, mediante radiografía o fluoroscopia, así como la uretrocistoscopia, siempre que el diámetro uretral lo permita.
Aunque el estudio radiográfico simple puede confirmar la existencia de urolitos radiodensos, los estudios radiográficos de contraste proporcionan una imagen más detallada de la uretra, especialmente si se lleva a cabo bajo control fluoroscópico (Figura 5).
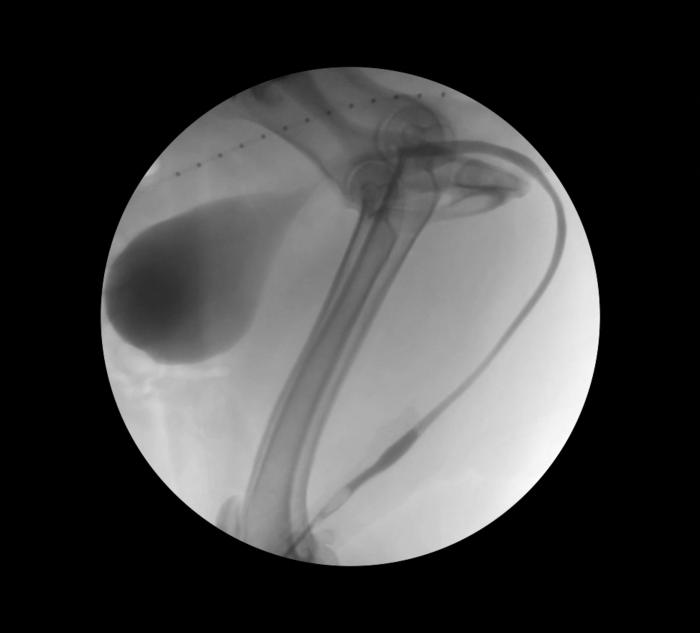
Figura 5. Uretrocistograma retrógrado en paciente canino.
Estos permiten identificar, ubicar y determinar la extensión de la estenosis, así como a detectar posibles desviaciones o anormalidades en el tracto urinario.
Por su parte, la uretrocistoscopia permite confirmar y localizar la estenosis, pero no determina la extensión de la misma, así como la existencia de más estenosis craneales a la misma, por lo que siempre se recomienda combinar la exploración endoscópica de la uretra con la realización de un uretrocistograma para un diagnóstico más preciso de la morfología de la estenosis. Aun así, sí permite la identificación y manejo de obstrucciones secundarias a urolitos no radiodensos que pudieran haber pasado desapercibidos a otros métodos de diagnóstico por imagen, como la ecografía o los estudios radiográficos simples. Cabe recordar que, de cara a valorar el componente maligno de la estenosis, y determinar así el pronóstico de la misma, se hace necesaria la toma de muestras para su estudio citológico o histopatológico. Debido al riesgo de siembra que conlleva la obtención de muestras mediante cistocentesis en el caso de CCT, se recomienda la obtención de muestras mediante uretrocistoscopia bajo control endoscópico como técnica de primera elección, o la obtención de muestras mediante sondaje traumático ecoguiado en aquellos casos en los que no sea posible su manejo endoscópico.
Tratamiento mínimamente invasivo
El tratamiento de las estenosis uretrales puede variar dependiendo de la causa subyacente, de la naturaleza de la estenosis y de la severidad de la misma. En los casos de estenosis uretral benigna, se describen como alternativas terapéuticas mínimamente invasivas la dilatación con catéter balón, la uretrotomía endoscópica mediante el empleo de láser, así como la implantación de stents uretrales, temporales o permanentes, en aquellos casos especialmente refractarios. Por otro lado, en el caso de estenosis uretrales malignas, el manejo mínimamente invasivo con dilataciones seriadas con catéter balón o la implantación de stents de forma permanente forman parte de un manejo terapéutico multimodal. Esto se debe a que, debido a su etiología neoplásica, las distintas opciones mínimamente invasivas buscan garantizar la repermeabilización del lumen uretral de forma paliativa, debiendo ser combinadas con terapias oncológicas, p. ej., quimioterapia, radioterapia, que permitan incrementar la esperanza de vida del paciente y disminuir la tasa de recidiva de la obstrucción uretral. Cabe destacar que, en aquellos casos muy avanzados, y siempre que se informe correctamente a los propietarios, pueden emplearse dichas técnicas de endourología como terapia exclusivamente paliativa, centrada en mejorar la calidad de vida del paciente.
Dilatación con balón
El manejo mediante dilataciones con catéter balón de obstrucciones a nivel uretral va a estar indicado en todos aquellos casos en los que se deba a la existencia de una estenosis benigna, pudiendo tener dicho manejo un carácter curativo, o de estenosis malignas, siendo generalmente un manejo paliativo para la repermeabilización temporal de la uretra como se describió anteriormente.
Todos los procedimientos de dilatación con balón se deben de llevar a cabo con un catéter balón bajo control fluoroscópico. Se debe localizar y cuantificar la longitud de la obstrucción uretral, generalmente mediante uretrografía retrógrada con medio de contraste bajo asistencia fluoroscópica. Mediante el empleo de una guía hidrofílica vía uretral, se hace pasar a través de la estenosis, hasta alojar el extremo atraumático en posición intravesical. Posteriormente se introduce sobre la guía hidrofílica un catéter balón de diámetro y longitud adecuados en base a las dimensiones de la uretra no afectada por la estenosis. Si la longitud de la porción obstruida de la uretra excede la longitud deseada de la dilatación con balón, el procedimiento se debe realizar en dos veces, una para la mitad proximal y otra para la mitad distal del punto de obstrucción. Bajo control fluoroscópico se procede a la dilatación de la estenosis mediante inyección de medio de contraste y suero salino en proporción 1:1 a la presión recomendada por el fabricante del catéter balón (Figura 6).
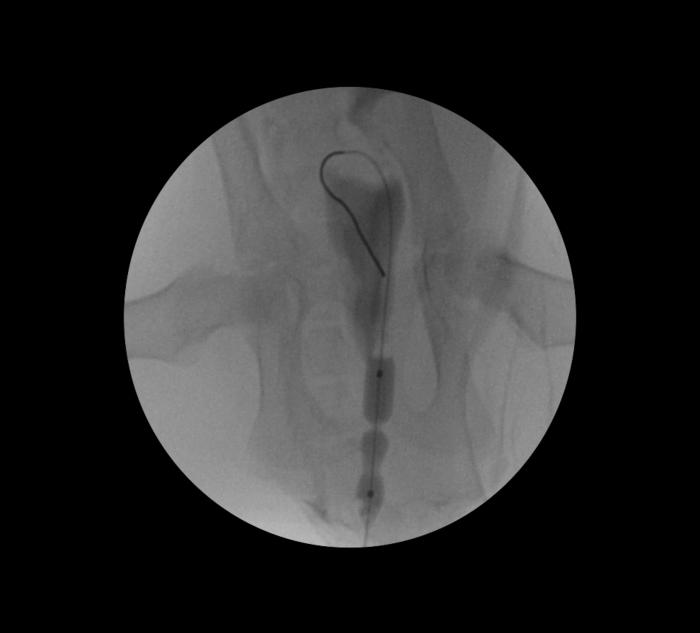
Figura 6. Manejo endoluminal de estenosis uretral en paciente felino. Proyección VD.
Si la dilatación se considera insuficiente, el mismo procedimiento se repite hasta alcanzar el grado deseado de dilatación, realizándose de 2-3 dilataciones de la estenosis en el mismo procedimiento, comprobándose vía fluoroscópica y/o endoscópica la correcta respuesta a dichas dilataciones. Cabe destacar que no existe un consenso respecto al tiempo en el que el balón debe mantenerse ejerciendo la dilatación, existiendo descripciones de entre 1 minuto a 5 minutos. Generalmente se procede a la implantación de un catéter uretral durante los siguientes días tras la sesión de dilatación con balón, asociado a manejo antiinflamatorio y antibioterapia de cobertura, con el fin de prevenir una posible obstrucción uretral temporal tras el procedimiento.
Implantación stent uretral
Se trata de un procedimiento mínimamente invasivo que puede ofrecer una solución rápida, segura y efectiva al restablecer la permeabilidad de la uretra en un paciente comprometido. Los stents uretrales están diseñados para el manejo de obstrucciones del tracto urinario inferior que no puedan ser manejadas médica o quirúrgicamente, aliviando así las obstrucciones que afectan al trígono o la uretra en pequeños animales. La implantación de un stent uretral puede tener una ventaja sobre la dilatación con balón, ya que puede proporcionar un alivio inmediato de la obstrucción en un único procedimiento anestésico, lo que potencialmente ahorra costos y disminuye la morbilidad asociada a la anestesia. Además, puede ser terapéutico en afecciones en las que no se espera que respondan a la dilatación con balón, como la disinergia refleja uretral y la uretritis proliferativa refractaria.
Se recomienda realizar el estudio ecográfico del abdomen con el fin de evaluar el resto del tracto urinario superior, principalmente para evaluar si el uréter está involucrado, ya que una obstrucción ureteral unilateral puede no acompañarse de signos clínicos ni de cambios en los parámetros renales de la bioquímica sérica. Como se ha descrito anteriormente, en machos también será importante evaluar la próstata, ya que un pequeño tumor prostático puede ser la causa de un cuadro severo de tenesmo, debiendo ser capaces de diferenciar un cuadro de tenesmo de un cuadro de estranguria durante la anamnesis.
De cara a la selección del stent (Tabla 3) se debe tener presente tanto la localización y longitud de la estenosis, ya que deben ser lo suficientemente largos para abarcar toda la longitud de la estenosis, así como el material del stent, en base a la estrategia terapéutica del empleo del stent, p. ej., temporal vs. permanente, y la respuesta biológica esperada, p. ej., riesgo de infección, inflamación, así como la talla del paciente, ya que el diámetro y la longitud del stent deben ajustarse al tamaño y anatomía del paciente para evitar complicaciones que se desarrollarán más adelante.
| Criterio | Tipos |
|---|---|
| Método de liberación |
|
| Fabricación |
|
| Diseño |
|
Tabla 3. Principales tipos de stent uretral empleados en pequeños animales.
A criterio de los autores, el stent recomendado para su empleo de forma permanente a nivel uretral es el stent metálico autoexpandible recubierto, siendo imprescindible disponer de fluoroscopio, ya que el procedimiento no es posible llevarlo a cabo con garantías mediante control endoscópico. Para ayudar con la selección del tamaño del stent, primero se debe determinar la extensión de la estenosis y el diámetro máximo de la uretra sana. Para ello se introduce un catéter de medición a través del ano, alojándolo a nivel rectal, con lo que se garantiza una escala para la obtención de las distintas medidas durante la realización del uretrocistograma retrógrado bajo control fluoroscópico tras la introducción de guía hidrofílica y catéter de forma retrógrada. En aquellos casos en los que el acceso anterógrado sea imposible debido al grado de obstrucción, lo que impida el paso de la guía en sentido retrógrado, se puede optar por el empleo de la técnica alternativa que consiste en un acceso uretral anterógrado vía percutánea. Para ello se debe rasurar y preparar asépticamente la pared abdominal, procediéndose a contrastar la vejiga mediante el empleo de agente de contraste no iodado (p. ej., iopramida) para contrastar ligeramente la silueta vesical bajo control fluoroscópico. Es en este momento en el que se procede a la introducción de la guía hidrofílica en sentido caudal, hacia el trígono vesical y uretra, lo que permita su exteriorización a través de la vulva o del glande, lo que permite así la realización alternativa de un acceso completo (Figura 7).
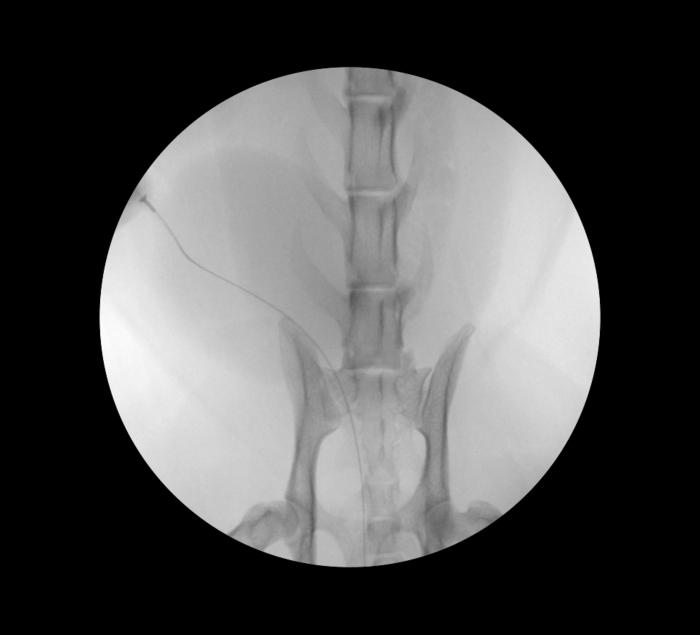
Figura 7. Control fluoroscópico del acceso uretral anterógrado vía percutánea en paciente felino. Proyección VD.
Una vez determinada la extensión de la estenosis uretral y del diámetro máximo de la uretra sana, la selección de la longitud del stent se determina incrementando 6-10 mm a la longitud del segmento estenótico, con el fin de dejar un margen de 3-5 mm craneal y caudal a la estenosis en el que el stent esté actuando. Por su parte el diámetro del stent se determina sobreestimando un 10-15 % el diámetro máximo de la uretra, con el fin de minimizar el riesgo de migración del mismo. En el caso particular de la especie felina cabe recordar tener en cuenta su anatomía particular respecto a la estrecha proximidad de la unión ureterovesical a la uretra proximal respecto a la especie canina.
La guía hidrofilica sirve de igual forma para conducir el dispositivo de liberación del stent hasta la ubicación deseada bajo control fluoroscópico, teniendo en cuenta los marcadores radiopacos del stent (Figura 8).
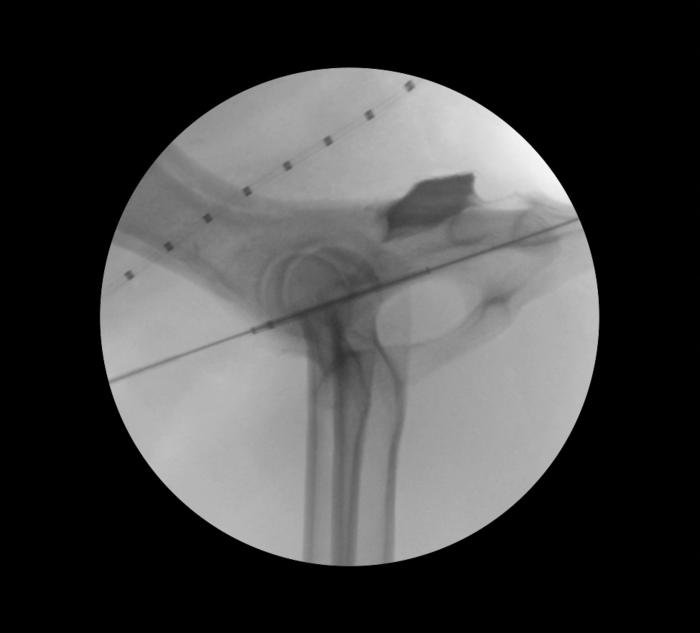
Figura 8. Posicionamiento del sistema de entrega del stent mediante control fluoroscópico.
El stent debe ser cuidadosamente liberado para no movilizarse, consiguiendo una correcta expansión del mismo al liberarse. Posteriormente debe monitorizarse su correcta implantación, tanto endoscópica como fluoroscópicamente (Figura 9), para lo cual puede ser interesante la realización de un uretrograma retrógrado.
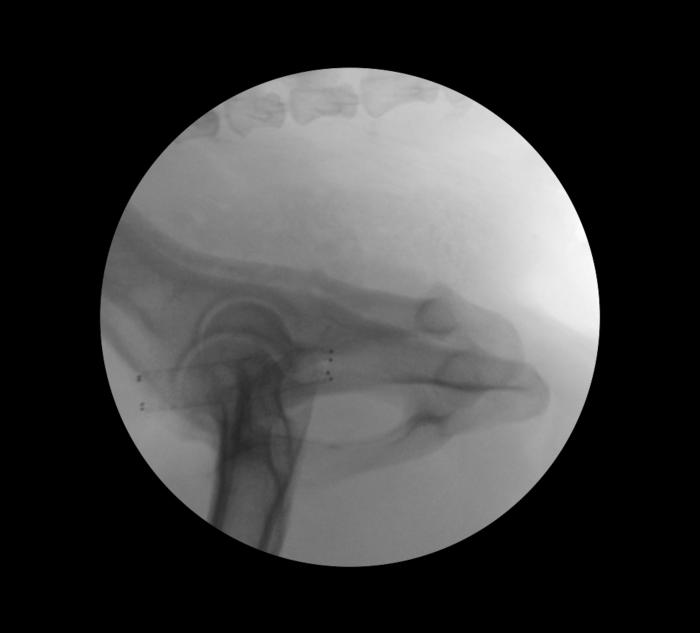
Figura 9. Control radiológico tras la implantación de stent autoexpandible a nivel uretral.
Los pacientes generalmente son dados de alta el mismo día del procedimiento o a la mañana siguiente, siempre después de que se compruebe una micción adecuada.
Cabe destacar que en aquellos casos en los que se trate de un manejo paliativo de estenosis maligna, normalmente no es necesario un estadiaje completo del tumor, a menos que los resultados puedan cambiar la decisión del propietario para autorizar el procedimiento.
Uretrotomía endoscópica mediante el empleo de láser
Consiste en la ablación de tejido proliferativo mediante el empleo de láser vía endoscópica y asistencia ecográfica, siendo otra de las técnicas endoluminales avanzadas de mayor utilidad, especialmente en el manejo terapéutico tanto de neoplasias benignas como malignas responsables de un grado variable de obstrucción a nivel de las vías urinarias bajas.
Se debe llevar a cabo el procotolo de exploración uretrocistoscópico convencional, en el que se procede a explorar toda la longitud de la uretra, siempre que sea posible el acceso a través del lumen uretral, evitando generar iatrogenias durante la identificación de la localización, forma y textura del proceso neoplásico. Una vez identificados localización y aspecto de la masa obstructiva, antes de proceder a la uretrotomía endoscópica, se debe proceder a la obtención de muestras si aún no se ha llevado a cabo el diagnóstico histopatológico de la neoplasia.
Se debe posicionar el extremo distal del endoscopio frente al extremo distal de la masa, se introducirá una fibra láser a través del canal de trabajo. En el caso de emplear equipos flexibles, se recomienda llevar a cabo la introducción de la fibra a través del canal de trabajo fuera de la uretra y en posición completamente longitudinal del equipo flexible ya que las fibras láser pueden dañar gravemente el canal de trabajo durante su introducción en caso de flexión del equipo.
Una vez introducida la fibra, debe ponerse en contacto su extremo distal con la masa responsable de la estenosis procediéndose a activar el equipo láser para la vaporización del tejido obstructivo (Figura 10).
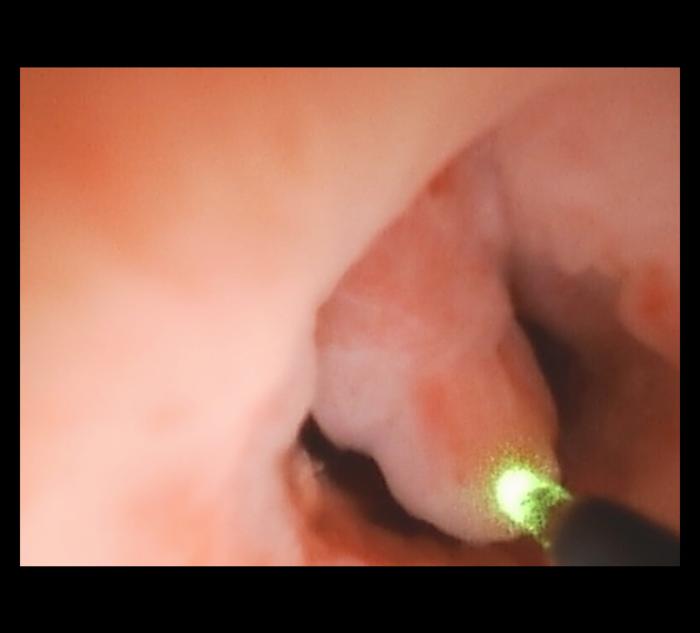
Figura 10. Manejo mediante láser Ho:YAG de tejido proliferativo a nivel de la uretra, responsable de la obstrucción parcial del lumen uretral.
Es aconsejable que todo el procedimiento sea monitorizado ecográficamente con el fin de evitar perforaciones iatrogénicas de la pared uretral. Este control ecográfico es difícil de llevar a cabo a nivel de la porción craneal de la uretra, debido a la presencia del pubis. Aun así, se puede llevar a cabo sin muchos riesgos en esta zona y en el resto de la uretra, ya que siempre se lleva a cabo de forma paralela al eje uretral, por lo que las posibilidades de iatrogenia, siendo conservadores, disminuyen sensiblemente. Durante todo el procedimiento deben de introducirse fluidos de forma permanente con el fin de ir eliminando todos los detritus procedentes de la ablación, mantener refrigerada la zona, así como mantener una buena visión de trabajo, siempre con la precaución de no ejercer una presión excesiva a nivel vesical que provoque iatrogenias a nivel de su pared. Si durante la realización del procedimiento se generase un edema e inflamación claramente visibles, se recomienda la implantación de un catéter urinario durante las siguientes 24-72 horas.
Otras alternativas
En aquellos casos en los que exista cierto componente refractario al manejo con dilataciones con balón, los propietarios no puedan acceder al empleo de stents autoexpandibles recubiertos, o se requiera garantizar la permeabilidad de la uretra hasta poder implantar el stent permanente, se ha descrito el empleo de catéteres urinarios como estrategia más conservadora que pueda implicar su empleo como stents de forma temporal.
El principal reto que puede existir en estos casos es que el sondaje pueda verse dificultado, especialmente en casos estenosis malignas que afecten al lumen uretral. Como se ha descrito anteriormente, la necesidad de garantizar una vía urinaria permeable en estos pacientes, evitando la exposición a otros tejidos distintos a los de la vía urinaria de células que potencialmente pueden generar la diseminación de la neoplasia, p. ej., en el caso estenosis maligna, hace que la alternativa de implantar un catéter uretral, en aquellos casos en los que haya que esperar por la implantación de un stent, pueda ser una alternativa más segura que los sistemas de drenaje vesical percutáneo.
Para ello, es necesario el empleo de la endoscopia, flexible o rígida en función de las preferencias del endoscopista, así como del sexo del paciente. A criterio de los autores, la endoscopia flexible es la de elección en el perro, mientras que la endoscopia rígida es la técnica de elección para la perra y la gata. En el caso del gato, actualmente la técnica asistida por endoscopia para el sondaje vesical retrógrado se ve imposibilitada por la ausencia de equipos en el mercado adaptados al diámetro uretral del gato, que permita el empleo de canal de trabajo.
Independientemente del tipo de endoscopio empleado, los distintos pasos para llevar a cabo dicha técnica son comunes. Para ello, inicialmente se debe llevar a cabo el rasurado y preparación aséptica de la región perineal, perivulvar y periprepucial para la realización de una uretrocistoscopia retrógrada hasta alcanzar el interior de la vejiga.
Una vez se alcanza endoscópicamente el interior de la vejiga, se debe haber garantizado el correcto vaciado de la vejiga, siendo de interés clínico la realización de un lavado vesical, especialmente en aquellos pacientes con un cuadro de estranguria que haya sido responsable de un cuadro de retención de orina. Es en este momento en el que se introduce el extremo atraumático de una guía hidrofílica a través del canal de trabajo del endoscopio, para alojarlo a nivel intravesical. Esta maniobra puede monitorizarse exclusivamente mediante endoscopia o realizarla fluoroscópicamente asistida (Figura 11).
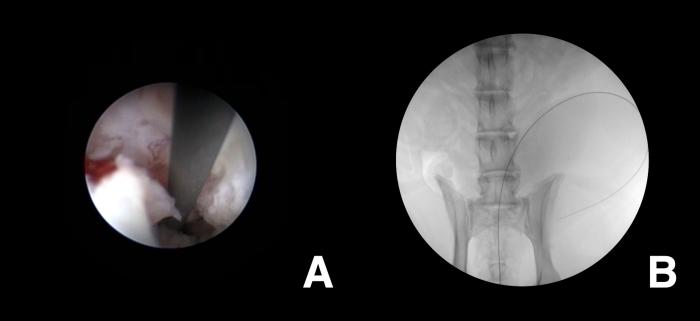
Figura 11. Monitorización (A) endoscópica y (B) fluoroscópica de la introducción de la guía hidrofílica durante las maniobras de sondaje uretral en paciente canino con CCT uretral.
Una vez se ha garantizado que la guía hidrofílica se encuentra a nivel vesical, se debe retirar el endoscopio evitando la movilización de la guía hidrofílica, para lo cual se debe inmovilizar esta durante toda la maniobra de retirada del endoscopio. Posteriormente, y una vez se ha retirado el endoscopio, se procede a introducir un catéter uretral empleando la guía hidrofílica como fiador, pudiendo llevar a cabo dicha maniobra a ciegas, sin monitorización endoscópica. Cabe destacar que los catéteres uretrales recomendados para este tipo de pacientes son los catéteres de Foley. Estos catéteres tienen un balón cerca del extremo distal que permite que el catéter permanezca en su lugar sin el uso de suturas externas, por lo que una vez que se consigue introducir el extremo distal del catéter a nivel intravesical, se inyecta solución salina o una mezcla 1:1 de solución salina y agente de contraste de baja osmolaridad (iohexol, iopromida, iopamidol) a un volumen total recomendado por el fabricante del catéter, con el fin de evitar que este pueda ser retirado de forma accidental o de forma voluntaria por parte del paciente. Finalmente, el catéter debe ser conectado asépticamente a un sistema de recolección de orina cerrado o emplear un tapón adaptado a su diámetro y forma para evitar infecciones nosocomiales asociada al catéter uretral.
Control posquirúrgico
El control posquirúrgico tras el manejo mínimamente invasivo de las estenosis uretrales en pequeños animales es crucial para asegurar una recuperación exitosa y prevenir complicaciones. Este proceso incluye una serie de cuidados específicos que van desde el manejo del dolor, mediante la administración de terapia antiinflamatoria no esteroidea, combinada o no con analgésicos puros, así como la administración de antibioterapia de cobertura en base a los resultados del cultivo y antibiograma de muestras obtenidas durante el diagnóstico.
La implantación de un catéter como medio paliativo de forma temporal implica una serie de cuidados que van desde garantizar una higiene estricta del área perineal, asegurando la limpieza diaria, hasta monitorizar la correcta disposición del catéter para evitar obstrucciones o desplazamientos, incluso valorando el empleo de collar isabelino para restringir el acceso del paciente al catéter, en el caso de que este quede exteriorizado. Además, se debe verificar regularmente el flujo de orina y la ausencia de signos de infección por parte de los propietarios, como turbidez o mal olor en la orina.
Las revisiones periódicas son esenciales para monitorizar la evolución del caso y detectar cualquier signo de recurrencia de la estenosis de forma precoz, debiendo incluir exámenes físicos, urianálisis, así como estudios de imagen para comprobar la persistencia de la respuesta a la terapia mínimamente invasiva.
Cabe destacar que las principales complicaciones perioperatorias derivadas de la implantación de un stent a nivel uretral incluyen el desarrollo de un cuadro de incontinencia, la aparición de atonía vesical, así como procesos de reobstrucción aguda, incluso por oclusión del propio stent por manipulación incorrecta, habiendo sido descrito un caso en el que se dobló inadvertidamente al introducir un termómetro vía rectal. También se describe la migración del stent por mala elección de su diámetro, pudiendo ser extraído por cistotomía e implantando un segundo stent para estabilizarlo, así como la no resolución completa de la estenosis, lo que podría hacer necesaria también la implantación de un segundo stent. Las complicaciones a medio y largo plazo están relacionadas con el crecimiento de tejido proliferativo en el interior del lumen. Este puede ser de tipo benigno, como en los casos de uretritis proliferativa, inflamación linfoplasmocitaria, o fibrosis, así como de tipo maligno, generalmente asociado al proceso neoplásico responsable de la estenosis maligna. Este tipo de complicaciones generalmente pueden tener lugar tras el empleo de stentsno recubiertos.
Las principales complicaciones descritas tras el empleo de la uretrotomía endoscópica con láser son el desarrollo de perforación uretral que, en el caso de no ser perforaciones graves, pueden llegar a ser manejadas de forma conservadora mediante la implantación de un catéter urinario durante las siguientes 24-48 horas. También son frecuentes las infecciones del tracto urinario por lo que, si a pesar de haber administrado una antibioterapia de cobertura se desarrollase una infección, puede ser necesaria la realización de nueva antibioterapia en base a los resultados de un cultivo y antibiograma. Como complicación menos frecuente se ha descrito el desarrollo de estenosis uretrales benignas por cicatrización excesiva del urotelio en aquellos casos en el que se trabaje sobre una gran cantidad de superficie del diámetro uretral.
Mientras que el pronóstico para estenosis uretrales benignas es generalmente bueno con un manejo mínimamente invasivo adecuado, ya sea mediante dilatación con balón o la implantación de un stent, ya que la principal incertidumbre es el carácter refractario de la propia estenosis benigna, el pronóstico para las estenosis uretrales malignas varía dependiendo del tipo de tumor, su extensión y la respuesta al tratamiento. En general, los tumores malignos del tracto urinario tienden a tener un pronóstico reservado a pobre, especialmente si se diagnostican en etapas avanzadas, ya que el manejo mínimamente invasivo en estos casos puede mejorar la calidad de vida del paciente, pero la progresión del cuadro oncológico y las complicaciones asociadas a menudo al propio tratamiento oncológico concomitante limitan la supervivencia a largo plazo del paciente.
Discusión
Las descripciones actuales determinan que el manejo mínimamente invasivo de la estenosis uretral en pequeños animales ofrece una alternativa eficaz a las intervenciones quirúrgicas tradicionales, especialmente en casos de estenosis benignas. Es por ello por lo que es imperativa la distinción entre estenosis benigna y maligna para el manejo adecuado. Mientras que las estenosis benignas responden bien a técnicas como la dilatación y los stents, las estenosis malignas requieren un enfoque más agresivo y multidisciplinario, incluyendo la posible necesidad de quimioterapia y radioterapia.
Además, el diagnóstico precoz es esencial para un manejo mínimamente invasivo exitoso de la estenosis uretral, por lo que una correcta anamnesis y exploración física, combinadas con técnicas de diagnóstico por imagen juegan un papel crucial en dicho diagnóstico precoz de la estenosis, lo que permite una planificación del tratamiento más eficaz.
Respecto a la preferencia de una u otra técnica, dentro de las opciones de manejo mínimamente invasivo de la estenosis uretral, generalmente se propone la dilatación seriada con catéter balón como una posible opción de tratamiento antes de considerar la implantación de un stent. Aun así, en ocasiones, tanto la incertidumbre de requerir numerosos procedimientos de dilatación con balón, como el costo asociado al mismo, hace que muchos propietarios opten por la implantación del stent uretral como técnica de primera elección. Aunque generalmente, como se ha descrito anteriormente, la implantación de un stent a nivel uretral suele estar precedido del fracaso de uno o más procedimientos de dilatación con catéter balón.
Es de destacar que el empleo de las dilataciones con catéter balón posee un efecto limitado en aquellas patologías que cursen con compresiones extramurales de la uretra, donde evidentemente la implantación de un stent proporcionaría mejores resultados, ya que, en estas circunstancias, la dilatación uretral con balón puede tener un efecto limitado o inexistente. Aun así, cabe destacar que existen descripciones del empleo de dilataciones seriadas con catéter balón en estenosis malignas secundarias a CCT en la especie canina como manejo paliativo alternativo a la implantación de stent ureteral, con un período medio de ausencia de signos de estranguria tras una sesión de dilatación con balón de hasta 84 días. Aun así, cuando se determina que las dilataciones con catéter balón no permiten obtener el efecto esperado, es el momento de optar por un tratamiento alternativo, como la implantación de un stent uretral, la implantación de un tubo de cistostomía de bajo perfil o incluso la implantación de un catéter uretral como se ha descrito anteriormente.
En cuanto a la preferencia del tipo de stent a ser implantado a nivel uretral, existe cierto consenso a la hora de considerar como stent de elección a los metálicos autoexpandibles en lugar de los stents expandibles con balón, debido a la falta de flexibilidad de estos últimos y a la posibilidad de que se deformen por compresión. Aun así, los stents expandibles con balón permiten ser implantados en segmentos más cortos, siendo más fáciles de implantar que los autoexpandibles, por lo que, en caso de segmentos estenóticos muy cortos, pueden seguir siendo una alternativa a tener en cuenta. Además, debido a la capacidad de invasión del urotelio del lumen del stent a través de este, en el caso de los no recubiertos, independientemente de que la etiología sea una estenosis benigna o maligna, hace que los stents metálicos autoexpandibles recubiertos sean potencialmente el stent de primera elección para el manejo endoluminal de las estenosis uretrales en pequeños animales, independientemente de su etiología. Cabe destacar que, en la práctica clínica, debido al costo asociado a estos stents metálicos autoexpandibles recubiertos, muchos propietarios suelen interesarse en la implantación inicial de un stent autoexpandible metálico no recubierto, por lo que hay que informar concienzudamente de todas las repercusiones que puede conllevar la implantación de un stent no recubierto en función del tipo de estenosis.
En conclusión, el manejo mínimamente invasivo de la estenosis uretral en la especie canina y felina es una opción efectiva y viable, dependiente de la correcta diferenciación entre estenosis benigna y maligna y la selección de la técnica adecuada para el éxito del tratamiento. Así, con el avance de las tecnologías y una mejor comprensión de la fisiopatología de la estenosis uretral, se espera que el pronóstico para los pacientes afectados continúe mejorando.
Bibliografía recomendada
- Blackburn AL, Berent AC, Weisse CW, Brown DC. Evaluation of outcome following urethral stent placement for the treatment of obstructive carcinoma of the urethra in dogs: 42 cases (2004–2008).Journal of the American Veterinary Medical Association,2013; 242(1), 59-68.
- Brace MA, Weisse C, Berent A. Preliminary experience with stenting for management of non‐urolith urethral obstruction in eight cats.Veterinary surgery,2014; 43(2): 199-208.
- Della Maggiore, AM, Steffey MA, Westropp JL. Treatment of traumatic penile urethral stricture in a dog with a self-expanding, covered nitinol stent.Journal of the American Veterinary Medical Association,2013; 242(8): 1117-1121.
- Emanuel M, Berent AC, Weisse C, Donovan T, Lamb KE. Retrospective study of proliferative urethritis in dogs: Clinical presentation and outcome using various treatment modalities in 11 dogs.Journal of Veterinary Internal Medicine,2021; 35(1): 312-320.
- Griffin MA, Culp WT, Giuffrida MA, Ellis P, Tuohy J, Perry JA, ..., Kent MS. Lower urinary tract transitional cell carcinoma in cats: Clinical findings, treatments, and outcomes in 118 cases.Journal of veterinary internal medicine,2020; 34(1): 274-282.
- Hadar EN, Morgan MJ, De Morgan O. Use of a self-expanding metallic stent for the treatment of a urethral stricture in a young cat.Journal of feline medicine and surgery,2011; 13(8): 597-601.
- Hammond TN, King RG, Danielson KC. Successful management of pelvic urethral strictures with balloon dilation in 3 cats.Journal of Veterinary Emergency and Critical Care,2023; 33(3): 371-379.
- Hill TL, Berent AC, Weisse, C. W. (2014). Evaluation of urethral stent placement for benign urethral obstructions in dogs.Journal of veterinary internal medicine,28(5), 1384-1390.
- Kim S, Hosoya K, Takagi S, Okumura. Outcomes following balloon dilation for management of urethral obstruction secondary to urothelial carcinoma in dogs: 12 cases (2010–2015).Journal of the American Veterinary Medical Association,2019; 255(3): 330-335.
- Ko GY, Kim GC, Seo TS, Kim TH, Lim JO, Lee JH, Song HY. Covered, retrievable, expandable urethral nitinol stent: feasibility study in dogs. Radiology, 2002; 223(1): 83-90.
- Lulich JP. Evaluation of temporary urethral stents in the management of malignant and nonmalignant urethral diseases in dogs.Veterinary Sciences,2022; 9(2): 63.
- McMillan SK, Knapp DW, Ramos-Vara JA, Bonney PL, Adams LG. Outcome of urethral stent placement for management of urethral obstruction secondary to transitional cell carcinoma in dogs: 19 cases (2007–2010).Journal of the American Veterinary Medical Association,2012; 241(12): 1627-1632.
- Palm CA, Canvasser NE, Culp WT. Stenting of Malignant Urinary Tract Obstructions in Humans and Companion Animals.Veterinary sciences,2021; 9(1): 13.
- Pratt CL, Balakrishnan A, McGowan E, Drobatz KJ, Reineke EL. A prospective randomized, double‐blinded clinical study evaluating the efficacy and safety of bupivacaine versus morphine‐bupivacaine in caudal epidurals in cats with urethral obstruction.Journal of veterinary emergency and critical care,2020; 30(2), 170-178.
- Radhakrishnan A. Urethral stenting for obstructive uropathy utilizing digital radiography for guidance: feasibility and clinical outcome in 26 dogs.Journal of Veterinary Internal Medicine,2017; 31(2): 427-433.
- Rincon Alvarez J, Smith V, Broome C. Fluoroscopy-guided balloon dilation of a proximal urethral stricture caused by a urethral membrane in a female cat.Journal of feline medicine and surgery open reports,2019; 5(2): 2055116919867177.
- Robben JH. A novel insertion technique for urinary catheters in female dogs with the use of a guidewire.Journal of Veterinary Emergency and Critical Care,2020; 30(5): 597-600.
- Schwartz P. Current concepts in urinary surgery.Veterinary Clinics: Small Animal Practice,2022; 52(2): 387-417.
- Weisse C, Berent A, Todd K, Clifford C, Solomon J. Evaluation of palliative stenting for management of malignant urethral obstructions in dogs.Journal of the American Veterinary Medical Association, 2006; 229(2): 226-234.
- Wood MW, Vaden S, Cerda-Gonzalez S, Keene B. Cystoscopic-guided balloon dilation of a urethral stricture in a female dog.The Canadian Veterinary Journal,2007; 48(7): 731.
 by Multimédica
by Multimédica