Shunt portosistémico extrahepático asociado a situs inversus abdominalis y agenesia segmentaria de vena cava abdominal. Reporte clínico quirúrgico
Resumen breve
Se presenta a consulta un paciente canino, Dachshund, macho de 5 meses, con antecedentes clínicos compatibles con shunt portosistémico extra hepático (SPS EH). La anamnesis reportaba antecedentes de menor crecimiento y peso corporal para su raza y edad, y episodios leves de encefalopatía hepática post prandrial.Índice de contenidos

Caso clínico
Se presenta a consulta un paciente canino, Dachshund, macho de 5 meses, con antecedentes clínicos compatibles con shunt portosistémico extra hepático (SPS EH). La anamnesis reportaba antecedentes de menor crecimiento y peso corporal para su raza y edad, y episodios leves de encefalopatía hepática post prandrial.
Los datos relevantes de la analítica sanguínea revelaban valores bajos de uremia y albuminemia e incremento de ácidos biliares pre y post pandriales.
Luego de una primera ecografía, donde se visualizaba microhepatia sugerente de SPS EH, se solicitó un ecoDoppler abdominal confirmatorio con un profesional certificado en ultrasonografía vascular. Los principales hallazgos del segundo estudio revelaron:
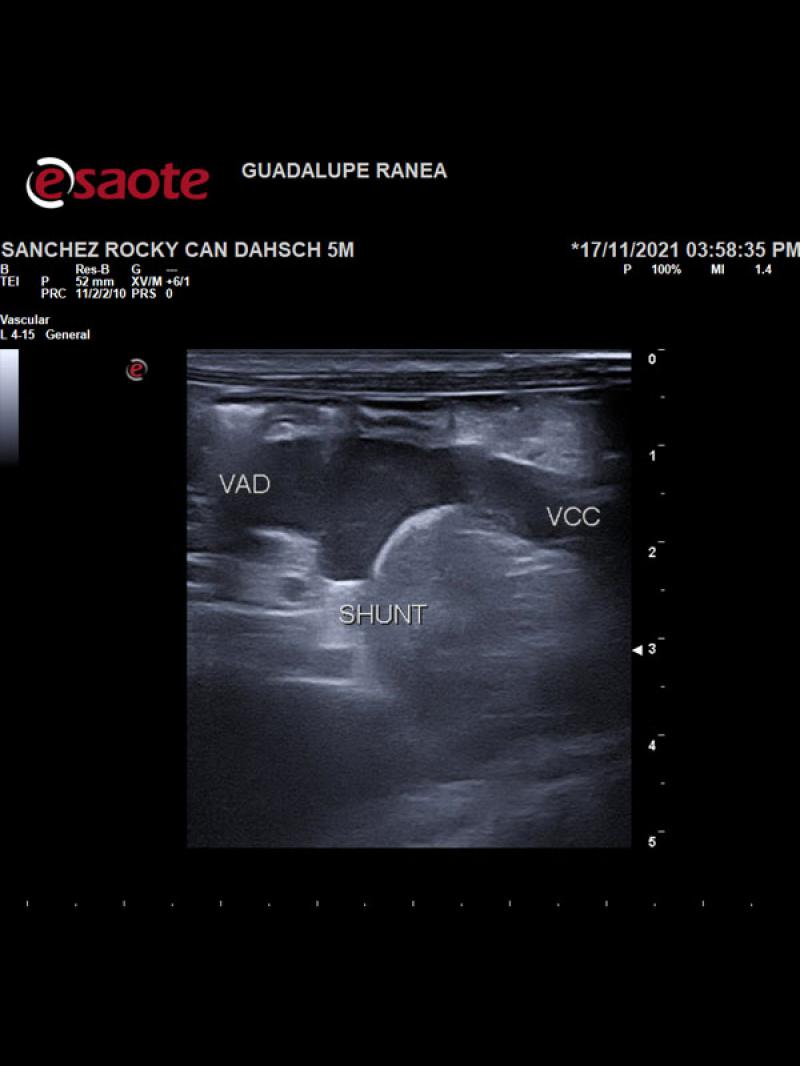
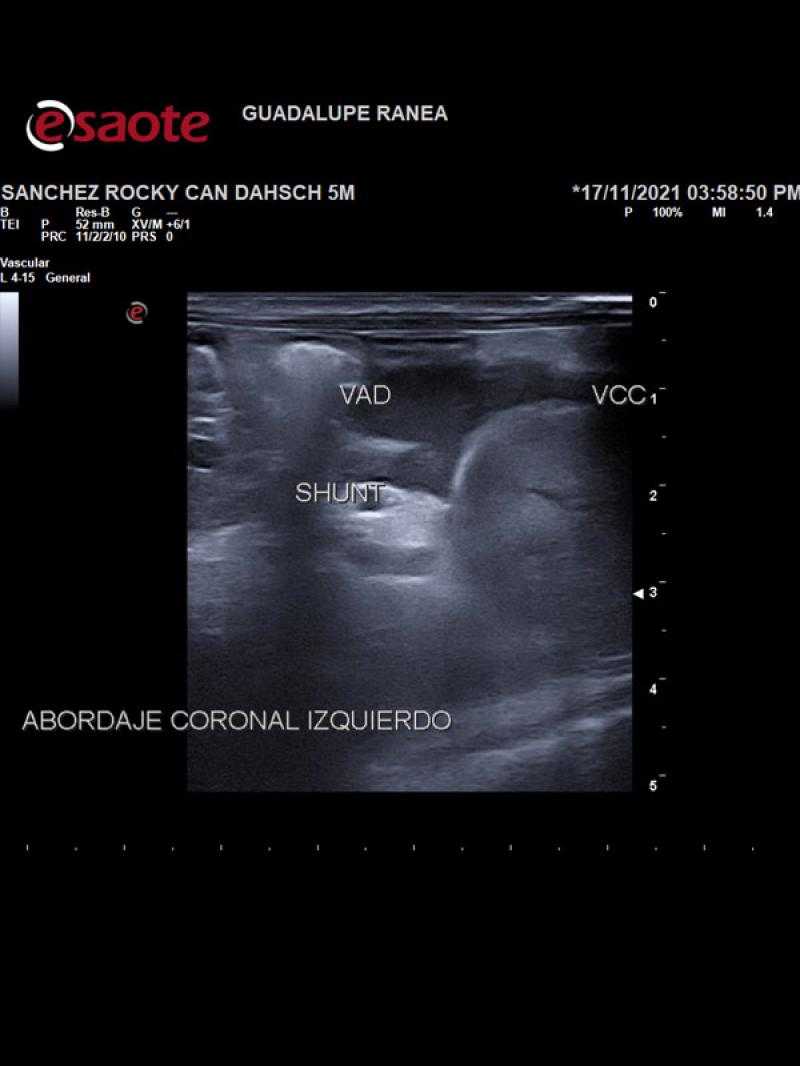
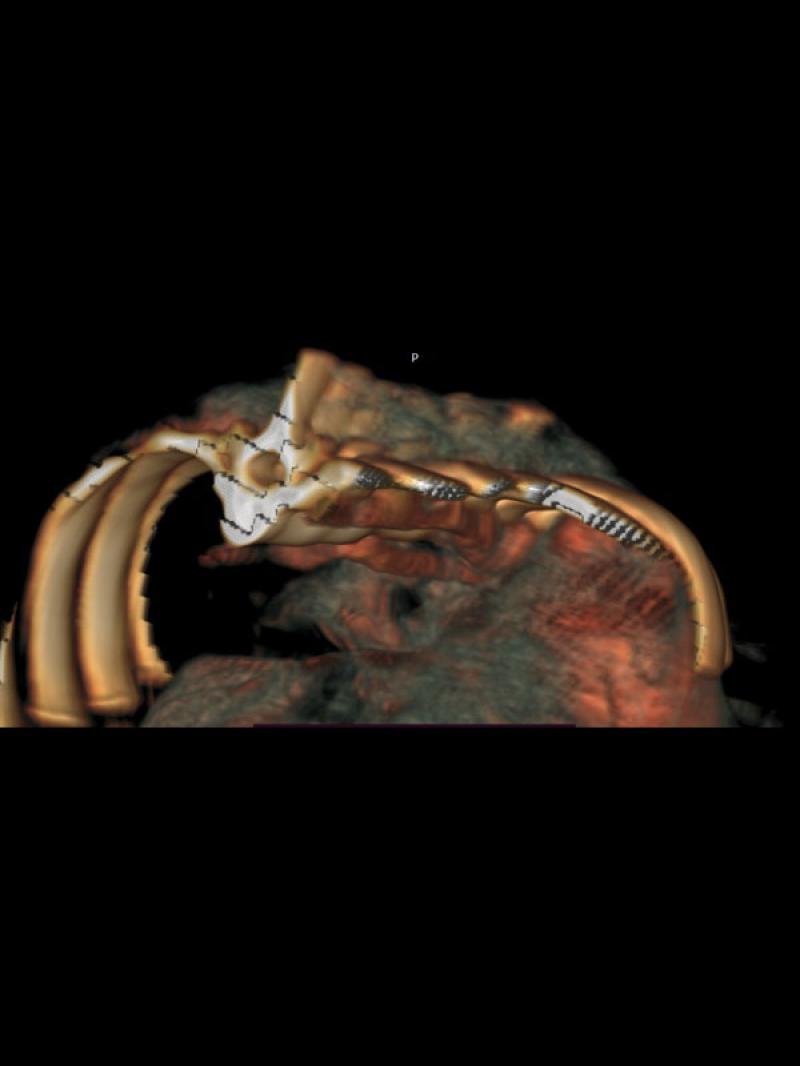
- Posición anómala de la vena cava caudal hacia la izquierda del plano medio con una dilatación sacular de 8.9 mm de diámetro a la altura de las primeras vértebras lumbares con un flujo venoso turbulento de alta velocidad circulatoria. Luego de la dilatación se observa un vaso venoso sublumbar de diámetro superior a la vena cava pre venectasia (Figura 1).
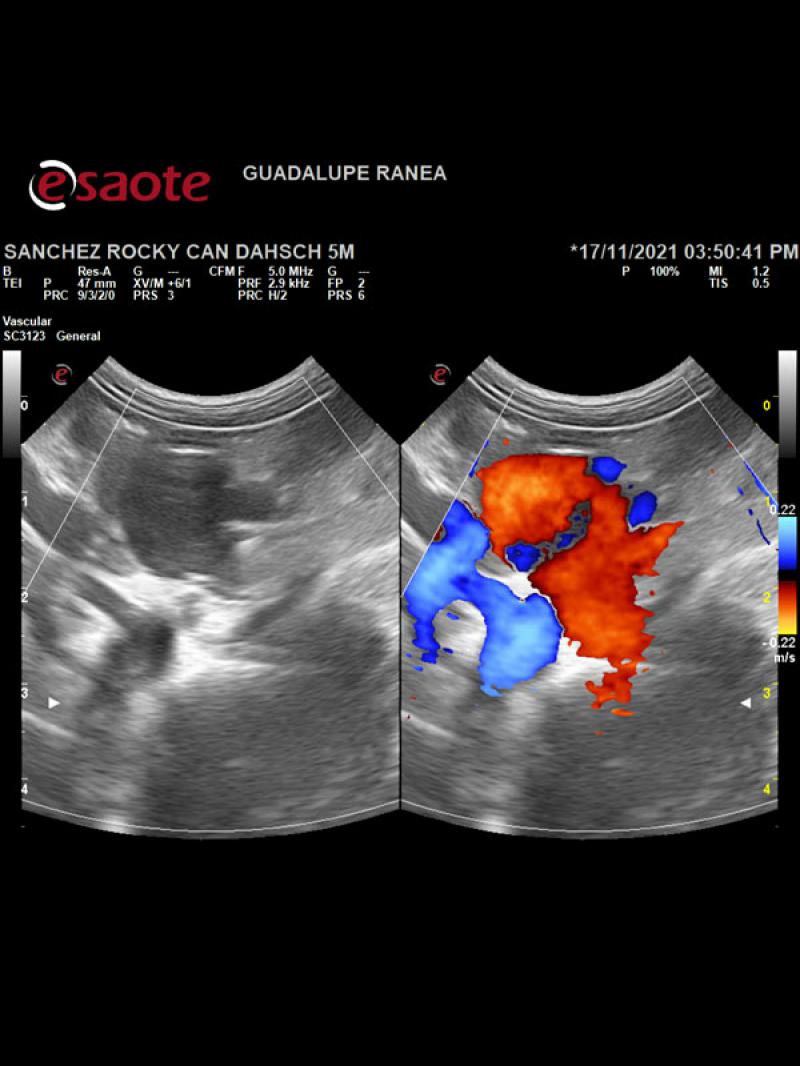
- Presencia de un vaso anómalo en el abdomen craneal izquierdo que aboca a la cara ventral de la vena cava caudal, a la altura de la dilatación sacular con flujo venoso hepatófugo (Figuras 2 y 3).
- Disposición espacial anómala de los órganos abdominales en posición invertida o en “espejo” respecto a la anatomía normal.
El paciente ingresó a UCI por un cuadro de encefalopatía hepática asociado a la derivación portosistémica congénita, de esta manera se procede a estabilizarlo por medio del uso de enemas de evacuación con lactulosa. La respuesta a la terapia básica es escasa por lo que se plantea uso de emulsiones lipídicas (ELI) en forma intravenosa a 1.5 ml/kg IV lento y luego 0.25 ml/kg/h a IRC en 60 minutos, ya que existen reportes del uso de las ELI en cuadros de encefalopatía hepática con resultados positivos. El paciente comienza a evidenciar una notable mejora en su condición neurológica a las pocas horas, por lo que se prosigue con la terapia base basada en dieta hepática, lactulosa vía oral y antibioticoterapia. Una vez logrado un estado clínico neurológico normal se da de alta al paciente y continúa con terapia en forma ambulatoria por 10 días (de acuerdo a protocolo) y se lo prepara en forma electiva para el procedimiento quirúrgico.
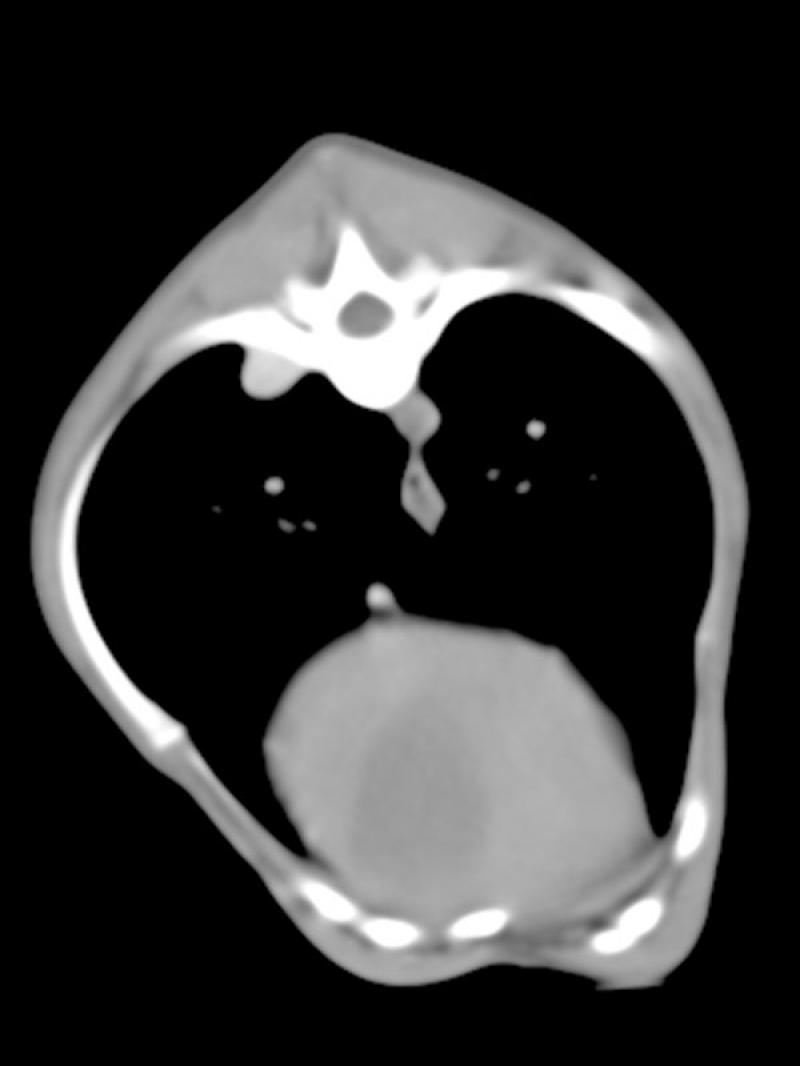
Se complementó el diagnóstico con una angio TC toraco abdominal, que reveló un gran desarrollo de la vena ácigos (VA), que triplicaba en su volumen a la vena cava caudal intratorácica (VCC) (Figuras 4 y 5).
Los datos anatómicos que se tenían de referencia para la ubicación espacial durante la exploración eran:
- Sospecha de SPS porto ácigos
- Vena porta y VCC abdominal en posición izquierda
- Duodeno en posición izquierda
- Colon en posición derecha
- Bazo en posición derecha
Se realizó una celiotomía xifo retroumbinical exploratoria. La observación in situ reveló el bazo trilobulado en posición izquierda. Se evidenció la microhepatia, se realizó biopsia hepática y se constató posición de vesícula biliar y colédoco con recorrido izquierdo. Se exploró el territorio parieto meso colónico derecho. Al traccionar del duodeno hacia medial se pudo identificar a las venas ilíacas que conformaban la VCC, donde la misma luego de recibir las dos venas renales y el SPS (Figura 6), se continuaba del lado izquierdo como una “gran” vena ácigos.
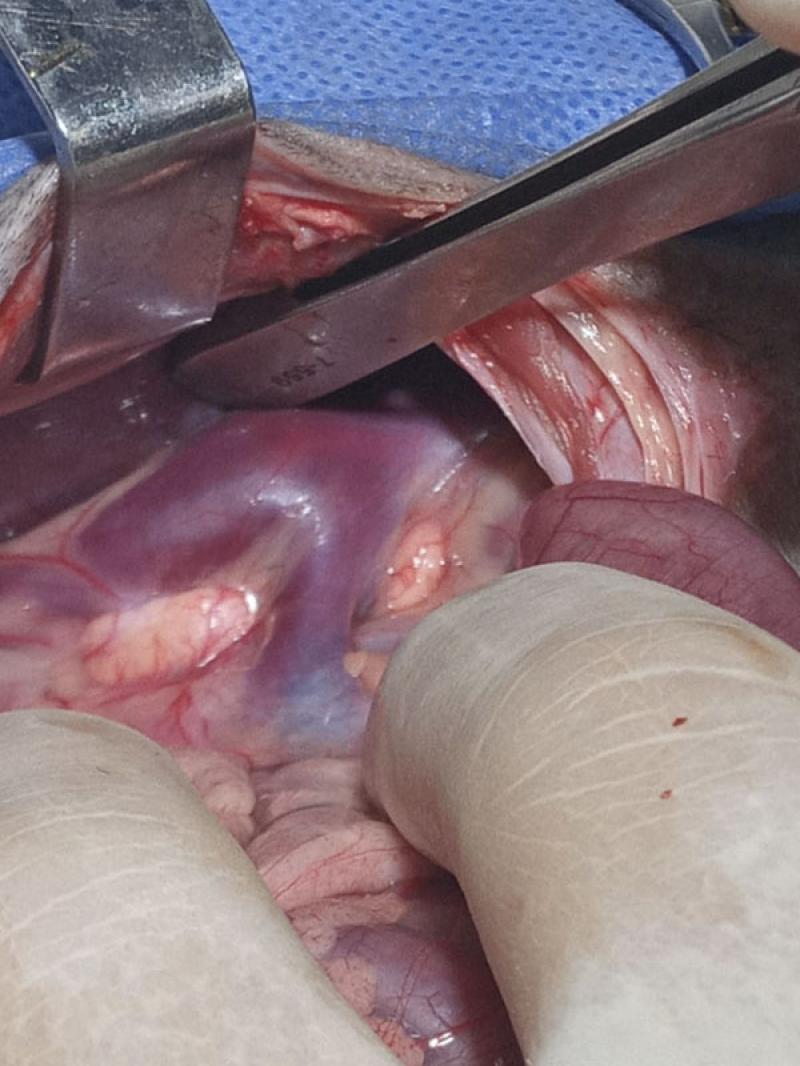
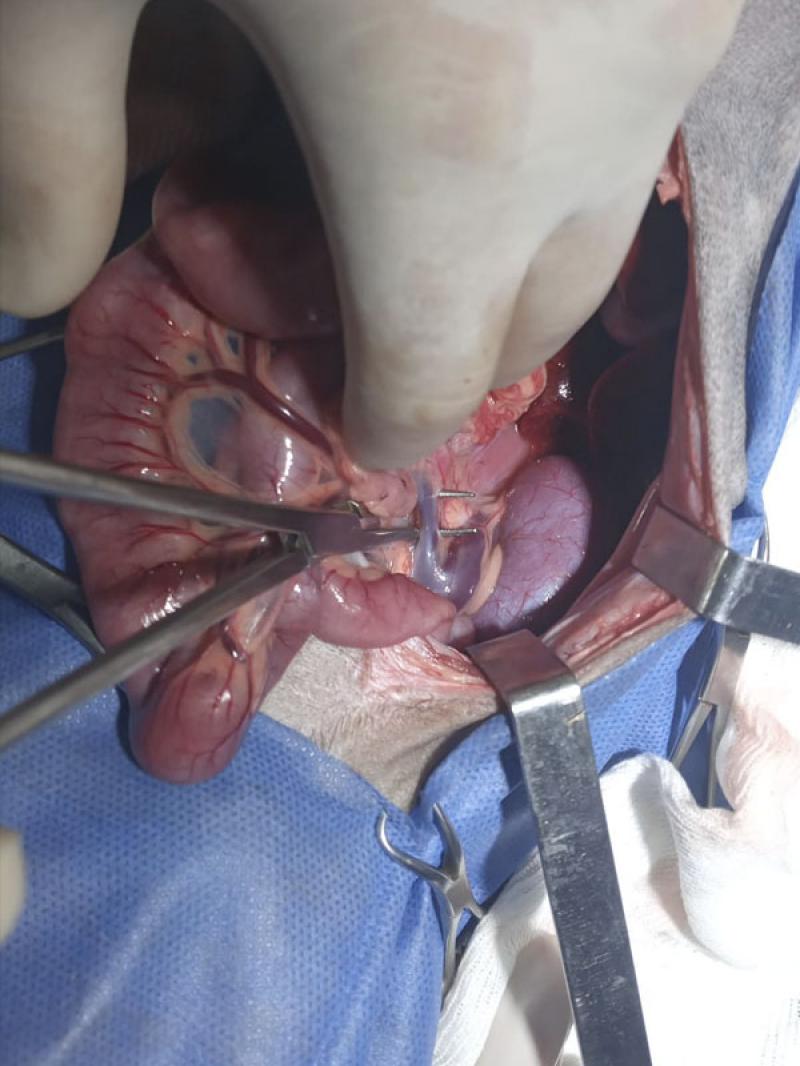
El SPS fue atenuado con banda de celofán y tres clips de titanio en su punto de desembocadura (Figura 7-8). La exploración abdominal, junto a los datos de imágenes previos terminaron de concluir que el paciente tenía una aplasia “segmentaria” de VCC abdominal. La misma, volvía a formarse en posición intratorácica como vena cava caudal para recepcionar las venas hepáticas, con un calibre 3 veces menor que la VA.
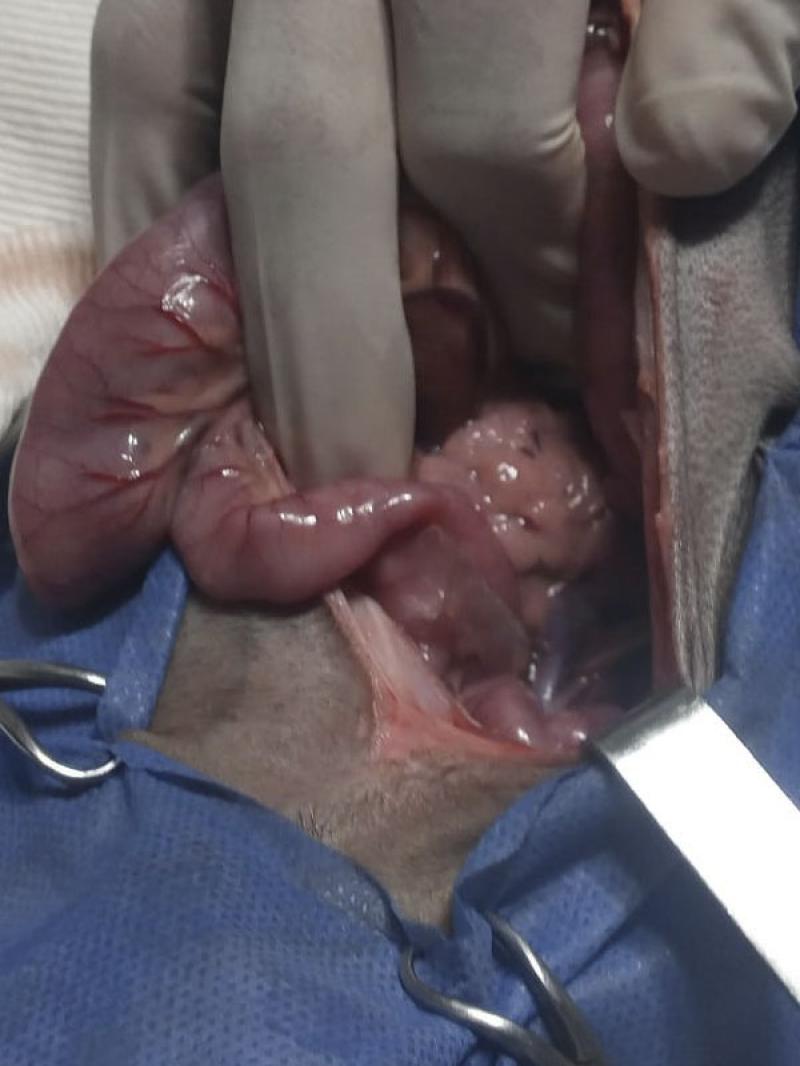
Luego de la síntesis, el paciente se recuperó en UCI sin complicaciones y fue externado a las 48 horas con indicaciones de mantener dieta hepática y lactulon cada 12 horas.
A los 30 días postoperatorios el paciente incrementó su actividad física y peso corporal. En el Doppler control se evidenció aumento del tamaño hepático, con flujo venoso portal en el mínimo del rango normal. No se observó flujo residual en el sitio de atenuación, mientras que la vena ácigos mantuvo su dilatación con un flujo laminar de alta velocidad circulatoria de 88.7 cm/seg.
La histopatología hepática informó espacios portas con incremento de conductillos biliares, arteriolas dilatadas, venas imperceptibles y hepatocitos con cambios vacuolares hidrópicos, con ausencia de cambios inflamatorios.
Discusión y conclusiones
La frecuencia de variantes de SPSEH en perros se concentran en el 94 % de los casos en los siguientes tipos: espleno-cava, gástrica izquierda-frénica, gástrica izquierda-ácigos y las originadas en gástrica derecha1.
Dentro de los métodos de diagnóstico por imágenes de mayor sensibilidad se utiliza la ecografía Doppler y angio tomografía computada con reconstrucción 3D, complementados según necesidad por la venoportografía y los hallazgos anatómicos durante la observación directa intraoperatoria.
Aproximadamente un 25 % de los SPSEH tienen derivación hacia la vena ácigos. La caracterización preoperatoria de esta variante de shunt puede complementarse con el uso de angioTC, dando información precisa de su inserción luego de avanzar hacia el tórax por el hiato esofágico2. Pueden presentarse diferentes tipos de SPS porto ácigos con mínimas variaciones.
La presencia de anomalías vasculares asociadas como la aplasia segmentaria de VCC es atípica. Los segmentos de la vena cava abdominal derivan embriológicamente de las venas supra y subcardinales y vitelina3. La retención del segmento medio de la vena supracardinal determina la continuidad embriológica entre la vena cava caudal y la vena ácigos. En humanos esta rara condición tiene una incidencia del 0.005 % y puede estar asociada a presentaciones clínicas de trombosis venosas profundas4,5.
A su vez la presentación de situs inversus abdominales, agrega un punto de dificultad para la exploración quirúrgica, teniendo que tener una ubicación espacial en espejo en relación a la anatomía normal. Aunque no hay datos epidemiológicos de su presentación en perros, la incidencia en humanos es de 1 en 10.000. Esta condición puede ser asintomática o venir asociada en los situs inversus totalis al “Kartagener’s síndrome”, el cual fue descripto también en medicina veterinaria6.
En el presente caso las etapas diagnósticas colaboraron en el diagnóstico final y en la toma de decisiones. La ecografía Doppler describió la inversión de los órganos abdominales y la desembocadura de un vaso anómalo en posición cercana al riñón izquierdo, mientras que la angio TC orientó sobre la discordancia cavo-ácigos, con una relación 1/3 intratorácica. Finalmente, la exploración quirúrgica definió la aplasia segmentaria de VCC abdominal.
Durante la cirugía, se recomienda siempre la colocación de dispositivos de oclusión gradual lo más cercano a los sitios de desembocadura de los SPP EH. La errónea interpretación de la anatomía vascular de este caso podría haber llevado al error de colocar el dispositivo a nivel de los pilares del diafragma, confundiendo un SPS EH porto ácigos clásico en un paciente con situs inversus y agenesia segmentaria de VCC.
Actualmente, el paciente se encuentra clínicamente estable y mantiene su flujo venoso de retorno caudal de modo ácigos dominante, mientras que la VCC intratorácica recoge solo el flujo venoso hepático. Según la ley de Poiseuille, hay más resistencia al flujo en un SPS porto-ácigos que en un porto-cava, dado que el diámetro de la vena ácigos es considerablemente menor que el de la vena cava. En este paciente, esta interpretación física estaba alterada debido a la inversión de diámetros de estos vasos a nivel intratorácico.
El abordaje interdisciplinario en imágenes, la planificación y discusión con el grupo de trabajo, llevan a poder arribar a un diagnóstico y terapéutica correcta en casos de SPS EH de presentación no habitual y con patologías vasculares concomitantes.
Bibliografía
- White R, Shales C, Parry A. New perspectives on the development of extrahepatic portosystemic shunts. Journal of Small Animal Practice (2017). DOI: 10.1111/jsap.12728
- Or M, Ishigaki K, de Rooster H, Kutar K, Asano K. Determination of Porto-Azygos Shunt Anatomy in Dogs by Computed Tomography Angiography.2016. Veterinary Surgery.
- Lohse CL, Selcer RR, Suter PF. Hepatoencephalopathy associated with situs inversus of abdominal organs and vascular anomalies in a dog. J. Am. Vet. Med. Assoc. 1976. 168: 681–688.
- Morosetti D, Picchi E, Calcagni A, Lamacchia F, Cavallo A, Bozzi A, et al. Anomalous development of the inferior vena cava: Case reports of agenesis and hypoplasia. Radiol Case Rep 2018; 13 (4): 895-903.
- Leitão A, Esteves J, Abreu J, Pereira A, Boncoraglio M, Certo M, et al. Deep Venous Thrombosis and a Very Rare Finding: Inferior Vena Cava Infra-renal Segment Agenesis. Eur J Case Rep Intern Med 2019; 6(3): 1.
- August JR, Teer PA, Bartels JE. Kartagener’s syndrome in a dog. J Am Anim Hosp Assoc 1982;18:822-826
- Heejin O, Jisun K, Yeonho B, Juyeon O, Seungjo P, Gahyun L, Sunghoon J,Jihye C Computed Tomography Angiography of Situs Inversus, Portosystemic Shunt and Multiple Vena Cava Anomalies in a Dog. J. Vet. Med. Sci. 75(11): 1525–1528, 2013
 by Multimédica
by Multimédica