Tratamiento de la obstrucción ureteral mediante técnicas guiadas por imagen
Resumen breve
La obstrucción ureteral (OU) es una entidad clínica de difícil manejo en pequeños animales. En este trabajo se presentan los dos procedimientos que se consideran de elección en el tratamiento inicial de la obstrucción ureteral en pequeños animales: los stents ureterales o catéteres ureterales doble jota (catéter JJ) y el bypass ureteral. Estas técnicas de derivación urinaria guiadas por imagen, están desplazando a los procedimientos tradicionales.Índice de contenidos
Introducción
La obstrucción ureteral (OU) es una entidad clínica de difícil manejo en pequeños animales. Su incidencia se ha incrementado significativamente en las últimas décadas, como consecuencia, probablemente, de la mejora en las técnicas de diagnóstico por imagen. Las principales causas de OU son la ureterolitiasis, la estenosis ureteral, los coágulos sanguíneos, la ligadura iatrogénica del uréter, la existencia de uréter circuncavo, así como cuadros de fibrosis retroperitoneal o neoplasias (Tabla 1).
| - | Benigna | Maligna |
|---|---|---|
| Intraluminal |
| - |
| Mural |
|
|
| Extrínseca |
|
|
Tabla 1. Etiología de la obstrucción ureteral.
Los signos clínicos del paciente con OU pueden ser inespecíficos, generalmente caracterizado por un cuadro de letargia, disminución del apetito/anorexia, vómitos, poliuria/polidipsia, dolor abdominal, pérdida ponderal o incluso con la presencia de signos de tracto urinario inferior. Cabe destacar que la severidad del cuadro clínico va a depender de la función del riñón contralateral, así como de la presencia de otras comorbilidades.
El diagnóstico de OU requiere una exhaustiva exploración y anamnesis del paciente, en combinación con análisis laboratoriales (hemograma, bioquímica sanguínea, urianálisis) y pruebas de imagen. La anomalía sanguínea más frecuente es la azotemia, que se puede acompañar de anemia, neutrofilia, hiperfosfatemia e hiperkalemia. La ecografía y la radiografía son esenciales para establecer el diagnóstico final de OU. Se han descrito tasas de sensibilidad del 81 % del estudio radiográfico simple del abdomen para el diagnóstico de litiasis ureterales. Por su parte, la ecografía ofrece información sobre la apariencia ecográfica del parénquima renal y la dilatación del sistema colector superior; aunque su sensibilidad puede ser limitada ante determinadas causas de obstrucción (Figura 1).
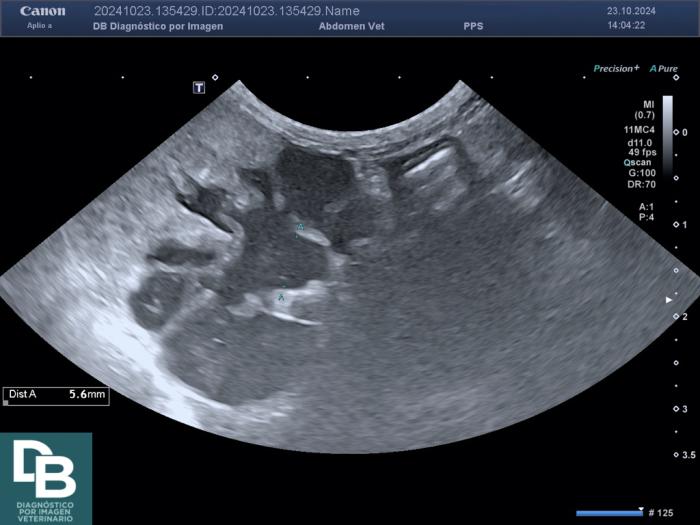
Figura 1. Valororación ultrasonográfica de paciente felino monorreno con azotemia moderada. (A) Hidronefrosis G-III. (B) Hidrouréter por litiasis en uréter proximal (imágenes cedidas por cortesía de DiezBru-Diagnóstico por Imagen Veterinario).
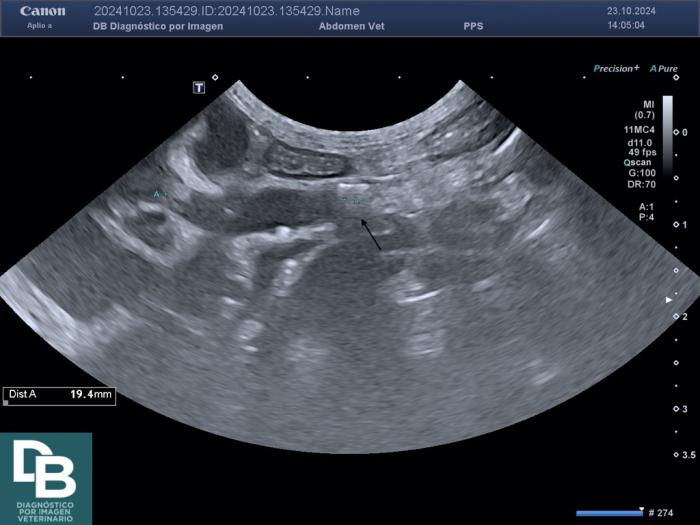
La dilatación de la pelvis renal por encima de los 13 mm es suficiente para establecer el diagnóstico de OU, aun cuando no se haya identificado su etiología. Sin embargo, una dilatación menor no excluye la existencia de una OU. En estos casos, la pielografía anterógrada ofrece una buena opacificación de la vía urinaria superior para identificar la OU, pero es un procedimiento invasivo, motivo por el cual tan solo está indicada cuando su resultado implique un cambio en el planteamiento terapéutico del caso.
Por otro lado, la OU desencadena una serie de mecanismos fisiopatológicos que conducen a una atrofia renal. A las 24 horas de la obstrucción existe una marcada reducción del flujo sanguíneo renal y comienza a instaurarse un infiltrado inflamatorio en el parénquima renal que produce apoptosis, deposición de proteínas matriz e inducción de una fibrosis renal progresiva. La evolución de estos mecanismos de fibrosis puede continuar incluso tras la resolución de la obstrucción. Por todo ello, el tratamiento de la obstrucción ureteral debe realizarse tan pronto como sea posible. La respuesta renal a la resolución de la obstrucción ureteral depende de varios factores como la duración y severidad de la obstrucción, la edad del paciente, la compliancia ureteral, la presencia de enfermedad renal preexistente y la función del riñón contralateral.
En aquellos pacientes estables con OU intraluminal y una dilatación discreta de la pelvis renal, se puede instaurar un tratamiento médico encaminado a hacer descender la litiasis hasta la vejiga de la orina. Aunque el porcentaje de éxito es limitado, este se basa en la administración agentes relajantes de la musculatura lisa ureteral, junto con un incremento de la diuresis (Tabla 2).
| Medicación | Dosis | Efecto | Observaciones |
|---|---|---|---|
| Fluidoterapia | 4-5 ml/kg/h | Incremento del volumen intravascular, mejorando la perfusión y oxigenación de órganos y mantenimiento de la hidratación | Suplementación en función de los desequilibrios electrólitos Monitorización del peso corporal y estado de hidratación para prevenir la sobrecarga por fluidos |
| Glucagón | 0.05-0.1 mg/gato/8-24 h IV | Relajación de la musculatura lisa ureteral y resolución de cólico ureteral | Puede causar vómitos, diarrea, náuseas e hipokalemia |
| Prazosina | 0.25-0.5 mg/gato/12-24 h PO | Relajación de la musculatura lisa ureteral | Puede causar sedación, elevación del tercer párpado, hipotensión |
| Tamsulosina | 0.004-0.006 mg/kg/12-24 h PO | Relajación de la musculatura lisa ureteral | Pocos estudios en cuanto a dosificación y seguridad Puede causar letargia, vómitos e hipotensión |
| Manitol | Bolo: 0.25 mg/kg en 30-60 min Infusión continua 60 mg/kg/h, durante 24 horas | Diurético osmótico para incrementar el flujo de orina a través del uréter | Contraindicado en anuria y sobrecarga de fluidos Puede causar sobrecarga de fluidos en paciente con enfermedad cardíaca o sobrehidratado |
Tabla 2. Manejo médico de la obstrucción ureteral.
Este tratamiento no debe prolongarse más de 24-72 horas y requiere de una estrecha monitorización de los parámetros de funcionalidad renal y dilatación del sistema colector superior, con el fin de proceder al planteamiento quirúrgico ante un empeoramiento de los mismos.
Asimismo, en los pacientes que se presentan azotémicos, también se instaura un tratamiento médico para su estabilización previa a la cirugía, que consiste en el manejo de la insuficiencia renal mediante fluidoterapia con cristaloides isotónicos, además de los agentes relajantes de la musculatura lisa ureteral, la corrección de la hiperfosfatemia/hiperkalemia/desequilibrios electrolíticos que estén presentes, así como analgesia y profilaxis antibiótica si estuviera indicada. Resulta fundamental evitar una sobrecarga de fluidos, ya que se relaciona con una disminución en la tasa de supervivencia (Tabla 3).
|
Tabla 3. Signos de sobrecarga hídrica en el paciente con fluidoterapia.
Si a pesar del tratamiento médico, el paciente continúa oligúrico/anúrico, hay una azotemia/hiperkalemia progresiva o empeoramiento de la hidronefrosis, es necesario suspender el tratamiento y recurrir a otras alternativas terapéuticas. Las terapias de reemplazo renal están indicadas en hiperkalemias severas que cursen con alteraciones cardíacas y no respondan al tratamiento médico. En ocasiones, no es posible una estabilización adecuada previa a la cirugía y los tutores deben ser debidamente informados del riesgo anestésico que esto supone.
Finalmente hay que destacar que las técnicas quirúrgicas tradicionales para la resolución de las OUs presentan una elevada tasa de complicaciones, fracaso a medio-largo plazo y morbimortalidad asociadas. Por este motivo, en las últimas décadas se ha evidenciado una expansión e implantación de los procedimientos endourológicos guiados por imagen. En este trabajo se presentan los dos procedimientos que se consideran de elección en el tratamiento inicial de la obstrucción ureteral en pequeños animales: los stents ureterales o catéteres ureterales doble jota (catéter JJ) y el bypass ureteral.
Catéter ureteral doble jota
Descripción
El catéter JJ es un dispositivo tubular hueco que discurre por el interior del uréter. Su sistema autorretentivo se fundamenta en la modificación en forma de bucle o pig-tail de sus extremos, que quedan alojados en el interior de la pelvis renal (extremo proximal) y vejiga de la orina (extremo distal) (Figura 2A-C).

Figura 2. Catéter ureteral doble jota. (A) Catéter ureteral doble jota, extremo proximal (flecha roja), extremo distal (flecha verde). (B) Guía hidrofílica (flechas amarillas) en el canal del catéter ureteral doble jota, rectificación de extremos proximal (flecha roja) y distal (flecha verde). (C) Detalle del extremo próxima del catéter JJ con orificios laterales (flechas blancas).


Estos extremos están dotados de memoria térmica. Es decir, se pueden rectificar al introducir una guía por el interior del catéter y adquieren su forma enrollada al retirar esta guía. Poseen a lo largo de toda su longitud, una serie de orificios laterales que favorecen el drenaje de orina por el interior del dispositivo. Están fabricados habitualmente de un material plástico, poliuretano o silicona, con una cubierta hidrofílica. Al tratarse de superficies poliméricas con una alta porosidad, estos materiales predisponen al desarrollo de biofilm bacteriano o incrustaciones sobre su superficie. En este sentido, la silicona ha demostrado mayor resistencia que el poliuretano, por lo que es de elección cuando la indicación de la colocación del catéter JJ sea a largo plazo o de manera permanente; o bien en aquellos pacientes que ya han desarrollado estas complicaciones y es necesario reemplazar los catéteres. Con menor frecuencia, los catéteres JJ también pueden ser metálicos, aunque hasta el momento, no existen trabajos que valoren su seguridad y efectividad en pequeños animales.
El catéter JJ ocasiona una dilatación pasiva de la vía urinaria superior. Esta dilatación se desarrolla de manera paulatina, siendo óptima entre las 3-6 semanas posteriores a su implantación. Se trata de un efecto fisiopatológico que los catéteres JJ causan sobre el uréter y que puede aprovecharse con fines profilácticos y terapéuticos (Tabla 4).
| Indicación | Objetivo | Uso |
|---|---|---|
Profiláctica | Previo a una intervención en el tracto urinario superior:
| Temporal 3-8 semanas |
| Profiláctica | Posterior a una intervención en el tracto urinario superior:
| Temporal 3-8 semanas |
| Terapéutica | Pionefrosis obstructiva | Temporal 1-3 meses |
| Terapéutica | Obstrucción ureteral benigna | Temporal/permanente |
| Terapéutica | Obstrucción ureteral maligna | Permanente |
| Terapéutica | Traumatismo ureteral | Temporal 4-8 semanas |
Tabla 4. Indicaciones de los catéteres JJ.
Así, el empleo de un catéter JJ persigue diferentes objetivos, como favorecer el drenaje de orina, ayudar a eliminar una infección del tracto urinario superior, facilitar el descenso de litiasis o coágulos o preparar al uréter para una intervención posterior. Si se implanta después de una intervención en el tracto urinario superior (ureterotomía, plastia o acceso endourológico) el catéter JJ ayuda a una correcta cicatrización, previniendo la fuga de orina, el desarrollo de estenosis y la obstrucción por edema o inflamación. Por estos motivos, la tendencia actual es implantar un catéter JJ durante 3-6 semanas previa a una intervención ureteral; así como 8 semanas después de la realización de la misma, momento en el que se considera cicatrizada la capa muscular del uréter. En todos estos casos, el catéter JJ tiene un uso temporal, con el objetivo de que, tras su retirada, la vía urinaria quede permeable y libre de las complicaciones que a largo plazo ocasionan los dispositivos urinarios permanentes. En cuanto a las indicaciones terapéuticas, los catéteres JJ se consideran el tratamiento de elección en los casos de obstrucciones urinarias, principalmente pionefrosis obstructiva, ayudando a resolver la infección, garantizando el drenaje urinario y preparando el uréter para una posible intervención posterior, así como obstrucciones ureterales benignas, pudiendo emplearse como tratamiento definitivo o bien como adyuvante de otra intervención. También se ha descrito en casos de obstrucciones ureterales malignas como uso permanente, por lo que se aconseja seleccionar materiales resistentes y de larga duración, así como en casos de traumatismo/iatrogenia ureteral.
| Paciente | Diámetro catéter ureteral | Guía hidrofílica | Abordaje |
|---|---|---|---|
| Especie felina - hembra | 2.4-2.5 F | 0.016-0.018” |
|
| Especie felina - macho | 2.4-2.5 F | 0.016-0.018” | Cistotomía abierta |
| Especie canina < 5 kg - hembra | 3-3.7 F | 0.025” |
|
| Especie canina < 5 kg - macho | 3-3.7 F | 0.025” | Cistotomía abierta |
| Especie canina 5-35 kg - hembra | 4-5 F | 0.035“ | Abordaje endoscópico transuretral:
|
| Especie canina 5-35 kg - macho | 4-5 F | 0.035“ | Abordaje endoscópico transuretral: endoscopio flexible de 2,8 mm y 1,2 mm canal de trabajo |
| Especie canina >35 kg - hembra | 5-7 F, considera longitud > 22 cm | 0.035-0.038” | 0.035-0.038”Abordaje endoscópico transuretral: cistoscopio rígido: óptica de 4 mm y 30º + vaina externa |
| Especie canina >35 kg - macho | 5-7 F, considera longitud > 22 cm | 0.035-0.038” | Abordaje endoscópico transuretral: endoscopio flexible de 2.8-3.5 mm y canal de trabajo > 1.2 mm |
Tabla 5. Equipamiento y material específico para la disposición de un catéter ureteral doble jota.
La disposición de un catéter JJ requiere del siguiente material auxiliar (Tabla 5):
- Catéter ureteral doble jota de tamaño adecuado para el paciente.
- Guía hidrofílica, posee un extremo atraumático que puede ser recto o curvo (Figura 3).
- Catéter centimetrado con marcas radioopacas para la determinación de la longitud ureteral.
- Catéter de lavado ureteral (Figura 4).
- Empujador o pusher, empleado para hacer avanzar el catéter JJ durante el acceso endoscópico (Figura 5).
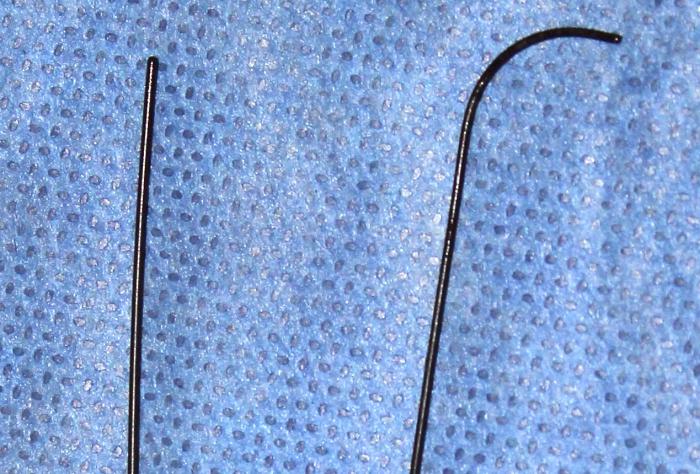
Figura 3. Detalle del extremo atraumático de la guía hifrofílica recto (izquierda) y curvo (derecha).

Figura 4. Catéter ureteral de lavado.

Figura 5. Empujado o pusher con marca radioopaca en extremo proximal.
En cuanto al equipamiento necesario, se aconseja realizar el procedimiento bajo control fluoroscópico y es recomendable disponer de apoyo ecográfico para algunos pacientes. Si el abordaje es endoscópico, resulta más útil el empleo de un cistoscopio rígido para las hembras de las especies canina y felina, mientras que en perros se suele usar un cistoscopio flexible de 2.8 mm o menor (ver Tabla 5).
Técnica
La implantación del catéter ureteral doble jota se puede llevar a cabo vía retrógrada, desde el orificio ureteral hasta la pelvis renal, o anterógrada, es decir, desde la pelvis renal hasta la vejiga de la orina.
El abordaje retrógrado es de elección siempre que sea posible, ya que minimiza el traumatismo del parénquima renal. No obstante, en ocasiones es necesario recurrir al acceso anterógrado debido a la imposibilidad de conseguir la cateterización ureteral, como en casos de obstrucciones secundarias a neoplasias del trígono vesical, o bien por alteraciones morfológicas en las que no es posible ascender la guía hidrofílica. A su vez, el abordaje retrógrado se puede establecer mediante un acceso endoscópico (Figura 6A-G) o asistido por cirugía (Figura 7A-B).
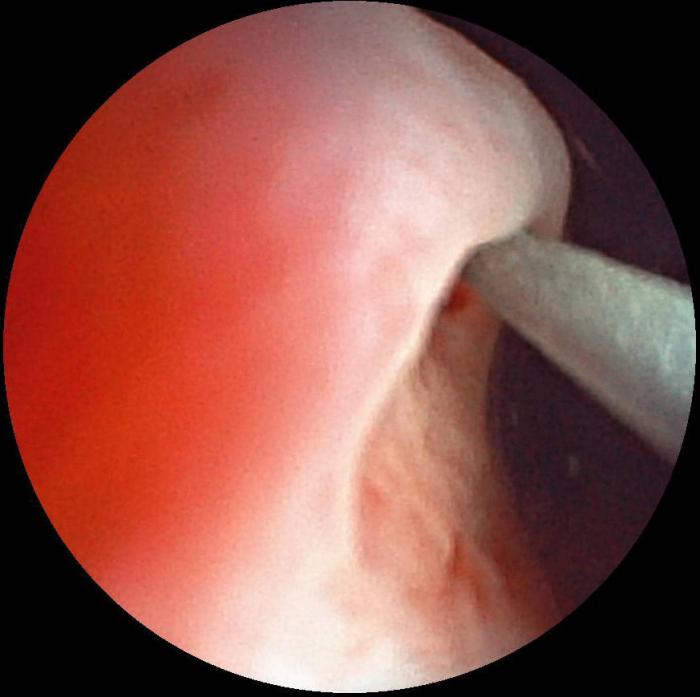
Figura 6. Implantación de catéter JJ en abordaje endoscópico retrógrado. (A) Cateterización endoscópica con guía hidrofílica. (B) Ascenso de guía hidrofílica (flecha verde) por el uréter (control fluoroscópico). (C) Ascenso de guía hidrofílica (flecha verde) hasta pelvis renal con formación de bucle (control fluoroscópico). (D) Rectificación de guía hidrofílica (flecha verde) y eliminación del bucle. (E) Intercambio de guía hidrofílica (flecha verde) por catéter de lavado (flecha roja) para ureteropielografía retrógrada. (F) Ureteropielografía retrógrada con contraste iodado al 50 %. (G) Posicionamiento de pig-tail proximal del catéter JJ.
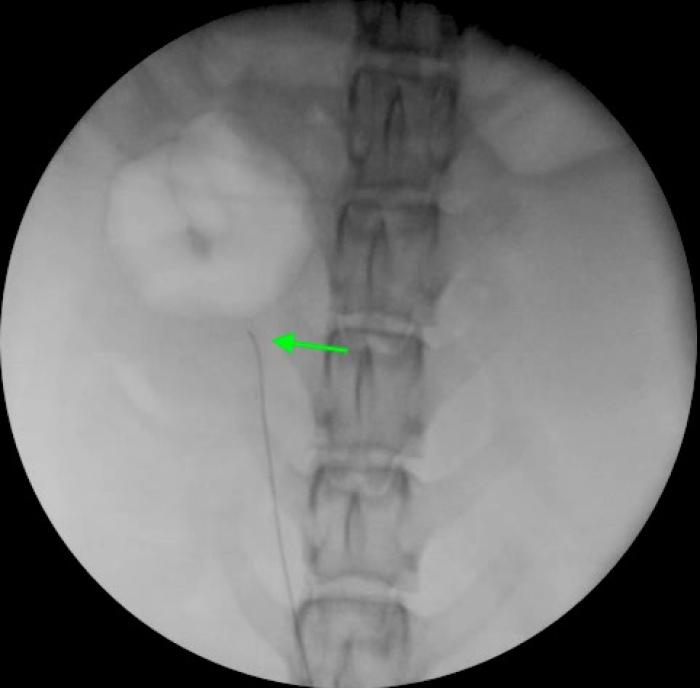
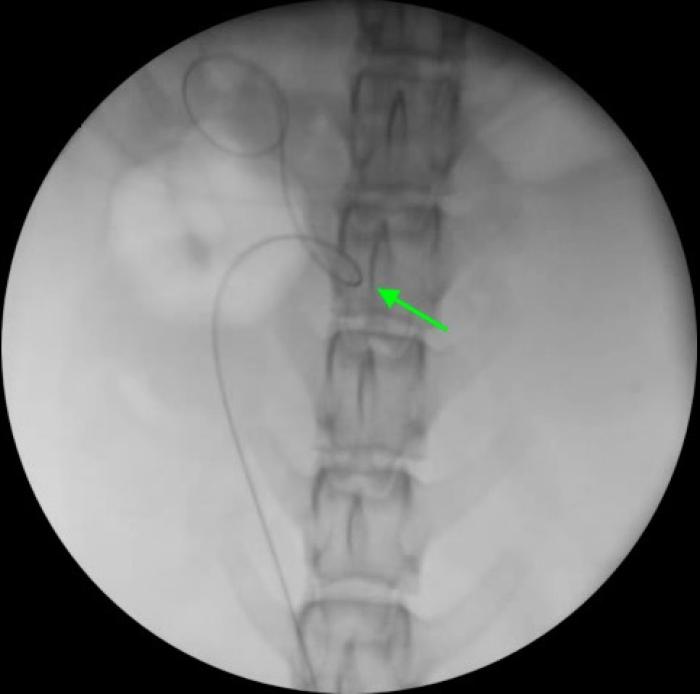
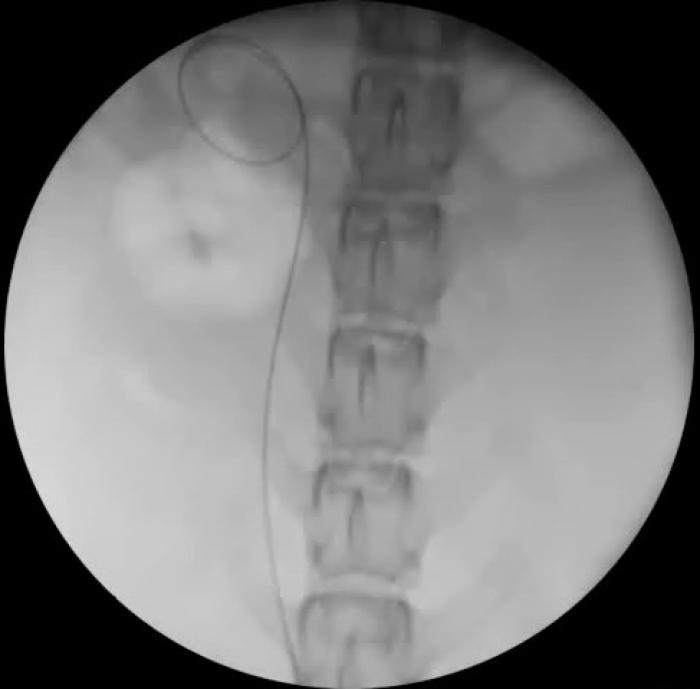
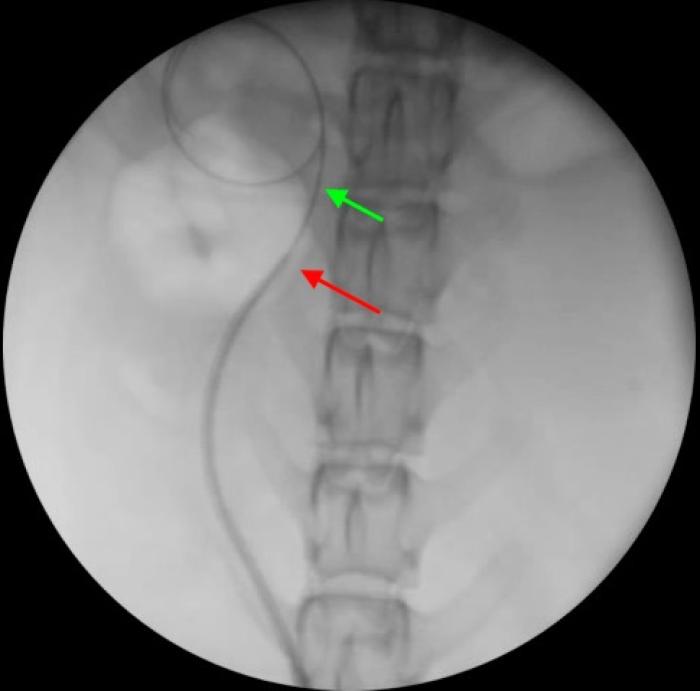


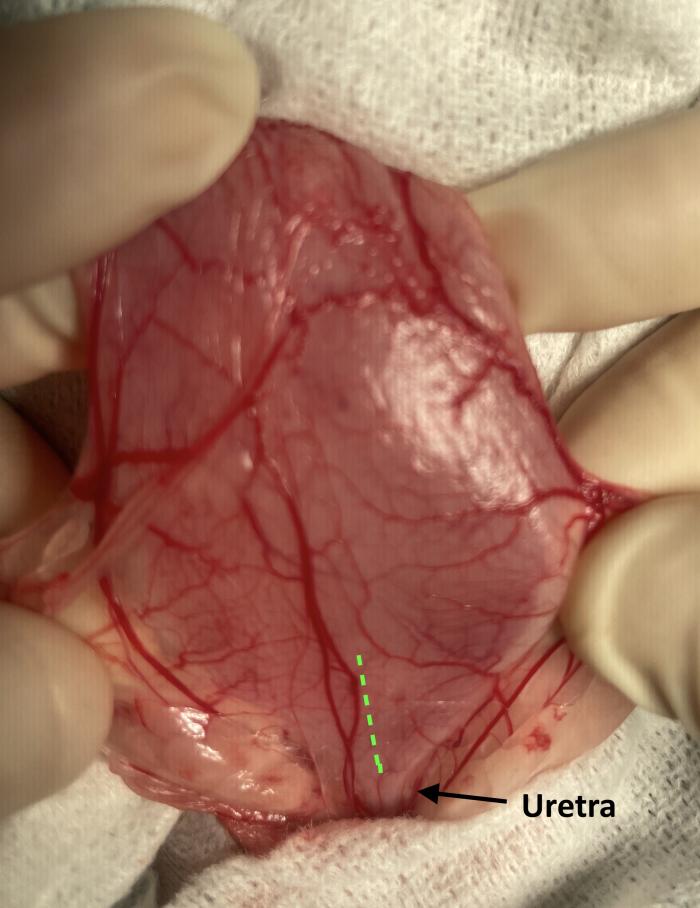
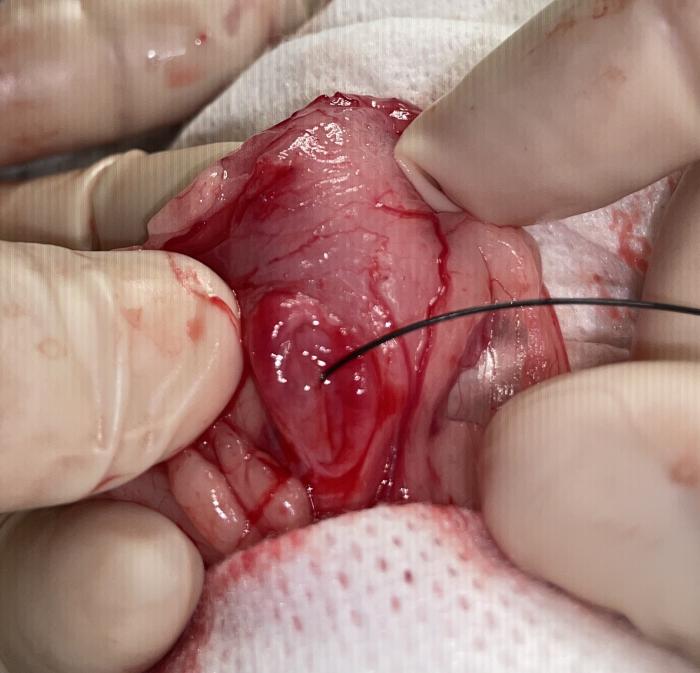
Figura 7. Disposición retrógrada de catéter JJ en macho especie felina, acceso asistido por cirugía. (A) Pared ventral de la vejiga de la orina mediante laparotomía media distal. La línea de puntos indica el lugar de cistotomía para exposición de los orificios ureterales. (B) Cateterización de orificio ureteral derecho con guía hidrofílica de 0.018”, para continuar con el procedimiento bajo control fluoroscópico.
Por su parte, el abordaje anterógrado es preferido cuando la indicación del stent sea la presencia de un carcinoma urotelial con afectación del trígono vesical, ya que, en estos casos, resulta complicado encontrar el orificio ureteral por la proliferación tumoral. También se puede realizar este abordaje cuando el acceso retrógrado no sea posible por alteraciones anatómicas, como un traumatismo que impida identificar con claridad los orificios ureterales. En la especie felina puede ser necesario recurrir a este acceso, o bien a un abordaje combinado, debido al diámetro de los orificios ureterales o a la presencia de estenosis en el recorrido ureteral. El abordaje anterógrado, a su vez, puede realizarse mediante acceso percutáneo (Figura 8A-E) o mediante cirugía convencional (Figura 9A-B).
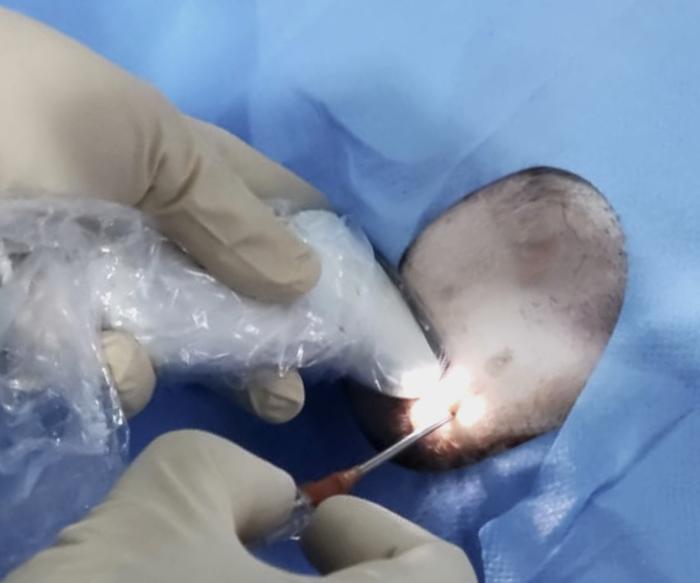
Figura 8. Disposición anterógrada de catéter JJ, acceso percutáneo. (A) Punción renal ecodirigida. (B) Comprobación de salida de orina de pelvis renal e instilación de contraste iodado al 50 % para pieloureterografía descendente. (C) Pielouretrografía descendente. (D) Posicionamiento de guía hidrofílica (flecha verde) hasta vejiga de la orina y avance coaxial de catéter JJ. (E) Visión endoscópica de catéter JJ derecho, implantado mediante abordaje anterógrado percutáneo, en hembra de la especie canina con invasión del trígono vesical por carcinoma urotelial.
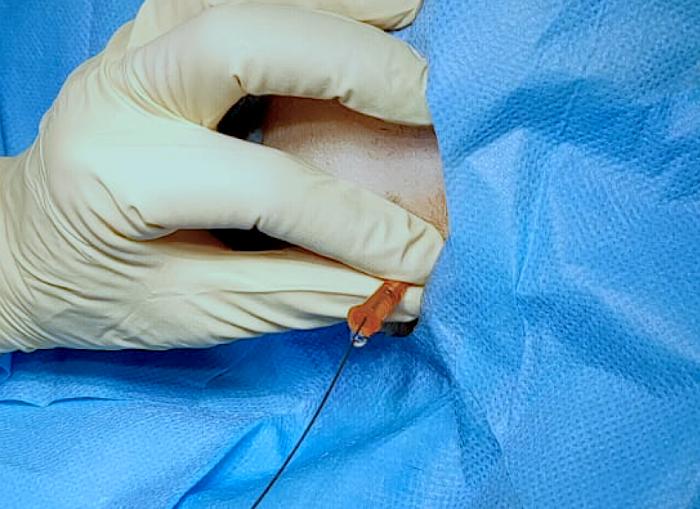
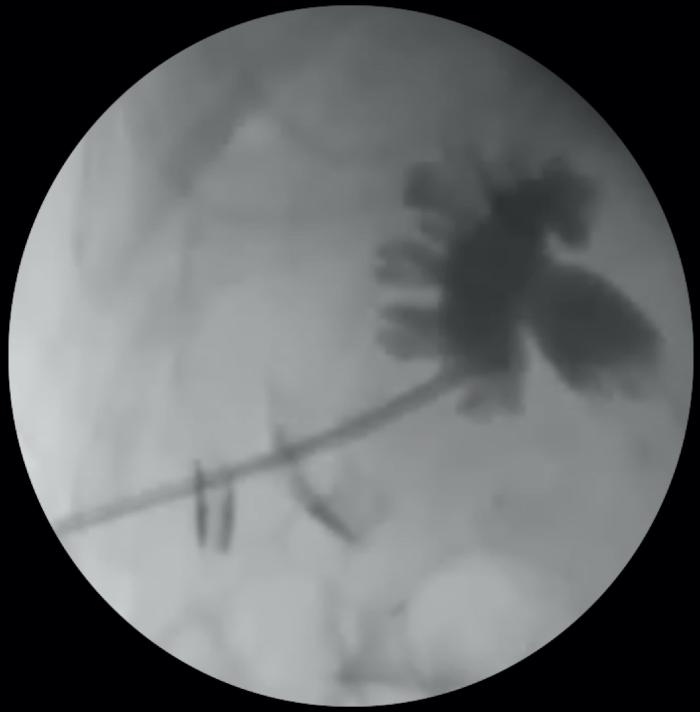
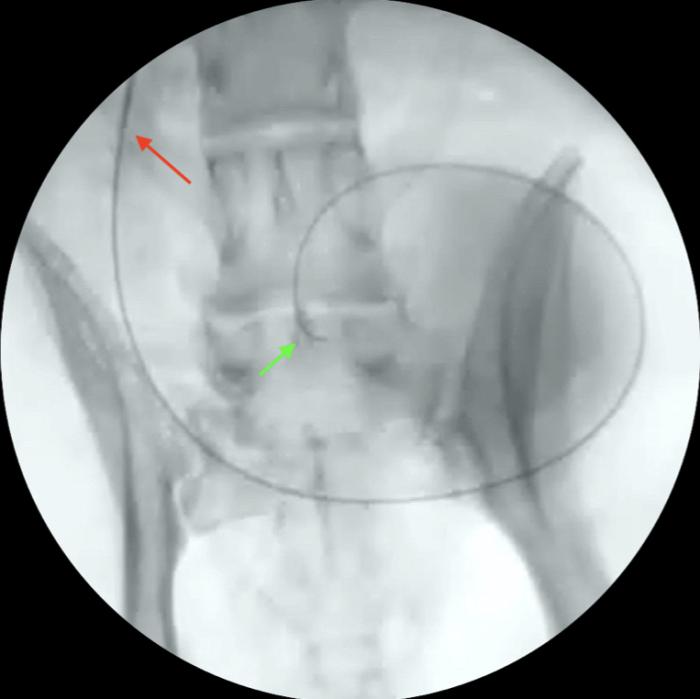
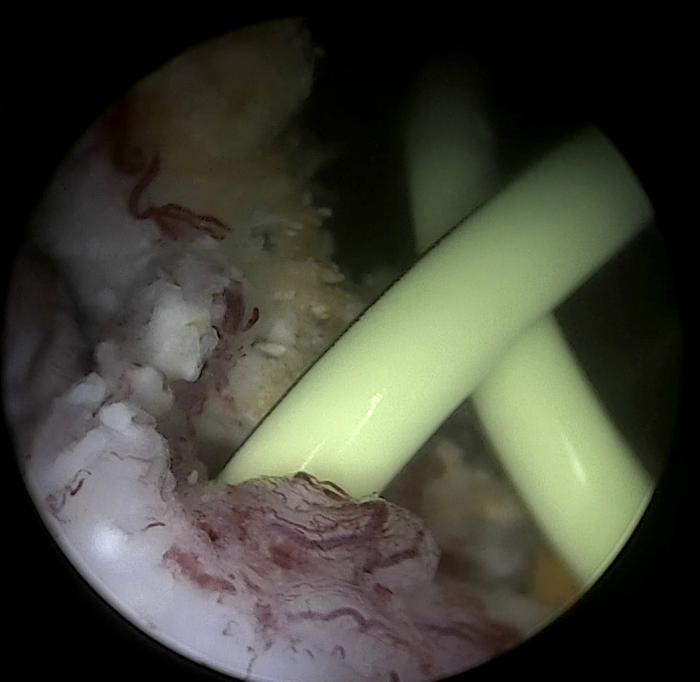
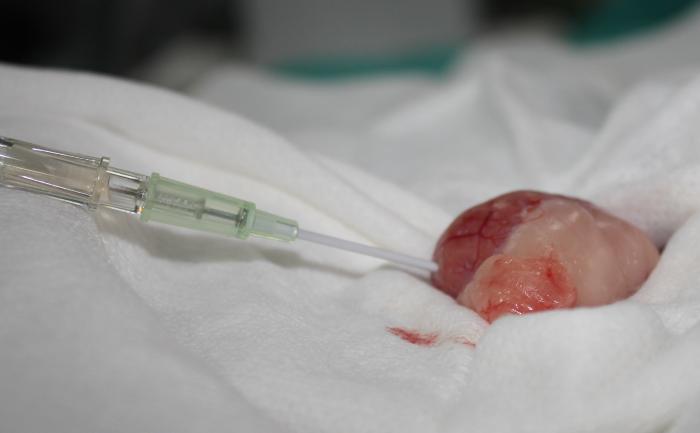
Figura 9. Disposición anterógrada de catéter JJ en especie felina, acceso guiado por cirugía. (A) Exteriorización de riñón y punción de pelvis renal. (B) Pieloureterografía descendente con contraste iodado al 50 %, para introducción de guía, de acuerdo a lo descrito en la Figura 8.
Seguimiento, recambio y retirada de los catéteres ureterales doble jota
Tras la implantación del catéter JJ, es necesario llevar a cabo un seguimiento exhaustivo del paciente para valorar la evolución y poder evitar complicaciones. Inicialmente, los autores recomiendan realizar un estudio ultrasonográfico a las 24 horas, 7 días y 3 semanas. En función del motivo de la implantación del catéter JJ, después de la 3ª semana se puede valorar su retirada, tratamiento definitivo o realizar otro seguimiento a las 6-8 semanas. En el caso de que la implantación del catéter JJ sea la medida definitiva para la resolución de la afección, se recomienda realizar estudio ecográfico cada 8 semanas. Estos estudios deben acompañarse de anamnesis del paciente, que incluya datos como síntomas urinarios, dolor, apetito, patrón de micción (disuria, polaquiuria, incontinencia), así como uroanálisis y estudio de la funcionalidad renal. En medicina humana, los catéteres JJ se reemplazan cada 6-12 semanas. En veterinaria, se describe su empleo por más tiempo sin complicaciones. Sin embargo, resulta fundamental un seguimiento estrecho y recambio del catéter JJ si aparecen infecciones de repetición, mineralización, incrustaciones o migración.
La retirada del stent se lleva a cabo mediante un abordaje mínimamente invasivo. Es posible completarlo mediante cistoscopia transuretral con ayuda de unas pinzas de cuerpos extraños. Alternativamente, en aquellos pacientes donde no sea posible el acceso endoscópico, se puede retirar bajo control fluoroscópico con ayuda de una guía hidrofílica o una cestilla de litiasis.
Para el recambio del catéter JJ, se procede a extraer el extremo distal del stent como se ha descrito, con la precaución de mantener el extremo proximal en el interior del uréter. Por el lumen del catéter se asciende una guía hidrofílica hasta la pelvis renal, se extrae el catéter antiguo y sobre la guía hidrofílica, correctamente posicionada, se introduce el nuevo catéter JJ.
Resultados y complicaciones
La implantación de catéteres JJ se considera una técnica segura y eficaz cuando se realiza por un especialista entrenado. El empleo del equipamiento adecuado, como fluoroscopia, ecografía y sistemas de endoscopia, así como guías y catéteres de diámetro apropiado para la talla de nuestros pacientes, reduce substancialmente la aparición de complicaciones. Con los medios adecuados, la tasa de éxito de la disposición del catéter puede superar el 95 % en gatos y es del 100 % en perros. La mortalidad perioperatoria depende del estado de salud del paciente y normalmente se relaciona con causas no urinarias.
Durante la disposición del dispositivo, se puede provocar una perforación del uréter con la guía hidrofílica (2-4 %) a nivel de la litiasis o en una zona de uréter desvitalizada. Si esto ocurre, debe retirarse la guía hidrofílica y redirigirla para posicionar correctamente el catéter JJ, sin que esto suponga la aparición de complicaciones mayores como uroabdomen.
En la especie felina, la implantación de un catéter JJ puede resultar un reto. Antes del desarrollo de los catéteres ureterales felinos, la disposición de un stent de 3 F requería de la realización de una neoureterocistostomía. Como la unión ureterovesical y el orificio ureteral presentan un diámetro muy reducido, es habitual que se necesite su dilatación antes de la introducción de un catéter JJ, incluso cuando se emplean los stents de 2.4 F. Para ello, los catéteres JJ felinos incluyen en su kit un dilatador telescópico; aunque los autores prefieren realizar una dilatación seriada con catéteres intravenosos de diámetro creciente al considerarse menos traumático. Otros estudios describen la incisión a nivel del urotelio del orificio ureteral para poder implantar el dispositivo. En determinadas ocasiones, el uréter presenta una estenosis fibrosa, secundaria a la presencia de un urolito o de forma congénita, que puede dificultar la técnica. Cabe destacar que este evento se ha relacionado con una elevada tasa de reobstrucción en la especie felina. Por este motivo, si durante la implantación del catéter JJ se encuentra una estenosis fibrosa, los autores recomiendan reconvertir la intervención hacia la disposición de un bypass ureteral. Al tratarse de una decisión intraquirúrgica, los tutores deben ser advertidos de todas las posibilidades con anterioridad.
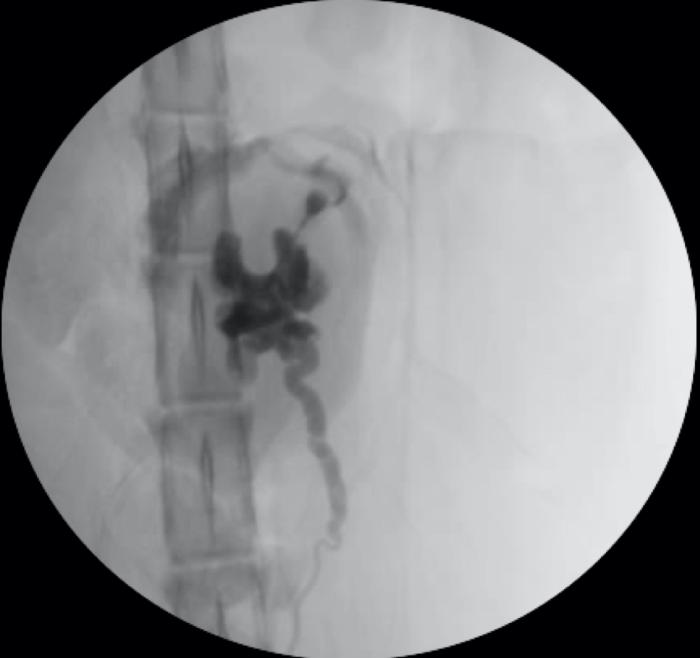
Una de las complicaciones más frecuentes es la migración del catéter JJ (3-9 %) (Figura 10).
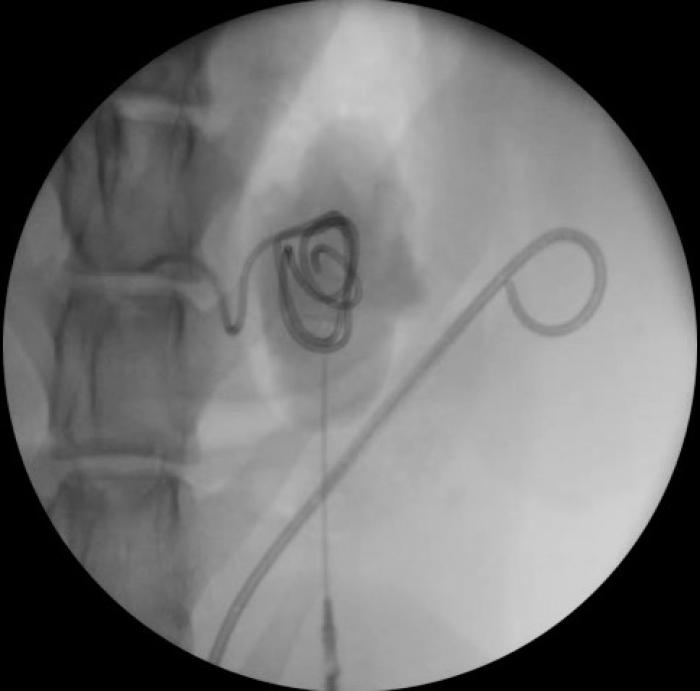
Figura 10. Migración proximal de catéter JJ en riñón derecho. Imagen de fluoroscopia, durante el acceso renal guiado por cirugía para su recolocación.
Puede ocurrir de manera proximal, quedando alojado en el interior del tracto urinario superior. Esta situación requiere de una intervención de urgencia, ya que el propio catéter puede inducir un proceso obstructivo. La retirada puede realizarse preferentemente vía endoscópica (ureteroscopia o nefroscopia) o mediante ureteroromía. Si la migración es distal, es posible valorar si se procede a la retirada completa del stent, ya no es necesaria su función, o a su recolocación.
Otra complicación grave es la reobstrucción ureteral, que puede requerir su reintervención en el 19 % de los casos. Es frecuente que el canal interno del catéter JJ se ocluya debido a la precipitación de sedimento y detritus celular. No obstante, debido a que el catéter JJ induce una dilatación pasiva del uréter por la relajación de la musculatura lisa, el flujo de orina se establece preferentemente alrededor del stent. A pesar de ello, determinadas situaciones clínicas, como una marcada ureteritis o las estenosis ureterales presentan un riesgo mayor de reobstrucción. Ante la aparición de una reobstrucción ureteral es preciso comprobar si el catéter está correctamente colocado. Si es así, se debe considerar la posibilidad de sustituirlo por otro catéter de mayor resistencia, o bien proceder a otra alterativa terapéutica.
La incrustación también es una complicación grave, que consiste en la mineralización del catéter, más frecuentemente en sus extremos proximal y/o distal (Figura 11).
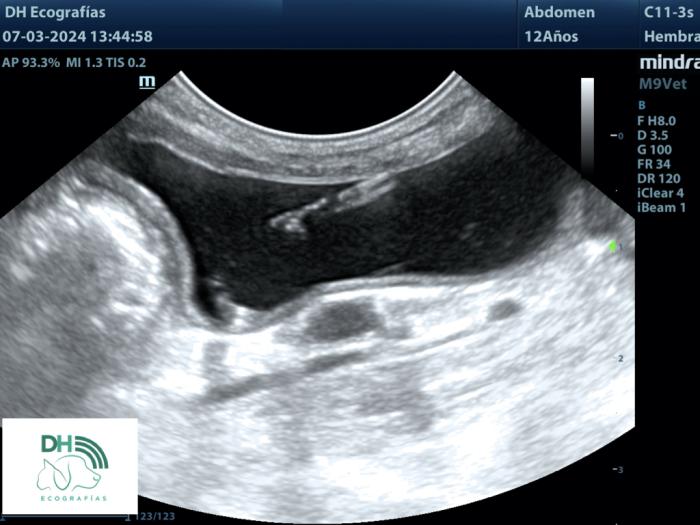
Figura 11. Imagen ecográfica de incrustación del extremo vesical de catéter JJ (imagen cortesía de David Hernández-DH Ecografías).
Si no se detecta de manera precoz, las mineralizaciones incrementan de tamaño, formando adherencias con el urotelio adyacente y suponiendo en sí mismas un cuadro obstructivo. Por este motivo, resulta fundamental establecer un seguimiento ecográfico periódico tras la disposición de un catéter JJ. Si la incrustación es de gran tamaño y no es posible la extracción endoscópica de manera convencional, se puede proceder a la fragmentación de la misma mediante litotricia láser. El desarrollo de incrustaciones es más frecuente en la especie canina que en la felina y sucede de manera precoz en los pacientes formadores de cálculos. La fisiopatología de esta complicación comprende un mecanismo multifactorial que incluye la colonización del stent por bacterias formadoras de biofilm y ureasa +, las características de la composición urinaria, así como el material del catéter JJ y de sus cubiertas externas.
Además, los catéteres JJ pueden provocar una serie de efectos adversos que suponen un impacto negativo en la calidad de vida del paciente, como reflujo vesicoureteral, disuria, estranguria y polaquiuria, no necesariamente relacionados con una infección. La presencia del catéter a nivel de la unión ureterovesical, así como el efecto irritativo del mismo sobre el trígono vesical son los principales desencadenantes de estas molestias. En medicina humana, también se han identificado otros factores relacionados como el diseño del catéter JJ, el material de su recubrimiento y la longitud del dispositivo. En veterinaria, suele ser un efecto transitorio y autolimitante o que responde al tratamiento con glucocorticoides, observado preferentemente en la especie felina. En los casos refractarios al tratamiento (3 %) se puede valorar reemplazar el catéter JJ o llevar a cabo otra alternativa quirúrgica.
Otras complicaciones descritas con los catéteres JJ son infecciones persistentes o de repetición, hematuria intermitente o la diseminación tumoral en un abordaje anterógrado para colocar un catéter JJ en un caso de carcinoma urotelial en la especie canina.
BYPASS URETERAL
Descripción
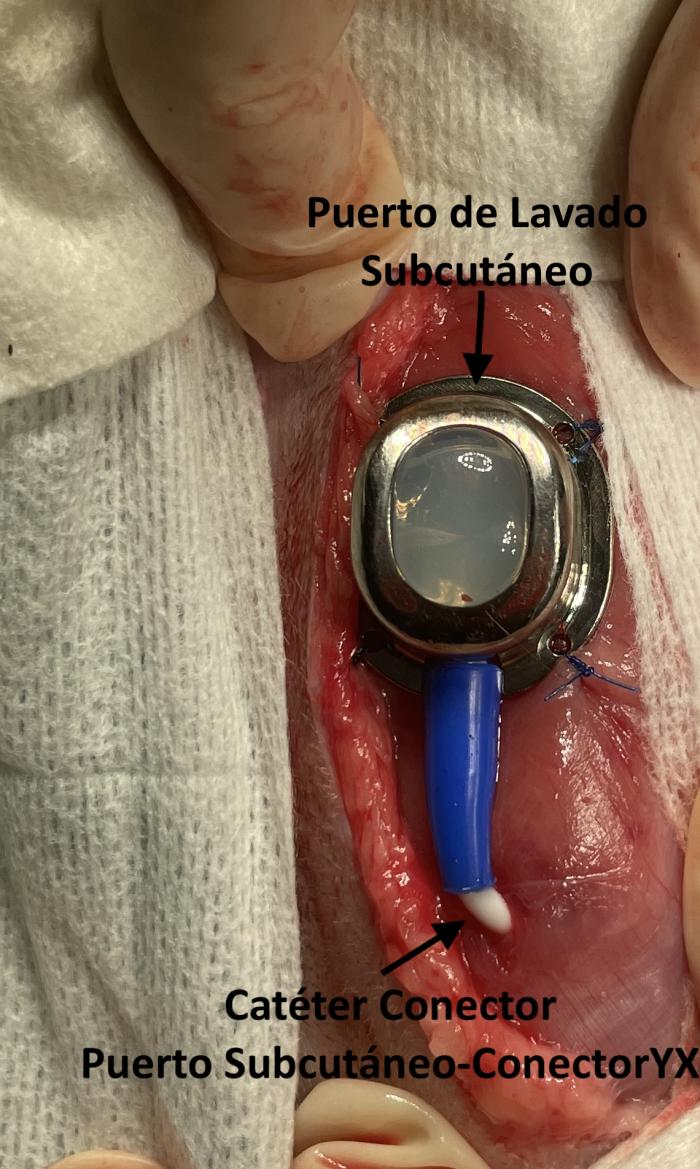
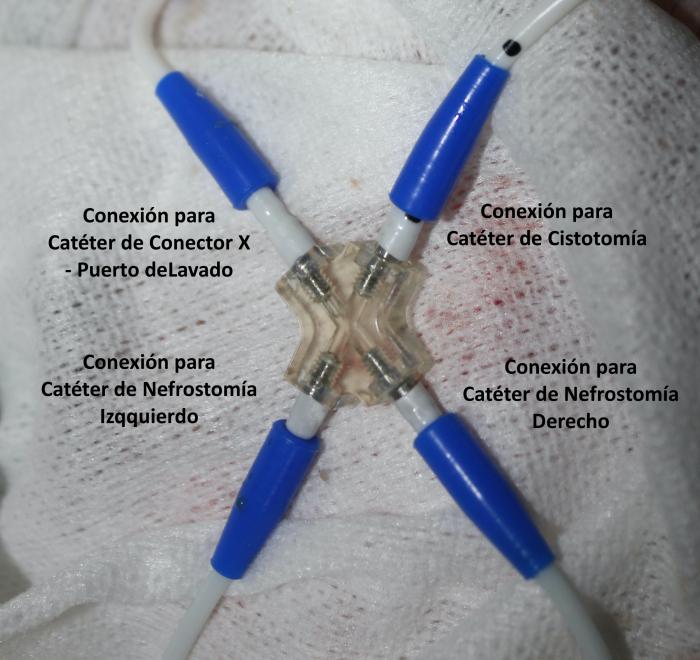
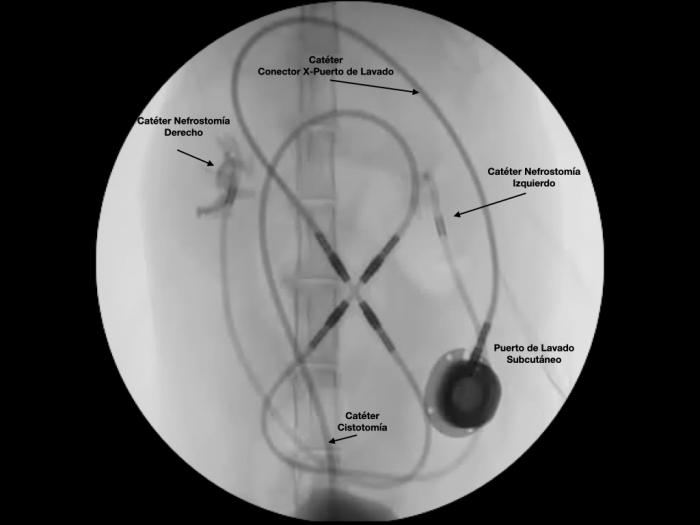
El bypass ureteral o derivación urinaria subcutánea es un sistema de drenaje en el que se establece una conexión entre la pelvis renal y la vejiga de la orina, a través de una serie de catéteres que, a su vez, se conectan a un puerto de lavado subcutáneo. El más empleado en la actualidad es el Subcutaneous Ureteral Bypass- SUB® 3.0 (Norfolk Vet Products, Illinois, EEUU), que consta de un catéter de nefrostomía y un catéter de cistostomía conectados a un puerto de lavado subcutáneo (Figura 12A-J).
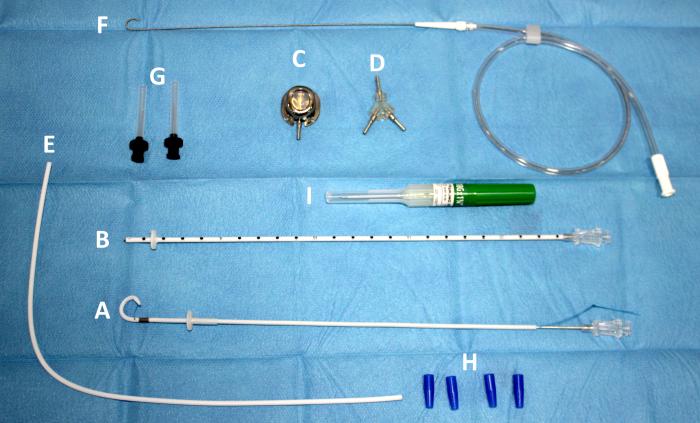
Figura 12. Elementos del Subcutaneous Ureteral Bypass 3.0. (A) Catéter de nefrostomía. Catéter fabricado en poliuretano, con sistema autoretentivo en forma de pigtail. (B) Catéter de cistostomía, fabricado en poliuretano de terminación corta y recta, para disminuir la irritación vesical y cistitis estéril. (C) Puerto de lavado subcutáneo, fabricado en titanio. Posee conexión para el catéter conector-puerto subcutáneo. (D) Conector metálico. Puede ser en forma de Y, para el sistema unilateral; o bien en forma de X para el sistema bilateral. (E) Catéter conector-puerto subcutáneo. (F) Guía metálica. (G) Agujas Huber para limpieza a través del puerto de lavado subcutáneo. (H) Conectores antifuga. (I) Catéter 18G. (J) Conector metálico en forma de X para sistema bilateral.
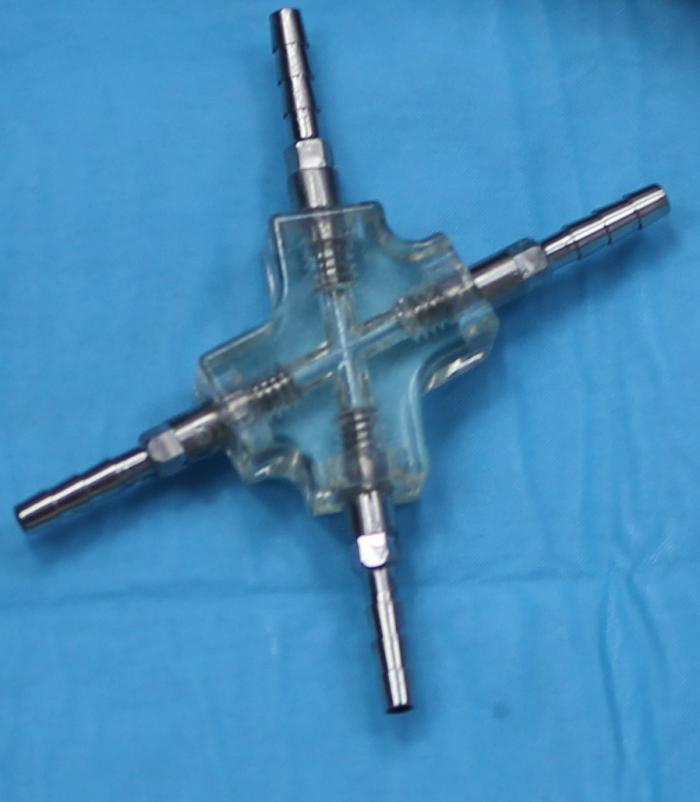
Desde su primera descripción en 2009 hasta la actualidad, el diseño de este dispositivo ha experimentado algunas modificaciones, con el objetivo de reducir las complicaciones reportadas en las diferentes series clínicas.
Técnica
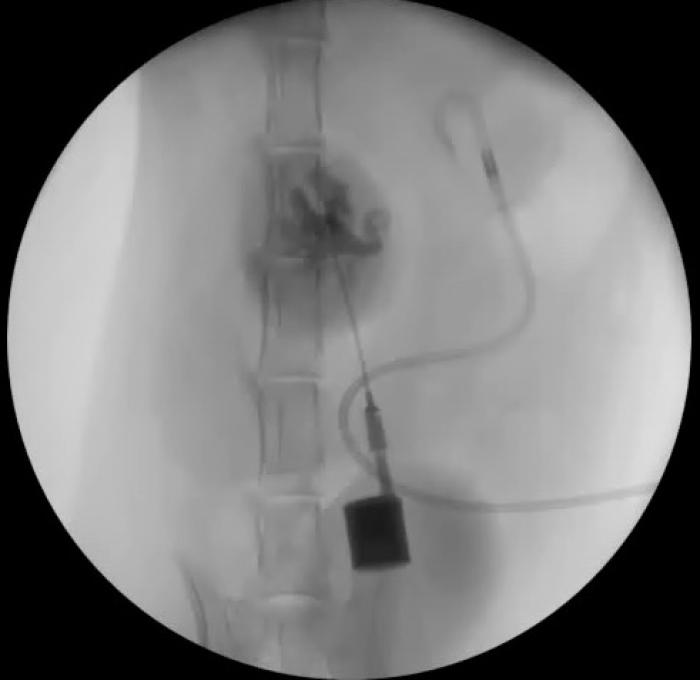
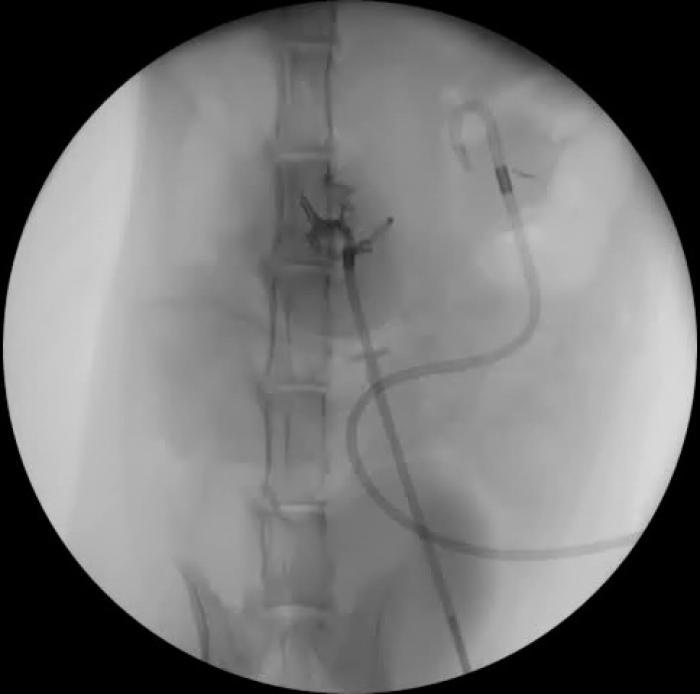
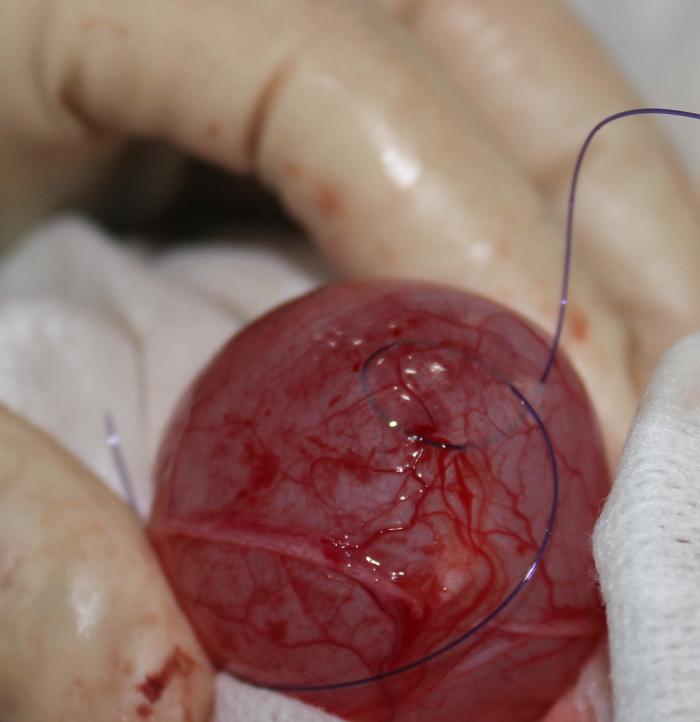
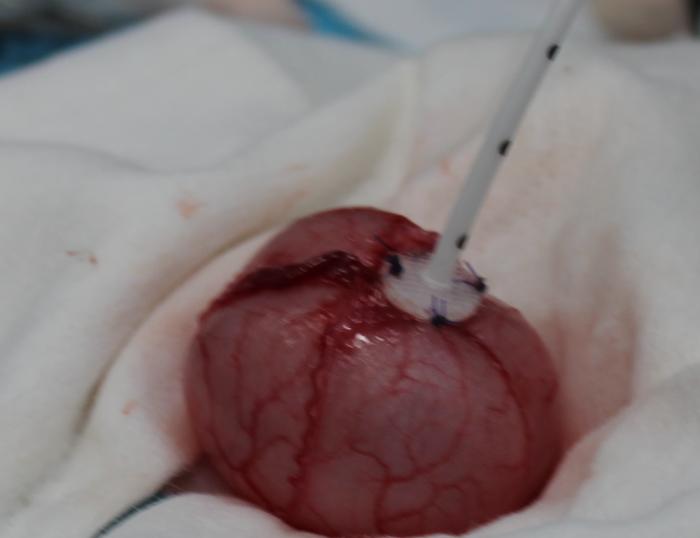
La implantación del bypass ureteral puede realizarse mediante control fluoroscópico, ecográfico o mediante técnica ciega. La fluoroscopia ofrece mayor seguridad, debido a que permite detectar acodamientos en los catéteres del dispositivo, controla la correcta disposición del catéter de nefrostomía, reduciendo el riesgo de perforación del parénquima renal y permite descartar fugas de orina en cualquier parte del sistema. La monitorización ecográfica puede emplearse en sustitución a la fluoroscopia, en aquellos centros que carecen de este sistema de imagen. Si no es posible el empleo de fluoroscopia, los autores recomiendan el uso de la ecografía, tratando de evitar, en la medida de lo posible, la técnica ciega. Tanto en la técnica guida por ecografía como ciega, resulta fundamental realizar radiografías posquirúrgicas en varias proyecciones ortogonales. Los principales pasos se resumen en la Figura 13A-I.
Figura 13. Implantación de SUB 3.0. (A) Exposición renal y punción ecodirigida a través de polo caudal del riñón con catéter IV 18 G. (B) Pieloureterografía descendente con contraste iodado al 50 %. (C) Disposición de la guía en la pelvis renal. (D) Colocación del catéter de nefrostomía bajo control fluoroscópico. (E) Exposición vesical, sutura en bolsa de tabaco en el ápex vesical para introducir catéter de cistostomía. (F) Fijación del catéter de cistostomía. (G) Disposición del puerto subcutáneo. (H) Ensamblaje de los catéteres al conector. (I) Fluoroscopia de control con SUB 3.0 bilateral implantado.

Mantenimiento
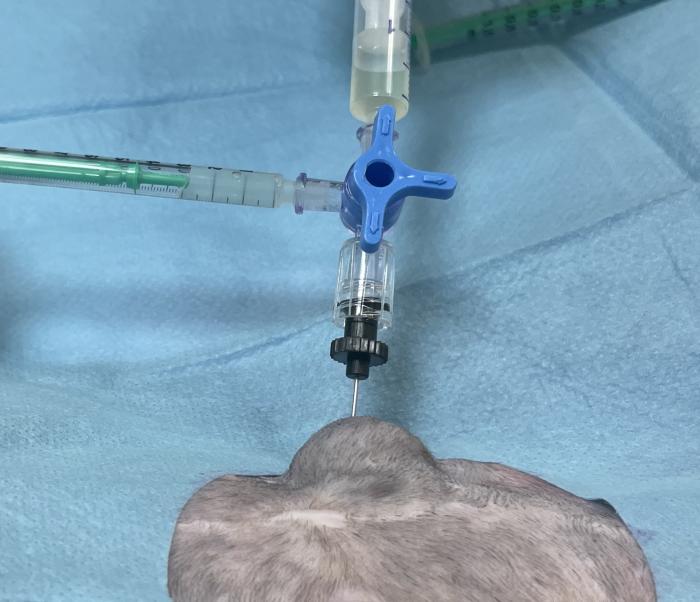
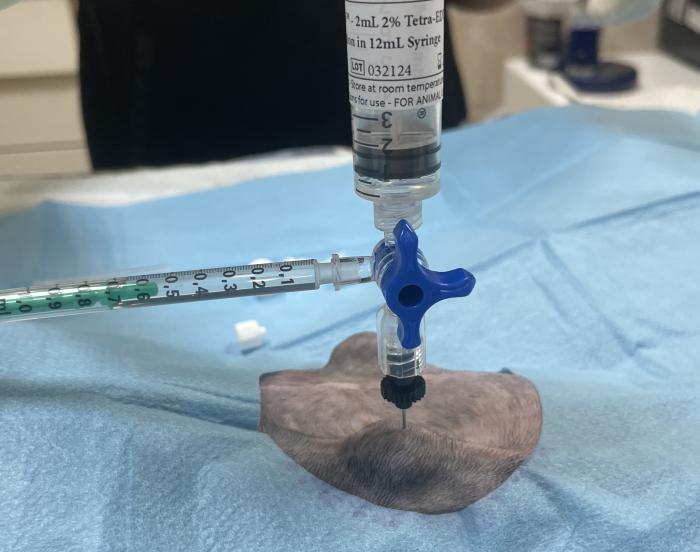
Tras la implantación del bypass ureteral se recomienda su limpieza con suero salino y solución de tetra-EDTA al 2 % a las 24 horas, 7 días, 1 mes y posteriormente cada 3 meses (Figura 14A-C).
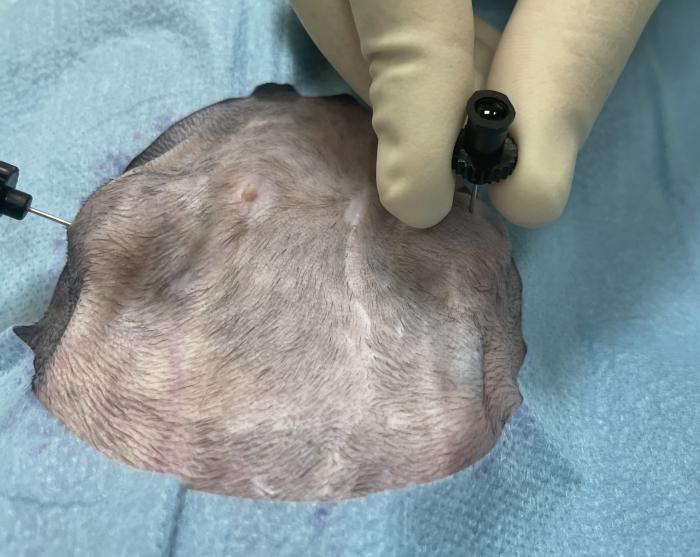
Figura 14. Limpieza del SUB. (A) Punción percutánea con aguja Huber del puerto de lavado. (B) Extracción de orina para urianálisis y cultivo. (C) Lavado con suero salino fisiológico y tetraEDTA 2 % durante monitorización ecográfica.
Coincidiendo con esta limpieza, los autores recomiendan realizar ecografía abdominal, urianálisis, hemograma y perfil renal. Ante el desarrollo de sintomatología de tracto urinario inferior, infecciones resistentes u obstrucción del bypass, la frecuencia y protocolo de limpieza se puede modificar para el control del cuadro clínico.
Resultados y complicaciones
La implantación de un SUB ofrece una descompresión inmediata de la pelvis renal (> 98 %), resultando en una disminución de la creatinina en los casos esperados. Un 93 % de los pacientes sobreviven al alta hospitalaria, con un tiempo medio de 821 días (1-2170 días) y menos de un 25-52 % mueren debido a la enfermedad renal. En la Tabla 6 se relatan los factores relacionados negativamente con el tiempo de supervivencia después de la cirugía de bypass ureteral.
|
Tabla 6. Factores relacionados con una disminución en el tiempo de supervivencia después de la disposición de un bypass ureteral.
Una de las complicaciones más frecuentes de los SUBs es la infección urinaria. Resulta difícil comparar la tasa de infección entre estudios, debido a la heterogeneidad en la metodología de las principales series clínicas. En general, el porcentaje de bacteriuria es del 24-54 % en el momento de la implantación del dispositivo, de los cuales el 43-93 % representa una infección propiamente dicha (cultivo positivo y signos de tracto urinario inferior) y el resto una bacteriuria subclínica. Un 25 % de gatos tienen cultivos positivos durante los seguimientos, con un 8 % de infecciones persistentes.La ISCAD recomienda no tratar las bacteriurias subclínicas. Sin embargo, no se hace mención sobre cómo manejar esta situación en presencia de implantes urinarios (JJ o SUB), cuya superficie predispone a la colonización bacteriana y mineralización del dispositivo. Determinados trabajos describen el desarrollo de complicaciones como pielonefritis o absceso perirrenal en pacientes con SUB que desarrollaron bacteriurias subclínicas no tratadas. Por todo ello, los autores recomiendan el tratamiento antibiótico en estos casos. Los principales factores de riesgo para el desarrollo de infecciones se relacionan con un estado crítico del paciente (Tabla 7).
|
Tabla 7. Factores de riesgo para el desarrollo de infecciones urinarias en pacientes con bypass ureteral.
Algunas recomendaciones para reducir la tasa de infección son la administración de antibiótico profiláctico (5-7 días posintervención, manteniendo 3 semanas si el cultivo es positivo) o evitar el sondaje transuretral durante la hospitalización. La ureterotomía para la eliminación de la litiasis ureteral en el momento de la implantación de un SUB no ha demostrado disminuir el riesgo de infección.
La infección persistente puede además conducir a otras complicaciones, como la extrusión del puerto de lavado a través de la piel (Figura 15); probablemente como consecuencia de la diseminación bacteriana al tejido subcutáneo durante los lavados. Suele suceder en pacientes con una condición corporal baja, anemia y en general, un estado de salud debilitado. Si esto ocurre, se puede recolocar el puerto subcutáneo en otra localización, tras la realización de un lavado subcutáneo abundante con solución antibiótica, o reemplazar el SUB por uno nuevo.
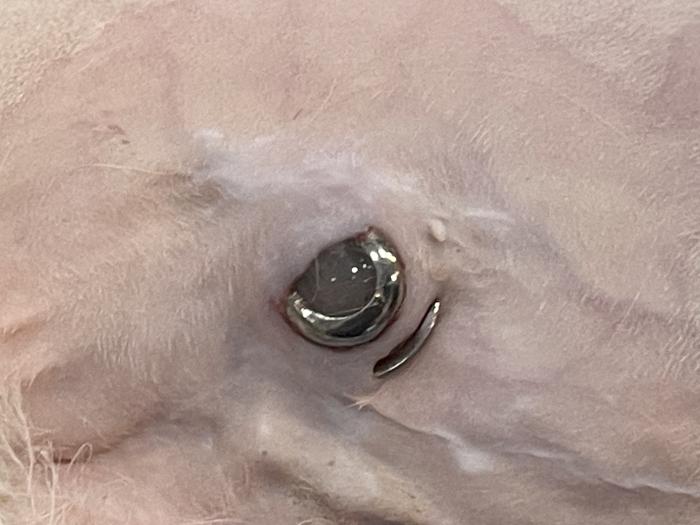
Figura 15. Extrusión del puerto de lavado del SUB 3.0.
Por otra parte, la cistitis estéril se ha observado en el 12.5-38.5 % de los pacientes; aunque se espera que este porcentaje sea menor con el diseño del catéter de nefrostomía del SUB 3.0.
Otra de las complicaciones de mayor relevancia clínica es la oclusión del bypass ureteral. Cuando sucede en el posoperatorio temprano suele ser secundaria a la formación de coágulos (incidencia 8 %, tasa de recambio 67 %). Para evitarlo, resulta fundamental realizar lavados seriados ante hematuria severa. Recientemente, se ha descrito el manejo de esta complicación mediante la administración de altepasa (0.9 mg/kg y/o 0.5-1 mg/kg intravesical), aunque son necesarios más estudios para comprobar la efectividad y seguridad de este tratamiento. Con el objetivo de reducir el sangrado tras la implantación del catéter de nefrostomía del SUB, los autores recomiendan su disposición con control ultrasonográfico, evitando el acceso a través de las arterias arcuatas. La obstrucción intraluminal del SUB en el posoperatorio temprano también puede producirse en pacientes con infecciones graves del tracto urinario superior, como en casos de pionefrosis o infecciones fúngicas, que se pueden manejar mediante lavados con tetra-EDTA y NaCl 0.9 %.
Otro motivo de obstrucción a corto y medio plazo es el acodamiento de los catéteres. Los primeros trabajos con SUBs describían una tasa más alta de esta complicación. El perfeccionamiento de la técnica, dejando una longitud mayor del catéter subcutáneo, así como el diseño del SUB 3.0, junto con el empleo de fluoroscopia, disminuyen significativamente la incidencia de esta complicación.
Además, la mineralización intraluminal del bypass ureteral (Figura 16) representa la principal causa de oclusión a medio-largo plazo en la especie felina (incidencia 15-24 %, tiempo medio 204-463 días, tasa de recambio 8-12.8 %).
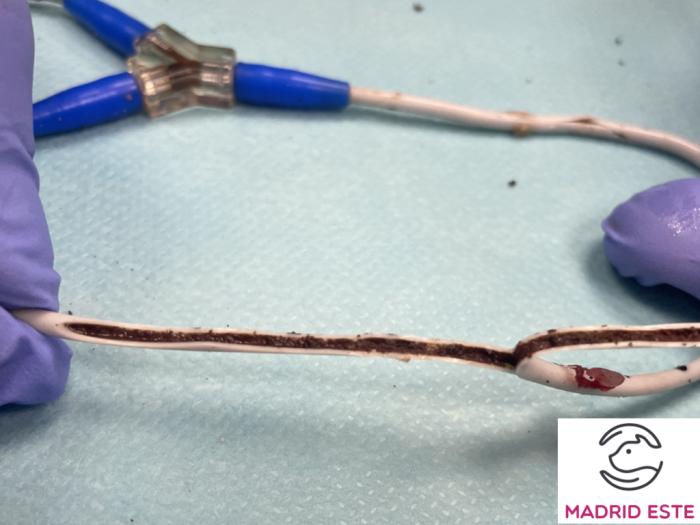
Figura 16. Mineralización interna del catéter de nefrostomía del SUB 3.0 (imagen cortesía del Hospital Veterinario Madrid Este).
Se han propuesto protocolos de rescate mediante lavados con tetra-EDTA 2 % (T-FloLoc®, Norfolk) o 4% (KiteLock® 4 %; SterileCare) (repermeabilización 69-100 %, recidiva 25-54 %). Es importante valorar con el tutor las expectativas del tratamiento de rescate, riesgos de la cirugía de recambio del SUB y costes de ambas opciones. En la especie canina, la mineralización intraluminal es la principal causa de fracaso del bypass ureteral (50 %, tiempo medio 205 días), por lo que existe una tendencia generalizada a no emplear SUBs en dicha especie. A pesar de ello, se han descrito casos con SUBs permeables 40 meses después de su implantación.
Un total de 4 estudios reportan daños digestivos como una rara complicación del SUB. En 11 pacientes (14 SUBs) se produce una migración del catéter de nefrostomía o cistostomía con perforación intestinal; en 2 pacientes se describe la perforación duodenal con el disco de Dracon® del catéter de nefrostomía derecho, sin migración; mientras que en un paciente se produce una fístula enterovesical a nivel del catéter de cistostomía. En ninguno de los casos, se pudo diagnosticar este evento con las pruebas de imagen rutinarias. Es por ello que los diferentes artículos ponen de manifiesto la necesidad de realizar pruebas de imagen adicionales a la ecografía cuando haya infecciones persistentes, especialmente por enterobacterias, junto con la oclusión del dispositivo.
Discusión
La OU es una afección grave que puede ocasionar la pérdida de la funcionalidad del riñón ipsilateral. La magnitud del daño renal está directamente relacionada con el tiempo de obstrucción, por este motivo, la OU debe considerarse como una situación de urgencia en todos los casos y proceder a su resolución tan pronto como sea posible y con independencia de:
- Si se trata de obstrucciones parciales o completas, ya que incluso las obstrucciones más leves pueden inducir una fibrosis del parénquima renal y pérdida de su funcionalidad.
- Si existe o no una dilatación de la pelvis renal, debido a que no todas las obstrucciones cursan con hidronefrosis/hidrouréter, pero sí con daño renal.
- Si ha sido posible o no identificar la etiología de la obstrucción, debido a que las técnicas de imagen, en ocasiones, no son sensibles a determinadas causas de OU.
- Las características de imagen preoperatorias del parénquima renal, su grosor o la relación entre el diámetro de pelvis y tamaño renal total, puesto que no se ha encontrado correlación entre estos parámetros y la evolución de la función renal tras la resolución de la OU.
- La presencia o magnitud de la azotemia, ya que esta depende del grado de funcionalidad del riñón contralateral.
En muchas ocasiones, los pacientes con OU son pacientes con un estado de salud crítico y, a pesar de que es aconsejable una estabilización previa a la intervención quirúrgica, con frecuencia esto no es posible sin haber resuelto la obstrucción. Debido a ello, el éxito global de la técnica requiere de la participación de un equipo multidisciplinar, con especialistas en anestesia, cuidados intensivos, diagnóstico por imagen, medicina interna y endoscopistas intervencionistas.
En la actualidad, las guías clínicas recomiendan el empleo de catéteres JJ o bypass ureteral para el tratamiento inicial de la OU, desplazando a las técnicas convencionales como ureterotomía, reimplantación ureteral o plastias de la vía urinaria superior. Esto es debido a que ambos dispositivos consiguen una rápida descompresión del sistema nefroureteral afectado, restaurando el flujo de orina y contribuyendo de manera más efectiva a la recuperación de la lesión renal. Además, se reduce significativamente la incidencia de complicaciones como uroabdomen, estenosis o sepsis, frecuentemente descritos con las técnicas tradicionales. En cualquier caso, se debe evitar la nefrectomía, aun cuando los valores de funcionalidad renal permanezcan dentro de los rangos de normalidad establecidos para la especie. Ante OUs, la nefrectomía tan sólo está indicada en hidronefrosis grado V (bolsa hidronefrótica con destrucción completa del parénquima renal) o cuando los tutores rechacen otras alternativas más convenientes.
A pesar de ello, no existe una clara recomendación sobre en qué situaciones utilizar cada uno de estos dispositivos (catéter JJ vs. bypass ureteral). Según el criterio de los autores, los catéteres JJ presentan claras ventajas frente a los SUBs. En primer lugar, el sistema de implantación de los stent ureterales es menos traumático y más rápido, lo que permite reducir el plano y tiempo anestésicos, el periodo de recuperación y las complicaciones relacionadas. Tanto es así que en la mayoría de los pacientes caninos es posible una liberación completamente endoscópica. En la especie felina, aun cuando es necesario recurrir al abordaje quirúrgico, se evita la disección de espacio subcutáneo propia de la implantación de un SUB y con ello generar menos traumatismo quirúrgico y menos dolor perioperatorio.
La segunda ventaja de los catéteres JJ es la posibilidad de emplearlos de manera temporal. Tanto los stent como los bypass ureterales están fabricados con materiales poliméricos, de naturaleza porosa. Por lo tanto, la presencia de estos dispositivos en contacto con la orina favorece la colonización bacteriana con desarrollo de biofilm, que a su vez predispone a la aparición de infecciones multirresistentes, sintomatología e incrustaciones. Los efectos adversos y complicaciones a medio-largo plazo son, por ende, frecuentes con cualquier tipo de implante urinario. Es por ello que el paradigma actual es su empleo de manera temporal y no permanente, evitando la comorbilidad asociada. Esto es más sencillo de llevar a cabo con los catéteres JJ, ya que su retirada o recambio se puede conseguir de manera mínimamente invasiva, a diferencia de los bypass ureterales.
En determinadas situaciones clínicas, como en obstrucciones de origen maligno, esperanza de vida reducida o pobre condición general, el catéter JJ puede considerarse como un tratamiento permanente. En estos casos, un adecuado seguimiento del paciente, con técnicas de imagen y cultivos de orina seriados, puede ayudar a detectar de manera precoz complicaciones como infecciones resistentes o incrustaciones, siendo posible el recambio del dispositivo por uno nuevo cuando sea necesario.
La principal limitación de los catéteres JJ es la dificultad técnica que representa su disposición en determinados pacientes de la especie felina. Por ello, algunos clínicos recurren de manera sistemática al bypass ureteral en el gato. A criterio de los autores de este trabajo, los catéteres JJ también deberían ser la primera opción a considerar en los siguientes casos en la especie felina:
- Litiasis ureteral única en combinación con ureterotomía, empleando el catéter JJ de manera temporal.
- Litiasis ureteral múltiple de pequeño tamaño, susceptible de descender a vejiga de la orina con la dilatación que provoca el catéter JJ temporal.
- Otras causas de obstrucción ureteral intraluminal diferente a litiasis.
- Pielonefritis/pionefrosis en el momento del diagnóstico, con el fin de resolver la infección y evitar colocar un SUB en una vía urinaria infectada.
En cualquier caso, los tutores deben ser debidamente informados sobre la posibilidad de conversión intraquirúrgica a bypass ureteral, en los casos donde la colocación del catéter JJ no sea factible. Asimismo, los autores también consideran una indicación de conversión a SUB la presencia de estenosis/fibrosis ureteral (Figura 17A-B), habitualmente secundarias a la presencia de una litiasis impactada a ese nivel.
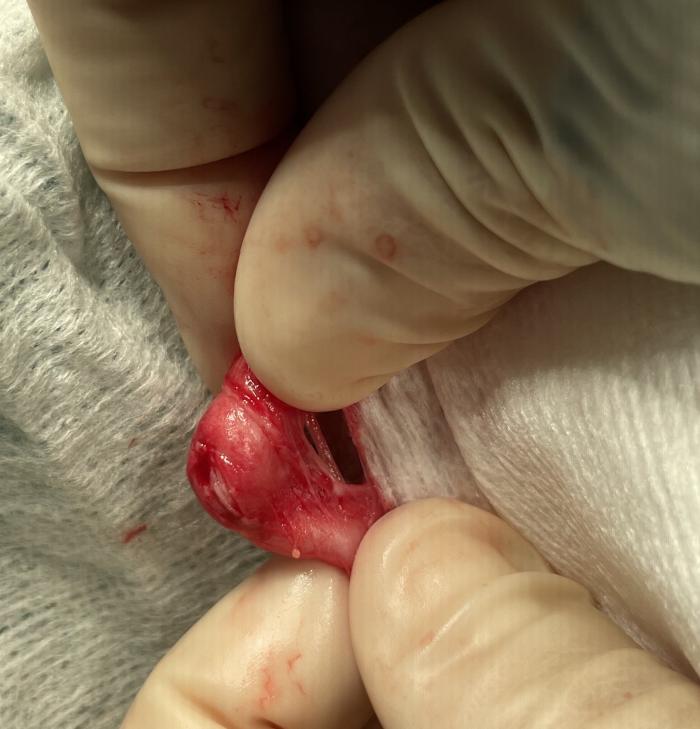
Figura 17. Estenosis fibrótica del uréter por presencia de litiasis. (A) Endurecimiento externo del uréter. (B) Engrosamiento de la pared ureteral que ocluye la luz del órgano.
Con el objetivo de reducir las complicaciones a largo plazo del SUB, resulta fundamental un mantenimiento y limpieza periódica del mismo. Además, se ha descrito que el 54 % de los gatos que se someten a la implantación de un bypass ureteral por ureterolitiasis consigue expulsar el cálculo, quedando el uréter nuevamente permeable. En base a lo anterior, algunos autores abogan por la retirada del dispositivo, aunque es necesario advertir al tutor sobre la posibilidad de reobstrucción por estenosis ureterales o litiasis recidivante.
Conclusiones
La obstrucción ureteral es una afección grave que requiere una descompresión rápida de la vía urinaria, con el objetivo de conservar la funcionalidad renal. Las técnicas de derivación urinaria guiadas por imagen, como los catéteres JJ o el bypass ureteral están desplazando a los procedimientos tradicionales. No obstante, estos dispositivos no están exentos de complicaciones, por lo que es necesario un planteamiento terapéutico individualizado, así como un seguimiento exhaustivo de cada paciente.
Bibliografía recomendada
- Adams LG. Nephroliths and ureteroliths: a new stone age. N Z Vet J 2013;61:212-6.
- Allinder M, Tynan B, Martin C, Furbish A, Austin G, Bartges J, Lorenço BN. Uroliths composed of antiviral compound GS-441524 in 2 cats undergoing treatment for feline infectious peritonitis. J Vet Intern Med 2024; 38:370-4.
- Balsa IM, Culp WTN, Palm CA, Hopper K, Hardy BT, Ben-Aderet DG, Mayhew PD, Drobatz KJ. Factors associated with postobstructive diuresis following decompressive surgery with placement of ureteral stents or subcutaneous ureteral bypass systems for treatment of ureteral obstruction in cats: 37 cases (2010-2014). J Am Vet Med Assoc 2019;254:944-52.
- Berent AC, Weisse CW, Bagley DH, Lamb K. Use of a subcutaneous ureteral bypass device for treatment of benign ureteral obstruction in cats: 174 ureters in 134 cats (2009-2015). J Am Vet Med Assoc 2018;253:1309-27.
- Borchert C, Berent A, Weisse C. Subcutaneous ureteral bypass for treatment of bilateral ureteral obstruction in a cat with retroperitoneal paraganglioma. J Am Vet Med Assoc 2018;253:1169-76.
- Boullenger J, Lafuma F, Baudin Trehiou C, Blond L, Gibert S, Kulendra N. Transmural migration of a subcutaneous ureteral bypass into the intestine in three cats. J Small Anim Pract 2022;63:792-6.
- Butty EM, Labato MA. Subcutaneous ureteral bypass device placement with intraoperative ultrasound guidance, with or without microsurgical ureterotomy, in 24 cats J Feline Med Surg 2021;23:1183-91.
- Cannon AB, Ruby AL, Westropp JL, Ruby AL, Kass PH. Evaluation of trends in urolith composition in cats: 5,230 cases (1985-2004). J Am Vet Med Assoc2007;231:570–6.
- Chik C, Berent AC, Weisse CW, Ryder M. Therapeutic use of tetrasodium ethylenediaminetetraacetic acid solution for treatment of subcutaneous ureteral bypass device mineralization in cats. J Vet Intern Med 2019;33:2124-32.
- Clarke DL. Feline ureteral obstructions Part 1: medical management. Iran J Basic Med Sci 2020;23:1367-73.
- Cray M, Berent AC, Weisse CW, Bagley D. Treatment of pyonephrosis with a subcutaneous ureteral bypass device in four cats. J Am Vet Med Assoc 2018;252:744-53.
- Deprey J, Baldinger A, Livet V, Blondel M, Taroni M, Lefebvre C, Goy-Thollot I, Moissonnier P, Viguier É, Pouzot-Nevoret C, Carozzo C, Cachon T. Risk factors and clinical relevance of positive urine cultures in cats with subcutaneous ureteral bypass. BMC Vet Res 2021;17:199.
- Dirrig H, Lamb CR, Kulendra N, Halfacree Z. Diagnostic imaging observations in cats treated with the subcutaneous ureteral bypass system. J Small Anim Pract2020;61:24-31.
- Djoneva L, Lawson J, Rutherford L, Geddes R. Analysis of lower urinary tract signs and bacteriuria in cats with subcutaneous ureteral bypass systems. Vet Rec Open2023; 10:e69.
- Dropkin CA, Burdick SK, Berent AC, Weisse CW. Use of tissue plasminogen activator to alleviate postoperative subcutaneous ureteral bypass obstruction secondary to blood clot in seven cats. J Feline Med Surg 2021;23:996-1004.
- Duval V, Dunn M, Vachon C. Use of tetrasodium EDTA acid for the treatment of intraluminal obstruction of subcutaneous ureteral bypass devices. J Feline Med Surg2022;24:e330-e337.
- Etzioni AL, Raskin RE, Van Alstine WG, Yu J. The cytologic and histologic diagnosis of ureteral fibroepithelial polyp in a dog. Vet Clin Pathol 2020;49:646-651.
- Fouhety A, Boursier JF. Infection and extrusion of a subcutaneous access port in a cat: a long-term postoperative complication of a subcutaneous ureteral bypass device. JFMS Open Rep 2020;6:2055116920911765.
- Gallagher A. Interventional Radiology and Interventional Endoscopy in treatment of nephroureteral disease in the dog and cat. Vet Clin North Am Small Anim Pract2018;48:843-862.
- Gloor C, Schweighhauer A, Rytz U, Francey T. Placement of a subcutaneous ureteral bypass in a Miniature Pinscher with presumed xanthine urolithiasis as a result of allopurinol treatment. Schweiz Arch Tierheilkd 2024; 166:207-15.
- Horowitz C, Berent A, Weisse C, Langston C, Bagley D. Predictors of outcome for cats with ureteral obstructions after interventional management using ureteral stents or a subcutaneous ureteral bypass device. J Feline Med Surg 2013;15:1052-62.
- Johnson CM, Culp WT, Palm CA, Zacuto AC. Subcutaneous ureteral bypass device for treatment of iatrogenic ureteral ligation in a kitten J Am Vet Med Assoc2015;247:924-31.
- Johnston SK, Bennett T, Miller AJ. Intestinal perforation involving the Dacron cuff of nephrostomy tubes following subcutaneous ureteral bypass system implantation for ureteral obstructions in two cats. JFMS Open Rep 2021;7:20551169211013295.
- Kaeidi A, Maleki M, Shamsizadeh A, Fatemi I, Hakimizadeh E, Hassanshahi J. The therapeutic approaches of renal recovery after relief of the unilateral ureteral obstruction: A comprehensive review. Iran J Basic Med Sci 2020; 23:1367-73.
- Kim MY, Aerin J, Traslavina RP, Yoon HY. Orthotopic ureterocele with concurrent ureteral urothelial carcinoma in a dog. Vet Med Sci 2022; 8:1881-1886.
- Kopecny L, Palm CA, Drobatz KJ, Balsa IM, Culp WTN. Risk factors for positive urine cultures in cats with subcutaneous ureteral bypass and ureteral stents (2010-2016). J Vet Intern Med 2019;33:178-83.
- Kulendra NJ, Borgeat K, Syme H, Dirrig H, Halfacree Z. Survival and complications in cats treated with subcutaneous ureteral bypass. J Small Anim Pract2021;62:4-11.
- Kwon M, Kim S, Lee K, Yoon H. Case Report: Imaging Features and Successful Management of Ureteral Stenosis in a Kitten With Bilateral Atypical Papillary Transitional Mucosal Hyperplasi. Front Vet Sci 2022;8:796638.
- Kwon M, Kim S, Lee K, Yoon H. Case Report: Imaging Features and Successful Management of Ureteral Stenosis in a Kitten With Bilateral Atypical Papillary Transitional Mucosal Hyperplasi. Front Vet Sci 2022;8:796638.
- Lemieux C, Vachon C, Beauchamp G, Dunn ME. Minimal renal pelvis dilation in cats diagnosed with benign ureteral obstruction by antegrade pyelography: a retrospective study of 82 cases (2012-2018). J Feline Med Surg 2021;23:892-9.
- Low WW, Uhl JM, Kass PH, Ruby AL, Westropp JL. Evaluation of trends in urolith composition and characteristics of dogs with urolithiasis: 25,499 cases (1985-2006). J Am V Med Assoc 2010; 236:193–200.
- Luca GC, Monteiro BP, Dunn M, Steagall PVM. A retrospective study of anesthesia for subcutaneous ureteral bypass placement in cats: 27 cases. J Vet Med Sci2017;79:992-8.
- Maia SR, Manochio M, Soares LV, Andrade YCC, Alvarenga AWO, Crivellenti LZ. Right-sided ureteral hemangiosarcoma in a paraplegic dog. BMC Vet Res2024;20:271.
- McEntee EP, Berent AC, Weisse C, Le Roux A, Lamb K. Evaluation of preoperative ultrasonographic parameters to predict renal recovery in long-term survivors after treatment of feline ureteral obstructions: 2012-2019 J Feline Med Surg 2022;24:328-36.
- McQuitty RG, Branter EM. Treatment of fungal pyelonephritis and ureterolithiasis with a subcutaneous ureteral bypass system and systemic antifungal medication in a cat. Vet Med (Auckl) 2018;9:73-8.
- Milligan ML, Berent AC, Weisse CW, Lamb K, Toizer E. Outcome of SUB placement for the treatment of benign ureteral obstruction in dogs: nine dogs and 12 renal units (2013 to 2017). J Small Anim Pract 2020;61:428-35.
- Nørregaard R, Mutsaers HAM, Frøkiær J, Kwon TH. Obstructive nephropathy and molecular pathophysiology of renal interstitial fibrosis. Physiol Rev2023;103:2827-72.
- Palm CA, Culp WTN. Nephroureteral obstructions. The use of stent and ureteralbypass system for renal decompression. Vet Clin Small Anim 2016; 42:1183-92.
- Pavia PR, Berent AC, Weisse CW, Neiman D, Lamb K, Bagley D. Outcome of ureteral stent placement for treatment of benign ureteral obstruction in dogs: 44 cases (2010-2013). J Am Vet Med Assoc 2018;252:721-31.
- Pennington CE, Halfacree Z, Colville-Hyde C, Geddes RF. Factors associated with positive urine cultures in cats with subcutaneous ureteral bypass system implantation. J Feline Med Surg 2021;23:331-6.
- Rigas JD, Smith TJ, Gorman ME, Valentine BA, Simpson JM, Seguin B. Primary ureteral giant cell sarcoma in a Pomeranian. Vet Clin Pathol 2012; 41:141-6.
- Steinhaus J, Berent AC, Weisse C, Eatroff A, Donovan T, Haddad J, Bagley D. Clinical presentation and outcome of cats with circumcaval ureters associated with a ureteral obstruction. J Vet Intern Med. 2015;29:63-70.
- Vedrine B. Perioperative Occlusion of a Subcutaneous Ureteral Bypass Secondary to a Severe Pyonephrosis in a Birman Cat. Top Companion Anim Med 2017;32:58-60.
- Véran E, Vachon C, Byron J, Howard J, Berent A, Weisse C, Javard R, Spencer A, Gradilla S, Palm C, Culp W, Cléroux A, Dunn M. Multicenter retrospective evaluation of transmural migration of subcutaneous ureteral bypass devices within the digestive tract in cats. J Vet Intern Med 2022;36:1677-85.
- Vrijsen E, Devriendt N, Mortier F, Stock E, Van Goethem B, de Rooster H. Complications and survival after subcutaneous ureteral bypass device placement in 24 cats: a retrospective study (2016-2019). J Feline Med Surg 2021;23:759-69.
- Westropp JL, Ruby AL, Bailiff NL, Kyles AE, Ling GV. Dried solidified blood calculi in the urinary tract of cats. J Vet Intern Med 2006; 20:828–34.
- Wuillemin F, Vachon C, Beauchamp G, Dunn M. Subcutaneous ureteral bypass device placement in 81 cats with benign ureteral obstruction (2013-2018). J Vet Intern Med. 2021;35:2778-86.
 by Multimédica
by Multimédica