Dermatosis acantolíticas caninas
Resumen breve
Los queratinocitos constituyen las células más abundantes de la epidermis. Para dar estabilidad a esta capa de la piel necesitan estar unidos de forma fuerte y estable mediante unas estructuras denominadas desmosomas, formados por filamentos intermedios de queratina y sus placas de fijación en la membrana plasmática de los queratinocitos y el núcleo del desmosoma. Cuando, debido a diferentes etiologías, estas uniones se ven afectadas, se puede producir la separación de los queratinocitos dando…Índice de contenidos
Resumen
Los queratinocitos constituyen las células más abundantes de la epidermis. Para dar estabilidad a esta capa de la piel necesitan estar unidos de forma fuerte y estable mediante unas estructuras denominadas desmosomas, formados por filamentos intermedios de queratina y sus placas de fijación en la membrana plasmática de los queratinocitos y el núcleo del desmosoma. Cuando, debido a diferentes etiologías, estas uniones se ven afectadas, se puede producir la separación de los queratinocitos dando lugar a las dermatosis acantolíticas, caracterizadas por la formación de grandes fisuras en la epidermis con presencia de queratinocitos acantolíticos en su interior. La etiología puede ser de base genética, autoinmune, bacteriana, fúngica e idiopática, dando lugar a diferentes enfermedades que presentan hallazgos clínicos e histopatológicos muy similares y que suponen un auténtico reto diagnóstico para el clínico y el histopatólogo.
Introducción
La epidermis del perro está formada por queratinocitos, melanocitos, células de Langerhans y de Merkel. Los queratinocitos suponen aproximadamente el 85 % del total de estas células y se encuentran unidos entre sí por unas estructuras denominadas desmosomas, que constituyen un andamiaje tridimensional que proporciona estabilidad y fortaleza a la epidermis. Los desmosomas realizan esta función mediante la formación de uniones intercelulares entre células adyacentes, a través de la adhesión de las caderinas desmosomales a los filamentos intermedios del citoesqueleto.
Los desmosomas están formados por filamentos intermedios de queratina y sus placas de fijación en la membrana plasmática de los queratinocitos y el núcleo del desmosoma, que se llama desmoglea y está situado entre las dos membranas plasmáticas de los queratinocitos adyacentes. Se han descrito varias proteínas de la placa desmosomal, como las desmoplaquinas (subtipos 1 y 2), la placofilina y la placoglobina; y glucoproteínas del núcleo desmosomal, como las desmocolinas (subtipos 1-3) y las desmogleínas (subtipos 1-4)1. Algunas de estas moléculas son la diana de numerosos agentes etiológicos, que alteran su estructura y provocan la separación de los queratinocitos, en el proceso conocido como acantolisis, que da lugar a la aparición de grandes fisuras en la epidermis con presencia de queratinocitos acantolíticos en su interior.
Dicha alteración de los desmosomas puede ser observada en enfermedades de base genética (p. ej., enfermedad de Darier), autoinmunes (p. ej., complejo pénfigo), degradación por proteasas (p. ej., impétigo bulloso y dermatofitosis pustulosa superficial) y enfermedades idiopáticas (p. ej., dermatosis pustulosa lineal acantolítica idiopática)2.
En este artículo se realiza una revisión de las enfermedades cutáneas que cursan con acantolisis en el perro, centrándose en los signos clínicos y hallazgos citológicos e histopatológicos. En alguno de los casos se hará referencia a las pautas terapéuticas.
Enfermedades acantolíticas caninas de base genética
Enfermedad de Darier
La enfermedad de Darier en los humanos es una rara enfermedad hereditaria autosómica dominante que fue reportada por Darier y White en 1889. Está causada por mutaciones en el gen ATP2A2, que codifica la bomba de calcio SERCA2 (ATPasa tipo 2 del retículo sarco-endoplasmático). Esta enfermedad se desarrolla en la infancia y persiste en la adolescencia, causando pequeñas pápulas, principalmente en áreas seborreicas como la cara, pecho y espalda. Histológicamente se caracteriza por presentar una disqueratosis con cuerpos redondos, granulares y una acantolisis a nivel suprabasal. No existen tratamientos curativos, tratándose la mayoría de los casos de forma sintomática. Los retinoides orales parecen presentar cierta eficacia, pero su uso ha sido limitado debido a la asociación con diversos efectos adversos. También se ha reportado la utilidad de los inhibidores de la COX2 en el tratamiento de esta enfermedad3.
Una dermatosis parecida a la enfermedad de Darier ha sido descrita en el perro4,5. En un artículo del año 1993 se reportó una rara genodermatosis en tres perros de raza Setter inglés. Posteriormente se realizaron cruces con una hembra de Beagle, que señalaron la probabilidad de una herencia autosómica dominante de esta enfermedad. Estos perros desarrollaron a los seis meses de edad unas lesiones características, consistentes en unas placas eritematosas, costrosas, alopécicas e hipertróficas localizadas en cabeza, tronco y extremidades, sobre todo en puntos de presión y roce. Dichas lesiones no eran dolorosas ni pruriginosas. El estudio histopatológico mostró una hiperplasia epidérmica, hiperqueratosis ortoqueratósica y paraqueratótica, áreas multifocales de acantolisis a nivel de las porciones media e inferior de la epidermis y de la vaina radicular del folículo piloso. Se observaron también, en el estrato espinoso, queratinocitos acantolíticos disqueratósicos, denominados cuerpos redondos.
Displasia ectodérmica-síndrome de fragilidad cutáneo
En seres humanos se han descrito varios subtipos de epidermólisis bullosa simple. Uno de ellos es el síndrome de displasia ectodérmica-fragilidad cutánea en el que hay una deficiencia de placofilina-1 (PKP1) debido a mutaciones en la expresión de PKP1. Es una genodermatosis que ha sido documentada en pacientes humanos, que presentaban lesiones cutáneas desde el nacimiento6,7. Los recién nacidos mostraban eritrodermia difusa y fragilidad cutánea en áreas de roce o trauma. Existía también una queilitis crónica y fisuras a nivel palmar y plantar. Todos los pacientes padecían alteraciones en el cabello, desde hipotricosis hasta alopecia total, pelo lanoso y distrofias ungueales. Los hallazgos histopatológicos mostraban hiperplasia epidérmica con severa acantolisis en el estrato espinoso y agregación de filamentos de queratina.
En 2012 un artículo describió una nueva genodermatosis que afectaba a cachorros de raza Chesapeake Bay retriever procedentes de padres clínicamente sanos8. Estos animales reproducían clínica, histológica y ultraestructuralmente el fenotipo de la displasia ectodérmica-síndrome de fragilidad cutánea que se había descrito en pacientes humanos, con deficiencia de PKP1. Los nueve cachorros afectados presentaban, desde el nacimiento, desprendimiento de la piel y erosiones en áreas de roce y uniones mucocutáneas. Su manto era más fino de lo normal y existían parches de alopecia. La histopatología reveló una acantolisis suprabasal severa, evolucionando a menos severa con el envejecimiento. A nivel ultraestructural se observaban desmosomas parcialmente formados con filamentos intermedios de queratina agregados. Las inmunotinciones para evaluar la adhesión de los desmosomas mostraron falta de tinción para PKP1 y alteraciones en la distribución de desmoplaquina y queratinas 10 y 14. El análisis de las mutaciones y el genotipado revelaron una mutación homocigótica que afectaba a la expresión de PKP1.
No existe un tratamiento efectivo para esta rara enfermedad.
Enfermedades acantolíticas de etiología autoinmune
Pénfigo foliáceo
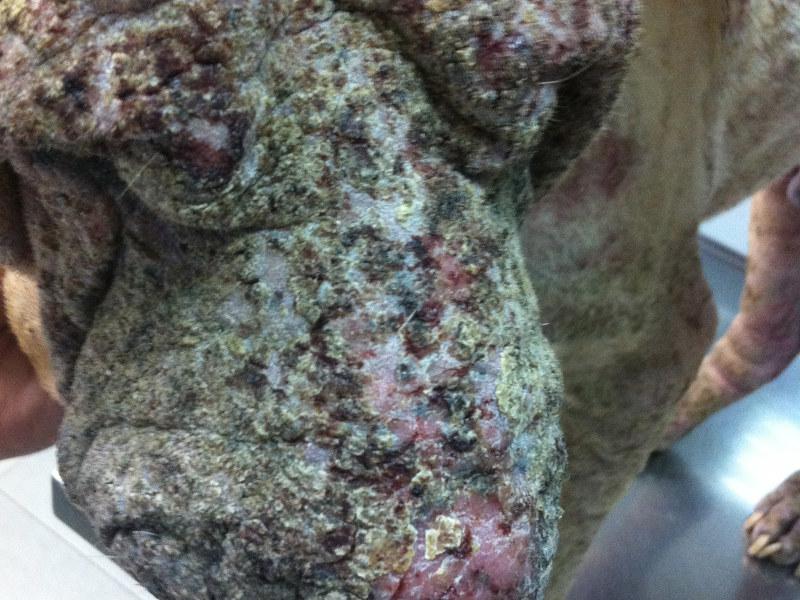
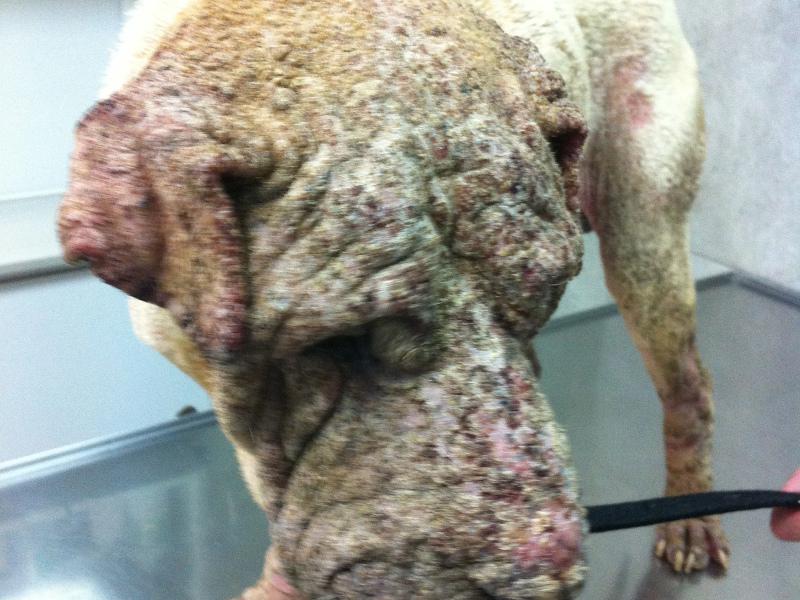
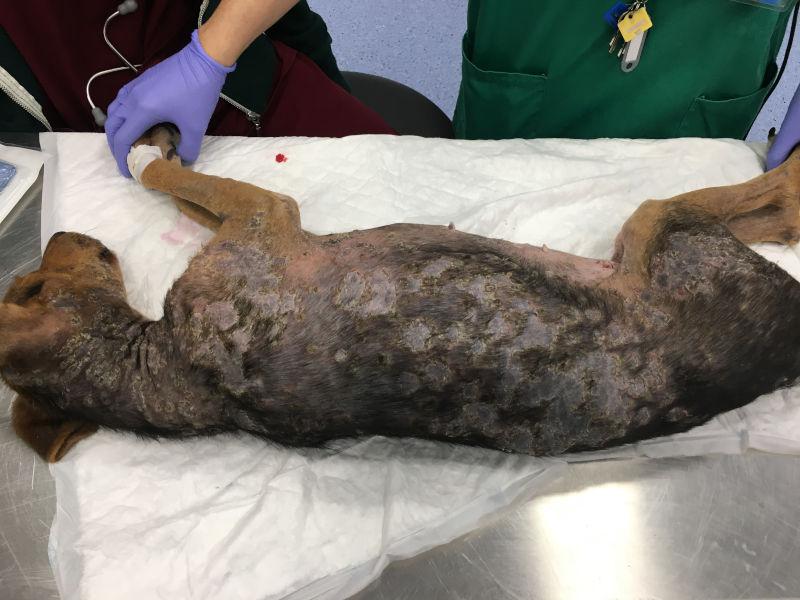
El pénfigo foliáceo es la enfermedad autoinmune cutánea más común en el perro. Parece existir predisposición racial, estando más representada en Akita, Chow-chow, Cocker spaniel, Dachshund, Doberman, Collie y Shar-pei9. A diferencia del pénfigo foliáceo humano, en el que el autoantígeno es la Desmogleina-1 (Dsg1), en el perro es reconocida por los autoanticuerpos (IgG4) en menos del 10% de los perros afectados, siendo la Desmocolina-1 (Dsc1) el autoantígeno principal10-12. Muchos casos de pénfigo son idiopáticos, aunque hay sospecha de algunos casos inducidos por fármacos13-17. Una historia de dermatitis atópica y alergia a la picadura de pulgas es común, pero no está claro si influye en la presentación de la enfermedad, siendo solo un hallazgo casual.
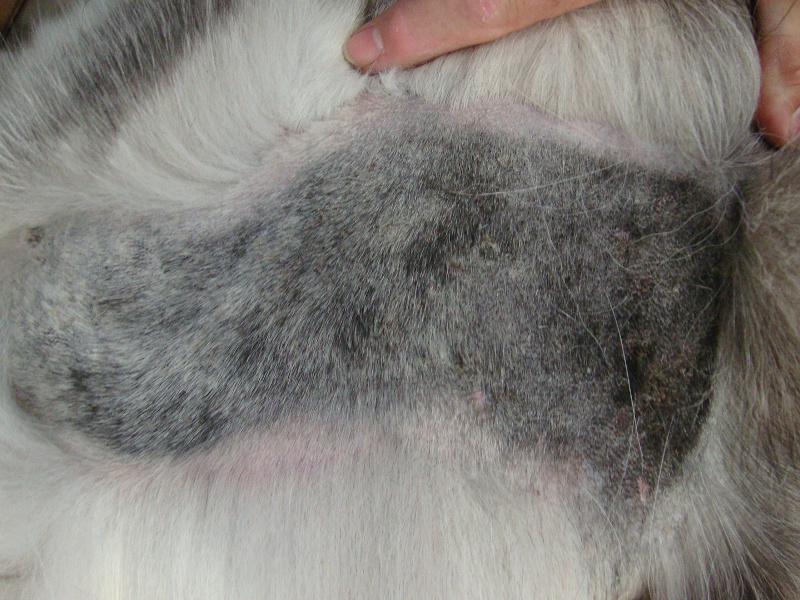
Las lesiones características del pénfigo foliáceo canino consisten en grandes pústulas (Figura 1), que pueden abarcar varios folículos pilosos. Estas pústulas progresan rápidamente a erosiones y costras. Las lesiones suelen ser simétricas y son más comunes en la cara interna de los pabellones auriculares, cara, tronco y almohadillas plantares (Figura 2A-C). Raramente afectan a membranas mucosas y si lo hacen se debería pensar en otra variedad de pénfigo, como el vulgar. El prurito puede estar presente y en casos graves, con enfermedad generalizada se puede observar depresión, fiebre, anorexia y pérdida de peso.
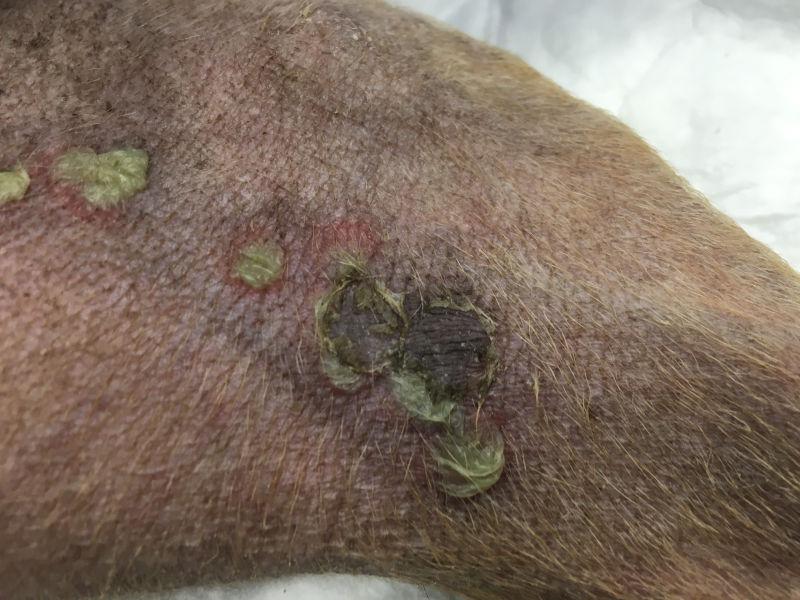
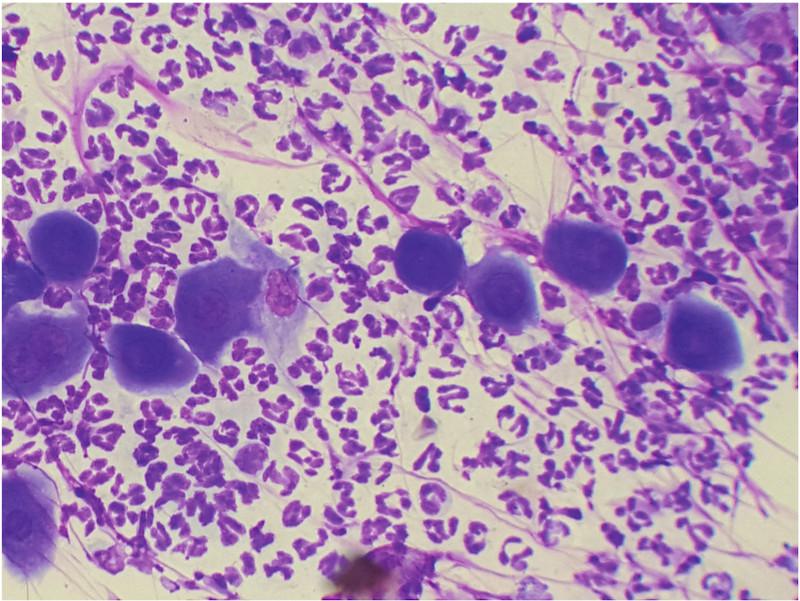
La citología es de gran ayuda para orientar el diagnóstico. Las citologías de contenido de pústulas intactas muestran queratinocitos acantolíticos asociados con gran cantidad de neutrófilos intactos y algunos eosinófilos (Figura 3). Estos acantocitos son redondos, con núcleo densamente teñido y morfología diferenciada de células pertenecientes al estrato espinoso o granuloso de la epidermis. Se debe tener en cuenta que estos hallazgos citológicos no son exclusivos del pénfigo foliáceo, pudiendo observarse también en dermatofitosis causadas por Trichophyton sp. y en el pioderma bacteriano.
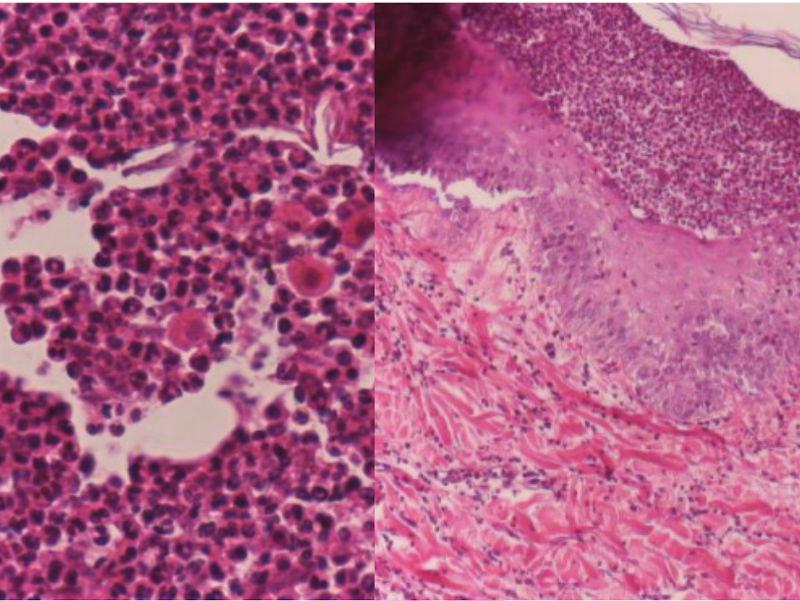
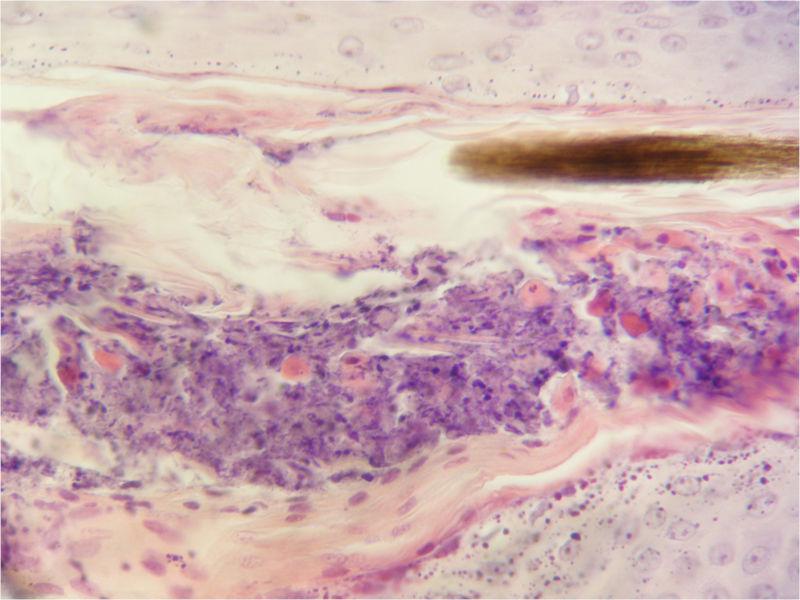
Por lo tanto, el diagnóstico definitivo se obtendrá a través del examen histopatológico. La muestra ideal para la toma de biopsia es la obtenida de una pústula intacta o costras fuertemente adheridas. Es preferible la biopsia excisional con bisturí en lugar de la biopsia con punzón por el mayor riesgo de rotura de la pústula con esta última técnica. Los hallazgos histopatológicos consisten en pústulas subcorneales que contienen grupos de queratinocitos acantolíticos, gran cantidad de neutrófilos no degenerados y algunos eosinófilos (Figura 4). Se puede proponer tinciones especiales como el PAS o Grocott para descartar la presencia de dermatofitos18-20.
El tratamiento requiere de la administración de fármacos inmunosupresores, siendo los corticoesteroides la base del abordaje terapéutico9,21. La prednisona, prednisolona o metilprednisolona a dosis de 2 mg/kg/24 h, o dividida en dos tomas, es el tratamiento más usado. Se mantiene esta dosis hasta lograr la remisión del cuadro clínico y posteriormente se va bajando la dosis un 25% cada 2-4 semanas hasta mantener una dosis de 1 mg/kg en días alternos. Si no se logra el control de la enfermedad con el uso de corticoesteroides se puede añadir al protocolo terapéutico un inmunosupresor como la azatioprina, en dosis de 1,5 a 2,5 mg/kg/día. La respuesta puede tardar de 3 a 6 semanas en ser evidente. Se debe monitorizar el tratamiento con hemogramas y bioquímicas sanguíneas seriadas cada 2-4 semanas debido a los efectos hepatotóxicos y supresores de la médula ósea que puede provocar el uso continuado de este inmunosupresor. Algunos clínicos prefieren iniciar el tratamiento combinado con un corticoesteroide y azatioprina, después van reduciendo la dosis hasta lograr administrar el corticoesteroide un día y la azatioprina el siguiente. Aunque, se ha sugerido que esta combinación terapéutica no produce una respuesta más rápida ni un mejor resultado final. La dosis de mantenimiento de la azatioprina sería de 0,5 mg/kg. Se han visto casos de pancreatitis con esta pauta. Se ha propuesto también una terapia alternativa mediante un tratamiento en pulsos con dosis iniciales altas de glucocorticoides (10 mg/kg/día de metilprednisolona por vía oral) durante unos días para lograr la remisión de los signos clínicos, continuando después con dosis más bajas de las normalmente necesarias para el mantenimiento de la remisión (1,1 mg/kg/día de metilprednisolona)22. Otros fármacos que han sido usados con resultados variables en el tratamiento del pénfigo foliáceo canino son la ciclosporina, el clorambucilo, la combinación de tetraciclina con niacinamida y el micofenolato de mofetilo9,21. Está descrito el beneficio del tratamiento con corticoesteroides tópicos o tacrolimus 0,1% en lesiones localizadas.
Los animales afectados suelen presentar una buena respuesta al tratamiento. Muchos pacientes requieren tratamiento de por vida, aunque son mantenidos a las dosis efectivas más bajas. En algunos casos se consiguen largos periodos de remisión tras la retirada de la terapia23. Son muy pocos los pacientes que fallecen o son eutanasiados debido a la falta de éxito del tratamiento.
Pénfigo vulgar
El pénfigo vulgar es una enfermedad autoinmune, vesicular, bullosa y ulcerativa severa, de muy rara presentación en el perro. Algunas razas como el Pastor alemán o los Collies parecen estar más representadas, pudiendo ocurrir a cualquier edad. Sí parece existir predisposición de sexo, habiendo sido descritos más casos en machos que en hembras. En esta enfermedad la Desmogleína-3 (Dsg3) es el autoantígeno principal, siendo el objetivo de anticuerpos IgG y afectando a la mucosa oral24. La Desmogleína-1 también puede actuar como autoantígeno y ser atacada, hecho que se observa sobre todo en las lesiones localizadas en mucosas y áreas de piel con pelo. Se documentó un caso de pénfigo vulgar que parecía estar relacionado con la aplicación tópica de polimixina B, pero parece ser que la evidencia era tan débil que no pudo confirmarse la implicación de esta medicación25,26.
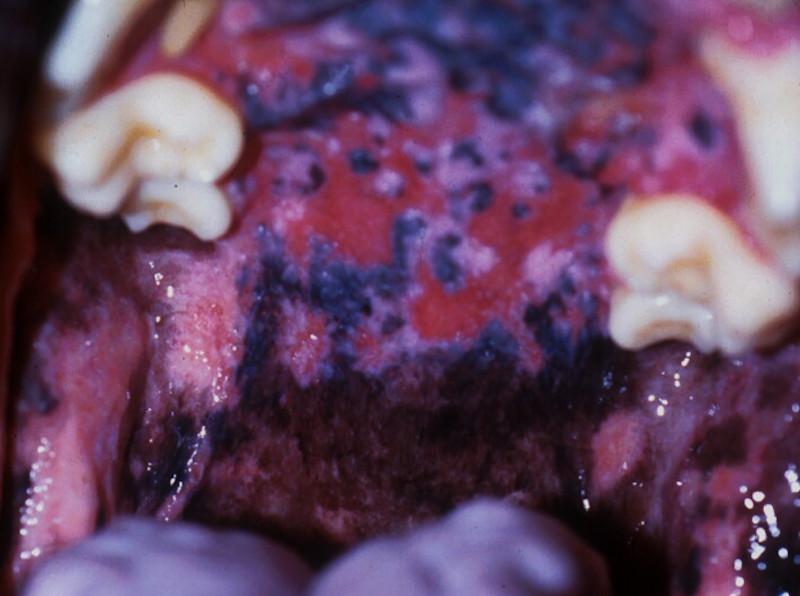
A nivel clínico, las lesiones consisten en ampollas y bullas que rápidamente se transforman en erosiones y úlceras. Se inician en la cavidad oral y uniones mucocutáneas, presentando úlceras coalescentes, en la lengua, paladar y encías (Figura 5). Posteriormente evolucionan en extensión y severidad desde este fenotipo mucoso inicial hacia un fenotipo mucocutáneo. En zonas de piel con pelo las lesiones se desarrollan en puntos de presión y pliegues cutáneos, secundarias a la fricción. Puede haber signo de Nikolsky positivo con desprendimiento de piel debido a la falta de cohesión epidérmica.
Histopatológicamente la lesión característica es una hendidura o separación suprabasilar debido a la acantolisis, que conduce a la formación de una ampolla (Figura 6). En la base de la hendidura suelen quedar células basales residuales dispuestas en hileras a modo de lápidas de tumbas27. En las ampollas intactas no se observa inflamación. La inmunofluorescencia directa o la inmunohistoquímica son positivas, revelando el depósito transepidérmico de inmunoglobulinas, normalmente IgG.
El tratamiento debe ser agresivo, mediante la combinación de corticoesteroides y azatioprina o clorambucilo. Es absolutamente necesario el tratamiento antibiótico concomitante. El pronóstico suele ser malo, con una supervivencia del 25 % de los pacientes en un año9.
Pénfigo paraneoplásico
Solo hay tres casos descritos hasta el momento de esta severa variante de pénfigo. Es una enfermedad autoinmune cutánea, ampollosa, de muy rara presentación, que afecta a mucosas y uniones mucocutáneas y que en estos tres casos se ha visto asociada a la existencia de neoplasias, una perra Bouvier de Flandes de 7 años, en la que se detectó un linfoma tímico con metástasis en hígado28, un Golden retriever de 7 años con un sarcoma esplénico29 y el primer caso descrito, en 197530, que presentaba un timoma. El patrón lesional era parecido al pénfigo vulgar, con presencia de vesículas flácidas, erosiones y ulceraciones en cavidad oral, nariz y vulva, en todas las membranas mucosas, uniones mucocutáneas y piel cubierta de pelo. Los pacientes también mostraban signos sistémicos como depresión, letargia y fiebre. Inmunológicamente, se observó la presencia de autoanticuerpos IgG dirigidos contra desmogleína-3, envoplaquina y periplaquina.
Los hallazgos histopatológicos observados fueron una acantolisis epitelial suprabasal (como la observada en el pénfigo vulgar) y dermatitis de interfase linfocítica con queratinocitos apoptóticos (como ocurre en el eritema multiforme).
El pénfigo paraneoplásico resultó mortal en los tres perros.
Pénfigo vegetante
El pénfigo vegetante humano, es una dermatosis autoinmune, acantolítica que combina lesiones cutáneas hiperplásicas, verrugosas y pustulares, además de erosiones mucosales31. En medicina veterinaria solo existe un caso descrito con características análogas a la presentación de la enfermedad en humanos. El paciente era un perro de raza Gran boyero suizo de 4 años, que presentaba pápulas y pústulas costrosas y verrugoides multifocales, así como erosiones y úlceras en cavidad oral, prepucio y ano32,33.
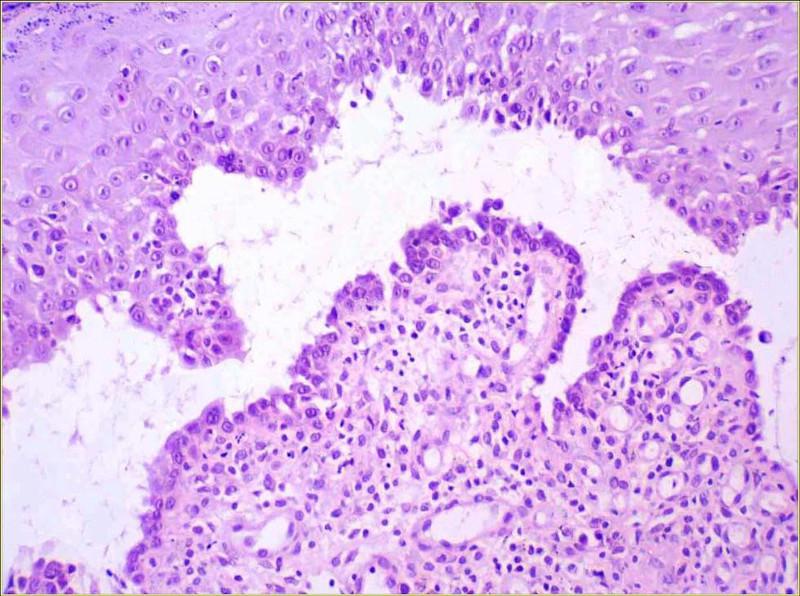
La histopatología reveló una combinación de pústulas acantolíticas con hendiduras suprabasales. Las pústulas se presentaban a nivel superficial y profundo en la epidermis y contenían neutrófilos sin signos de degeneración, eosinófilos y queratinocitos acantolíticos tanto aislados como en grupos. Las hendiduras situadas a nivel suprabasal mostraron queratinocitos basales redondeados y algunos neutrófilos, células mononucleares, eritrocitos y muy escasos queratinocitos acantolíticos. En las lesiones de la cavidad oral se observó una acantolisis suprabasal. En las muestras de piel con pelo, la epidermis desarrolló una hiperqueratosis ortoqueratótica, hiperplasia epidérmica con patrón papilar y proyecciones exofíticas. La dermis presentaba un leve infiltrado inflamatorio perivascular a intersticial formado por neutrófilos, linfocitos, histiocitos, mastocitos y neutrófilos.
La inmunofluorescencia indirecta mostró autoanticuerpos anti-Desmogleína-1. Esto constituye una diferencia respecto a la forma humana de pénfigo vegetante, en la que se detectan anticuerpos anti-Desmogleína-3.
Pénfigo eritematoso
En medicina humana el pénfigo eritematoso es una entidad clínicamente heterogénea que ha sido relacionada con el lupus cutáneo discoide y pénfigo superficial, considerándose actualmente una variante de pénfigo foliáceo y evidenciando la presencia de anticuerpos anti-Desmogleína-1, que se corresponden con el desarrollo de este tipo de pénfigo en humanos.
En medicina veterinaria no existen suficientes evidencias para considerarla una entidad diferente de un pénfigo foliáceo localizado a nivel facial, teniendo en cuenta sus características clínicas, histopatológicas o inmunológicas19. Los perros afectados presentan lesiones costrosas simétricas en nariz, cara y pabellones auriculares. En el plano nasal se pueden observar erosiones y úlceras con pérdida de pigmentación. Estas lesiones son similares a las encontradas en el lupus eritematoso discoide, por lo que este sería el principal diagnóstico diferencial de la enfermedad. A nivel histopatológico se encuentran pústulas intragranulares y subcorneales que contienen neutrófilos, eosinófilos y queratinocitos acantolíticos, características de pénfigo foliáceo, junto con una dermatitis liquenoide de interfase, similar a la del lupus eritematoso discoide. La inmunofluorescencia directa revela depósitos epidérmicos intracelulares de inmunoglobulinas y también a nivel de la membrana basal, con o sin activación del complemento. La inmunofluorescencia indirecta resulta negativa para todos los pacientes, aunque aproximadamente la mitad de los perros testados pueden presentar títulos bajos de anticuerpos antinucleares (1:10-1:40).
Los pacientes presentan buen pronóstico al no tratarse de una enfermedad agresiva. Las lesiones responden bien a la terapia inmunosupresora o al tratamiento con tetraciclina y niacinamida. El tratamiento tópico con tacrolimus al 0,1% ha demostrado ser eficaz34. La radiación solar puede exacerbar la enfermedad, por lo que es importante el uso de protectores solares y evitar en lo posible la exposición al sol.
Dermatosis acantolíticas producidas por bacterias
En seres humanos se ha demostrado que las toxinas exfoliativas (ETA, ETB y ETC) producidas por los Staphylococcus aureus están implicadas en la patogénesis de dos enfermedades ampollosas, el impétigo bulloso y el síndrome estafilocócico de la piel escaldada (SSS). En ambas enfermedades hay una fuerte evidencia de que estas toxinas son serin proteasas que se unen al segmento extracelular de la desmogleína-1 y lo degradan35,36. En el perro el Staphylococcus pseudintermedius es capaz de producir toxinas exfoliativas (EXPA y EXPB), que resultan en lesiones ampollosas, siendo el agente etiológico del impétigo bulloso y el pioderma exfoliativo superficial37,38.
El impétigo bulloso afecta a cachorros y perros adultos inmunosuprimidos. Las lesiones características consisten en grandes pústulas no foliculares, flácidas o tensas, que se rompen fácilmente y dan lugar a costras amarillentas y collaretes epidérmicos (Figura 7). En la citología se pueden encontrar gran cantidad de neutrófilos, muchos de ellos degenerados, queratinocitos acantolíticos y bacterias cocoides (Figura 8). Histológicamente se observan grandes pústulas, subcorneales o intragranulares, neutrofílicas, que contienen un número variable de queratinocitos acantolíticos. Se suelen detectar también cocos gram-positivos.
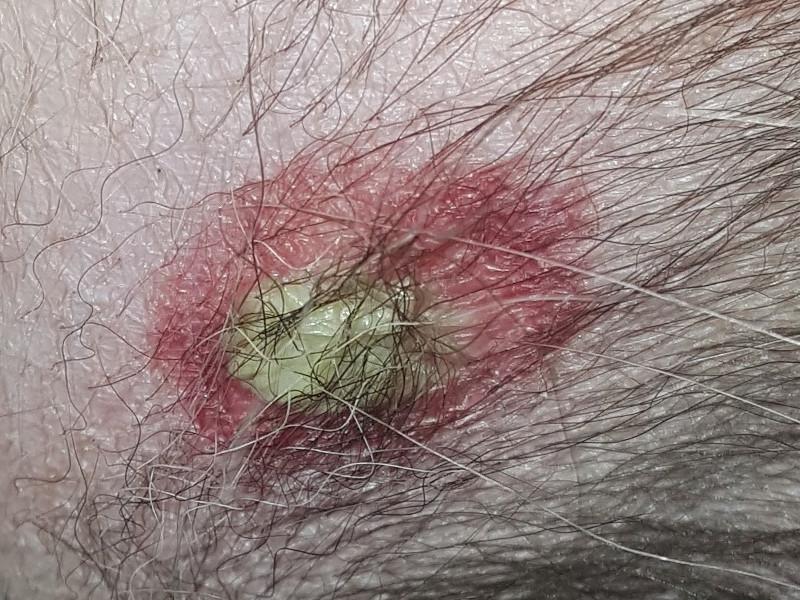
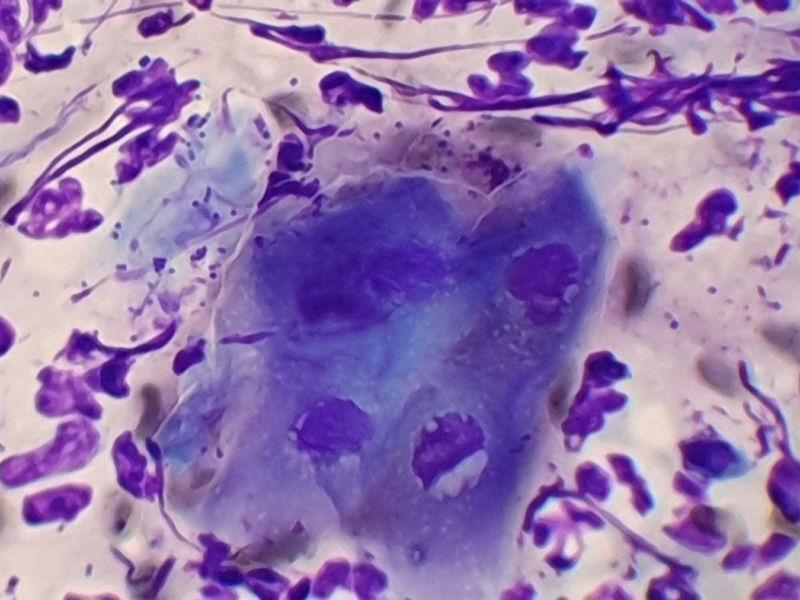
En el pioderma exfoliativo superficial se hallan dos fenotipos diferentes. El más común es el pioderma de extensión superficial, que presenta collaretes epidérmicos (Figura 9) que se extienden y confluyen hasta ocupar grandes áreas de piel39. En ocasiones se observa eritema periférico e hiperpigmentación central post-inflamatoria. El segundo fenotipo es parecido al síndrome estafilocócico de la piel escaldada de los humanos. En esta presentación, el patrón de extensión de los collaretes epidérmicos no está muy definido y se observa un eritema regional o generalizado, de inicio agudo, con descamación compuesta de grandes láminas de estrato córneo. Ambas variedades de pioderma exfoliativo superficial raramente coinciden con lesiones típicas de la foliculitis bacteriana superficial.
A nivel histológico se observan pústulas epidérmicas superficiales con elevación del estrato córneo. Es más común encontrar queratinocitos acantolíticos en el impétigo bulloso que en el pioderma exfoliativo superficial, de hecho, en un estudio del año 201739, no observaron queratinocitos acantolíticos en ninguna de las biopsias analizadas, por lo que posiblemente, no sería correcto clasificar a la pioderma superficial exfoliativa, en su fenotipo de collaretes epidérmicos, como dermatosis acantolítica. También se podrán encontrar cocos gram-positivos en zonas donde predominan los neutrófilos degenerados.
Dermatosis acantolíticas producidas por hongos
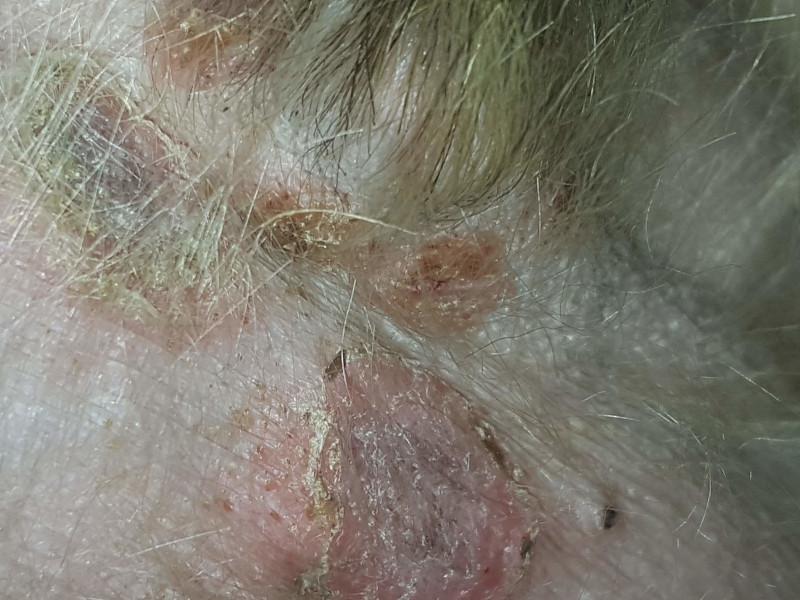
Los dermatofitos patógenos son capaces de secretar gran cantidad de exoproteasas y endoproteasas. Se ha demostrado que las enzimas de Trichophyton son capaces de producir acantolisis in vitro al ser añadidas a cultivos de piel humana. En el perro, se ha observado que Trichophyton es capaz de producir acantolisis pustulosa superficial, que imita en gran medida al pénfigo foliáceo9. En la dermatofitosis pustulosa superficial, Trichophyton spp. coloniza el estrato córneo de la epidermis, alcanzando en ocasiones el infundíbulo folicular. Esto origina un reclutamiento de neutrófilos que se acumulan a nivel subcorneal. Macroscópicamente las lesiones consisten en pápulas, pústulas, descamación y costras, muchas veces iniciadas a nivel facial, que se extienden de forma centrífuga, hasta afectar a grandes áreas (Figura 10). El examen microscópico de escamas y costras puede revelar la presencia de hifas fúngicas (Figura 11). A nivel histopatológico se observa un patrón lesional parecido al pénfigo foliáceo, con pústulas subcorneales que contienen gran cantidad de neutrófilos y queratinocitos acantolíticos. También se puede encontrar una dermatitis de interfase rica en linfocitos. Para la detección de las formas fúngicas se deben usar tinciones especiales como el PAS (ácido peryódico de Schiff) o el Grocott. En el año 2007 se publicaron los resultados de un estudio retrospectivo llevado a cabo en 190 biopsias de piel canina, 95 casos para cada diagnóstico de pénfigo foliáceo o dermatofitosis40. Las preparaciones se tiñeron con hematoxilina-eosina, Grocott y PAS. En ninguno de los casos de pénfigo se detectaron dermatofitos, mientras que se detectaron queratinocitos acantolíticos en el 14% de los casos de dermatofitosis, ninguno de los cuales tenía signos clínicos compatibles con pénfigo superficial (eritematoso y foliáceo). Entre los casos con presencia de queratinocitos acantolíticos, la presencia de estas células era significativamente mayor en los casos de pénfigo. Sin embargo, estos resultados no serían relevantes en la dermatofitosis pustulosa superficial, puesto que, en todos los casos publicados de perros afectados, se identificaron queratinocitos acantolíticos41.

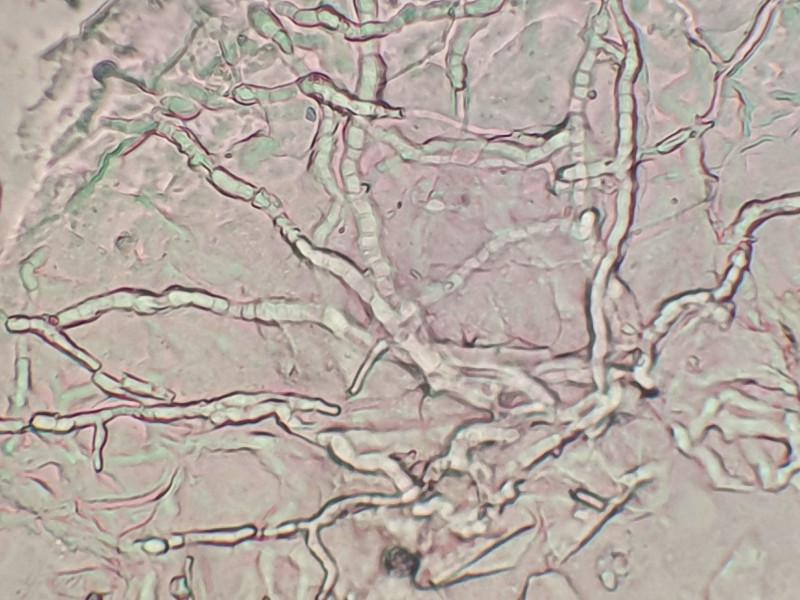
Dermatosis acantolíticas idiopáticas
Dermatosis pustulosa lineal acantolítica idiopática
Se han descrito dos casos de dermatosis pustulosa lineal acantolítica idiopática en perros jóvenes42,43 y un caso sugestivo de padecer dicha enfermedad en un perro geriátrico44. Se observaron lesiones lineales, con pápulas, pústulas, costras y eritema en miembro pélvico, tórax o cara (Figura 12). Las citologías de las pústulas mostraron numerosos neutrófilos, algunos de ellos degenerados, cocos intra y extracelulares además de algunos queratinocitos acantolíticos. Histopatológicamente se observó una foliculitis mural y luminal neutrofílica con marcada acantolisis (Figura 13). En los tres casos se realizaron pruebas complementarias para descartar la presencia de agentes infecciosos, como tinciones especiales y terapia antibiótica previa a la biopsia. En los dos casos descritos en animales jóvenes se optó por un tratamiento oral con metilprednisolona a dosis de 1,6 mg/kg una vez al día, mostrando una buena respuesta en las primeras dos semanas de tratamiento. En el caso del perro geriátrico se optó por un tratamiento tópico con betametasona dipropionato al 0,598 % cada 12 horas, evidenciando una respuesta clínica favorable a las dos semanas de tratamiento. En uno de los pacientes jóvenes la enfermedad mostró varias recurrencias. El paciente geriátrico murió a los 4 meses por una hemorragia debida a la rotura de una masa esplénica.
La etiología de esta enfermedad es desconocida, aunque la respuesta a los corticoides podría sugerir una etiología inmunomediada.
Conclusiones
Las dermatosis acantolíticas caninas son enfermedades poco comunes que se caracterizan por la destrucción o alteración de las uniones desmosómicas entre los queratinocitos. Este hecho da lugar a la aparición de lesiones muy similares a nivel clínico, citológico e histopatológico entre las diferentes enfermedades que cursan con acantolisis y, en ocasiones, se convierte en un auténtico reto llegar a un diagnóstico definitivo. Los hallazgos clínicos y citológicos orientarán el diagnóstico, pero en la mayor parte de casos, dicho diagnóstico se obtendrá a partir del estudio histopatológico, que podrá requerir la realización de tinciones especiales para la detección de formas fúngicas o inmunotinciones para tratar de caracterizar las inmunoglobulinas que intervienen en cada proceso acantolítico.
Bibliografía
- Kowalczyk, A. P., & Green, K. J. (2013). Structure, function, and regulation of desmosomes. Progress in molecular biology and translational science, 116, 95–118.
- Stahley, S. N., & Kowalczyk, A. P. (2015). Desmosomes in acquired disease. Cell and tissue research, 360(3), 439–456. doi:10.1007/s00441-015-2155-2
- Takagi, A. , Kamijo, M. and Ikeda, S. (2016), Darier disease. J Dermatol, 43: 275-279. doi:10.1111/1346-8138.13230
- Olivry, T. and Linder, K. E. (2009), Dermatoses affecting desmosomes in animals: a mechanistic review of acantholytic blistering skin diseases. Veterinary Dermatology, 20: 313-326.
- Ueki, H. , Shanley, K. , Goldsmichdt, M. , Lazarus, G. and Murphy, G. (1997), Dominantly inherited epidermal acantholysis in dogs, simulating human benign familial chronic pemphigus (Hailey–Hailey disease). British Journal of Dermatology, 136: 190-196.
- John A. McGrath, Jemima E. Mellerio, (2010). Ectodermal Dysplasia-Skin Fragility Syndrome, Dermatologic Clinics, Volume 28, Issue 1, Pages 125-129.
- Boyce, A. E., McGrath, J. A., Techanukul, T. , Murrell, D. F., Chow, C. W., McGregor, L. and Warren, L. J. (2012), Ectodermal dysplasia‐skin fragility syndrome due to a new homozygous internal deletion mutation in the PKP1 gene. Australasian Journal of Dermatology, 53: 61-65.
- Olivry, T., Linder, K. E., Wang, P., Bizikova, P., Bernstein, J. A., Dunston, S. M., … Casal, M. L. (2012). Deficient plakophilin-1 expression due to a mutation in PKP1 causes ectodermal dysplasia-skin fragility syndrome in Chesapeake Bay retriever dogs. PloS one, 7(2), e32072.
- William H. Miller Jr., Craig E. Griffin, Karen L. Campbell. Muller & Kirk’s Small animal Dermatology. – 7th ed. Ed. Elsevier, 2013: 438-446
- Olivry, T. , Dunston, S. M., Walker, R. H., Alhaidari, Z. , Messinger, L. and Liu, Z. (2009), Investigations on the nature and pathogenicity of circulating antikeratinocyte antibodies in dogs with pemphigus foliaceus. Veterinary Dermatology, 20: 42-50.
- Bizikova P, Dean GA, Hashimoto T et al. (2012). Cloning and establishment of canine desmocollin‐1 as a major autoantigen in canine pemphigus foliaceus. Vet Immunol Immunopathol; 149: 197– 207.
- Bizikova P, Linder KE, Olivry T. Immunomapping of desmosomal and nondesmosomal adhesion molecules in healthy canine footpad, haired skin and buccal mucosal epithelia: comparison with canine pemphigus foliaceus serum immunoglobulin G staining patterns. Vet Dermatol 2011; 22: 132– 142.
- White, S. D., Carlotti, D. N., Pin, D. , Bonenberger, T. , Ihrke, P. J., Monet, E. , Nishifuji, K. , Iwasaki, T. and Papich, M. G. (2002), Putative drug‐related pemphigus foliaceus in four dogs. Veterinary Dermatology, 13: 195-202.
- Oberkirchner, U., Linder, K. E., Dunston, S. , Bizikova, P. and Olivry, T. (2011), Metaflumizone–amitraz (Promeris)‐associated pustular acantholytic dermatitis in 22 dogs: evidence suggests contact drug‐triggered pemphigus foliaceus. Veterinary Dermatology, 22: 436-448.
- Bizikova, P., Linder, K. E. and Olivry, T. (2014), Fipronil–amitraz–S‐methoprene‐triggered pemphigus foliaceus in 21 dogs: clinical, histological and immunological characteristics. Vet Dermatol, 25: 103-e30.
- Sung, H. J., Yoon, I. H., & Kim, J. H. (2017). Putative contact ketoconazole shampoo-triggered pemphigus foliaceus in a dog. The Canadian veterinary journal = La revue veterinaire canadienne, 58(9), 914–918.
- White, A., Hicks, K., Bizikova, P., Bailey, J., Linder, K. (2019) Probable drug-triggered pemphigus foliaceus in a dog following administration of afoxolaner (NexGard)Veterinary Record Case Reports 7: e000735.
- Ralf S. Mueller, Ingar Krebs, Helen T. Power, and Kathryn V. Fieseler (2006) Pemphigus Foliaceus in 91 Dogs. Journal of the American Animal Hospital Association: May/June 2006, Vol. 42, No. 3, pp. 189-196.
- Olivry T. A review of autoimmune skin diseases in domestic animals: I – Superficial pemphigus. Vet Dermatol 2006; 17: 291– 305.
- Vaughan, D. F., Clay Hodgin, E., Hosgood, G. L. and Bernstein, J. A. (2010), Clinical and histopathological features of pemphigus foliaceus with and without eosinophilic infiltrates: a retrospective evaluation of 40 dogs. Veterinary Dermatology, 21: 166-174.
- Rosenkrantz, W. S. (2004), Pemphigus: current therapy. Veterinary Dermatology, 15: 90-98.
- Bizikova, P. and Olivry, T. (2015), Oral glucocorticoid pulse therapy for induction of treatment of canine pemphigus foliaceus – a comparative study. Vet Dermatol, 26: 354-e77.
- Olivry, T, Bergvall, K. E. and Atlee, B. A. (2004), Prolonged remission after immunosuppressive therapy in six dogs with pemphigus foliaceus. Veterinary Dermatology, 15: 245-252.
- Koji Nishifuji, Thierry Olivry, Ken Ishii, Toshiroh Iwasaki, Masayuki Amagai, (2007). IgG autoantibodies directed against desmoglein 3 cause dissociation of keratinocytes in canine pemphigus vulgaris and paraneoplastic pemphigus, Veterinary Immunology and Immunopathology, Volume 117, Issues 3–4, 2007, Pages 209-221, ISSN 0165-2427.
- Rybnicek J, Hill PB. (2007) Suspected polymyxin B‐induced pemphigus vulgaris in a dog. Veterinary Dermatology; 18: 165– 70.
- Olivry, T. (2007), Drug‐associated canine pemphigus vulgaris? Who knows!. Veterinary Dermatology, 18: 378-379
- González JL, Sagredo P, Fraile C, Rupérez C. (1996). Pénfigo vulgar en un perro. Clinica Veterinaria de Pequeños Animales (Avepa) Vol. 16, nº1, Pags, 45-50
- Lemmens, , De Bruin, , De Meulemeester, , Wyder, and Suter, (1998), Paraneoplastic pemphigus in a dog. Veterinary Dermatology, 9: 127-134
- Elmore SA, Basseches J, Anhalt GJ et al. (2005). Paraneoplastic pemphigus in a dog with splenic sarcoma. Veterinary Pathology: 42: 88– 91.
- Stannard AA, Gribble DH, Baker BB. (1975). A mucocutaneous disease in the dog resembling pemphigus vulgaris in man. Journal of the American Veterinary Medical Association; 166: 575– 82.
- Kasperkiewicz, M., Ellebrecht, C., Takahashi, H. et al. Pemphigus. Nat Rev Dis Primers 3, 17026 (2017)
- Heimann, M. , Beco, L. , Petein, M. , Rademaeker, V. and Olivry, T. (2004). Clinical, histological and immunological characteristics of Neumann‐type pemphigus vegetans in a dog. Veterinary Dermatology, 15: 57-57.
- Heimann M, Beco L, Petein M et al. (2007). Canine hyperplastic intraepidermal pustular and suprabasal acantholytic dermatosis with features of human pemphigus vegetans. Veterinary Pathology; 44: 550-5
- Griffies, J. D., Mendelsohn, C. L., Rosenkrantz, W. S., Muse, R. , Boord, M. J. and Griffin, C. E. (2002), Topical 0.1% tacrolimus for the treatment of discoid lupus erythematosus and pemphigus erythematosus in dogs. Veterinary Dermatology, 13: 211-229.
- Stanley JR1, Amagai M. (2006). Pemphigus, bullous impetigo, and the staphylococcal scalded-skin syndrome. N Engl J Med; 355(17):1800-10.
- Ladhani, S , Poston, S. , Joannou, C. and Evans, R. (1999), Staphylococcal scalded skin syndrome: exfoliative toxin A (ETA) induces serine protease activity when combined with A431 cells. Acta Pædiatrica, 88: 776-779.
- Iyori, K. , Futagawa‐Saito, K. , Hisatsune, J. , Yamamoto, M. , Sekiguchi, M. , Ide, K. , Son, W. , Olivry, T. , Sugai, M. , Fukuyasu, T. , Iwasaki, T. and Nishifuji, K. (2011), Staphylococcus pseudintermedius exfoliative toxin EXI selectively digests canine desmoglein 1 and causes subcorneal clefts in canine epidermis. Veterinary Dermatology, 22: 319-326.
- Iyori K, Hisatsune J, Kawakami T et al. (2010). Identification of a novel Staphylococcus pseudintermedius exfoliative toxin gene and its prevalence in isolates from canines with pyoderma and healthy dogs. FEMS Microbiol Lett; 312: 169–175.
- Banovic, F. , Linder, K. and Olivry, T. (2017), Clinical, microscopic and microbial characterization of exfoliative superficial pyoderma‐associated epidermal collarettes in dogs. Vet Dermatol, 28: 107-e23.
- Peters, J. , Scott, D. W., Erb, H. N. and Miller, W. H. (2007), Comparative analysis of canine dermatophytosis and superficial pemphigus for the prevalence of dermatophytes and acantholytic keratinocytes: a histopathological and clinical retrospective study. Veterinary Dermatology, 18: 234-240.
- Gross TL, Ihrke PJ, Walder EJ et al. Pustular Diseases of the epidermis (2005). In: Skin diseases of the Dog and Cat. Clinical and Histopatologic Diagnosis. Oxford, UK: Blackwell Publishing: 4-25.
- Beningo, K. E. and Scott, D. W. (2001), Idiopathic linear pustular acantholytic dermatosis in a young Brittany Spaniel dog. Veterinary Dermatology, 12: 209-213.
- Scott, D. W. (2003), Canine idiopathic linear pustular acantholytic dermatosis: a second case. Veterinary Dermatology, 14: 275-275.
- Dalmau A, Ordeix, L. (2012). Acantholytic pustular foliculitis and dermatitis in an old dog suggesting an Idiopathic Linear Pustular Acantholytic Dermatosis. Clin. Vet. Peq. Anim, 2012, 32 (1): 33-37
 by Multimédica
by Multimédica