Colitis histiocítica ulcerativa en una cachorra Bulldog francés
Resumen breve
La diarrea crónica en cachorros constituye uno de los desafíos diagnósticos más complejos en medicina interna veterinaria. Si bien muchos cuadros responden a tratamientos convencionales frente a parásitos intestinales o dietas hipoalergénicas, existen casos en los que la falta de respuesta obliga a ampliar el estudio y contemplar patologías menos frecuentes.Índice de contenidos
Introducción
La diarrea crónica en cachorros constituye uno de los desafíos diagnósticos más complejos en medicina interna veterinaria. Si bien muchos cuadros responden a tratamientos convencionales frente a parásitos intestinales o dietas hipoalergénicas, existen casos en los que la falta de respuesta obliga a ampliar el estudio y contemplar patologías menos frecuentes. Dentro de ellas, la colitis histiocítica ulcerativa, también denominada colitis granulomatosa, ocupa un lugar particular por su estrecha asociación a ciertas razas como el Bóxer y el Bulldog francés, y por la participación de cepas invasivas de Escherichia coli que colonizan el colon de manera persistente.
Caso clínico
El siguiente caso clínico describe el abordaje diagnóstico y terapéutico en una cachorra Bulldog francés de 5 meses, con historia crónica de signos digestivos y un diagnóstico definitivo de colitis granulomatosa.
Los tutores reportaron que, desde su adquisición a los 2 meses de edad, observaron deposiciones anormales, descritas como heces acuosas, a menudo con moco y trazas de sangre. La perra recibió un curso corto (10 días) de metronidazol sin que se apreciara mejoría alguna. Inicialmente, su estado de ánimo, actividad y apetito no se vieron alterados. Sin embargo, con el transcurso de las semanas, las diarreas persistieron y aparecieron nuevos signos clínicos, concretamente hiporexia, apatía y pérdida de peso. Acudió de nuevo a su veterinario y se le realizó un SNAP de Giardia, resultando positivo. Se instauró tratamiento médico a base de fenbendazol 50 mg/kg/24 h VO, maropitant 2 mg/kg/24 h VO, metronidazol 10 mg/kg/12 h VO y probióticos, sin observar respuesta clínica aparente. Debido a que la condición clínica de la perra continuó deteriorando (desarrollo de letargia, anorexia, hematoquecia), el caso fue referido al centro del autor.
En consulta, la perra estaba aletargada pero responsiva a estímulos. Su peso corporal era de 3.4 kg (CC 3/9). En el examen físico las mucosas estaban rosadas y secas. El TRC era de 2 segundos. Se observó una deshidratación leve (~5 %). La auscultación cardíaca y pulmonar fueron normales (frecuencia cardíaca 136 lpm, frecuencia respiratoria 22 rpm). Los pulsos femorales eran fuertes y sincrónicos. Los ganglios linfáticos periféricos se encontraban dentro de los límites normales. La palpación abdominal demostró dolor leve (aspecto craneal). La temperatura rectal fue de 37.6 ºC. La región perianal se encontraba marcadamente eritematosa debido a la presencia de material fecal adherido.
Para investigar las causas extra-gastrointestinales y gastrointestinales de los signos digestivos y la pérdida de peso, las pruebas iniciales incluyeron: hemograma, bioquímica y urianálisis (Tablas 1-3), tiempos de coagulación, SNAP parvovirus y coronavirus, SNAP Giardia, estimulación con ACTH, SNAP cPLI, parasitología fecal, ecografía abdominal, concentraciones de folato, cobalamina y TLI, serología de Leishmania y proteinograma.
Tabla 1. Hemograma.
| Parámetro | Valor | Rango de referencia |
|---|---|---|
| Hematocrito (%) | 36 | 35 - 60 |
| Hemoglobina (g/dL) | 12.1 | 11.5 - 20.1 |
| Eritrocitos x 1012 /L | 5 | 5.2 - 8.69 |
| MCV (fL) | 71.7 | 60 - 77 |
| MCH (pg) | 24.2 | 18.5 - 30 |
| MCHC (g/dL) | 33.6 | 30 - 38 |
| Reticulocitos x 109/L | 59.7 | 10 - 110 |
| Plaquetas x 109 /L | 739 | 175 - 500 |
| MPV (fL) | 13.7 | |
| Leucocitos x 109/L | 22.19 | 5.5 - 16.9 |
| Neutrófilos x 109/L | 18.42 | 2 - 12 |
| Linfocitos x 109/L | 1.49 | 0.50 - 4.9 |
| Monocitos x 109/L | 2.13 | 0.30 - 2 |
| Eosinófilos x 109/L | 0.13 | 0.10 - 1.5 |
| Basófilos x 109/L | 0.02 | 0.00 - 0.1 |
Tabla 2. Bioquímica.
| Parámetro | Valor | Rango de referencia |
|---|---|---|
| Proteínas totales (g/dL) | 5.1 | 5 - 7.2 |
| Albumina (g/dL) | 1.6 | 2.6 - 4 |
| Globulinas (g/dL) | 3.3 | 1.6 - 3.7 |
| Calcio (mg/dL) | 10.3 | 9.3 - 12.1 |
| Urea (mg/dL) | 11.3 | 9.2 - 29.2 |
| Creatinina (mg/dL) | 0.4 | 0.4- 1.4 |
| Fósforo (mg/dL) | 4.7 | 1.9 - 5 |
| Lipasa (U/L) | 388 | 200 - 1800 |
| Glucosa (mg/dL) | 103 | 75 - 128 |
| Colesterol (mg/dL) | 125 | 111- 312 |
| Fosfatasa alcalina (U/L) | 79 | 0 - 140 |
| Gamma glutamil tranferasa (U/L) | 0 | 0 - 11 |
| Alanina aminotransferasa (U/L) | 23 | 0 - 140 |
| Bilirrubina (mg/dL) | 0.9 | 0 - 0.5 |
| Sodio (mmol/L) | 141 | 141 - 152 |
| Potasio (mmol/L) | 4 | 3.8 - 5 |
| Cloro (mmol/L) | 110 | 102 - 117 |
| SNAP cPLI | Negativo |
Figura 3. Urianálisis.
| Fuente | Cistocentesis |
|---|---|
| Parámetro | Valor |
| Color | Amarillo |
| Olor | Normal |
| Turbidez | Ligeramente turbia |
| Gravedad específica | 1036 |
| pH | 5 |
| Proteínas | - |
| Glucosa | - |
| Cetonas | - |
| Bilirrubina | - |
| Sangre | - |
| Urobilinógeno | - |
| Cilindros | - |
| Leucocitos | - |
| Células epiteliales | Pocas |
| Eritrocitos | - |
| Cristales | - |
| Bacterias | - |
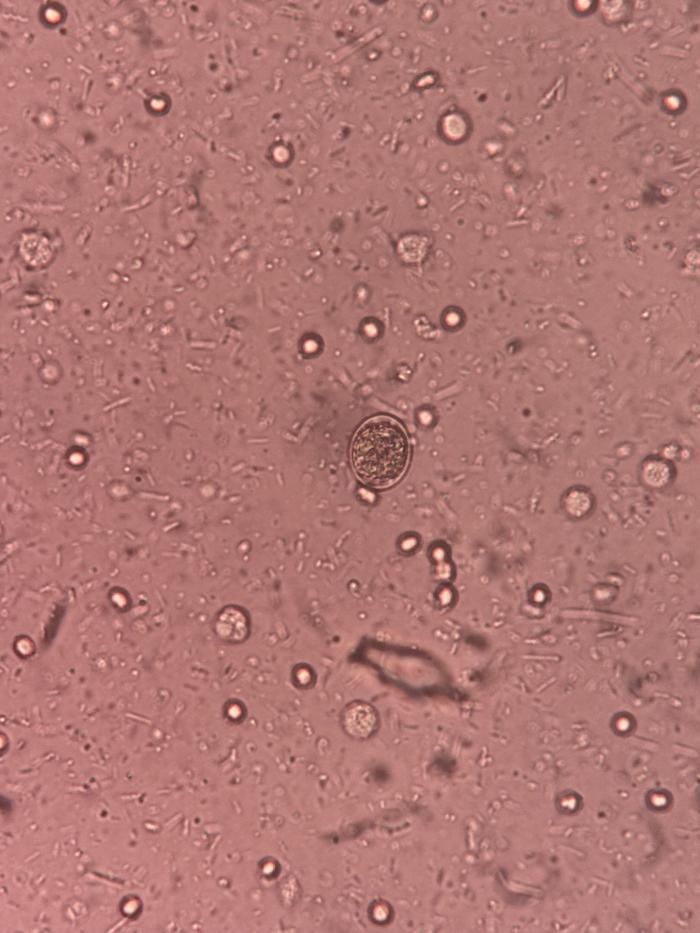
El hemograma reveló una anemia leve no regenerativa, leucocitosis leve con neutrofilia y monocitosis, y trombocitosis. La bioquímica mostró hipoalbuminemia moderada. Estos hallazgos fueron principalmente compatibles con un proceso inflamatorio crónico, con probable pérdida proteica digestiva. El urianálisis no mostró alteraciones. Los tiempos de coagulación se encontraban en rango. El SNAP frente a parvovirus y coronavirus fue negativo para ambos. El SNAP de Giardia resultó positivo. La estimulación con ACTH descartó la presencia de un hipoadrenocorticismo (cortisol post-ACTH 16.4 ug/dl). El SNAP de cPLI fue negativo para pancreatitis. El examen de heces (microscopía óptica por flotación) reveló la presencia de abundantes ooquistes de Cystoisospora spp. (Figura 1) así como abundantes leucocitos y bacterias. No se detectaron nematodos o cestodos. Tras digestión también se identificó la presencia de sangre oculta.
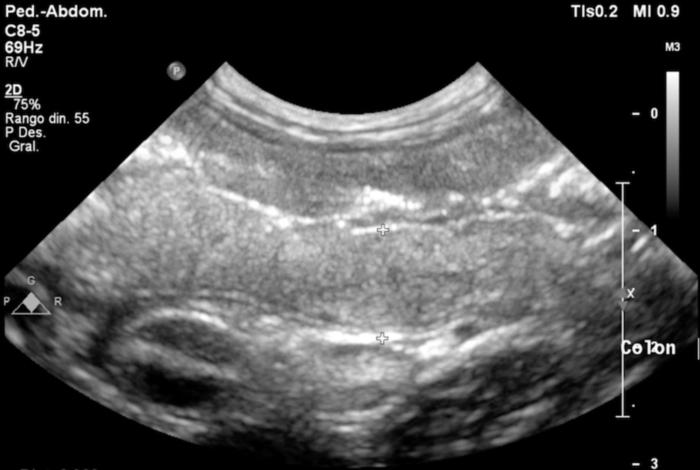
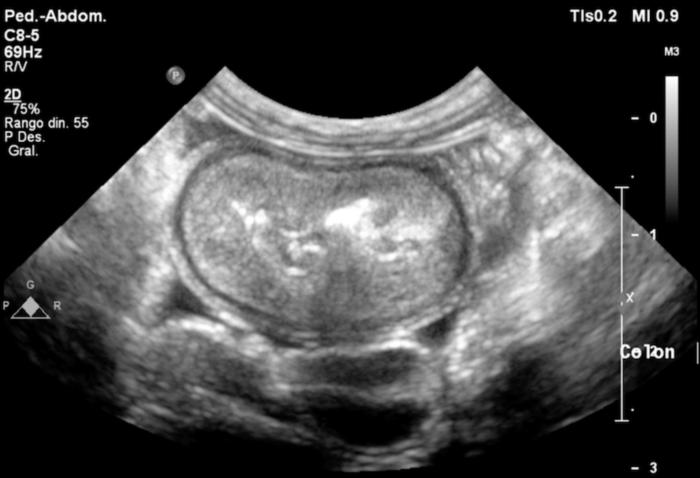
La ecografía abdominal mostró un engrosamiento marcado de la pared del colon, especialmente en el ciego y el colon descendente, con pérdida de la diferenciación normal de capas (Figura 2-3). También se observó linfadenomegalia mesentérica y una pequeña cantidad de líquido libre abdominal (no muestreable). Estos hallazgos reforzaron la sospecha de enfermedad inflamatoria intestinal, principalmente afectando al intestino grueso.
Las concentraciones de folato y cobalamina se encontraron disminuida (7.25 ng/ml, rr: 8.2-13.5) y aumentada (>1200 ng/l, rr: 275–590), respectivamente. La concentración de TLI estaba aumentada (> 50 ng/ml, rr: 10.9–50). La serología de Leishmania resultó negativa y el proteinograma no reveló alteraciones reseñables.
Dada la gravedad del cuadro clínico y los cambios ecográficos, se decidió realizar una endoscopia digestiva superior e inferior. A nivel macroscópico, el estómago presentaba eritema leve de forma difusa. La mucosa duodenal se observó eritematosa, friable y con dilatación de los conductos lacteales. La mucosa del colon se encontraba eritematosa, friable, granular, con sangrado al contacto y áreas nodulares marcadamente irregulares (Figura 4-5, Vídeo 1-2).
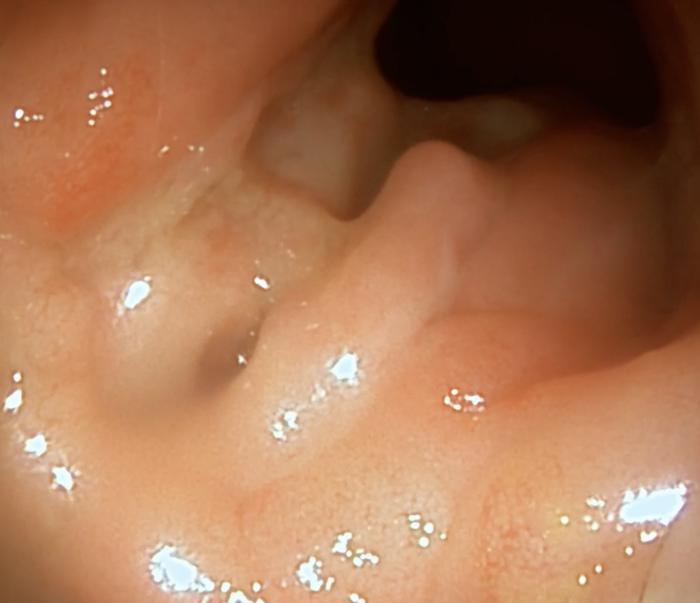
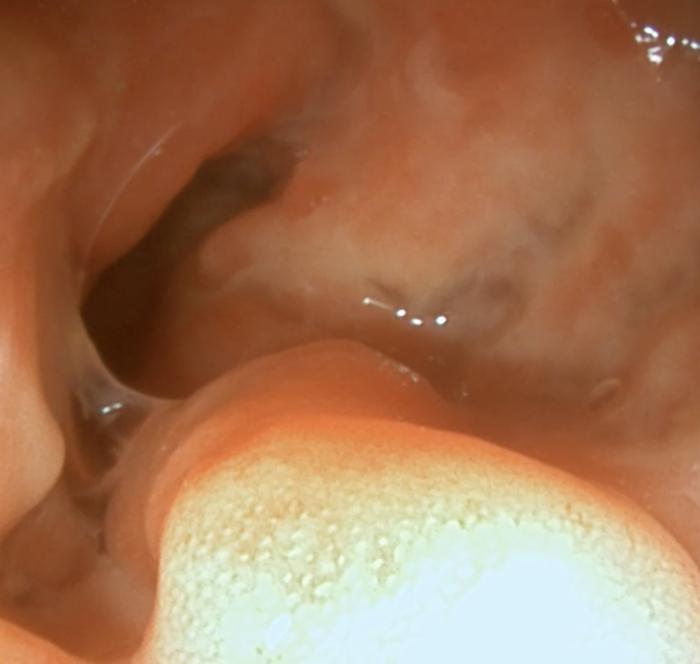
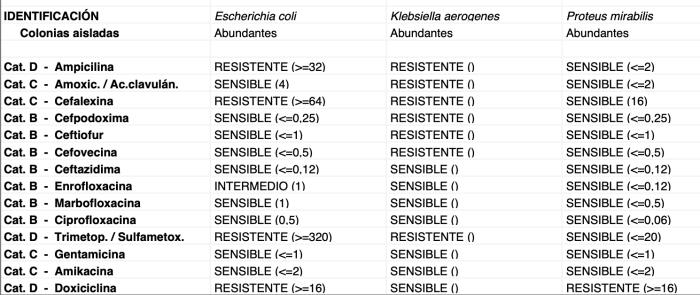
Se tomaron biopsias endoscópicas para su posterior estudio histopatológico, así como varias muestras de la mucosa colónica para cultivo microbiológico y antibiograma. El análisis microscópico del estómago fue compatible con una gastritis linfoplasmocitaria crónica leve, con hiperplasia epitelial superficial y presencia de bacterias helicoidales en el moco. A nivel duodenal, los cambios fueron compatibles con una enteritis eosinofílica y linfoplasmocitaria crónica moderada, con leve atrofia de vellosidades, fibrosis y linfangiectasia. Los cambios en el colon fueron compatibles con una colitis histiocítica y neutrofílica multifocal crónica intensa con ulceración y dilatación de criptas. La tinción especial PAS no detectó estructuras compatibles con estructuras fúngicas. Los macrófagos del infiltrado colónico presentaron gránulos PAS positivos en su citoplasma. La tinción de Ziehl-Neelsen no detectó estructuras compatibles con micobacterias en ninguno de los tejidos evaluados. En el cultivo bacteriano del tejido colónico se aislaron abundantes colonias de Escherichia coli, Klebsiella aerogenes y Proteus mirabilis. El antibiograma mostró sensibilidad a múltiples antibióticos (Figura 6).
En base a la historia, raza, signos clínicos, cambios ecográficos y endoscópicos, y hallazgos histopatológicos, se emitió un diagnóstico de colitis histiocítica ulcerativa asociada a infección por cepas invasivas de Escherichia coli. De forma concomitante, se diagnosticó una enteritis eosinofílica y linfoplasmocitaria e infección parasitaria por Cystoisospora spp., probablemente debido al pobre estado inmunitario de la perra.
Durante la hospitalización, la cachorra recibió fluidoterapia balanceada de soporte, antieméticos (maropitant 2 mg/kg/24 h IV), tratamiento antiparasitario (fenbendazol 50 mg/kg/24 h VO durante 5 días y toltrazurilo 20 mg/kg VO dosis única), probióticos y dieta de alta digestibilidad. Pasadas 24 horas, su estado general comenzó a mejorar, recuperando el apetito, mayor grado de actividad y resolución de los vómitos. Sin embargo, las diarreas persistían. Tras el procedimiento endoscópico, se instauró antibioterapia (enrofloxacino 5 mg/kg/24 h IV) y prednisolona a dosis antiinflamatorias (0.5 mg/kg/24 h VO). Pasadas 24 horas la cachorra fue dada de alta. Tras 5 días acudió de nuevo a consulta de revisión. La tutora reportó que se mantenía clínicamente estable y animada, comiendo con apetito y que la frecuencia de las deposiciones había disminuido notablemente, aunque las heces persistían siendo mayormente diarreicas. En la exploración física, se detectó ganancia de peso (3.8 kg). Se reevaluó la concentración de albúmina (2.2 g/dl, rr: 2.6–4), mostrando una clara mejoría con respecto al examen anterior (1.6 g/dl). Tras recibir los resultados del cultivo de la biopsia de colon y el antibiograma, se decidió realizar un cambio en la antibioterapia, sustituyendo el enrofloxacino (sensibilidad intermedia) a marbofloxacino (sensible), a una dosis de 2 mg/kg/24 h VO durante 6 semanas. En la revisión una semana después, la cachorra había ganado peso, estaba más activa, la frecuencia de las deposiciones había disminuido y el aspecto de las heces había mejorado de forma considerable. La revisión realizada 2 semanas después mostró ganancia de peso (4.5 kg) y normalización de la albuminemia.
Discusión
La colitis granulomatosa asociada a Escherichia coli es una forma específica de enfermedad inflamatoria intestinal crónica que afecta principalmente a perros jóvenes de razas predispuestas, como el Bóxer o el Bulldog francés. Se trata de una patología inmunomediada y de origen infeccioso, en la que se produce una inflamación crónica del colon debida a la presencia de cepas invasivas de E. coli, las cuales son capaces de penetrar y sobrevivir dentro de los macrófagos intestinales.
Diferentes estudios han demostrado que esta condición tiene una base genética, vinculada a una alteración en genes implicados en la detección y eliminación de bacterias intracelulares. Esta alteración compromete la capacidad del sistema inmune del perro para destruir las bacterias invasoras, lo que permite que estas persistan en la mucosa colónica y perpetúen el estado inflamatorio.
Los signos clínicos suelen incluir diarrea crónica de pequeño volumen, con frecuencia acompañada de sangre y moco, tenesmo, distensión abdominal y, en algunos casos, pérdida de peso, apatía, vómitos e hiporexia. El diagnóstico definitivo se realiza mediante la combinación de: estudio histopatológico y microbiológico de las biopsias colónicas, identificando sobrecrecimiento de la bacteria E. coli, así como potencialmente la técnica de “FISH” (hibridación fluorescente in situ) para confirmar la presencia de E. coli dentro de la mucosa y de los macrófagos. La presencia de macrófagos que presentan un material granular PAS positivo en su citoplasma también refuerza el diagnóstico de colitis ulcerativa granulomatosa.
El tratamiento de esta enfermedad se basa principalmente en el uso de antibióticos capaces de eliminar las bacterias intracelulares. Las fluoroquinolonas (p. ej., enrofloxacino, marbofloxacino) son los fármacos de elección inicial, y deben administrarse durante un periodo prolongado (mínimo 6-8 semanas), incluso aunque los signos remiten antes. En ocasiones, los perros afectados pueden desarrollar resistencia a estos antibióticos y se requiere el cambio a otro tipo de antibioterapia basándonos en el antibiograma realizado. Es importante destacar que, el éxito del tratamiento depende en gran medida de la erradicación completa de la E. coli invasiva, lo cual puede lograrse en más del 80 % de los casos si el tratamiento es adecuado.
En el presente caso, es probable que la presencia de la colitis ulcerativa granulomatosa pudiera haber generado un compromiso inmunitario, favoreciendo la susceptibilidad a infecciones oportunistas como Giardia y Cystoisospora, complicando o prolongando la eliminación efectiva de estos parásitos. Es por ello muy importante informar y educar al tutor con el objetivo de mantener una adecuada higiene para evitar reinfecciones, evitando el lamido de la región anal, la ingesta de heces y desinfectando con frecuencia los lugares de defecación.
Bibliografía
- Smith C.R., Miller A.D. In situ hybridization to detect Escherichia coli in canine granulomatous colitis. (2024). Journal of Veterinary Diagnostic Investigation, 36(1):142-145.
- Conrado F.O., Jones E.A., Graham E.A., Simpson K.W., Craft W.F., Beatty S.K. Cytologic, histopatologic, and clinical features of granulomatous colitis in a French Bulldog. (2022). Veterinary Clinical Pathology, 50 Suppl 1:76-82.
- Mansfield C.S., James F.E., Craven M., Davies D.R., O'Hara A.J., Nicholls P.K., Dogan B., MacDonough S.P., Simpson K.W. Remission of histiocytic ulcerative colitis in Boxer dogs correaltes with eradication of invasive intramucosal Escherichia coli. (2009). Journal of Veterinary Internal Medicine, 23(5):964-9.
- Hostutler R.A., Luria B.J., Johnson S.E., Weisbride S.E., Sherding R.G., Jaeger J.Q., Guilford W.G. Antibiotic-responsibe histiocytic ulcerative colitis in 9 dogs. (2004). Journal of Veterinary Internal Medicine, 18(4):499-504.
 by Multimédica
by Multimédica