Coronavirus en hurones
Resumen breve
Los hurones pueden padecer dos enfermedades asociadas a la infección por coronavirus: una forma más leve que cursa con diarrea mucosa de color verde denominada, enteritis catarral epizoótica (ECE) causada por el coronavirus entérico del hurón (FRECV), y otra más grave, que clínicamente recuerda a la forma no efusiva de la peritonitis infecciosa felina (PIF) y que provoca la aparición de granulomas de forma diseminada, causada por el coronavirus…Índice de contenidos
Resumen
Los hurones pueden padecer dos enfermedades asociadas a la infección por coronavirus: una forma más leve que cursa con diarrea mucosa de color verde denominada, enteritis catarral epizoótica (ECE) causada por el coronavirus entérico del hurón (FRECV), y otra más grave, que clínicamente recuerda a la forma no efusiva de la peritonitis infecciosa felina (PIF) y que provoca la aparición de granulomas de forma diseminada, causada por el coronavirus sistémico del hurón (FRSCV). La relación entre ambos tipos de virus y, si la mutación de la forma leve a la forma grave se puede producir en un mismo individuo o bien existen dos virus circulando en las poblaciones de hurones, todavía se desconoce.
Por otro lado, los hurones se utilizan como modelos experimentales de diferentes virus respiratorios humanos por su sensibilidad frente a estos, entre ellos, el coronavirus causante del síndrome respiratorio agudo grave (SARS-CoV). Este hecho hace que, en la actual situación de pandemia, se deba considerar la posibilidad de que se presenten hurones afectados por SARS-CoV-2 en los próximos meses y años.
Introducción
Los coronavirus (CoVs) son un grupo de virus pertenecientes a la familia Coronaviridae, subfamilia Coronavirinae, que causan infecciones respiratorias e intestinales en animales y humanos. Dentro de la subfamilia se distinguen cuatro géneros: Alphacoronavirus, Betacoronavirus, Gammacoronavirus y Deltacoronavirus. Hasta hace unos años estos géneros se denominaban grupo 1, grupo 2, grupo 3 y grupo 4, respectivamente.
Los Alfacoronavirus y Betacoronavirus infectan solo a mamíferos y normalmente causan problemas respiratorios en humanos y gastroenteritis en animales. Los Gammacoronavirus y los Deltacoronavirus infectan a pájaros, peces y algunos de ellos también mamíferos (Tabla 1). Los coronavirus son bien conocidos por su capacidad de saltar entre especies y su enorme facilidad para mutar y recombinarse. Estas características hacen que sean capaces de producir brotes de enfermedad grave en diferentes especies1.
Estructuralmente los coronavirus son virus esféricos de 100 -160 nm de diámetro, con envuelta de bicapa lipídica y que contienen ARN monocatenario de polaridad positiva. Son bastante resistentes en el medio ambiente, llegando a permanecer viables en el medio de 9 a 28 días a temperatura ambiente (coronavirus humanos y animales, respectivamente).
Los coronavirus del hurón
Coronavirus entérico del hurón (FRECV)
En marzo de 1993 se describió en la costa Este de los Estados Unidos un brote de una enfermedad que provocaba una diarrea verde y profusa en hurones; en base a su similitud con la gastroenteritis catarral epizoótica del visón la enfermedad recibió el nombre de enteritis catarral epizoótica (ECE)2.
| Tabla 1. Géneros de coronavirus, especies más importantes y especie hospedadora. |
| Género | Especie | Hospedador |
| Alphacoronavirus | Virus del resfriado humano (HCoV) Coronavirus entérico felino (FECV) Peritonitis infecciosa felina (FIPV) Coronavirus canino (CCoV) Coronavirus entérico del hurón (FRECV) Coronavirus sistémico del hurón (FRSCV) Gastroenteritis transmisible del cerdo (TGE) | Humanos Felinos Felinos Perros Hurones Hurones Cerdos |
| Betacoronavirus | Coronavirus respiratorio canino (CRCoV) SARS.CoV MERS-CoV Virus de la hepatitis del ratón (MHV) | Perro Humanos Humanos,dromedarios Ratones |
| Gammacoronavirus | Virus de la bronquitis infecciosa (IBV) | Pollos |
| Deltacoronavirus | Coronavirus del bulbul (Bulbul CoV-HKU11) Deltacoronavirus porcino (PDCoV) | Bulbul Cerdos |
En estos casos se hallaron partículas de coronavirus en heces y lesiones inflamatorias y de atrofia de vellosidades intestinales3. El análisis filogenético demostró que se trataba de un Alfacoronavirus nuevo, genéticamente relacionado con el coronavirus felino (FCoV), el virus de la gastroenteritis transmisible del cerdo y el coronavirus canino4. Este virus se llamó coronavirus entérico del hurón (FRECV, por sus siglas en inglés).
Los síntomas de la ECE incluyen letargia, hiporexia o anorexia, vómitos, seguidos de una diarrea profusa, maloliente, de color verde brillante, muy líquida y con un alto contenido en moco. Generalmente los síntomas aparecen tras la introducción de un animal joven y asintomático en un grupo de mayor edad, y son los animales más mayores los que presentan sintomatología más grave5.
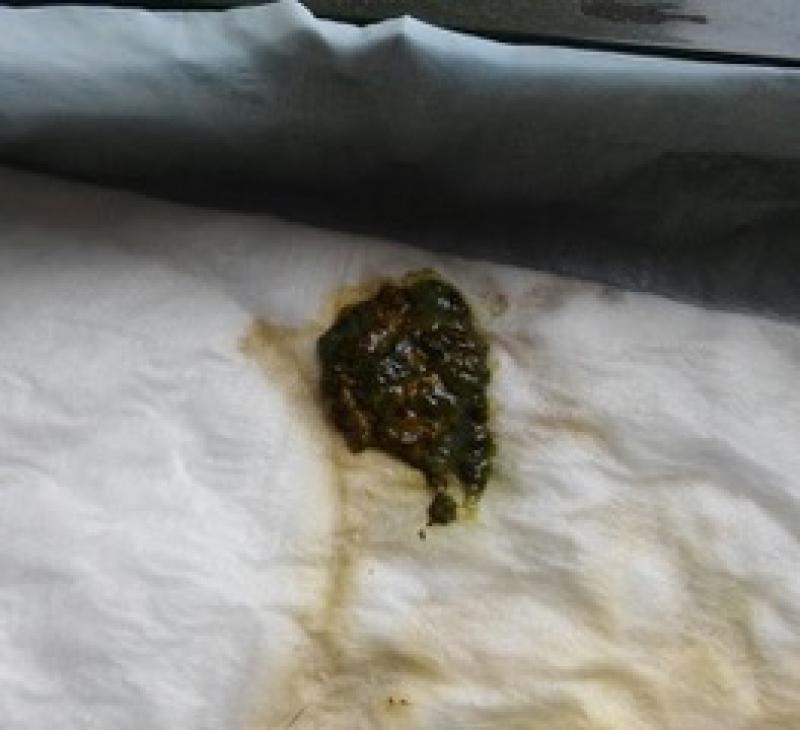
En los estadíos más crónicos las heces se parecen a semillas de mijo. Tanto las diarreas verdes mucosas (Figura 1), como las heces con aspecto de semillas se observan en otras enfermedades gastrointestinales que cursan con diarrea y maldigestión, por lo que no se pueden considerar patognomónicas de esta enfermedad.
En el examen físico se puede encontrar linfadenopatía mesentérica y signos de deshidratación.
No se han descrito hallazgos clinicopatológicos específicos asociados a ECE, más allá de los asociados a deshidratación o a complicaciones secundarias, como linfocitosis, neutrofilia (debido a infección bacteriana), aumento en lipasa y globulinas (inflamación intestinal), aumento de ALT y GGT (lipidosis hepática, hepatitis linfocítica), aumento de AST y CK (pérdida de peso) e hipoalbuminemia.
El examen histopatológico de las muestras de intestino de los animales afectados incluyen enteritis linfocítica difusa con atrofia, fusión y aplanamiento de las vellosidades, y degeneración vacuolar y necrosis del epitelio apical2.Se trata de una enfermedad altamente contagiosa, con una morbilidad cercana al 100 %, pero con mortalidades bajas (<5 %), que se observan sobre todo en animales de más edad.
La eliminación fecal del virus puede ser intermitente y la reinfección juega un papel importante en el mantenimiento de la infección en poblaciones grandes de hurones. Los hurones portadores pueden permanecer clínicamente sanos y desarrollar sintomatología ante situaciones de estrés4.
Una vez descartados otros posibles diagnósticos, como la coccidiosis, se puede llegar a un diagnóstico presuntivo mediante una PCR con transcriptasa inversa (RT-PCR) en una muestra de heces. En los casos crónicos los resultados del examen histopatológico son sugestivos de infección por FRECV, y permiten descartar otras enfermedades que cursan con maldigestión como la enfermedad inflamatoria intestinal. El diagnóstico definitivo se puede llevar a cabo mediante hibridación in situ en células de las vellosidades intestinales4.
El tratamiento empírico incluye el uso de antibióticos de amplio espectro (metronidazol, enrofloxacina, amoxicilina/ácido clavulánico), fluidoterapia agresiva y tratamiento de sostén. Algunos adultos pueden desarrollar malabsorción intermitente temporal o permanente. La administración de una dieta altamente digestible y el uso de corticosteroides (prednisona 1 mg/kg/12h/2 semanas) puede ayudar a acelerar la recuperación4.
A lo largo de los años, la enfermedad se diseminó por Estados Unidos y Europa, siendo alta su prevalencia en algunas poblaciones, pero ha ido disminuyendo su gravedad, probablemente porque el coronavirus de los hurones se ha vuelto endémico. Esta teoría queda respaldada por el hecho de que es posible detectar el virus en las heces de animales clínicamente normales4.
La elevada cantidad de animales seropositivos (89 %) que se halló en un estudio de seroprevalencia de coronavirus en hurones en Japón5 hace pensar que también en este país el virus se ha vuelto endémico. En España la evolución ha sido similar, con un gran número de casos hacia la primera década de los 2000, especialmente con el auge del hurón como animal de compañía y de los encuentros o “quedadas” de hurones, y prácticamente ninguno en la actualidad, aunque no disponemos de ningún estudio epidemiológico.
Coronavirus sistémico del hurón
En el año 2004 se diagnosticó en España por primera vez una enfermedad que clínica y patológicamente recuerda a la peritonitis infecciosa felina (PIF)6. Poco tiempo después también se describió en Estados Unidos. Esta enfermedad se vio que estaba asociada a la presencia de un Alfacoronavirus muy cercano a FRECV, al que se llamó coronavirus sistémico del hurón (FRSCV)4.
A diferencia del coronavirus entérico, el coronavirus sistémico suele afectar a animales jóvenes (la mayoría menores de 18 meses), que presentan síntomas inespecíficos como diarrea, pérdida de peso, letargia, anorexia o hiporexia y vómitos.
Algunos animales pueden presentar problemas neurológicos primarios, incluyendo ataxia, tortícolis, paraparesia o convulsiones. De forma menos frecuentes se pueden observar problemas respiratorios (estornudos, tos, disnea, secreción nasal), deshidratación, bruxismo, ictericia, focos de eritema cutáneo, orina verde, mucosa rectal enrojecida y prolapso rectal. En la palpación abdominal suelen detectarse masas abdominales, a menudo acompañadas de esplenomegalia y renomegalia. En algunos casos se ha descrito la linfadenopatía periférica y fiebre7.
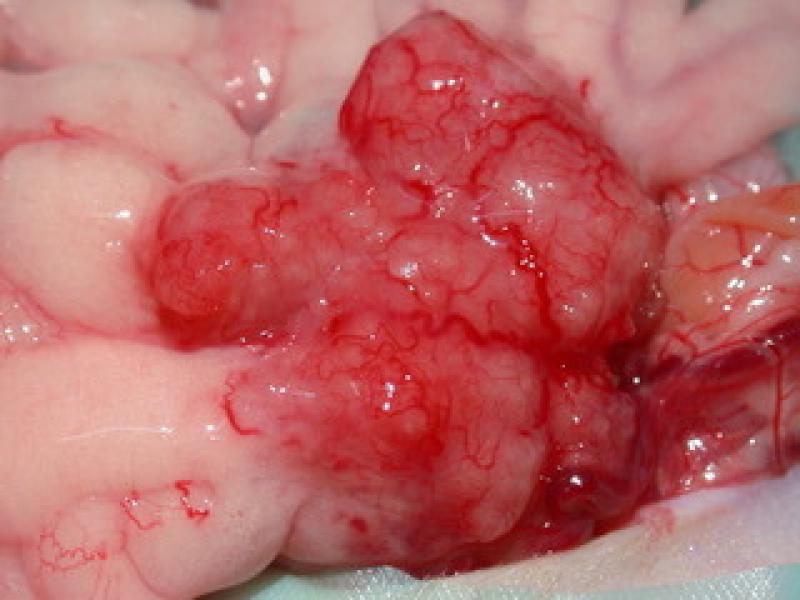
Estas masas abdominales se corresponden con los linfonodos mesentéricos, que se encuentran aumentados de tamaño, en ocasiones hasta 8 veces. Las lesiones típicas de esta enfermedad son nódulos multifocales o coalescentes de entre 0,5 a 2 cm en las serosas, generalmente en los trayectos vasculares (Figura 2). El peritoneo, especialmente la serosa intestinal y el mesenterio, se afectan con frecuencia, pero pocas veces los animales afectados presentan efusiones serosas en las cavidades, como pasa en la forma húmeda de la PIF. En animales con síntomas neurológicos las lesiones se localizan por completo en el cerebro7.
A nivel microscópico los nódulos se corresponden con focos de inflamación piogranulomatosa severa.
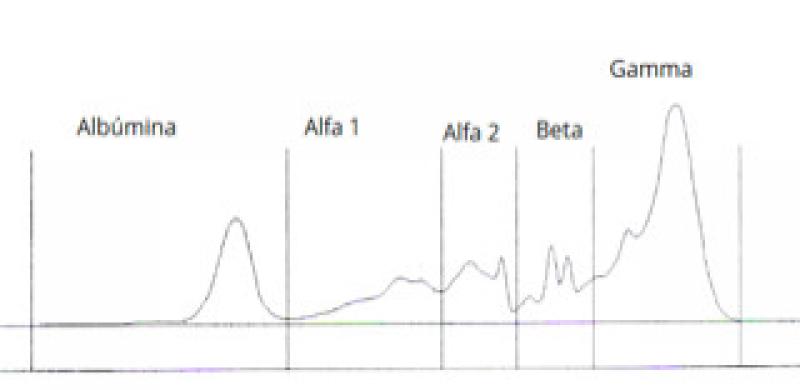
Las alteraciones del hemograma y de la bioquímica sanguínea son de nuevo inespecíficas y dependen de los órganos y sistemas afectados. Es frecuente observar anemia no regenerativa y trombocitopenia. El proteinograma presenta hipoalbuminemia y gammapatía policlonal (Figura 3), que son muy característicos de esta enfermedad pero que también se pueden dar en otras, como la enfermedad Aleutiana, linfoma, mieloma y otras infecciones crónicas como Helicobacter sp7.
Aunque la presentación clínica, la presencia de gammapatía y el aspecto microscópico de las lesiones son altamente sugestivas de infección por FRSCV, el diagnóstico definitivo se alcanza únicamente a partir de una tinción inmunohistoquímica positiva, utilizando el anticuerpo monoclonal FIPV3-70, que presenta reacción cruzada con todos los Alfacoronavirus, incluído el FRECV4.
Actualmente no existe ningún tratamiento efectivo frente a la enfermedad sistémica, y la mayoría de animales infectados muere o bien se eutanasia al cabo de unos pocos meses, incluso con tratamiento, aunque en la bibliografía se describen supervivencias de más de 3 años. Pese a las similitudes con la PIF, no se ha demostrado que la patogenia sea la misma en ambos casos, por lo que los tratamientos que se aplican en gatos, pueden resultar ineficaces en hurones.
Se ha descrito el uso de protocolos basados en los que se utilizan en gatos con PIF de forma anecdótica. De todos ellos, la combinación de prednisona, pentoxifilina y doxiciclina podría tener un efecto sinérgico a la hora de reducir la inflamación y vasculitis7.
Fármacos inmunosupresores:
- Prednisolona: suprime tanto la respuesta humoral como la celular, lo que podría ser un inconveniente al tratarse de una infección vírica; puede ayudar a reducir la diseminación sistémica del coronavirus en el interior de macrófagos y monocitos, ya que inhibe la fagocitosis. También tiene propiedades antiinflamatorias, y podría ayudar a controlar la hiporexia. Se propone una dosis alta (1-2 mg/kg/bid) inicial, que se va reduciendo gradualmente.
- Clorambucilo: se utiliza en el tratamiento del PIF en gatos para proporcionar una inmunosupresión adicional que permita reducir la dosis de prednisolona.
- Azatioprina: se ha descrito su uso en hurones para tratar enfermedad Aleutiana y enfermedad intestinal inflamatoria. En hurones se añade al tratamiento con corticoides si este no es suficiente para bajar la concentración de inmunoglobulinas4.
Fármacos inmunomoduladores:
- Poliprenil: parece prometedor en el tratamiento de PIF seca en gatos, y, aunque tiene un amplio margen de seguridad en gatos, perros y ratones, se desconoce su eficacia y seguridad en hurones.
- Interferón: tanto el interferón omega como el alfa humano han inhibido la replicación del coronavirus in vitro, sin embargo los estudios in vivo, no muestran una gran diferencia en cuanto a la supervivencia.
- Melatonina: los efectos beneficiosos de la melatonina como tratamiento coadyuvante en tratamientos víricos ha sido demostrado en repetidos estudios. La Melatonina tiene efecto antiinflamatorio, inmunomodulador, antioxidante reduciendo radicales libres y estimula el apetito7. Actualmente se está estudiando su uso en pacientes de COVID-198.
Tratamiento de la vasculitis:
En el caso de la PIF, la inhibición de ciertos promotores de la vasculitis, como el FNT (factor de necrosis tumoral) o la interleucina-1, puede ayudar en el tratamiento de la enfermedad. La pentoxifilina tiene este efecto y también reduce la fibrosis, por lo que algunos veterinarios la han utilizado de forma anecdótica para tratar PIF en gatos, a dosis de 20-25 mg/kg/bid.
La doxiciclina es una tetraciclina que, además de propiedades antibióticas tiene propiedades antiinflamatorias, inhibe la producción FNT, reduce la fibrosis e inhibe la adhesión de leucocitos a las células endoteliales. Como el uso de antibióticos de amplio espectro está indicado cuando se realiza terapia inmunosupresora, la doxiciclina se podría utilizar para este propósito. La prednisolona también se utiliza para tratar la vasculitis7
En medicina felina se han publicado en los últimos años estudios con el uso de fármacos antivirales en fase experimental con resultados prometedores. El GC376, un inhibidor de las proteasas, ha mostrado ser efectivo en algunos gatos sin efectos adversos importantes9. Aún más prometedores son los resultados con un análogo de los nucleósidos, GS-44152410.
Tratamiento sintomático:
Protectores gástricos para reducir las náuseas e inapetencia, y prevenir la aparición de úlceras gástricas (sucralfato, cimetidina, ranitidina, omeprazol), antieméticos (metoclopramida, maropitant), fluidoterapia o transfusión de albúmina y dieta altamente digestible. La suplementación con cobalamina puede resultar beneficiosa, ya que los hurones con maldigestión tienen a presentar deficiencias en esta vitamina. La cimetidina ha demostrado tener efectos beneficiosos sobre el sistema inmune, ya que aumentan la inmunidad celular y posee actividad antivírica.
Relación entre FRECV y FRSCV
A partir del estudio de la secuencia de la proteína S (proteína de la espícula) se llegó a la conclusión de que el FRSCV se parecía más al FRECV que a cualquier otro virus del mismo género11, por lo que es más probable que se haya originado del coronavirus de hurón que del virus de la PIF.
La diferencia en el gen que codifica la proteína S podría ser la misma que la mutación que sufre el coronavirus felino, que hace que aumente su tropismo por los macrófagos en el caso de la variante que causa la PIF.
Lo que no queda claro en ninguno de los dos casos es si la mutación se produce a partir de la infección crónica de la forma entérica en un mismo individuo (mutación in vivo) o si existen dos formas, una entérica y otra sistémica, circulando de forma simultánea11.
El hallazgo posteriormente de la secuencia genética asociada a la forma sistémica (o más virulenta) en muestras de hurones asintomáticos, ha puesto en duda la asociación entre virulencia y diferencia en la conformación de la proteína S5.
El análisis filogenético del coronavirus del hurón confirma que dentro del género Alfacoronavirus se encuentra estrechamente asociado al coronavirus del visón, formando un clado o grupo familiar; las diferencias entre este clado y el resto de Alfacoronavirus podrían hacer que en el futuro se clasifiquen como un género diferente (Alfacoronavirus 2)1.
Coronavirus humanos
Dentro de los coronavirus que afectan a los humanos hay cuatro virus que pertenecen al género Alfacoronavirus y provocan infecciones asociadas al resfriado común12; de hecho los coronavirus no se consideraron altamente patógenos en humanos hasta el brote de SARS en 2002 y 2003 en la provincia China de Guangdong. Diez años después del SARS, otro coronavirus altamente patógeno, MERS-CoV emergió en los países de Oriente Medio.
Actualmente, una variante del SARS-CoV, que se ha denominado SARS-CoV-2 está causando una pandemia con mortalidades elevadas y graves consecuencias para la salud pública y la economía de los países afectados.
El pulmón del hurón, comparte varias propiedades con el humano en cuanto a tejido pulmonar y arquitectura. Además, los síntomas que muestran los hurones frente a las infecciones víricas son similares a los de los humanos. Por otro lado, los hurones son sensibles a varios virus respiratorios humanos, como el de la influenza, el coronavirus asociado a síndrome respiratorio agudo grave (SARS-CoV), el virus respiratorio sincitial y el metapneumovirus humano12.
Por todos estos motivos el hurón es una especie que habitualmente se utiliza como modelo animal para el estudio de los virus respiratorios humanos.
Es frecuente que en los meses de invierno se presenten hurones en la clínica con fiebre y/o afección del tracto respiratorio superior asociados a casos de resfriado o gripe en las personas con las que convive el animal. Los virus de la gripe y el resfriado suelen afectar a los hurones de forma más grave que a los humanos, por lo que se desaconseja que las personas que tienen estas enfermedades interaccionen con sus hurones.
Si bien los hurones infectados con SARS-CoV muestran pérdida de peso, pero no reproducen la grave neumonía que desarrollan el 10 % de los humanos y a la que se atribuye la mortalidad12, y no son sensibles al MERS-CoV13, los experimentos llevados a cabo con SARS-CoV-2 sí que muestran que el virus se replica en los hurones, que en esta especie se contagia por contacto directo, que les causa fiebre y bronquiolitis, y que se elimina por saliva, secreción nasal, heces y orina14.
Por otro lado, recientemente se han diagnosticado casos de COVID-19 en trabajadores de granjas de visones en Holanda, que se sospecha que podrían haberse contagiado a partir de los visones y, aunque no se ha descrito la transmisión de humanos o, a hurones o viceversa, sí que se ha descrito la transmisión del SARS-CoV-2 a felinos.
Los hurones mantenidos como mascotas no suelen salir a la calle a pasear, por lo que es poco probable que puedan servir de foco de infección por SARS-CoV-2 a los humanos con los que conviven, tanto por haberse contagiado con el virus como por actuar como fómite. Sin embargo no es tan improbable que se puedan contagiar a partir de sus propietarios portadores o enfermos, igual que pasa con el resfriado o la gripe estacionales.
Por este motivo se debería considerar la posibilidad de contagio por SARS-CoV-2 en hurones que muestren síntomas respiratorios o fiebre, y tomar precauciones a la hora de explorar y tratar a estos pacientes.
Bibliografia
- Lamers MM, Smits SL, Hundie GB, et al: Naturally occurring recombination in ferret coronaviruses revealed by complete genome characterization. J Gen Virol. 2016 Sep;97(9):2180-2186.
- Williams B H, Kiupel M, West K H, et al: Coronavirus-associated epizootic catarrhal enteritis in ferrets. JAVMA 2000 Aug; 17(4): 526-530.
- Langlois I. Viral disease of ferrets. Vet Clin North Am Exot Anim Pract.2005 Jan; 8(1): 139-60.
- Kiupel M, Perpiñán D : Viral diseases of ferrets. In: Fox JG, Marini RP: Biology and Diseases of the Ferret (3rd ed); Ames, IA: Wiley & Sons, Inc.; 2014: 439- 502
- Minami S, Terada Y, Shimoda H, et al: Establishment of serological test to detect antibody against ferret coronavirus. J Vet Med Sci; 2016 Jul 1;78(6):1013-7.
- Martinez J, Ramis AJ, Reinacher M, et al. Detection of feline infectious peritonitis virus-like antigen in ferrets. Vet Rec 2006;158(15):523.
- Murray J, Kiupel M, Maes RK: Ferret coronavirus-associated diseases. Vet Clin North Am Exot Anim Pract. 2010 Sep;13(3):543-60.
- Zhang R, Wang X, Ni L,et al: COVID-19: Melatonin as a potential adjuvant treatment. Life Sci. 2020 Jun 1; 250: 117583. Published online 2020 Mar 23. doi: 10.1016/j.lfs.2020.117583.
- Pedersen NC, Kim Y, Liu H et al: Efficacy of a 3C-like Protease Inhibitor in Treating Various Forms of Acquired Feline Infectious Peritonitis. J Feline Med Surg. 2018 Apr; 20(4): 378-392
- Pedersen NC, Perron M, Bannash M, et al: Efficacy and safety of the nucleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis. J Feline Med Surg. 2019 Apr;21(4):271-281.
- Wise A G, Kiupel M, Garner, MM, et al: Comparative sequence analysis of the distal one-third of the genomes of a systemic and an enteric ferret coronavirus. Virus Res. 2010; 149:42–50.
- Taylor DR: The ferret in viral respiratory disease research. In: Fox JG, Marini RP: Biology and Diseases of the Ferret (3rd ed); Ames, IA: Wiley & Sons, Inc.; 2014:630-634.
- Doremalen N, Munster VJ: Animal models of middle east respiratory syndrome coronavirus infection. Antiviral Res. 2015 Oct;122:28-38.
- Kim Y, Kim S, Kim S, et al: Infection and rapid transmission of SARS-CoV-2 in ferrets. Cell Host Microbe. 2020 May 13;27(5):704-709.
- Lloret A: Coronavirus felinos y peritonitis infecciosa felina. VII Congreso de Medicina Interna Ignacio Menes. 2020 Girona.
 by Multimédica
by Multimédica