Manejo clínico de una coinfección por Dirofilaria immitis y Leishmania infantum en un paciente canino: ¿por dónde empezamos?
Resumen breve
En el caso que nos ocupa, se diagnosticó una coinfección moderada-grave por D. immitis (Clase 2-3) y leve-moderada por L. infantum (Estadio 2). Este caso clínico remarca la importancia de una exhaustiva anamnesis, exploración clínica detallada y un diagnóstico completo que incluya todas las posibles enfermedades prevalentes según el área geográfica donde se encuentre o haya viajado el paciente.Índice de contenidos
Resumen
Acude a consulta una perra mestiza de 9 años, recogida de la vía pública en la provincia de Huelva y alojada en un centro de protección animal con signos de adelgazamiento y leve intolerancia al ejercicio, asociado a una dermatitis no inflamatoria difusa. En el protocolo de diagnóstico, por la procedencia y cuadro clínico, se realiza un diagnóstico laboratorial completo de dirofilariosis así como una serología de las principales enfermedades vectoriales endémicas en la zona de actuación. Simultáneamente, se realiza un estudio radiológico completo de tórax y una ecocardiografía.
Con la información obtenida se lleva a cabo la clasificación clínica de la paciente considerándola positiva a dirofilariosis por Dirofilaria immitis (Clase 2-3) y positiva a leishmaniosis (Estadio 1 de LeishVet) ya que se considera fundamental para poder definir el protocolo de actuación, así como el pronóstico.
Se inició el protocolo específico para la dirofilariosis, utilizando un tratamiento secuencial con doxiciclina, seguido de un tratamiento con moxidectina como microfilaricida y con melarsomina sódica como adulticida. Durante la monitorización, se observó una mejoría de los signos clínicos y analíticos asociados a la dirofilariosis. Sin embargo, se apreció una progresión de la leishmaniosis a un Estadio 2 de LeishVet, lo que requirió la instauración de un tratamiento específico inicial con alopurinol a la espera de una evolución clínica favorable para iniciar un posterior tratamiento leishmanicida.
Lo más relevante de este caso clínico es como priorizar ante una coinfección de dos enfermedades vectoriales sistémicas con afección principalmente respiratoria; para lo cual fue primordial la clasificación clínica para la toma de decisiones y la monitorización activa a lo largo de todo el proceso.
Caso clínico: antecedentes
Alexa es una hembra mestiza de Podenco, gestante, de 9 años de edad y 9 kg de peso (Figura 1) recogida de la vía pública en Huelva. Tras una primera valoración por un veterinario local se alojó en una casa de acogida donde parió cinco cachorros de los que no se tiene información, a excepción de que un cachorro nació muerto, del cual no se realizó necropsia.

Figura 1. La paciente Alexa antes del tratamiento.
Posteriormente, fue vacunada frente al virus de la rabia y desparasitada con una combinación de praziquantel, pirantel y fenbendazol.
Dos meses después, Alexa fue trasladada a Madrid donde fue adoptada por la actual propietaria que acude a la Clínica Veterinaria Silvican donde se realizó un primer chequeo. A continuación, se detallan las pruebas diagnósticas realizadas y los resultados obtenidos:
- Prueba de diagnóstico rápido para la detección de antígeno de D. immitis y anticuerpos frente a Ehrlichia canis, Anaplasma spp y Borrelia burgdorferi: positivo a la detección de antígeno de D. immitis y negativo al resto.
- Inmunofluorescencia indirecta (IFI) para la detección de IgGs frente a L. infantum: título de 1/100 (punto de corte => 1/100).
- IFI para la detección de IgGs frente a E. canis: negativo.
- IFI para la detección de IgGs frente a de Rickettsia rickettsii y R. conorii: negativo ambos.
En la misma clínica veterinaria a la vista de los resultados se realizó una ecocardiografía y radiografías de tórax. En el estudio radiológico se detecta un aumento en el tamaño de la sombra cardíaca tanto en proyección laterolateral (Figura 2A) como en proyección ventrodorsal (Figura 2B).
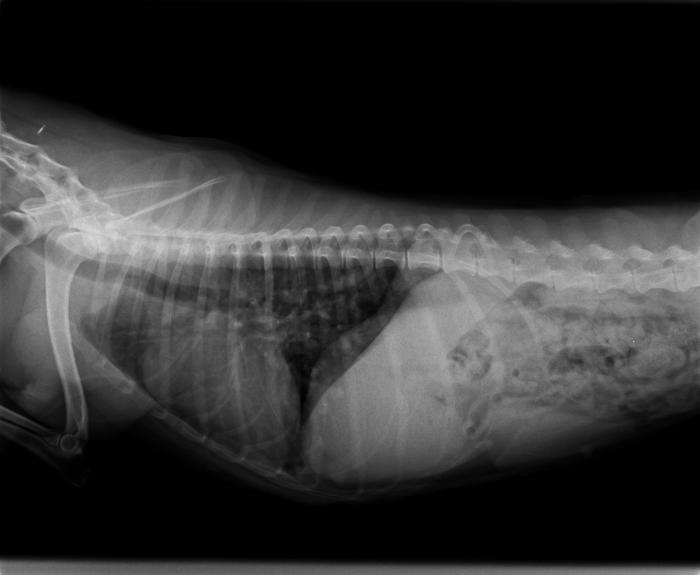
Figura 2A-B. Radiografías de tórax en ambas proyecciones (A) LL y (B) DV antes del tratamiento, realizadas en la Clínica Veterinaria Silvican.
El aumento de tamaño cardíaco era especialmente relevante en la zona de proyección de atrio y ventrículo derecho, así como en el tronco pulmonar. Respecto a los campos pulmonares, se detectó un patrón vascular arterial con fin abrupto. En las imágenes ecocardiográficas se observó una evidente dilatación del tronco pulmonar y arteria pulmonar derecha, con varias imágenes hiperecogénicas lineales dobles (signo de igual), compatibles con vermes adultos de D. immitis (Figura 3).
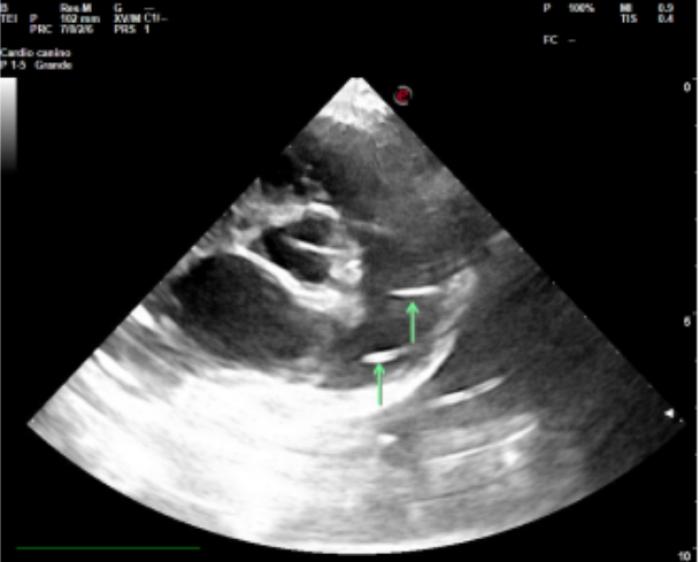
Figura 3. Ecocardiografía en el Hospital Universitario de la UAX (imagen cortesía: de Alejandro Casasús).
El tratamiento instaurado en la CV fue moxidectina en spot-on, doxiciclina (10 mg/kg/12 h 28 días) y prednisona (5 mg/12 h/7 días por vía oral dos semanas y reducción hasta cumplir un mes de tratamiento).
Diagnóstico diferencial
Antes de iniciar el tratamiento adulticida, se remite al Hospital Clínico Veterinario de la Universidad Complutense de Madrid (HCV-UCM) para una valoración en la consulta de especialidad de Patología Infecciosa y Parasitaria, donde la propietaria de Alexa refiere en la anamnesis que está alerta, activa, con apetito voraz y ansiedad por separación. Indica que presenta algo de prurito (2-4/10) en la región lumbar y pabellones, y poliuria/polidipsia desde que comenzó el tratamiento oral con prednisona.
A la exploración física apreciamos una condición corporal normal (5/9), membranas mucosas rosadas, FR: 28 rpm, FC: 80 lpm, AC: crepitación en la zona del ápex cardíaco, Tª: 37.5 ºC. En cuanto al estado de la piel, se observan lesiones cicatriciales compatibles con un antiguo pioderma profundo con afección del plano muscular y leve dermatitis exfoliativa.
Se plantea el siguiente plan de trabajo para establecer la clasificación clínica de ambos procesos (ver resultados en la Tabla 1):
- Diagnóstico completo y diferencial de filariosis.
- Valoración interconsulta con la especialidad de cardiología.
- Estudio radiológico de tórax en las 2 proyecciones (LL y DV) y ecocardiografía Doppler.
- Repetir la serología de leishmaniosis para valorar la cinética de anticuerpos.
- Hematología completa con hemograma, perfil bioquímico y proteinograma. Se incluyó además el dímero-D como biomarcador de posible tromboembolismo.
- Urianálisis completo con densidad urinaria, lectura de sedimento urinario y ratio proteína/creatinina en orina (UPC).
- Solicitar tres muestras seriadas de heces para valorar otras parasitosis digestivas y/o pulmonares (p. ej.: infección por Angiostrongylus vasorum).
El diagnóstico etiológico de la dirofilariosis incluyó la detección de microfilarias en sangre circulante y su posterior identificación específica para hacer diagnóstico diferencial de microfilarias pertenecientes a otras especies de filaroideos que pueden infectar al perro en nuestras latitudes (p. ej.: Dirofilaria repens y Acanthocheilonema spp). Por tanto, en primer lugar, la microfilaremia se detectó mediante la técnica de extensión en gota gruesa y observación al microscopio óptico. A continuación, la técnica de Knott permitió la cuantificación de la carga parasitaria (Figura 4). Y, la identificación de especie se realizó mediante la tinción histoquímica de las fosfatasas ácidas y una PCR múltiplex para el género Dirofilaria).

Figura 4. Microfilarias de Dirofilaria immitis teñidas por el método de Knott.
Los resultados de los análisis realizados fueron los siguientes:
- Técnica de Knott, fosfatasas ácidas y PCR múltiplex de dirofilariosis: 2000 microfilarias/ml, confirmándose la monoinfección por D. immitis, mediante la técnica de fosfatasas ácidas (Figura 5) y detección positiva de ADN de D. immitis mediante PCR.
- IFI para la detección de anticuerpos frente a L. infantum: 1/200.
- Análisis coprológico (Mini-FLOTAC y técnica de Baermann-Wetzel): negativo.
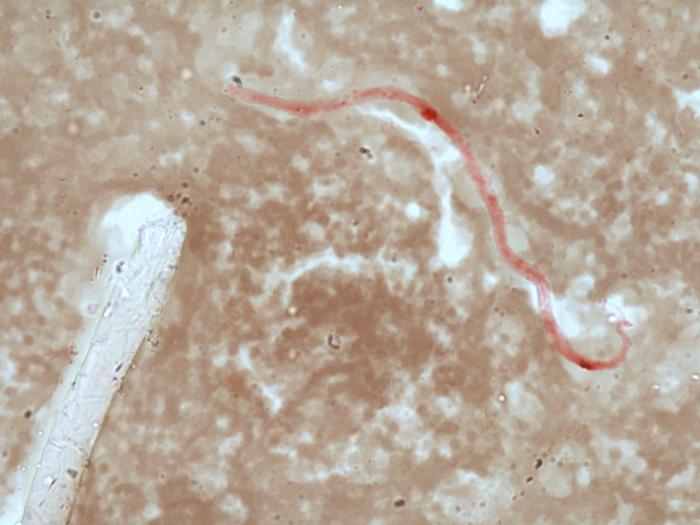
Figura 5. Microfilaria de Dirofilaria immitis teñida por el método de las fosfatasas ácidas donde se aprecia actividad enzimática en los poros anal y excretor.
Se remite al Servicio de Cardiología para su valoración donde, además de confirmar la presencia de imágenes lineales dobles compatibles con presencia de adultos en tronco pulmonar y arteria pulmonar derecha, se detectan signos ecocardiográficos de hipertensión pulmonar, engrosamiento leve de valvas de válvula mitral, insuficiencia mitral secundaria a degeneración valvular mitral crónica en estadio B1 y leve disfunción sistólica VI (EDVI: 122.4 ml/m2, DVIn: 1.75; Ratio AI/AO 1.44; FA Vi: 23 %). También se detectan signos ecocardiográficos que indican presencia de hipertensión pulmonar como la propia dilatación del tronco pulmonar, un tiempo de aceleración del flujo a través del tronco pulmonar disminuido (flujo a través del tronco pulmonar asimétrico) y un índice de distensibilidad de la arteria pulmonar derecha muy disminuido (1.7 %). En base al conjunto de datos ecocardiográficos (Figuras 6A-C), y fundamentalmente a la disfunción sistólica ventricular izquierda, se pauta un tratamiento con pimobendán a razón de 0.25 mg/kg/12 h.
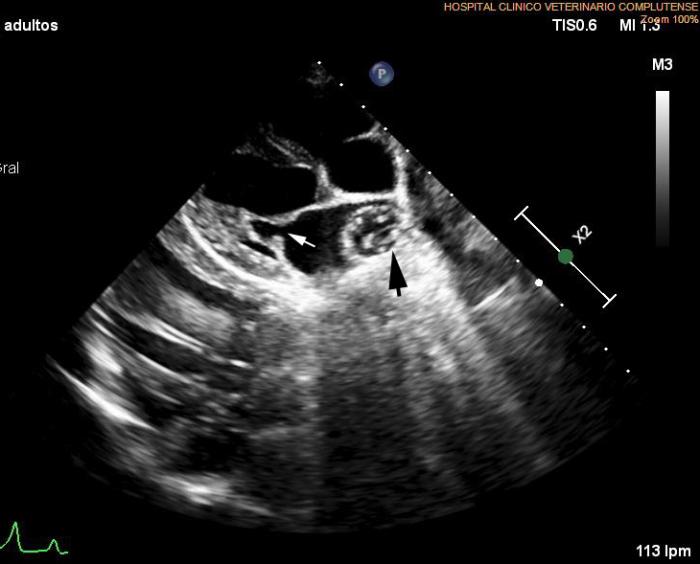
Figura 6A-C. Figura ecocardiografía antes del tratamiento con melarsomina sódica (Servicio de Cardiología del HCVC). (A) Corte longitudinal parasternal derecho de 4 cámaras en la que se pone de manifiesto la dilatación de la arteria pulmonar derecha con múltiples imágenes hiperecogénicas lineales dobles compatibles con dirofilarias adultas (flecha negra). Se observa un leve engrosamiento en valvas de válvula mitral (flecha blanca). (B) Modo M obtenido a partir de un corte transversal paraesternal derecho a nivel de los músculos papilares. Se observan signos de leve disfunción sistólica y leve dilatación ventricular izquierda. (C) Corte apical paraesternal izquierdo de cuatro cámaras con Doppler color evidenciando la insuficiencia mitral secundaria a engrosamiento leve de la válvula mitral compatible con degeneración valvular mitral crónica.
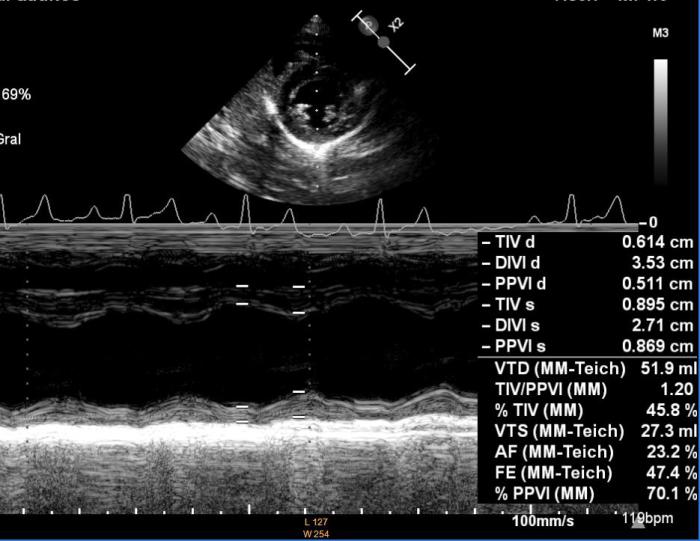
Tratamiento
A la vista de los resultados priorizamos el tratamiento de la dirofilariosis canina y proponemos el siguiente protocolo de tratamiento:
- Seguir las recomendaciones del servicio de cardiología y mantener el tratamiento con pimobendán a la dosis pautada.
- Continuar con la doxiclina (10 mg/kg/12 h) hasta completar un mes de tratamiento.
- Ivermectina oral mensual (6 μg/kg) por petición de la tutora que prefiere la vía oral.
- Melarsomina sódica (2.5 mg/kg, IM, tres dosis; días 60, 90 y 91).
Además, se recomienda restringir el ejercicio físico durante las siguientes 8 semanas, mientras se aplica el tratamiento adulticida, para reducir complicaciones derivadas de la muerte parasitaria.
Seguimiento clínico
Tres meses después de haber finalizado el tratamiento adulticida acude de nuevo a nuestra consulta del HCV-UCM para revisión.
Ha ganado 3 kg de peso (11.6 kg). Ha comenzado con tos seca, incluso en reposo, y a veces intolerancia al ejercicio en los paseos. La tutora indica que le cuesta subir a sitios elevados y lo asocia con posible dolor articular. Actualmente está en celo. Presenta poliuria, pero no polidipsia.
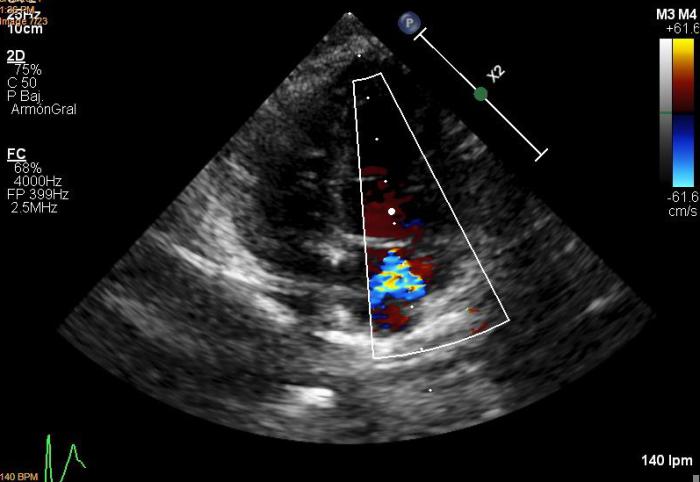
Se lleva a cabo un nuevo estudio ecocardiográfico en el que se siguen detectando imágenes hiperecogénicas lineales dobles compatibles con presencia de vermes adultos en arteria pulmonar derecha. Los valores ecocardiográficos que estiman la función ventricular izquierda están normalizados respecto a la ecocardiografía anterior (EDVI: 52.23 ml/m2, DVIn: 1.33; Ratio AI/AO 1.2; FA Vi: 54 %), se mantiene el diagnóstico de degeneración valvular mitral crónica en estadio B1, así como los datos que indican posible hipertensión arterial pulmonar (Figuras 7A-D).
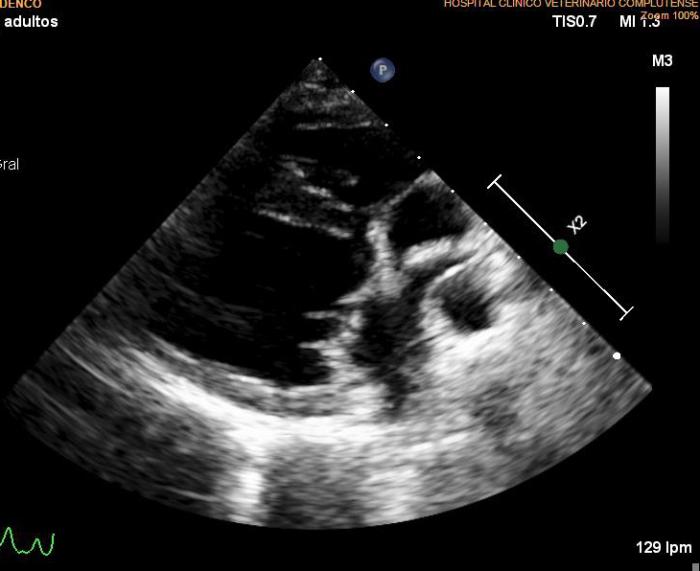
Figura 7A-D. Figura ecocardiografía tres meses después del tratamiento con melarsomina sódica (Servicio de Cardiología del HCVC). (A) Corte longitudinal paraesternal derecho de 4 cámaras similar a la imagen 1a, en la que se pone de manifiesto la dilatación de la arteria pulmonar derecha, no se observan imágenes hiperecogénicas lineales dobles compatibles con vermes adultos. (B) Modo M obtenido a partir de un corte transversal paraesternal derecho a nivel de los músculos papilares. En este momento se observa una normalización en las dimensiones y funcionalidad ventricular izquierda. (C) Doppler pulsado obtenido a través de la válvula pulmonar evidenciando un flujo sanguíneo asimétrico con tiempo de aceleración disminuido. (D) Corte transversal paraesternal derecho a nivel del tronco pulmonar. Se observan algunas imágenes hiperecogénicas lineales dobles (signo de igual) compatibles con vermes adultos (flecha). (*) Siglas de los informes ecocardiográficos: EDVI: end diastolic ventricular index; DVIn: dimensión ventricular izquierda en diástole normalizada; AO: aorta; AI: atrio izquierdo. FA: fracción de acortamiento.
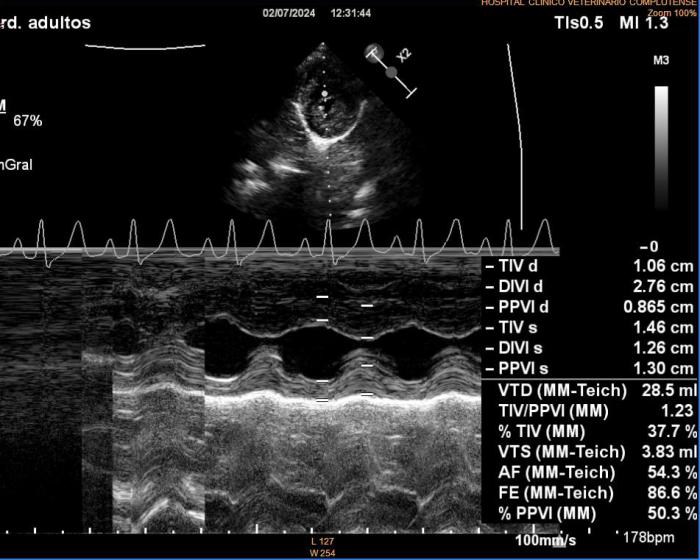
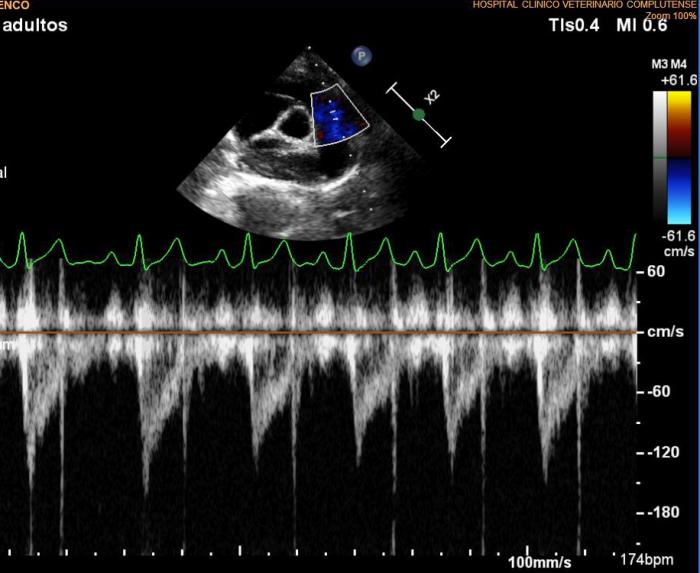
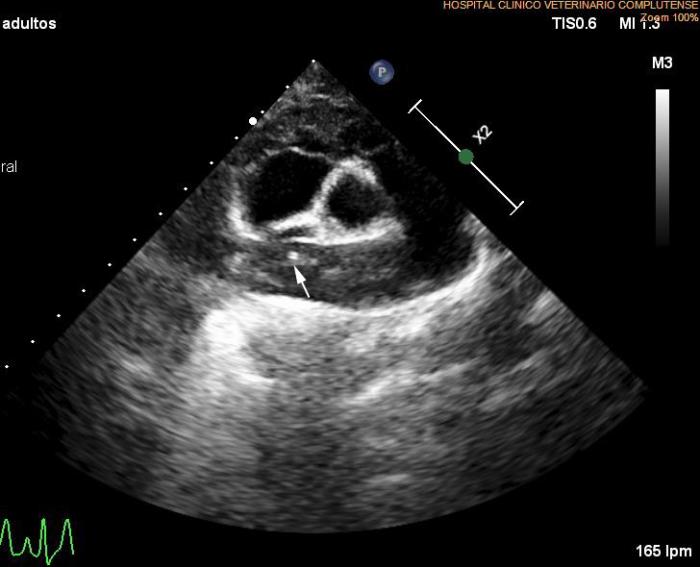
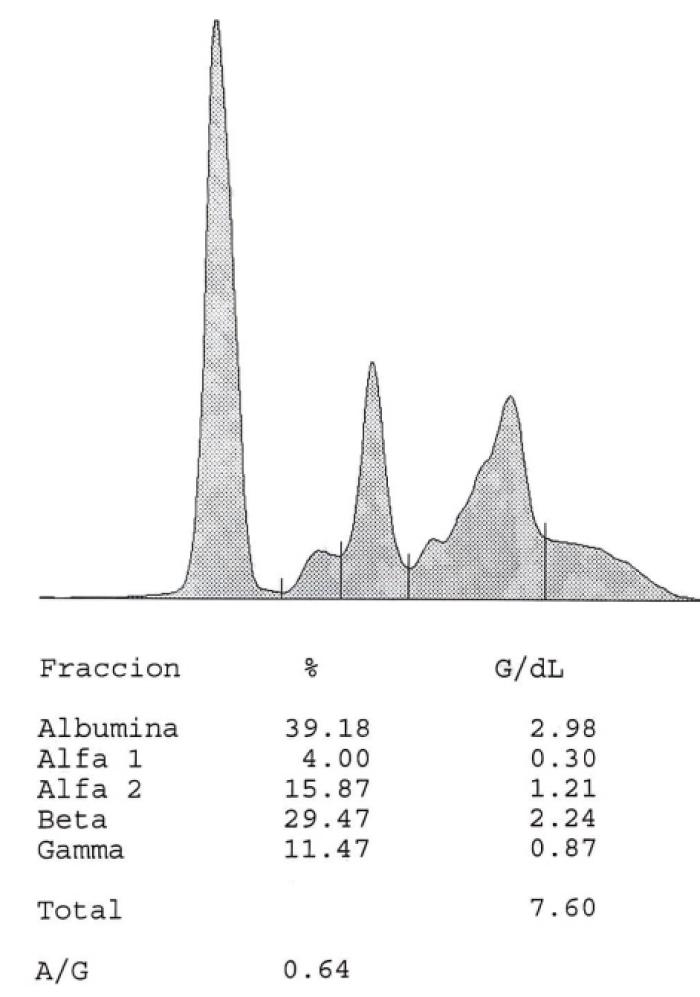
A la vista de estos resultados, se suspende el tratamiento con pimobendán, dado que ya no es necesario, por el estadio de la degeneración valvular mitral crónica ni por detectar en este momento ningún signo de disfunción sistólica en la paciente. Los resultados muestran una elevación en el título de anticuerpos de L. infantum y disproteinemia con respecto al proteinograma inicial (Tabla 1 - D120), por lo que comenzamos con un tratamiento leishmaniostático a base de alopurinol (10 mg/kg/12 h). Por otro lado, se ajusta la dosis de ivermectina oral según peso, ya que se ha incrementado el peso en 3 kg, y se comienza con un nuevo ciclo de doxiciclina debido a que en la ecocardiografía todavía se aprecia una imagen compatible con la presencia de vermes adultos.
Seis meses después del tratamiento inicial (Tabla 1 - D180) volvemos a revisar a la paciente. En la anamnesis todo es normal, la paciente sigue activa, no presenta signos respiratorios y tiene apetito y condición corporal normal (Figura 8).

Figura 8. Alexa a los 6 meses del tratamiento.
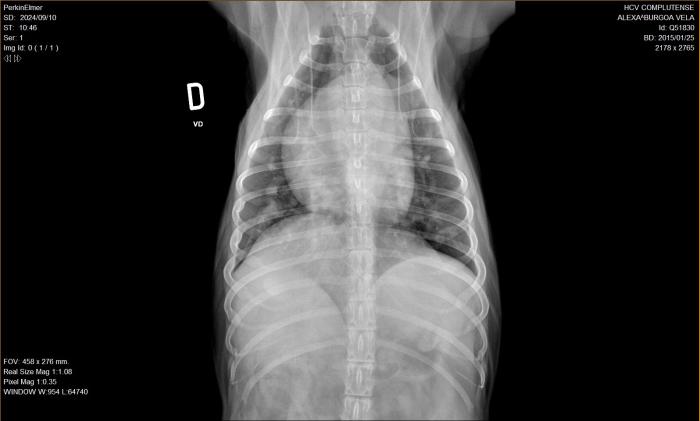
Tras el examen cardiológico por ecocardiografía de control, se observa una disminución significativa de la imagen previa hiperecogénica lineal doble compatible con vermes adultos. Además, se realiza una radiografía torácica en la que se observa un patrón vascular arterial con prominencia de las arterias lobulares caudales en las proyecciones VD y DV, además de una prominencia de la silueta cardíaca de 1 a 2 según la analogía del reloj (correspondiente al tronco pulmonar). El índice cardiovertebral (VHS = 11.5) se encuentra por encima del rango de normalidad. Estos hallazgos se correlacionan con los hallazgos ecocardiográficos de la paciente y la dirofilariosis previamente diagnosticada. Además, se observa un patrón intersticial leve en lóbulos caudales que puede estar asociado igualmente a la dirofilariosis (Figura 9A-B).
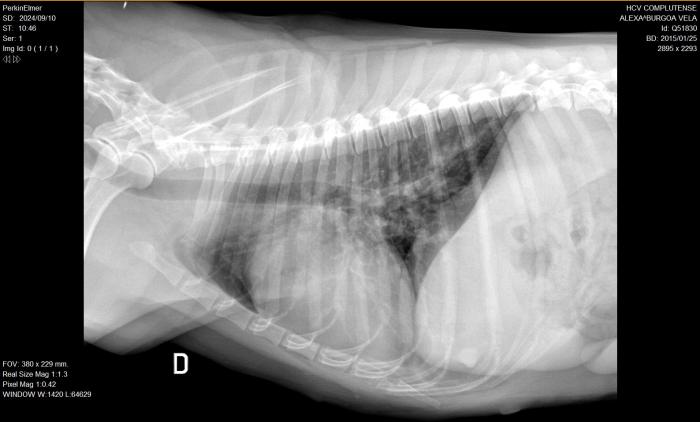
Figura 9A-B. Radiografías de tórax en ambas proyecciones (A) LL y (B) DV) después del tratamiento, realizadas en el HCV-UCM.
Por otra parte, los últimos resultados laboratoriales indican que la leishmaniosis empieza a sufrir una progresión negativa ya que, aunque no se observan signos clínicos asociados, ni hay alteraciones en el hemograma y el perfil bioquímico, el título de anticuerpos se incrementa en dos diluciones (1/800) asociado a una disproteinemia (leve hiperbetaglobulinemia y disminución del cociente A/G) (Tabla 1 - D180). En el sedimento urinario se descarta la presencia de cristales de xantina y en la ecografía abdominal no se aprecian cristales en suspensión en la vejiga de la orina ni tampoco mineralización en pelvis renal por lo que se decide continuar con alopurinol como monoterapia. En el momento de la redacción de este manuscrito se cita a la propietaria para iniciar una terapia leishmanicida con antimoniales durante 4 semanas, a las dosis recomendadas en un Estadio 2 de la clasificación de LeishVet.
| - | Día - 30 | Día 0 | Día 120 | Día 180 | Valores de referencia |
|---|---|---|---|---|---|
| Htc (%) | 50.5 | 40.9 | 37.6 | 40.7 | 37-55 |
| Hb (g/dl) | 16.2 | 14.5 | 12.9 | 14.1 | 12-18 |
| GR (x106/µl) | 6.82 | 6.14 | 5.67 | 6.22 | 5.5-8.5 |
| VCM (fl) | 74 | 66.7 | 66.2 | 65.4 | 60-77 |
| HCM (pg) | 23.8 | 23.6 | 22.8 | 22.6 | 19.5-24.5 |
| CCMH (g/dl) | 32.1 | 35.3 | 34.1 | 34.7 | 32-36 |
| Plaquetas (x1000/µl) | 181 | 89 (agreg. plaq.) | 138 (agreg. plaq.) | 190 | 180-500 |
| GB (x1000/µl) | 4.59 | 9.57 | 8.06 | 5.79 | 6-17 |
| Neutrófilos | 2570 | 7070 | 5080 | 4110 | 3000-11500 |
| Cayados | - | - | 320 | 0 | 0-300 |
| Linfocitos | 1230 | 1030 | 970 | 930 | 1000-4800 |
| Monocitos | 114 | 930 | 400 | 60 | 150-1350 |
| Eosinófilos | 290 | 550 | 129 | 690 | 100-1250 |
| PT (g/dl) | 7.7 | 7.8 | 8.1 | 7.6 | 5-7.2 |
| Albúmina (g/dl) | 3.3 | 2.8 | 2.82 | 2.98 | 2.8-4.0 |
| Globulinas | 4.4 | 5 | 5.28 | 4.62 | 2.5-4.0 |
| A/G | 0.75 | 0.6 | 0.54 | 0.64 | ≥ 1.0 |
| Creatinina (mg/dl) | 0.32 | 1.0 | 0.9 | 0.9 | < 14 |
| Urea (mg/dl) | 44 | - | 23 | 34 | 10-50 |
| ALT (U/L) | 18 | 109 | < 10 | 29 | 10-70 |
| Fosfatasa Alc (U/L) | 84 | 156 | sd | 119 | < 160 |
| Dímero D (µg/ml) | - | 0.47 | 0.19 | - | 0.023-0.65 |
| UPC | 0.7 | - | 0.11 | 0.15 | < 0.5 |
| IFI Leishmania | 1/100 | 1/200 | 1/800 | 1/800 | Punto de corte => 1/100 |
Tabla 1. Resultados de las pruebas de laboratorio de Alexa (antes y después del tratamiento).
Discusión
Desarrollamos un caso clínico de una coinfección por Dirofilaria immitis y Leishmania infantum en un perro recogido de la vía pública sin antecedentes epidemiológicos conocidos. La dirofilariosis y leishmaniosis son dos enfermedades vectoriales que suponen un desafío para el veterinario clínico, tanto en el protocolo de diagnóstico como en el manejo terapéutico y en el seguimiento.
En el caso que nos ocupa, se diagnosticó una coinfección moderada-grave por D. immitis (Clase 2-3) y leve-moderada por L. infantum (Estadio 2). Este caso clínico remarca la importancia de una exhaustiva anamnesis, exploración clínica detallada y un diagnóstico completo que incluya todas las posibles enfermedades prevalentes según el área geográfica donde se encuentre o haya viajado el paciente. Cabe destacar que el diagnóstico de las enfermedades vectoriales en perros con historial previo desconocido, (como es el caso de Alexa), es complicado debido a que estos, seguramente, pueden haber estado expuestos de manera prolongada a diferentes vectores (p. ej.: garrapatas, mosquitos, flebotomos) (ESCCAP, 2020).
En el caso de Alexa el diagnóstico de dirofilariosis se realizó de manera directa y eficiente puesto que el animal había sido recogido en Huelva, área hiperendémica y presentaba signos clínicos compatibles con esta parasitosis cardiobroncopulmonar. En un principio se detectó la presencia de antígeno de D. immitis por inmunodiagnóstico, pero el diagnóstico completo de dirofilariosis exige la puesta en evidencia de la presencia de microfilarias en sangre circulante (mediante las técnicas de Knott y/o filtración) ya que contribuyen a la reacción inflamatoria de esta grave parasitosis. En el caso de Alexa, estas larvas se identificaron como D. immitis, tanto por tinción específica como por PCR. Asimismo, el criterio y las pruebas del servicio de cardiología y radiodiagnóstico ayudaron a la clasificación de la dirofilariosis, haciéndose necesario instaurar un tratamiento adecuado según las recomendaciones descritas por las sociedades europeas y americana para el tratamiento y control de la dirofilariosis canina (ESCCAP, 2020; ESDA, 2021; AHS, 2024).
No obstante, es recomendable incluir otras enfermedades parasitarias en el diagnóstico diferencial puesto que hay otras filariosis (infección por Dirofilaria repens, Acanthocheilonema reconditum y A. dracunculoides) que también se manifiestan con la presencia de microfilarias en sangre circulante; por tanto, es fundamental el diagnóstico etiológico mediante la técnica de tinción de las fosfatasas ácidas (Peribañez et al., 2001) y/o diagnóstico molecular (Rishniw et al., 2006). Asimismo, el cuadro cardiorrespiratorio y la hipertensión pulmonar podrían estar causados por la presencia de vermes de Angiostrongylus vasorum en arterias pulmonares y/o en parénquima pulmonar, siendo necesario el diagnóstico diferencial mediante la técnica coprológica de Baermann-Wetzel o de migración larvaria para la detección de larvas de primer estadio (L1) en las heces (Schnyder et al., 2015).
Respecto al diagnóstico de la leishmaniosis canina, en un primer momento se detectó la presencia de un título de anticuerpos bajo (cercano al punto de corte (=> 1/100) que junto con unos resultados normales en la hematología y en el proteinograma permitieron clasificar a la paciente en un Estadio 1 de LeishVet (enfermedad leve), lo que nos permitió considerar de importancia secundaria esta coinfección. Sin embargo, hay que tener en cuenta que los títulos bajos de anticuerpos en perros infectados por Leishmania pueden deberse a una fase inicial de la infección, a una inmunosupresión o a una variación en la respuesta inmunitaria debida a la coinfección, siendo necesario la realización de pruebas diagnósticas complementarias para confirmar o descartar enfermedad (Noli y Saridomichelakis, 2014).
Cabe destacar la importancia de explorar la presencia de otras coinfecciones y/o otras comorbilidades en perros diagnosticados con una enfermedad vectorial, ya que en zonas donde la leishmaniosis es endémica, además de estar expuestos a las picaduras de flebotomos, también lo están a otros vectores artrópodos (p. ej.: garrapatas, pulgas) y por tanto, los perros tienen una mayor probabilidad de padecer una coinfección (p. ej.: dirofilariosis o erlichiosis/anaplasmosis, babesiosis, hepatozoonosis, etc. en función de las zonas geográficas donde vivan o hayan viajado), y este diagnóstico podría afectar directamente a la toma de decisiones en el tratamiento y manejo de estos pacientes (Apostolidis et al., 2023; Ramos et al., 2022; Dantas-Torres et al., 2018).
La disproteinemia y la elevación del título de anticuerpos anti-Leishmania durante el tratamiento de la dirofilariosis, se plantean varias posibles causas: en primer lugar, hay que tener en cuenta que se desconoce el momento de la infección por L. infantum, pudiendo haberse diagnosticado al principio de la infección ya que estudios previos indican que las alteraciones laboratoriales y la elevación del título de anticuerpos frente a L. infantum se puede prolongar desde uno a tres meses hasta incluso un año (Travi et al., 2018; Hernández et al., 2015); por otro lado, la leishmaniosis canina es una enfermedad inmunomediada y una coinfección podría comprometer la respuesta inmunitaria del perro enfermo (Sanz et al., 2022; Miró y Solano-Gallego, 2011). Así, diversos estudios han descrito la presencia de títulos bajos de anticuerpos frente a L. infantum en perros con infección por D. immitis en los que se demuestra la presencia de Wolbachia sp (bacteria Gram-negativo, endosimbionte de todas las fases evolutivas de D. immitis), sugiriendo que este endosimbionte podría inducir una respuesta inmunitaria de tipo Th1 y, por tanto, protectora en infecciones por L. infantum. Sin embargo, es una hipótesis que debe confirmarse (Latrofa et al., 2023; Maia et al., 2016; Tabar et al., 2013).
El objetivo del tratamiento en la dirofilariosis canina es mejorar la condición clínica del paciente y eliminar todos los estadios evolutivos del parásito con las mínimas complicaciones posibles posteriores al tratamiento, para reducir la respuesta inflamatoria y el cuadro clínico asociado, y además para evitar la transmisión a otros perros y a las personas dado su carácter zoonósico. Por el momento, no hay ningún tratamiento que elimine de forma simultánea los adultos y los estadios larvarios, por lo que es necesario implementar una pauta de tratamiento secuencial con fármacos con eficacia microfilaricida y adulticida, sin olvidarnos de la infección por Wolbachia. Además, es necesario recomendar una restricción del ejercicio físico en todos los perros durante el tratamiento, especialmente durante el tratamiento adulticida, para reducir las complicaciones derivadas de la muerte masiva de vermes (tromboembolismo, principalmente). Asimismo, los perros que muestran signos clínicos compatibles con tromboembolismo deben estabilizarse antes de administrar un tratamiento adulticida; esto puede requerir la administración de glucocorticoides, diuréticos, vasodilatadores y fluidoterapia (Montoya-Alonso y Carretón, 2012). Para un correcto tratamiento, es fundamental recurrir a las guías actuales sobre el tratamiento y control de la dirofilariosis canina (ESDA, 2021; AHS, 2024) para clasificar adecuadamente a los pacientes y poder así adoptar un criterio clínico basado en la exploración física y en los resultados de todas las pruebas complementarias realizadas. Así, el protocolo de tratamiento recomendado por la Sociedad Americana de Dirofilariosis incluye el pretratamiento con lactonas macrocíclicas como microfilaricidas y doxiciclina durante 30 días (para el tratamiento de la infección por Wolbachia), seguido de tres dosis del tratamiento adulticida en los días 60, 90 y 91. Es necesario apuntar que la segunda dosis adulticida puede administrarse a los 30 días de terminar el tratamiento con doxiciclina en los tiempos citados (día 60) o bien dilatar los intervalos en función de la evolución clínica del paciente a criterio del clínico responsable. Como microfilaricida se deben utilizar lactonas macrocíclicas con regularidad mensual durante un mínimo de 12 meses consecutivos y, deben administrarse desde los 2 meses anteriores al tratamiento adulticida, para reducir nuevas infecciones y eliminar las larvas existentes. El tratamiento complementario con doxiciclina elimina la infección por Wolbachia, reduciendo la patología asociada a la muerte parasitaria. Se administrará durante 4 semanas 2 meses antes de la administración del adulticida. Se ha demostrado que esperar hasta el día 60 para comenzar con el tratamiento adulticida permite que las proteínas de superficie de Wolbachia y otros metabolitos se eliminen, reduciendo la vitalidad de los vermes adultos, lo que supone una reducción paulatina de la carga parasitaria. Por tanto, con este protocolo se reducen las complicaciones respiratorias, circulatorias y la mortalidad asociada (Bazzocchi et al., 2008; Kramer et al., 2011; McCall et al., 2008, 2023; Moorhead et al., 2023). En la actualidad, el único principio activo eficaz disponible como tratamiento adulticida de la dirofilariosis canina, es la melarsomina sódica. Se recomienda emplear la vía intramuscular profunda en la región lumbar y pautar unas horas previas a su administración un tratamiento analgésico adecuado y mantenido durante las siguientes 24-48 horas. La pauta de tratamiento estándar de dos o tres dosis de melarsomina reduce el riesgo de tromboembolismo pulmonar (Vezzoni et al., 1992; AHS, 2024).
En cuanto a la monitorización de los perros infectados por L. infantum, resulta esencial hacerlo para el correcto manejo y control de la leishmaniosis canina, puesto que es una enfermedad crónica y progresiva y es frecuente que se sucedan las recidivas (LeishVet, 2024). Esta monitorización debe incluir la evaluación de los signos clínicos, pruebas laboratoriales que incluyan hemograma, perfil bioquímico con proteinograma y urianálisis completo con determinación del cociente proteína/creatinina en orina, así como la cuantificación del título de anticuerpos frente a L. infantum (Miró & Solano-Gallego, 2011).
En el presente caso clínico, la elevación del título de anticuerpos y la disproteinemia por hiperglobulinemia (ver Figura 10A-B), fue un factor decisivo para determinar una leishmaniosis activa, como señalan los últimos estudios llevados a cabo por nuestro grupo de investigación (Sarquis et al., 2024) en los que se considera el proteinograma una prueba complementaria de valor predictivo.
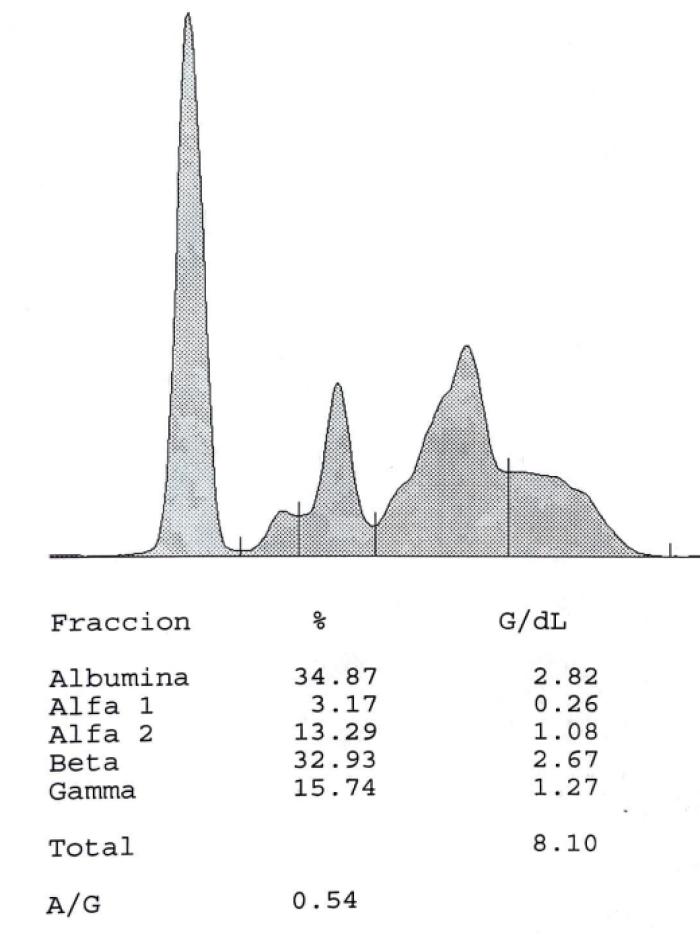
Figura 10A-B. Curva del proteinograma (A) antes del tratamiento y (B) tres meses después del tratamiento.
Se decidió instaurar un tratamiento inicial para la leishmaniosis con alopurinol puesto que ha demostrado su eficacia como leishmaniostático, siendo necesario monitorizar los efectos adversos que se puedan producir a largo plazo en algunos pacientes como urolitiasis y/o nefrolitiasis por xantina (Torres et al., 2016) para tomar las medidas encaminadas a reducir dichos efectos asociados a una inadecuada metabolización del fármaco en algunos perros. No obstante, el paciente debe ser monitorizado siguiendo las recomendaciones de LeishVet, considerando la posibilidad de introducir otros principios activos leishmanicidas, como los antimoniales o la miltefosina, si las alteraciones clinicopatológicas así lo requieren (LeishVet, 2024). Hay que tener en cuenta que la instauración de un elevado número de fármacos de forma simultánea podría incrementar el riesgo de toxicidad y de reacciones secundarias adversas, por lo que en el caso de Alexa no se recomienda el tratamiento simultáneo de ambos procesos parasitarios. En este sentido, la planificación presentada en el presente caso clínico y el tratamiento escalonado una vez establecidas las prioridades (clasificación clínica, cuadro clínico principal y diagnóstico por imagen), evidencia que se han minimizado los posibles efectos adversos secundarios a los fármacos y por consiguiente una mejor evolución clínica del paciente con el consiguiente buen pronóstico.
Conclusión
Este caso destaca la complejidad del diagnóstico y tratamiento de la coinfección por Dirofilaria immitis y Leishmania infantum en perros con historial previo desconocido, y subraya la importancia de la priorización terapéutica previa clasificación clínica basada en la gravedad y especificidad de los signos clínicos asociables a uno u otro proceso y al impacto orgánico de ambos agentes demostrable por el hallazgo de las alteraciones clinicopatológicas descritas. En este caso el abordaje terapéutico inicial se centró en la dirofilariosis, dada la evaluación clínica y laboratorial, aunque, en los posteriores seguimientos clínicos se consideró la necesidad de tratar la leishmaniosis. Así pues, el manejo terapéutico de forma escalonada y el seguimiento periódico del paciente permitió el control de ambas enfermedades de manera segura y eficaz, mejorando considerablemente su pronóstico.
Agradecimientos
A Silvia Ramiro y Laura Lavín, veterinarias de SILVICAN responsables del caso hasta su remisión al HCV-UCM. A Alejandro Casasús por facilitarnos el informe de la primera ecocardiografía realizada en el Hospital de la Universidad Alfonso X. A la propietaria de Alexa por su disponibilidad y dedicación. A Alexa por soportar estoicamente todas las pruebas, y por demostrar una gran fortaleza.
Bibliografía
- AHS American Heartworm Society Canine Guidelines for the Prevention, Diagnosis, and Management of Heartworm (Dirofilaria immitis) Infection in Dogs. https://d3ft8sckhnqim2.cloudfront.net/images/AHS_Canine_Guidelinesweb31JUL2024.pdf?1722529020. 2024.
- Apostolidis KN, Chatzis MK, Kasabalis D, Mataragka A, Ikonomopoulos J, Skampardonis V, Athanasiou LV, Mylonakis ME, Leontides LS, Saridomichelakis MN. Investigation of comorbidities in dogs with leishmaniosis due to Leishmania infantum. Vet Parasitol Reg Stud Reports. 2023 Apr;39:100844.
- Bazzocchi C, Mortarino M, Grandi G, Kramer LH, Genchi C, Bandi C, Genchi M, Sacchi L, McCall JW. Combined ivermectin and doxycycline treatment has microfilaricidal and adulticidal activity against Dirofilaria immitis in experimentally infected dogs. Int J Parasitol. 2008;38:1401-1410.
- Borrás P. Manual práctico de enfermedades infecciosas y parasitarias del perro. Multimédica Ediciones Veterinarias. 2024. Madrid.
- Carretón E, Morchón R, Simón F, Juste MC, Méndez JC, Montoya-Alonso JA. Cardiopulmonary and inflammatory biomarkers in the assessment of the severity of canine dirofilariosis. Vet Parasitol. 2014 Sep 6. pii: S0304-4017(14)00472-5.
- ESCCAP (European Scientific Counsel Companion Animal Parasites). Consideraciones a tener en cuenta cuando importamos un perro rescatado. https://www.esccap.es/wp-content/uploads/2020/05/pet-import-fact-sheet-es-v2.pdf. 2020. Spain.
- ESDA (European Society of Dirofilariosis and Angiostrongylosis). Guidelines for clinical management of canine heartworm disease. https://www.esda.vet/media/attachments/2021/08/19/canine-heartworm-disease.pdf. 2021.
- Hernández L, Montoya A, Checa R, Dado D, Gálvez R, Otranto D, Latrofa MS, Baneth G, Miró G. Course of experimental infection of canine leishmaniosis: follow-up and utility of noninvasive diagnostic techniques. Vet Parasitol. 2015 Jan 15;207(1-2):149-55.
- Kramer L, Grandi G, Passeri B, Gianelli P, Genchi M, Dzimianski MT, Supakorndej P, Mansour AM, Supakorndej, McCall SD, McCall JM. Evaluation of lung pathology in Dirofilaria immitis – Experimentally infected dogs treated with doxycycline or a combination of doxycycline and ivermectin before administration of melarsomine dihydrochloride. Vet Parasitol. 2011;176:357-360.
- Latrofa MS, Varotto-Boccazzi I, Louzada-Flores VN, Iatta R, Mendoza-Roldan JA, Roura X, Zatelli A, Epis S, Bandi C, Otranto D. Interaction between Wolbachia pipientis and Leishmania infantum in heartworm infected dogs. Parasit Vectors. 2023 Feb 27;16(1):77.
- LeishVet. Practical management of canine leishmaniosis. https://www.leishvet.org/wp-content/uploads/2024/04/FS-ALIVE24-canine.pdf. 2024
- Maia C, Altet L, Serrano L, Cristóvão JM, Tabar MD, Francino O, Cardoso L, Campino L, Roura X. Molecular detection of Leishmania infantum, filariae and Wolbachia spp. in dogs from southern Portugal. Parasit Vectors. 2016 May 10;9(1):170.
- McCall JW, Genchi C, Kramer L, Guerrero J, Dzimianski MT, Supakorndej P, Mansour AM, McCall SD, Supakorndej N, Grandi G, Carson B. Heartworm and Wolbachia: therapeutic implications. Vet Parasitol. 2008;158:204-214.
- McCall JW, Mansour A, DiCosty U, Fricks C, McCall S, Dzimianski MT, Carson B. Long-term evaluation of viability of microfilariae and intravenously transplanted adult Dirofilaria immitis in microfilaremic dogs treated with low-dose, short-and long-treatment regimens of doxycycline and ivermectin. Parasit Vectors. 2023;16:190.
- Miró G; Solano-Gallego L. Leishmaniosis canina y felina. En: Enfermedades Vectoriales del Perro y el Gato. Miró G; Solano-Gallego L (eds.). Editorial Acalanthis. 2011. Madrid.
- Montoya-Alonso JA; Carretón Gómez E (eds). Dirofilariosis. Pautas de manejo clínico. Editorial Multimédica 2012. Barcelona.
- Noli C, Saridomichelakis MN. An update on the diagnosis and treatment of canine leishmaniosis caused by Leishmania infantum (syn. L. chagasi). Vet J. 2014 Dec;202(3):425-35.
- Peribañez MA, Lucientes J, Arce S, Morales M, Castillo JA, Gracia MJ. Histochemical differentiation ofDirofilaria immitis,Dirofilaria repensandAcanthocheilonema dracunculoidesmicrofilariae by staining with a commercial kit, Leucognost-SP®Vet Parasitol.2001;102:173–175.
- Ramos RAN, Giannelli A, Ubirajara-Filho CRC, Ramos CADN, Betbder D, Bezerra-Santos MA, Dantas-Torres F, Alves LC, Otranto D. Vector-borne pathogens in dogs from areas where leishmaniosis is endemic. Vet Parasitol Reg Stud Reports. 2022 Jul;32:100746.
- Rishniw M, Barr SC, Simpson KW, Frongillo MF, Franz M, Dominguez Alpizar JL. Discrimination between six species of canine microfilariae by a single polymerase chain reaction.Vet Parasitol.2006;135:303–314.
- Sanz CR, Miró G, Sevane N, Reyes-Palomares A, Dunner S. Modulation of Host Immune Response duringLeishmania infantumNatural Infection: A Whole-Transcriptome Analysis of the Popliteal Lymph Nodes in Dogs. Front Immunol. 2022 Jan 4;12: 794627.
- Sarquis J, Raposo LM, Sanz CR, Montoya A, Barrera JP, Checa R, Perez-Montero B, Rodríguez MLF, Miró G. Relapses in canine leishmaniosis: risk factors identified through mixed-effects logistic regression. Parasit Vectors. 2024 Aug 22;17(1):357.
- Schnyder M, Jefferies R, Schucan A, Morgan ER, Deplazes P. Comparison of coprological, immunological and molecular methods for the detection of dogs infected with Angiostrongylus vasorum before and after anthelmintic treatment. Parasitology. 2015 Sep;142(10):1270-7.
- Tabar MD, Altet L, Martínez V, Roura X. Wolbachia, filariae and Leishmania coinfection in dogs from a Mediterranean area. J Small Anim Pract. 2013 Apr;54(4):174-8.
- Torres M, Pastor J, Roura X, Tabar MD, Espada Y, Font A, et al. Adverse urinary effects of allopurinol in dogs with leishmaniasis.J Small Anim Pract.2016;57:299–304.
- Travi BL, Cordeiro-da-Silva A, Dantas-Torres F, Miró G. Canine visceral leishmaniasis: Diagnosis and management of the reservoir living among us. PLoS Negl Trop Dis. 2018 Jan 11;12(1):e0006082
- Vezzoni A, Genchi C, Raynaud JP. Adulticide efficacy of RM 340 in dogs with mild and severe natural infections. In Proceedings of the Heartworm Symposium ’92. Austin, TX. American Heartworm Society, 1992, pp 231-240.
 by Multimédica
by Multimédica