Tratamiento de un paciente felino con anemia grave por leishmaniosis con comorbilidades asociadas.
Resumen breve
Se remitió a nuestro centro un paciente felino, Común europeo de 10 años, hembra esterilizada por hiporexia, apatía y fiebre de una semana de evolución. La paciente era positiva a anticuerpos del virus de la inmunodeficiencia felina desde pequeña. Las analíticas pusieron de manifiesto la presencia de anemia grave normocítica normocrómica no regenerativa. Se realizó PCR de patógenos transmitidos por pulgas, obteniéndose resultado positivo a Candidatus M. haemominutum.Índice de contenidos
Resumen
Se remitió a nuestro centro un paciente felino, Común europeo de 10 años, hembra esterilizada por hiporexia, apatía y fiebre de una semana de evolución. La paciente era positiva a anticuerpos del virus de la inmunodeficiencia felina desde pequeña. Además, había sido outdoor gran parte de su vida.
Las analíticas pusieron de manifiesto la presencia de anemia grave normocítica normocrómica no regenerativa. Se realizó PCR de patógenos transmitidos por pulgas, obteniéndose resultado positivo a Candidatus M. haemominutum. Tras el tratamiento con doxiciclina, y más tarde con marbofloxacino al no observarse una mejoría completa de la anemia, se decidió realizar extracción de médula ósea, así como serología de Leishmania infantum con proteinograma.Se observaron amastigotes de Leishmania spp. en la médula ósea, aunque la serología resultó negativa.
Se añadió al tratamiento alopurinol a 10 mg/kg/PO cada 12 h y antimoniato de meglumina a 50 mg/kg/SC cada 24 h, observándose una mejoría notable de la anemia hasta su total resolución tras un mes de tratamiento.
El tratamiento leishmanicida fue correctamente tolerado, se observó un incremento leve en los valores de creatinina (2 mg/dl), los cuales disminuyeron una vez se cesó el tratamiento con antimoniato de meglumina. Además, se desarrollaron cristales de xantina secundarios al tratamiento con alopurinol, por lo que se decidió incrementar el consumo de agua y bajar la dosis de alopurinol a 10 mg/kg/PO cada 24 h. Con estas modificaciones la cristaluria desapareció.
Tres años tras el diagnóstico la paciente continúa estable y en tratamiento.
Introducción
La información acerca de la leishmaniosis felina por Leishmania infantum es limitada. En áreas endémicas es relativamente frecuente encontrar infecciones subclínicas, siendo la enfermedad clínica poco frecuente y estando asociada en su mayoría a individuos inmunodeprimidos1-4. Los gatos actúan en el ciclo de la enfermedad como reservorios, aunque se hipotetiza que son más resistentes a la infección que los perros1.
En este artículo describimos el tratamiento exitoso con alopurinol y antimoniato de meglumina de una anemia grave por Leishmania infantum en una paciente inmunocomprometida con otras comorbilidades, y el desarrollo de cristales de xantina como complicación al tratamiento con alopurinol.
Descripción del caso
Se refirió a nuestro centro una hembra castrada felina, Común europeo de 10 años por una semana de hiporexia, apatía y fiebre de una semana de evolución. Había sido testada para retrovirus, siendo positiva a anticuerpos del virus inmunodeficiencia felina (FIV, por sus siglas en inglés). En el momento de su visita, la gata era indoor estricta, pero había sido outdoor gran parte de su vida, conviviendo con otros gatos en una colonia felina (Figura 1).

Figura 1. Foto de la paciente.
En el examen físico general se evidenciaron apatía moderada, mucosas pálidas, TRC <2”, pulso fuerte y sincrónico, auscultación cardiopulmonar dentro de la normalidad, fiebre (39.8ºC) e infestación moderada de pulgas. Los linfonodos periféricos se encontraron dentro de la normalidad, al igual que la palpación abdominal. La condición corporal y muscular fueron de 5/9 y 4/4, respectivamente.
La lista de problemas hasta ese momento era apatía, fiebre y mucosas pálidas.
Se consideró que la apatía estaba relacionada con la presencia de fiebre, pero otros diagnósticos diferenciales de esta son: enfermedades hormonales (p.ej.: hipoadrenocorticismo), enfermedades cardiovasculares (p.ej.: arritmias, fallo cardiaco congestivo, efusión pericárdica), alteraciones hematológicas (p.ej.: anemia, policitemia), alteraciones metabólicas (p.ej.: hipoglucemia, hipocalemia, azotemia), alteraciones neurológicas (p.ej.: encefalopatía metabólica, alteraciones primarias del sistema nervioso central), inflamación crónica en alguna parte del organismo, infección (p.ej.: bacteriana, viral, fúngica) y neoplasias.
Debido a la presencia de apatía, la hipertermia se consideró poco probable. El diagnóstico diferencial de fiebre es bastante amplio (Tabla 1).
| Infecciosas |
|
| Inflamatorias | Esteatitis, síndrome hipereosinofílico, miositis, pancreatitis. |
| Inmunomediadas | Anemia hemolítica inmunomediada (AHIM), poliartritis, polimiositis, trombocitopenia, enfermedades inmunomediadas polisistémicas (lupus eritrematoso sistémico), vasculitis. |
| Neoplasias | Enfermedad linfoproliferativa (p.ej.: linfoma), enfermedad mieloproliferativa (p.ej.: enfermedad histiocítica), tumores sólidos, enfermedad metastásica. |
| Enfermedades misceláneas | Reacción idiosincrática a medicamentos o vacunas, mielodisplasia, osteopatía metafiseal. |
Tabla 1. Diagnóstico diferencial de fiebre en el gato.
Los diagnósticos diferenciales de mucosas pálidas son anemia, hipoperfusión y vasoconstricción por estrés.
Teniendo en cuenta los diagnósticos diferenciales, se llevaron a cabo las pruebas diagnósticas. Se realizó hemograma, perfil bioquímico y urianálisis. En las analíticas sanguíneas se observó anemia moderada [Hto: 20 % rango de referencia (RR): 30.3-52.3], normocítica normocrómica no regenerativa, hipoalbuminemia [(1.9 mg/dl) RR: 2.3-4] e incremento en los valores de bilirrubina total [(2.5 mg/dl) RR: 0-0.9]. El urianálisis determinó la presencia de posible proteinuria (Tablas 2 - 4).
| Hemograma |
|---|
| Hto 20 % (RR: 30.3-52.3), VCM 53 fL (RR:35.9-53.1), HCM 17 pg (RR:11.8-17.3), Reticulocitos 5.8 k/µL (RR: 3-50), Leu 5.89 k/µL (RR: 2.87-17.02), neutrófilos 2.4 k/µL (RR: 2.3-10.29), linfocitos 4 k/µL (RR: 0.92-6.88), monocitos 0.18 k/µL (RR: 0.05-0.67), eosinófilos 0.18 k/µL (RR: 0.17-1.57), basófilos 0.01 (RR: 0.01-0.26), Plaq 246 k/µL (RR: 151-600). |
Tabla 2. Hemograma.
| Bioquímica |
|---|
| Glucosa 145 (RR: 74-159 mg/dl), Creatinina 1.5 (RR: 0.8-2.4 mg/dl), Urea 19 (RR: 16-36 mg/dl), Ratio urea/creatinina 10, Calcio 9.6 (RR: 7.8-11.3 mg/dl), Sodio 158 (RR: 150-165 mmol/L), Potasio 4.3 (RR: 3.5-5.8 mmol/L), Ratio sodio/potasio 37, Cloro 119 (RR: 112-129 mmol/L), Proteínas totales 8.9 (RR: 5.7-8.9 g/dl), Albúmina 1.9 (RR: 2.2-4.0 g/dl), Globulina 5.1 (RR: 2.8-5.1 g/dl), ALT 26 U/L (RR: 12-130 U/L), AST 47 (RR: 0-48 U/L), Fosfatasa alcalina 47 (RR: 14-111 U/L), GGT 0 (RR: 0-4 U/L), Bilirrubina Total 2.5 (RR: 0.0-0.9 mg/dl), Colesterol 221 (RR: 65-225 mg/dl), Triglicéridos 99 (RR: 10-100 mg/dl), CK 154 U/l (RR: 10-350). |
Tabla 3. Bioquímica.
| Urianálisis |
|---|
| Color de la orina amarillo Turbidez no Ph 7 (RR: 4.5 - 8.5) Glucosa en orina normal Cetonas negativo Bilirrubina en orina negativo Hematíes/ hemoglobina/ mioglobina 2+ Proteínas en orina positivo Densidad urinaria 1030 |
Tabla 4. Urianálisis.
Como diagnósticos diferenciales de la anemia normocítica, normocrómica no regenerativa, tenemos causas medulares y extramedulares (Tabla 5).
| Causas medulares | Causas extramedulares |
|---|---|
| Causas medulares primarias | Renales |
|
|
| Infecciones medulares | Endocrinas |
|
|
| Reacciones medicamentosas | Gastrointestinal/enfermedad malabsortiva |
|
|
| Toxinas | Enfermedad hepática |
| |
| Pancreatitis | |
| Neoplasia | Neoplasia |
| |
| Inmunomediada | Deficiencia de hierro |
|
|
Tabla 5. Diagnóstico diferencial de anemia no regenerativa en el gato.
La hipoalbuminemia puede estar causada por una disminución en la producción hepática debido a que es una proteína de fase aguda negativa (inflamaciones agudas en otras zonas del cuerpo pueden causar su disminución), insuficiencia hepática, pérdidas gastrointestinales, pérdidas del espacio vascular debido a vasculitis o pérdidas hacia el 3º espacio, hemorragia y glomerulopatía.
El incremento de bilirrubina total puede ser prehepático, hepático o poshepático, y múltiples las causas (Tabla 6).
| Causas prehepáticas (hemólisis) |
|
| Hepáticas |
|
| Poshepáticas |
|
Tabla 6. Diagnóstico diferencial de ictericia.
El diagnóstico diferencial de proteinuria se divide en proteinuria prerrenal (fiebre, fallo cardiaco congestivo, hematuria, hemoglobinuria, mioglobinuria, paraproteinuria o ejercicio intenso, hipertensión), renal (amiloidosis renal, glomerulonefropatías) o posrenal (cistitis idiopática felina, urolitiasis, infección de orina, neoplasias del tracto urinario).
Se continuó el protocolo diagnóstico con la realización de ecografía abdominal, radiografías torácicas de 3 proyecciones, y PCRs de hemoplasmas, piroplasmas y Bartonella spp. en sangre periférica en EDTA.
En la ecografía abdominal se evidenció hepatomegalia y esplenomegalia de aspecto apolillado (Figura 2).
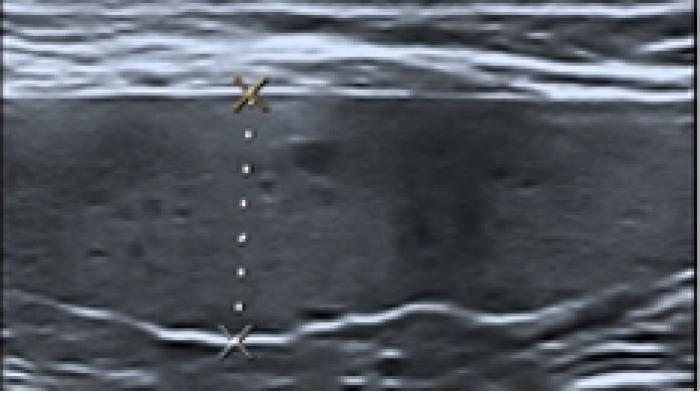
Figura 2. Bazo apolillado en ecografía abdominal.
Se realizaron punciones de ambos órganos, siendo las citologías sospechosas de proceso linfoproliferativo. Se realizó PARR sobre dichas muestras, obteniéndose una población de linfocitos T/B normal y con el patrón policlonal que indicaría la presencia de un proceso inflamatorio.
Se obtuvoresultado positivo en la PCR sanguínea a Candidatus Mycoplasma haemominutum y el resto de PCRs fueron negativas.
La paciente quedó hospitalizada, se realizó colocación de sonda de alimentación nasoesofágica y fluidoterapia intravenosa con Ringer lactato. Se inició tratamiento con doxiciclina a 5 mg/kg PO cada 12 horas. Tras 3 días de hospitalización, al desaparecer la fiebre, se realizó el cociente proteína creatinina, obteniéndose valores de 1.8 (RR< 0.2), por lo que se añadió benaceprilo a 0.5 mg/kg PO cada 24 horas al tratamiento.
Después de una semana de hospitalización, la bioquímica se normalizó, pero la anemia permanecía (Hto 17 %). La paciente se mostraba más activa y con apetito por lo que fue dada de alta. El tratamiento ambulatorio consistió en doxiciclina 5 mg/kg PO cada 12 horas y benaceprilo 0.5 mg/kg PO cada 24 horas.
Tras una semana en tratamiento, no se observó mejoría de la anemia, por lo que se decidió cambiar la doxiciclina por marbofloxacino a 3 mg/kg PO cada 24 horas. En las siguientes revisiones se observó incremento paulatino del hematocrito, llegando a alcanzar un 23 %, pero no se consiguió una mayor mejoría. Se repitió la PCR de Candidatus Mycoplasma haemominutum en sangre periférica para constatar el correcto tratamiento y resolución de la hemoplasmosis, obteniéndose resultado negativo.
Al no conseguirse una normalización del hematocrito y tratarse de una anemia no regenerativa, se recomendó realización de citología de médula ósea y serología de Leishmania infantum con proteinograma.
En la citología de médula ósea se observaron numerosos macrófagos con amastigotes compatibles con Leishmania infantum (Figura 3), aunque la serología resultó negativa (IFAT). En el proteinograma se evidenció aumento de gammaglobulinas [(4.2g/dl (RR:0.4-1.9)]. Se inició en ese momento tratamiento con alopurinol a 10 mg/kg PO cada 12 horas, antimoniato de meglumina a 50 mg/kg SC cada 24 horas y se cesó tratamiento con marbofloxacino. El benaceprilo fue mantenido.
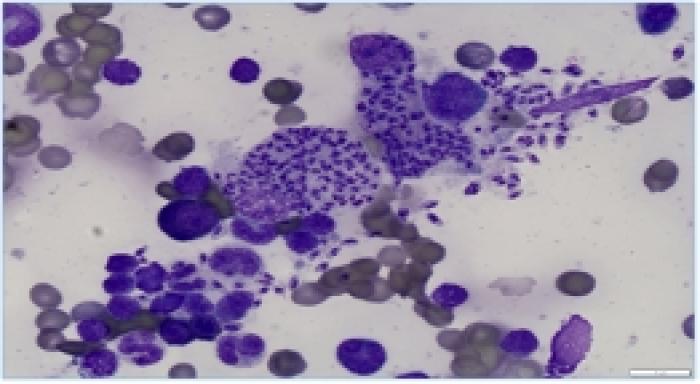
Figura 3. Amastigotes de Leishmania spp. en la médula ósea.
Tras un mes de tratamiento con alopurinol y antimoniato de meglumine se realizó hemograma de control, observándose un hematocrito en 30.6 %. La bioquímica evidenció un leve incremento de los valores de creatinina (2 mg/dl). En el proteinograma se observó disminución de los valores de gammaglobulinas [3.2 g/dl (RR: 0.4-1.9)], dado que la paciente había comenzado a no tolerar correctamente la administración vía subcutánea, se decidió cesar el tratamiento con antimoniato de meglumina manteniendo el resto.
Pasado otro mes, se realizaron analíticas de control, el hematocrito había incrementado hasta el 34 %, los valores de creatinina habían descendido hasta 1.6 mg/dl y el urianálisis evidenció la presencia de cristales de xantina abundantes. Se recomendó aumentar el consumo de agua y administración de Hydracare® oral, así como disminución el tratamiento con alopurinol a 10 mg/kg/PO cada 24 h. Se realizó SDMA, el cual resultó en 16 μg/dl (RR: 0-14), por lo que se cambió a dieta renal.Según la clasificación del IRIS, la paciente estaba en estadio 2 sin hipertensión y con proteinuria controlada por lo que se introdujo una dieta renal, además, como estrategia para la xantinuria.
Actualmente, tras 3 años desde el diagnóstico, la paciente continúa en seguimiento. Se han tenido que realizar otros 4 ciclos con antimoniato de meglumine durante este tiempo, en 3 de ellos se decidió reiniciar tratamiento al observar recaída en la anemia y amastigotes de Leishmania en linfonodos poplíteos. En una de las recaídas aparecieron lesiones dermatológicas, observándose amastigotes en el raspado cutáneo. Se ha bajado la dosis de alopurinol, pero ante las recaídas dela paciente, no hemos podido llegar a retirarlo.
La cristaluria resolvió con las medidas terapéuticas tomadas, los valores de creatinina descendieron de nuevo hasta los niveles basales (1.5 mg/dl) y los valores de UPC normalizaron, manteniéndose actualmente en valores de 0.22 (RR: 0.2-0.4). La serología de Leishmania spp. siguió resultando negativa durante el primer año, al segundo año de tratamiento se obtuvieron valores de seropositivo bajo.La paciente se ha mantenido en estadio IRIS II, con proteinuria controlada no hipertensa.
El tratamiento de mantenimiento actual consiste en alopurinol a 10 mg/kg/PO cada 24 h, nucleótidos y compuestos correlacionados de hexosa activa (N-AHCC) y benaceprilo 0.5 mg/kg cada 24 horas y dieta renal.
Discusión
Aún faltan evidencias acerca del correcto tratamiento de Leishmania infantum en gatos. El tratamiento con alopurinol ha sido establecido como seguro y efectivo en estudios previos4,5. El tratamiento con leishmanicidas resulta más controvertido, se han usado diferentes pautas de tratamiento en los pacientes felinos con diversas tasas de éxito, utilizándose tanto antimoniato de meglumina como miltefosina. El tratamiento con antimoniato de meglumina ha resultado ser más satisfactorio, reportándose una mayor tasa de éxito y menor de efectos adversos1,5. El propilenglicol, uno de los excipientes de la formulación oral de la miltefosina que tiene licencia para perros, ha sido reportado como causante de anemia por cuerpos de Heinz en gatos2,9,11,12.
También se han descrito otros tratamientos adyuvantes, como es el uso de N-AHCC o domperidona6,7,8,13.
En nuestro caso, se observó una mejoría parcial en la anemia al comenzar a usar marbofloxacino y no cuando se usó doxiciclina para tratar la hemoplasmosis. En perros, hay un estudio que demuestran la eficacia del marbofloxacino como tratamiento en leishmaniosis canina, pudiendo haber influido en la mejora de nuestra paciente, aunque en esos momentos desconocíamos la presencia de la leishmaniosis10. Además, se ha descrito el marbofloxacino como tratamiento para la hemoplasmosis, por lo tanto, se debe tener en cuenta que quizá la hemoplasmosis de nuestra paciente no respondía a la doxiciclina14.
Los signos clínicos de leishmaniosis en gatos pueden ser muy variados como son alteraciones dermatológicas (alopecia, dermatitis ulcerativas, nódulos dérmicos entre otros), linfadenomegalia, letargia, anorexia, pérdida de peso, fiebre, hepatomegalia/esplenomegalia, signos oftalmológicos (uveítis, coriorretinitis, glaucoma entre otros), descarga nasal, vómitos o alteraciones neurológicas y musculoesqueléticas, han sido descritos15. Las alteraciones analíticas más frecuentemente observadas son la anemia, neutrofilia, trombocitopenia, leucopenia, eosinofilia, hiperproteinemia, hiperglobulinemia, azotemia e hipoalbuminemia, aunque hay que tener presente, que algunas de estas alteraciones pueden ser causadas por la inmunodeficiencia felina en caso de una infección concomitante como en esta gata3,15.
El tratamiento durante un mes con antimoniato de meglumina a 50 mg/kg SC cada 24 horas fue bien tolerado. Se observó únicamente un leve incremento en los valores de creatinina, los cuales se normalizaron tras cesar la terapia. En los sucesivos ciclos de leishmanicida que se han realizado a la paciente, este ha sido correctamente tolerado. El incremento de los valores de creatinina durante la terapia con antimoniato de meglumina ya ha sido observado en otros casos, pudiéndose desarrollar un fallo renal agudo tras el inicio de la terapia8,15.
El tratamiento con alopurinol ha requerido de otras estrategias terapéuticas tras el desarrollo de cristales de xantina de manera abundante en la orina. La xantinuria y urolitiasis por tratamiento con alopurinol en gatos ya ha sido descrita previamente, por ello se recomienda su monitorización, al igual que en la especie canina, durante el tratamiento con alopurinol4,16. Medidas como el cambio a una dieta baja en purinas, incrementar el consumo de agua y la reducción de la dosis de alopurinol, han demostrado ser medidas eficaces para disminuir/cesar la xantinuria en perros14.
De manera controvertida, la serología de Leishmania spp. ha demostrado ser menos útil para el diagnóstico en gatos que en perros1. En nuestro caso la serología de Leishmania infantum resultó negativa, poniendo de manifiesto que una serología negativa no te excluye la presencia de la enfermedad. Esto puede estar causado por el bajo número de anticuerpos producidos en los gatos, debido a una respuesta inmunitaria diferente ante la enfermedad si los comparamos con los perros, y al hecho de que pocos laboratorios ofrecen test serológicos validados para la leishmaniosis felina. Además, se ha visto una menor sensibilidad de la técnica IFAT en comparación a la ELISA, por lo que la técnica utilizada para la realización de la serología puede influir en el número de falsos negativos1,16.
Nuestra paciente era positiva a inmunodeficiencia felina, lo cual podría hacer que la respuesta humoral frente a Leishmania sea inadecuada, facilitando que se obtenga una serología negativa. Se sabe que los gatos inmunocomprometidos están más predispuestos al desarrollo de Leishmania infantum, por lo que los gatos que vivan en áreas endémicas de Leishmania y sean FIV positivos, deberían ser testados de Leishmania infantum en caso de presentar alteraciones clínicas o analíticas compatibles con la enfermedad, así como usar prevención para las picaduras del flebótomo, en el caso de tratarse de gatos outdoor3.
El hecho de presentar inmunodeficiencia también hace que en estados avanzados sea más complicado controlar la leishmaniosis, así como que los pacientes presenten un mayor número de recaídas de la enfermedad, en comparación con los perros con Leishmania4.
Como conclusiones, este caso expone el tratamiento para el control de la leishmaniosis felina con antimoniato de meglumina y alopurinol en un paciente felino. Además, existen complicaciones secundarias al tratamiento como xantinuria, siendo necesario la realización de controles seriados en los cuales se incluyan urianálisis para una correcta monitorización. También, se subraya la importancia de tener más en cuenta esta enfermedad en pacientes inmunocomprometidos (p.ej.: FIV positivos), dada la mayor prevalencia de leishmaniosis en este grupo en áreas endémicas.
Bibliografía
- Pennisi, M., Cardoso, L., Baneth, G., Bourdeau, P., Koutinas, A., Miró, G., Oliva, G. and Solano-Gallego, L., 2015. LeishVet update and recommendations on feline leishmaniosis. Parasites & Vectors, 8(1).
- Pennisi, M. and Persichetti, M., 2018. Feline leishmaniosis: Is the cat a small dog?. Veterinary Parasitology, 251, pp.131-137.
- Priolo V, Masucci M, Donato G, Solano-Gallego L, Martínez-Orellana P, Persichetti MF, et al. Association between feline immunodeficiency virus and Leishmania infantum infections in cats: A retrospective matched case-control study. Parasites & Vectors. 2022;15(1).
- Garcia-Torres M, López MC, Tasker S, Lappin MR, Blasi-Brugué C, Roura X. Review and statistical analysis of clinical management of feline leishmaniosis caused by Leishmania infantum. Parasites & Vectors. 2022;15(1).
- Pereira A, Maia C. Leishmania infection in cats and feline leishmaniosis: An updated review with a proposal of a diagnosis algorithm and prevention guidelines. Current Research in Parasitology and Vector-Borne Diseases. 2021 Jun 2;1:100035
- Brianti, E., Celi, N., Napoli, E., Abbate, J., Arfuso, F., Gaglio, G., Iatta, R., Giannetto, S., Gramiccia, M. and Otranto, D., 2019. Treatment and long-term follow-up of a cat with leishmaniosis. Parasites & Vectors, 12(1).
- Richter, M., Schaarschmidt-Kiener, D. and Krudewig, C., 2014. Ocular signs, diagnosis and long-term treatment with allopurinol in a cat with leishmaniasis. Schweizer Archiv für Tierheilkunde, 156(6), pp.289-294.
- Fernandez-Gallego, A., Feo Bernabe, L., Dalmau, A., Esteban-Saltiveri, D., Font, A., Leiva, M., Ortuñez-Navarro, A., Peña, M., Tabar, M., Real-Sampietro, L., Saló, F., Lloret, A. and Bardagí, M., 2020. Feline leishmaniosis: diagnosis, treatment and outcome in 16 cats. Journal of Feline Medicine and Surgery, 22(10), pp.993-1007.
- Christopher MM, White JG, Eaton JW. Erythrocyte pathology and mechanisms of Heinz body‑mediated hemolysis in cats. Veterinary Pathol[CB1]ogy. 1990;27:299–310
- Pineda, C., Aguilera-Tejero, E., Morales, M., Belinchon-Lorenzo, S., Gomez-Nieto, L., Garcia, P., Martinez-Moreno, J., Rodriguez-Ortiz, M. and Lopez, I., 2017. Treatment of canine leishmaniasis with marbofloxacin in dogs with renal disease. PLOS ONE, 12(10).
- Bardagi M., Lloret A., Dalmau A., Esteban D., Font A., Leiva M., Ortunez A., Pena T., Real L., Salò F., Tabar M.D. Feline leishmaniosis: 15 cases. Veterinary Dermatology. 2016;27:112–113
- Maia C., Sousa C., Ramos C., Cristóvão J.M., Faísca P., Campino L. First case of feline leishmaniosis caused by Leishmania infantum genotype E in a cat with a concurrent nasal squamous cell carcinoma. Journal of Feline Medicine and Surgery Open Reports. 2015;1.
- Leal RO, Pereira H, Cartaxeiro C, Delgado E, Peleteiro MDC, Pereira da Fonseca I. Granulomatous rhinitis secondary to feline leishmaniosis: report of an unusual presentation and therapeutic complications. Journal of Feline Medicine and Surgery Open Reports. 2018 Nov 8;4(2).
- Novacco M, Sugiarto S, Willi B, Baumann J, Spiri AM, Oestmann A, Riond B, Boretti FS, Naegeli H, Hofmann-Lehmann R. Consecutive antibiotic treatment with doxycycline and marbofloxacin clears bacteremia in Mycoplasma haemofelis-infected cats. Veterinary Microbiology. 2018 Apr;217:112-120.
- Jesus L, Arenas C, Domínguez-Ruiz M, Silvestrini P, Englar RE, Roura X, Leal RO. Xanthinuria secondary to allopurinol treatment in dogs with leishmaniosis: Current perspectives of the Iberian veterinary community. Comparative Immunology, Microbiology Infectious Diseases. 2022 Apr;83:101783.
- da Silveira Neto L, Sobrinho LS, Martins CO, Machado RZ, Marcondes M, de Lima VM. Use of crude, FML and rK39 antigens in ELISA to detect anti-Leishmania spp. antibodies in Felis catus. Veterinary Parasitology. 2011;177:374–7.
 by Multimédica
by Multimédica