Citología ocular
Resumen breve
La citología de las lesiones oculares es una herramienta valiosa en el diagnóstico y, por tanto, en el tratamiento de las enfermedades oculares. En este trabajo se describe la utilidad de esta técnica diagnóstica en las enfermedades que afectan a los diferentes tejidos oculares (conjuntiva, córnea, párpados, anejos, humor acuoso, etc.), explicando el aspecto citológico fisiológico y poniendo en evidencia las variaciones patológicas. Se tendrán en cuenta determinados aspectos importantes,…Índice de contenidos
Resumen
La citología de las lesiones oculares es una herramienta valiosa en el diagnóstico y, por tanto, en el tratamiento de las enfermedades oculares. En este trabajo se describe la utilidad de esta técnica diagnóstica en las enfermedades que afectan a los diferentes tejidos oculares (conjuntiva, córnea, párpados, anejos, humor acuoso, etc.), explicando el aspecto citológico fisiológico y poniendo en evidencia las variaciones patológicas. Se tendrán en cuenta determinados aspectos importantes, previos a la evaluación microscópica, como son la recogida de la muestra de manera adecuada, el procesado de la misma, la preparación del portaobjetos y la tinción.
Introducción
La citología ocular permite la evaluación microscópica de células, microorganismos y cuerpos de inclusión, que podemos encontrar en la superficie ocular y estructuras intraoculares.
En muchos procesos, tales como las conjuntivitis, los signos clínicos no son suficientes para establecer un diagnóstico etiológico, por ello se requieren métodos complementarios de exploración que permitan establecer la causa del proceso. Así, el estudio citológico es una herramienta básica para establecer un diagnóstico en las patologías oculares, cuyo origen puede ser infeccioso, autoinmune o neoplásico.
Los instrumentos para recoger muestras para citología incluyen los hisopos de algodón, citocepillos o cepillos de citología (o bien cepillos interdentales), espátulas e, incluso, el borde romo de una hoja de bisturí. También se realizan citologías de impresión y aspiración con aguja fina.
Las muestras deben ser extendidas, con cuidado, en portaobjetos, para evitar la rotura celular. El método de tinción más utilizado es las tinciones de tipo Romanowsky (p. ej., Diff-Quick, Wright-Giemsa). Además, veces se utilizan otras tinciones, como la tinción de Gram para identificar bacterias, tinciones para organismos fúngicos (PAS, sales de plata) o tinciones de tipo acid-fast.
Para la evaluación citológica, se debe estar familiarizado con las características del tejido muestreado y reconocer los patrones celulares normales, así como distintos tipos de células inflamatorias (permite clasificar la inflamación como neutrofílica, linfocítica / plasmocítica, etc.), características citológicas de células tumorales (es importante reconocer que las neoplasias pueden inducir una respuesta inflamatoria), características citológicas de quistes, hemorragia aguda y crónica y enfermedades degenerativas.
Recogida y procesado de muestras
La recogida de muestras oculares se puede llevar a cabo mediante diversas técnicas y materiales, dependiendo del tejido objeto de estudio, de una manera sencilla.

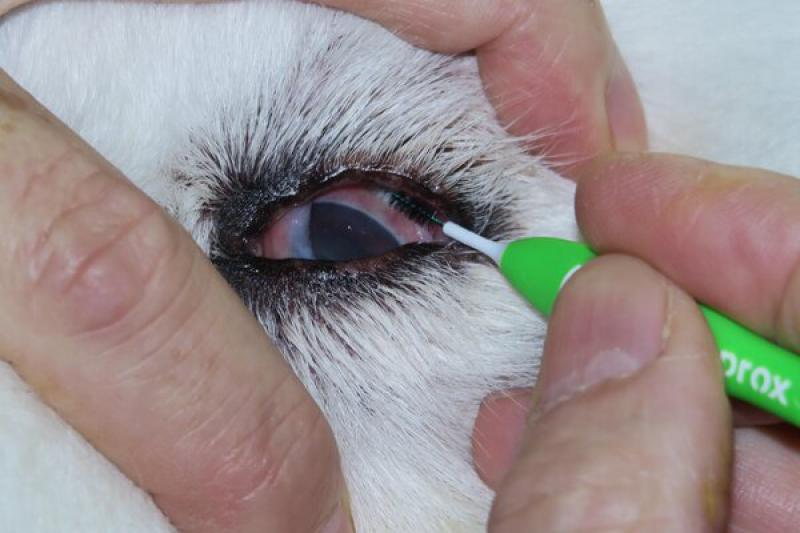
Al igual que para la toma de cultivos, lo ideal sería que el paciente no tenga tratamiento en curso, ya que este puede alterar el aspecto citológico de las lesiones (por ejemplo, los corticoides disminuyen la respuesta inflamatoria y el nitrato de plata da lugar a descamación de células epiteliales). Tampoco se debe utilizar ninguna tinción vital (rosa de bengala, fluoresceína) ni desinfectantes (yodo).
Anestésico tópico
La superficie ocular es una de las estructuras más sensibles del cuerpo, por lo que se recomienda el uso de anestésico tópico en colirio para inhibir la sensibilidad corneal. El protocolo más habitual consiste en instilar una gota, esperar un minuto y volver a poner otra gota una segunda vez. Tras esperar 5 minutos, se puede hacer la toma de muestra
Interpretación citológica y técnica de recogida de muestras
Conjuntiva
Las indicaciones principales para la evaluación citológica conjuntival son caracterizar un exudado, identificar la causa de la conjuntivitis y diagnosticar masas conjuntivales. La técnica de raspado conjuntival es sencilla. Se realiza mediante una espátula metálica o espátula conjuntival de Kimura, un hisopo humedecido con suero fisiológico o un cepillo para citología o cytobrush, previa instilación de un anestésico tópico en el saco conjuntival. Se recogen muestras de la conjuntiva palpebral y de la conjuntiva bulbar, así como de la membrana nictitante.
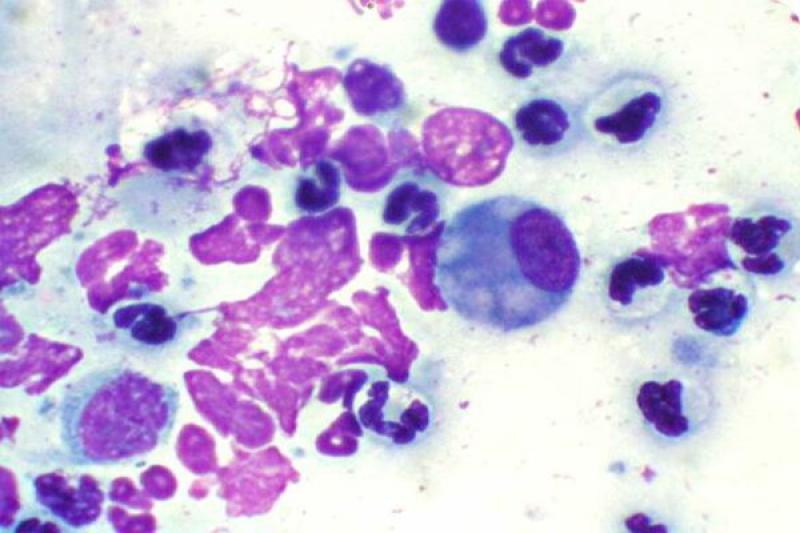
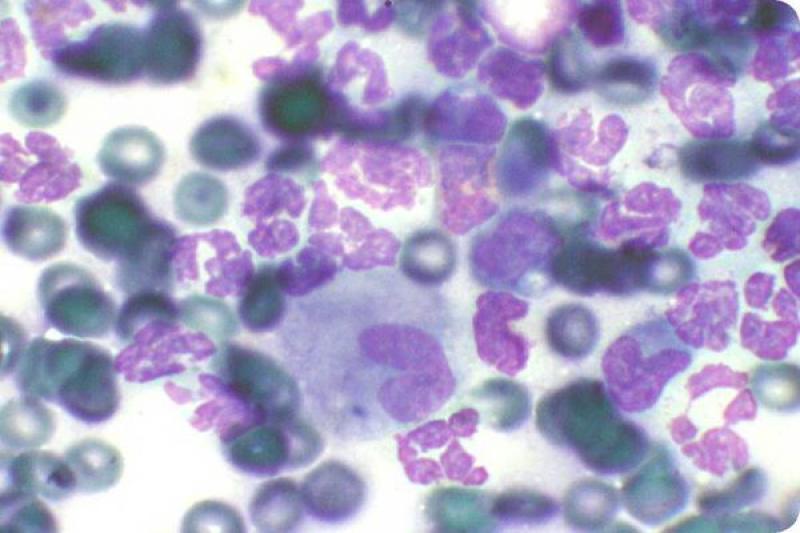
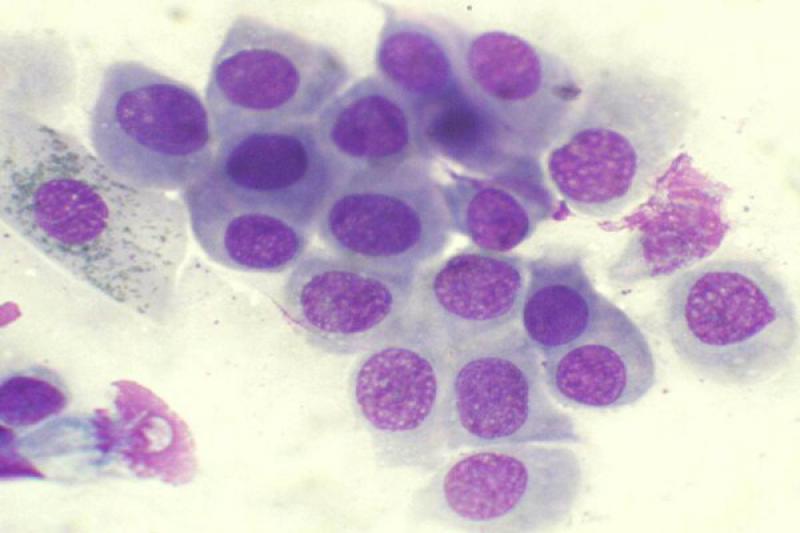
En condiciones normales el epitelio conjuntival es no queratinizado. En la extensión normal podemos encontrar células epiteliales de conjuntiva palpebral que son cilíndricas, y células de conjuntiva bulbar que son escamosas y pueden contener gránulos de melanina. Hay diferencia también entre células superficiales, con morfología más poliédrica, y células de estratos profundos. Las células caliciformes son las encargadas de la producción de moco, tienen un citoplasma espumoso con gránulos de mucina. Su número se puede reducir en las queratoconjuntivitis herpéticas.
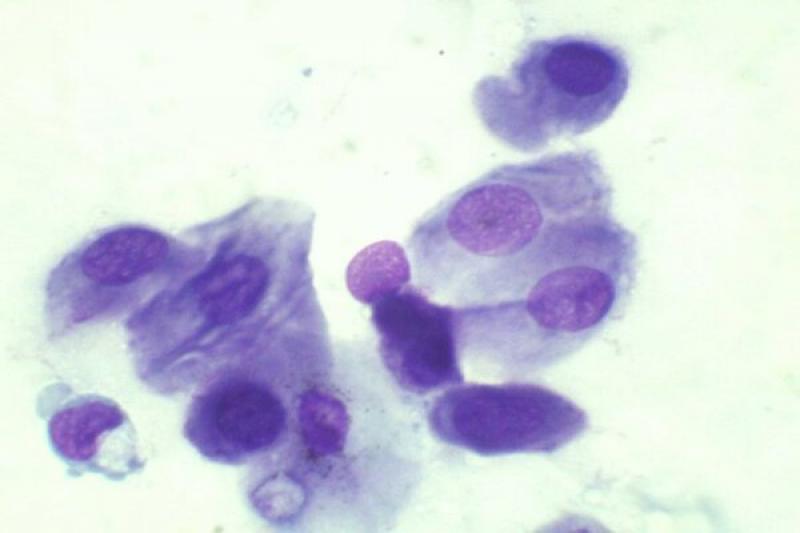
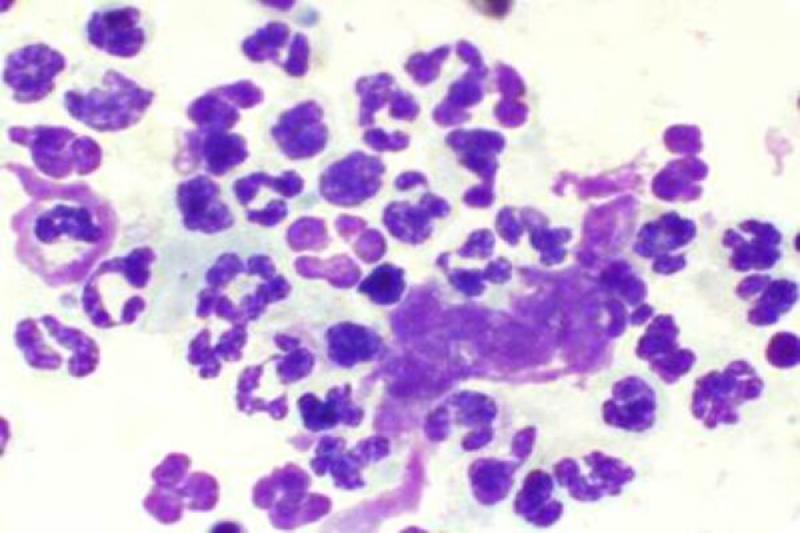
Las conjuntivitis en perros y gatos pueden presentar exudados con presencia de neutrófilos, en ocasiones asociadas a sobrecrecimiento bacteriano (menos frecuente en gatos), víricas, fúngicas, alérgicas… Dichos neutrófilos pueden presentar características degenerativas o signos de cariolisis. Pueden aparecer también células epiteliales degeneradas, células macrofágicas, fibrina y moco.
En la queratoconjuntivitis seca se puede encontrar un exudado neutrofílico con presencia de bacterias frecuentemente. Hay aumento de células queratinizadas, macrófagos, fibrina y moco. A medida que avanza el proceso hay una disminución de células caliciformes, y aumento de células no secretoras con aumento del tamaño de su citoplasma.
El moquillo es la causa vírica más importante de conjuntivitis neutrofílica. Inicialmente aparecen linfocitos, posteriormente neutrófilos y células plasmáticas. Los cuerpos de Lenz intracitoplasmáticos aparecen en los primeros días de la enfermedad.
Una causa de conjuntivitis con predominio de neutrófilos en el gato es el herpesvirus felino tipo 1 (FHV-1), aunque los cuerpos de inclusión intranucleares no son fácilmente observables y el diagnóstico se confirma mediante PCR del material obtenido por raspado conjuntival.En la citología se pueden observar células gigantes multinucleadas y un aumento del número de células superficiales y poliédricas.
Existe exudado con neutrófilos en las conjuntivitis felinas por Chlamydophila felis. A partir del día 6 post-infección podemos encontrar cuerpos de inclusión basófilos intracitoplasmáticos, grandes y solitarios, en el citoplasma de las células epiteliales escamosas.
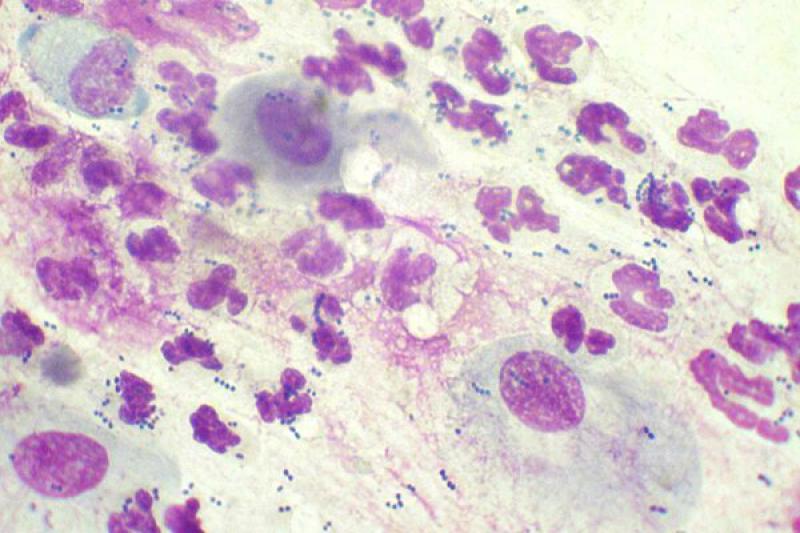
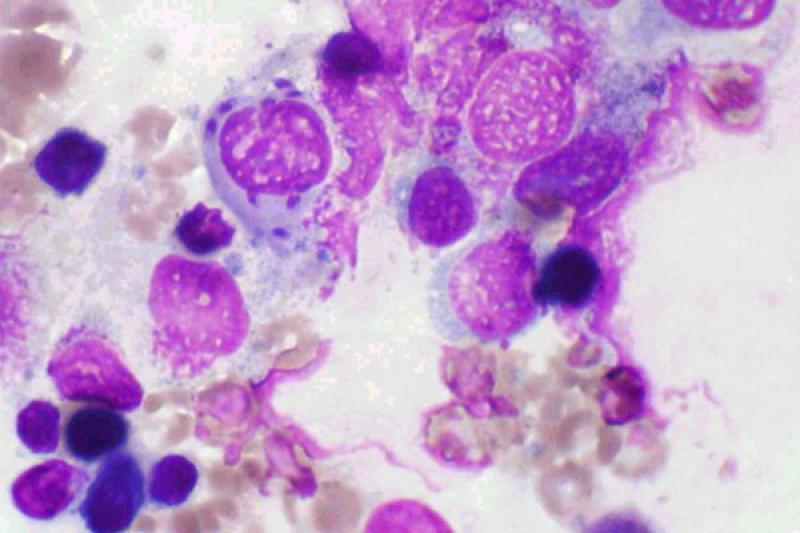
También se pueden encontrar como agregados de cuerpos cocoides basófilos junto al núcleo. Es importante diferenciarlos de los cuerpos de inclusión azules que pueden verse tras el tratamiento con neomicina. En infecciones experimentales rara vez se encuentran cuerpos de inclusión en el día 14 post-infección.
Dada la dificultad para encontrar los cuerpos de inclusión de C.felis, y dada su baja sensibilidad y especificidad, en muchas ocasiones hay que confirmar su presencia mediante PCR, ELISA o tinción con anticuerpos fluorescentes.
La micoplasmosis felina es otra causa de conjuntivitis neutrofílica. Se puede diagnosticar por la presencia de cuerpos de inclusión intracitoplasmáticos basófilos adyacentes a la membrana citoplasmática o sobre la superficie de las células epiteliales escamosas. Estas inclusiones no deben confundirse con gránulos de melanina.El aumento de células plasmáticas y linfocitos tiene lugar en las conjuntivitis alérgica.
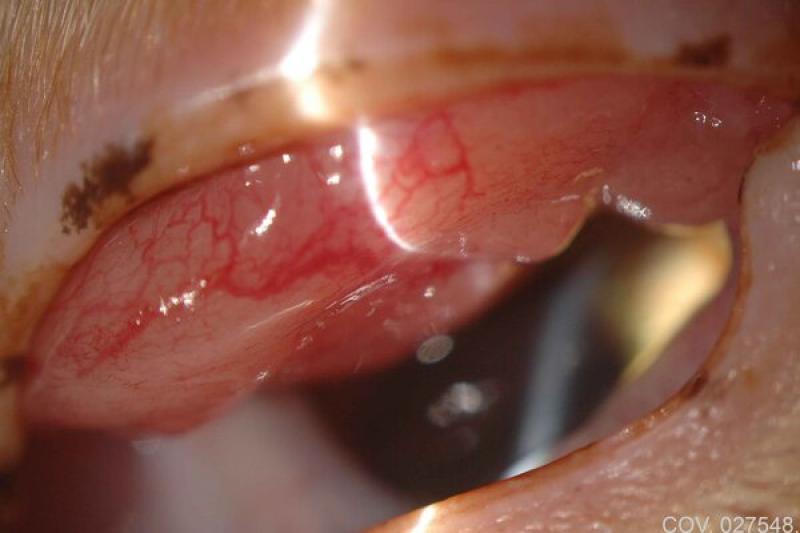
Este tipo de células pueden estar presentes en las conjuntivitis foliculares, observándose numerosos linfocitos de distintos tamaños y células plasmáticas, pocos neutrófilos no degenerados, algún linfoblasto y agrupaciones epiteliales, y en el plasmocitoma, donde observamos una infiltración de la conjuntiva de la membrana nictitante de linfocitos y células plasmáticas, en ocasiones relacionado con la queratitis crónica superficial.
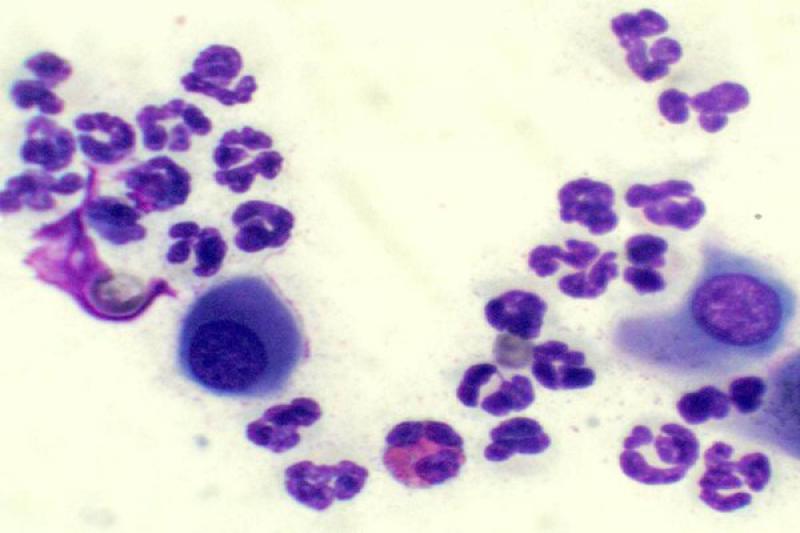
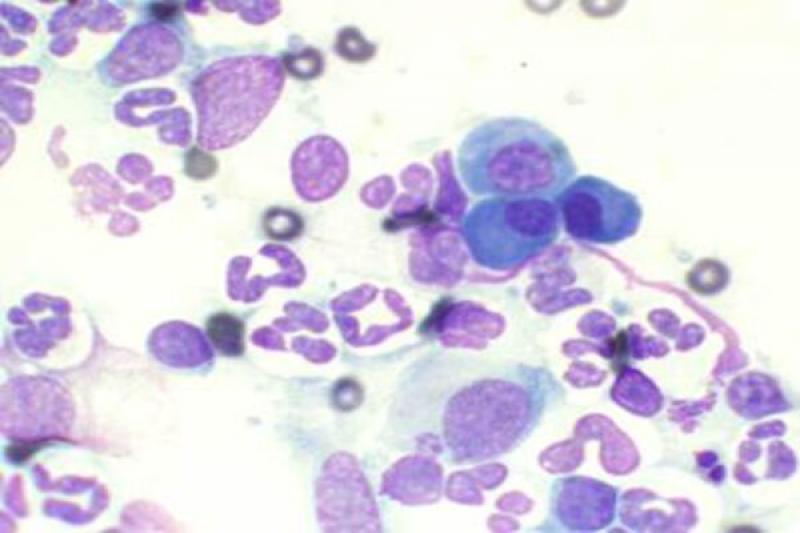
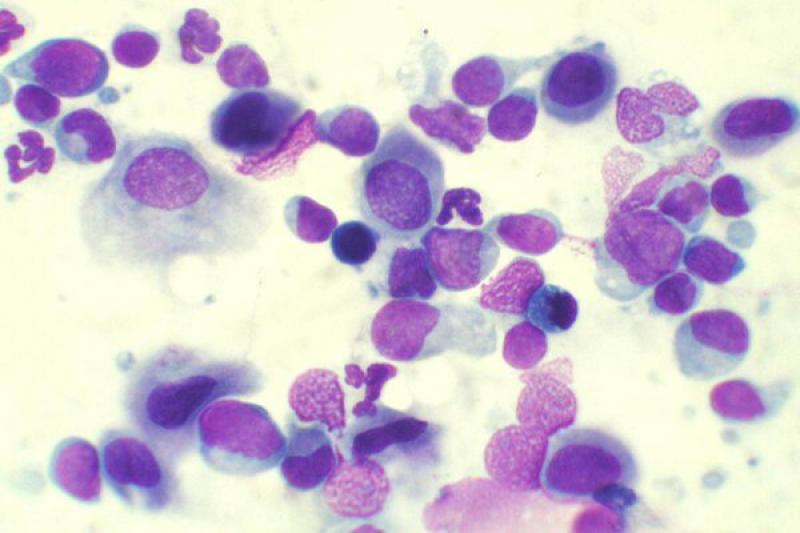
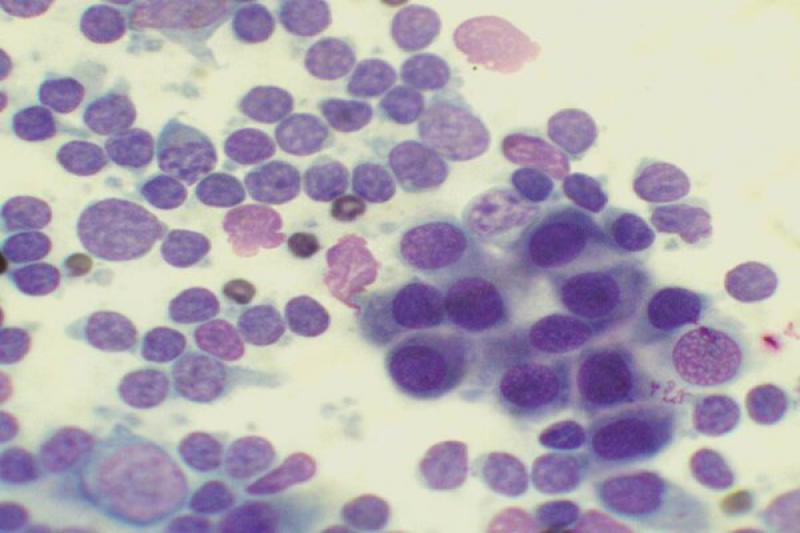
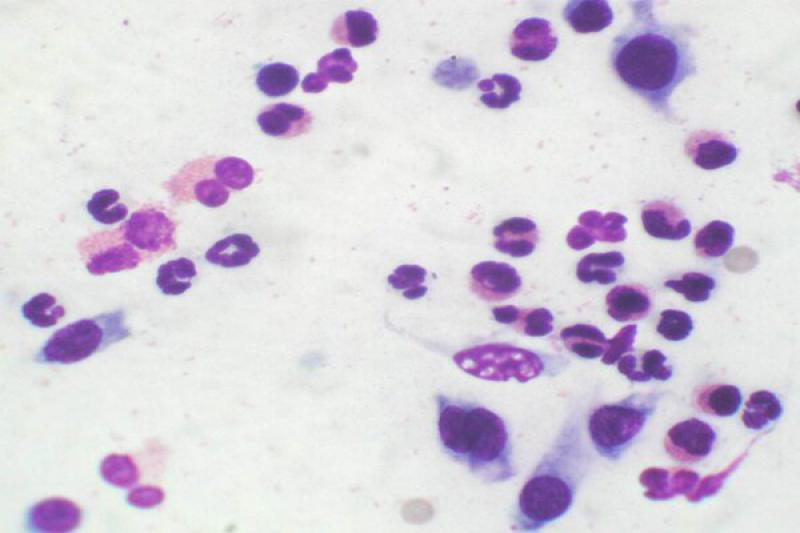
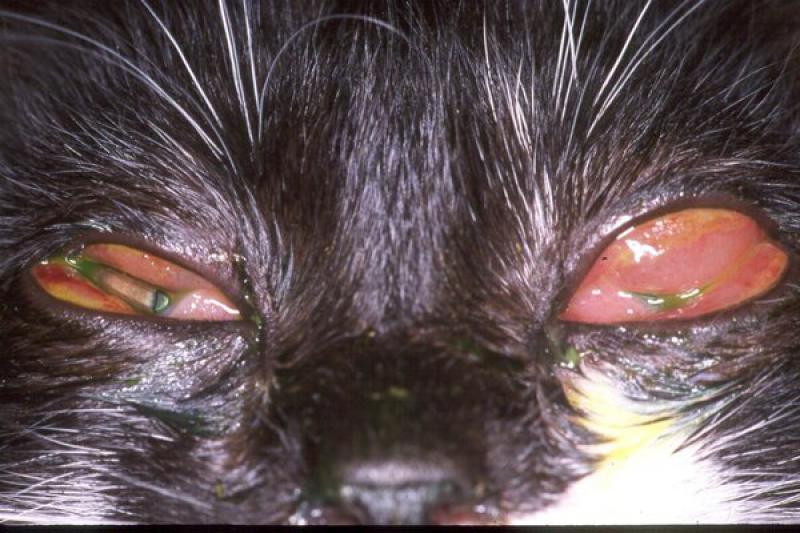
Otro tipo de conjuntivitis es aquella que cuenta con la presencia de eosinófilos y mastocitos en el estudio citológico. Las conjuntivitis eosinofílicas se pueden encontrar en perros y gatos, apareciendo en estos últimos asociados a la queratitis eosinofílica. Pueden aparecer también en el frotis mastocitos, así como gránulos de eosinófilos. En algunos gatos esta enfermedad puede estar asociada a FHV-1.
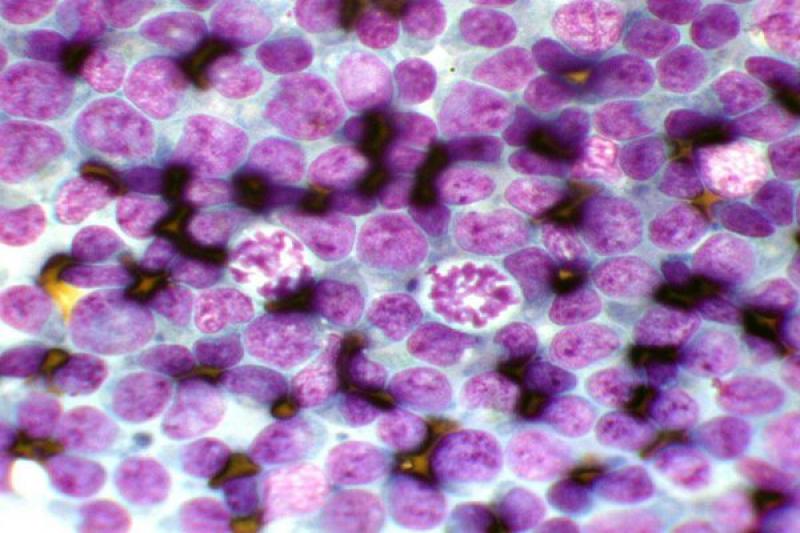
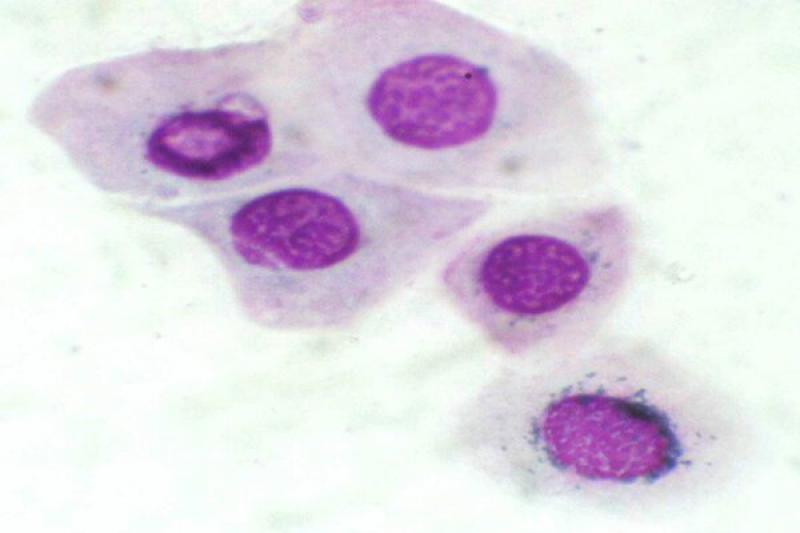
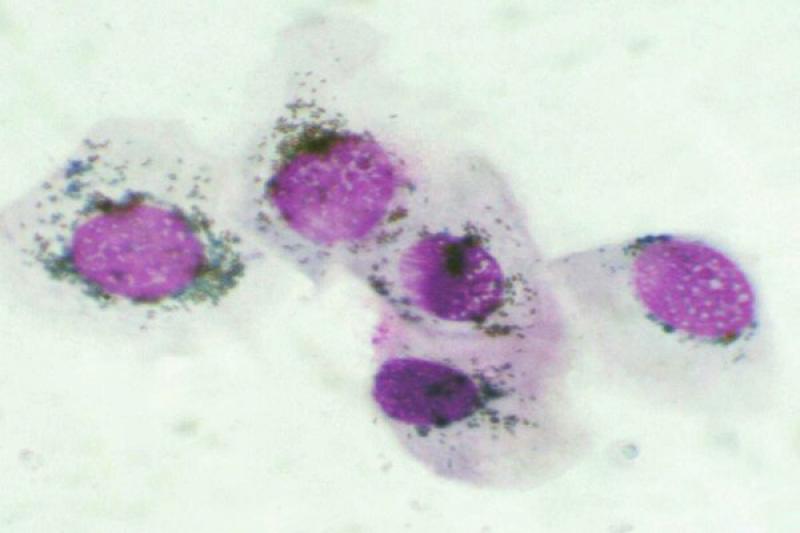
En la conjuntiva se pueden encontrar también lesiones no inflamatorias. Ciertas neoplasias como el carcinoma de células escamosas, adenoma/adenocarcinoma y el linfoma conjuntival, pueden ser diagnosticados mediante un raspado conjuntival.
Córnea
El examen citológico es útil para caracterizar las lesiones exudativas y puede ayudar en la diferenciación de ciertas lesiones proliferativas.Las muestras para citología corneal se obtienen principalmente mediante una espátula de Kimura o la parte roma de una hoja de bisturí, previa instilación de un anestésico tópico.
Si la lesión es muy pequeña o focal, se puede obtener mediante una aguja hipodérmica. Es muy importante ser extremadamente cuidadosos en la toma de muestras de córnea, ya que en determinadas queratitis existe riesgo de perforación.
También podemos obtener muestras mediante citología por impresión, con un papel Millipore® que se apoya directamente en la superficie corneal o conjuntival y quedan adheridas las células que se exfolian. El epitelio anterior es la capa más externa de la córnea. Es un epitelio plano, estratificado y no queratinizado.
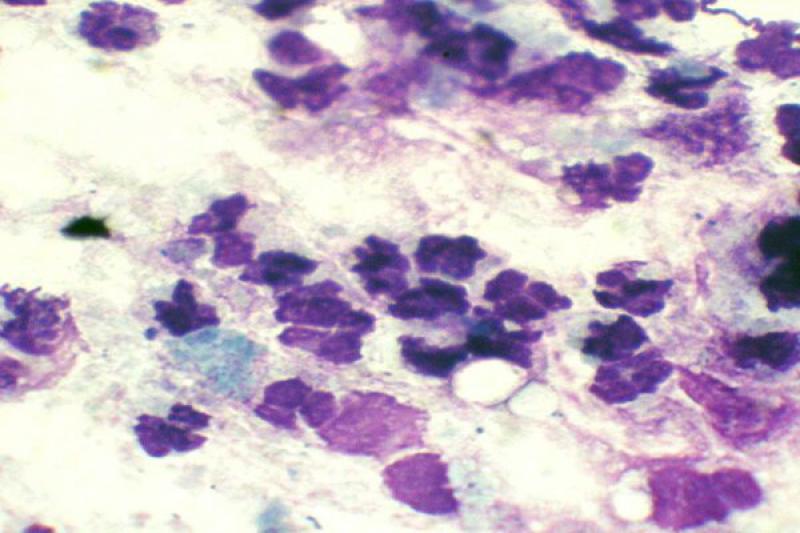
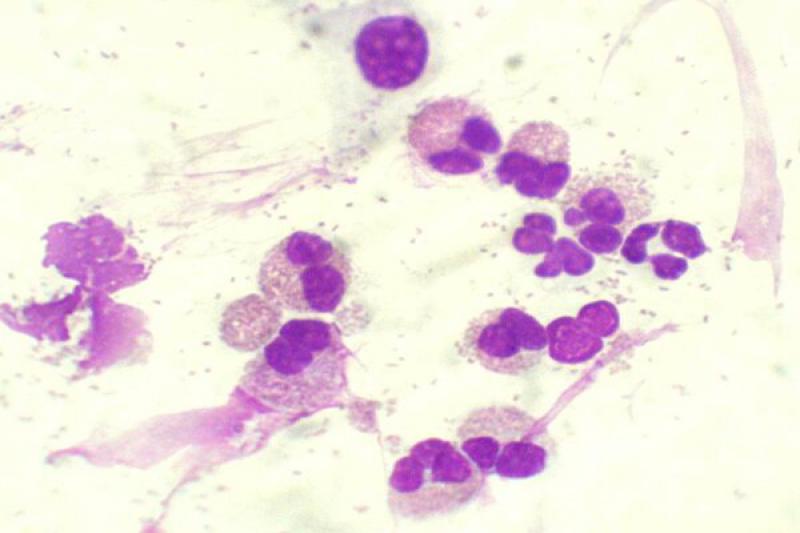
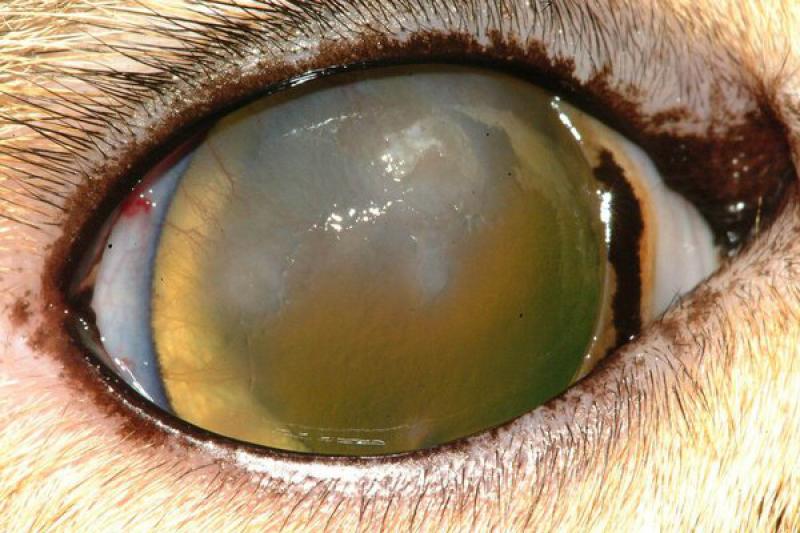
En úlceras corneales complicadas se puede realizar una citología para la búsqueda de bacterias u hongos. Muchas veces se acompaña de un cultivo. Las muestras deben tomarse de las zonas en las que hay infiltrado celular, ya que suelen ser en las que se observan estos microorganismos.
La presencia de bacilos puede sugerir que la úlcera está complicada con Pseudomonas Aureuginosa, bacteria que puede producir procesos de queratomalacia. La queratitis fúngica no es frecuente en el perro y el gato, pero, cuando está presente, los raspados pueden poner de manifiesto hifas de Aspergillus.
En la queratitis eosinofílica felina, el examen citológico suele ser diagnóstico. Aparece una lesión vascular elevada, generalmente no ulcerada, y con pequeños focos blanco-grisáceos en la superficie. El examen citológico muestra principalmente eosinófilos en mayor cantidad, observándose en ocasiones mastocitos, linfocitos y células plasmáticas.
El examen citológico en la queratitis superficial crónica pone de manifiesto la presencia de linfocitos, células plasmáticas, macrófagos y neutrófilos.
Los tumores corneales son poco frecuentes. Los que se presentan en más ocasiones en el perro son el carcinoma de células escamosas y el papiloma, seguidos del hemangiosarcoma/hemangioma. Es más recomendable PAAF o biopsia que impronta de las lesiones.
Párpados
Las blefaritis pueden tener diversos orígenes (bacteriana, parasitaria, alérgica, micótica, inmunomediada, endocrina, de origen neoplásico…), pudiéndose realizar distintos métodos de exploración complementarios para su caracterización (improntas, raspados, biopsias, citologías por punción con aguja fina…).
Los tumores palpebrales son más frecuentes en la especie canina que en la especie felina. En el perro el tumor que podemos encontrar en más ocasiones es el adenoma de las glándulas de Meibomio o glándulas tarsales.
En segundo lugar, los más frecuentes son los melanocitomas y los papilomas. Entre los tumores malignos se encuentran melanomas malignos y adenocarcinomas. Con menos frecuencia aparecen carcinomas de células escamosas, hemangiosarcomas y mioblastomas.
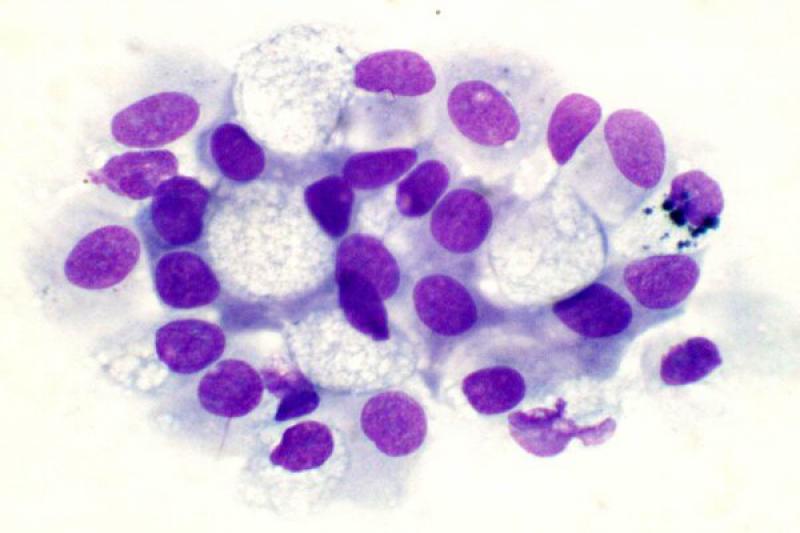
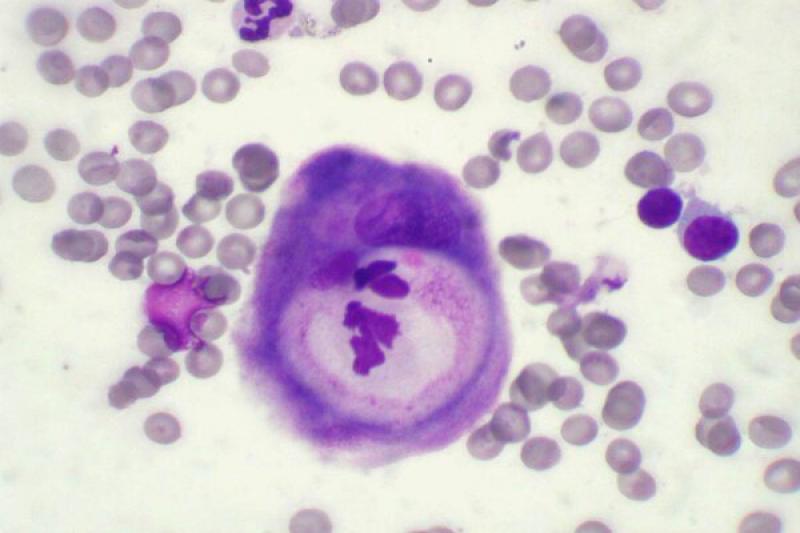
Son invasivos localmente y no suelen metastatizar. En la región periocular se pueden encontrar, entre otros, mastocitomas e histiocitomas. El mastocitoma se caracteriza por la presencia de una población monomórfica de células redondas con gránulos púrpura intracitoplasmáticos, gránulos en el fondo de la preparación y, normalemente la presencia de eosinófilos.
Los mastocitomas bien diferenciados presentan células con abundantes granulaciones y los tumores más anaplásicos presentan células con escaso número de granulaciones. Los histiocitomas son característicos de perros jóvenes. A nivel histológico, se distingue por la proliferación de células redondas monomórficas dispuestas en forma de hojas o cordones, las cuales poseen un escaso soporte de tejido conectivo.
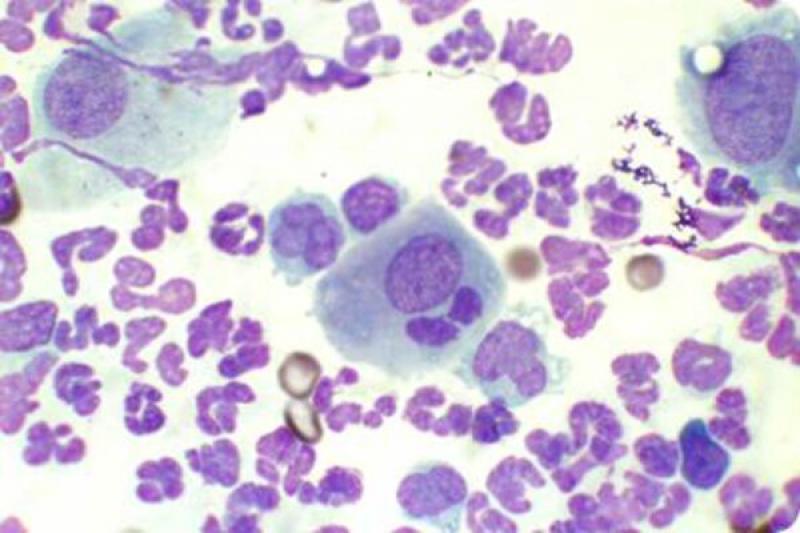
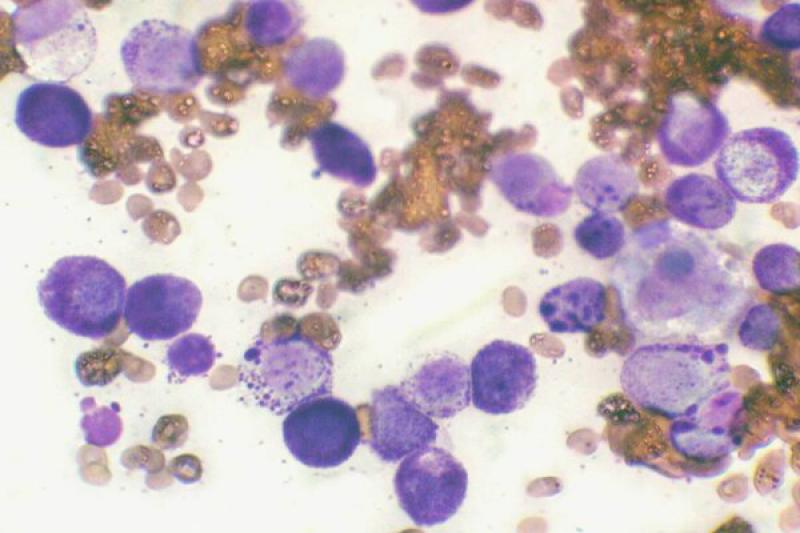
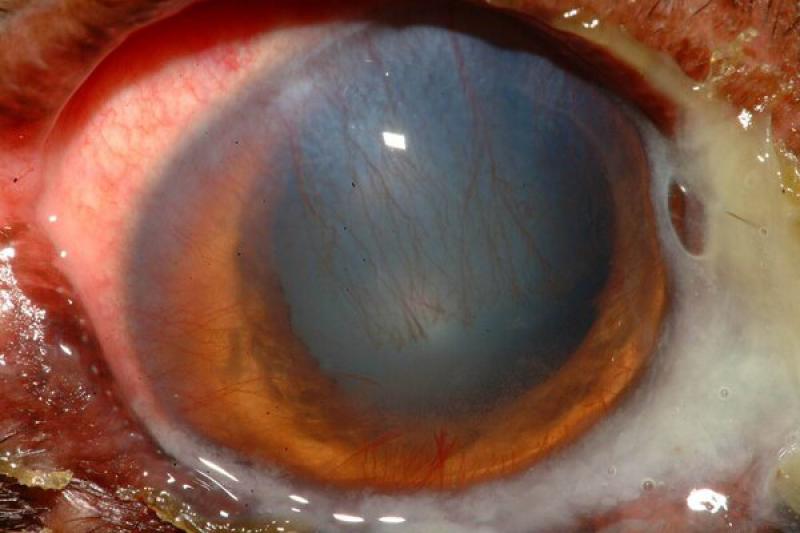
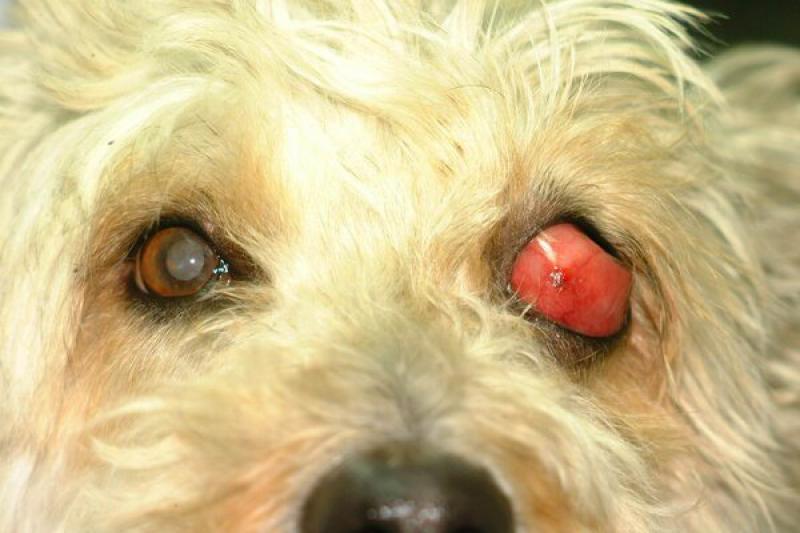
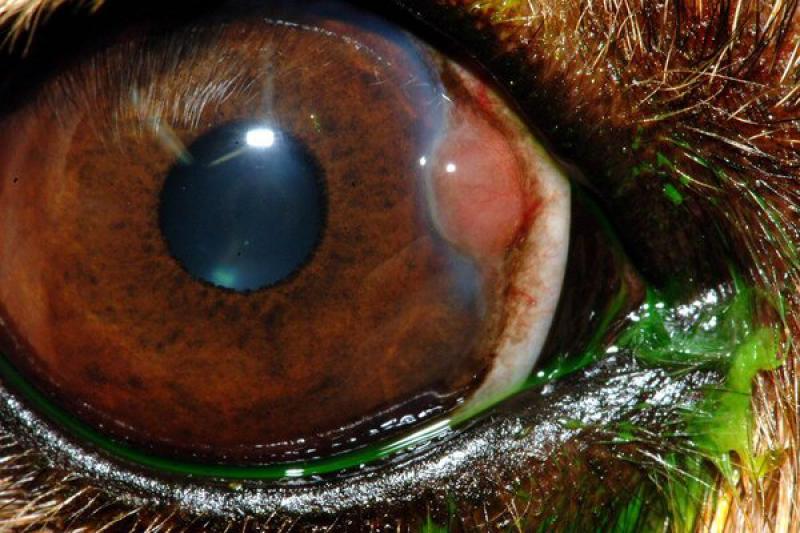
Las lesiones oculares ocasionadas por la leishmaniosis canina afectan a todas las estructuras oculares, con predisposición por el segmento anterior y por los anexos. El clínico puede encontrar signos característicos como granulomas palpebrales o córneo conjuntivales, alopecias y lesiones ulcerativas de los párpados.
Dadas las características de localización, en el limbo esclero-corneal, preferentemente en canto externo e interno, la consistencia y bilateralidad, la mayor parte de los autores coinciden en dar un carácter patognomónico a esta lesión. De igual forma, los granulomas pueden localizarse en la cara externa de la membrana nictitante y particularmente en su borde libre.
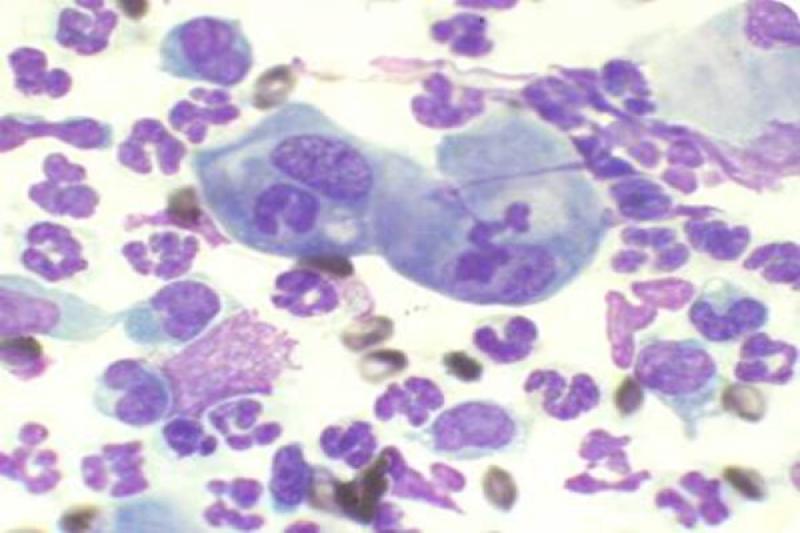
Histológicamente se caracterizan por la infiltración de células mononucleares (linfocitos, células plasmáticas y mácrofagos con abundante concentración de parásitos intra y extracelulares), que se localizan en posición perivascular y subepitelial.
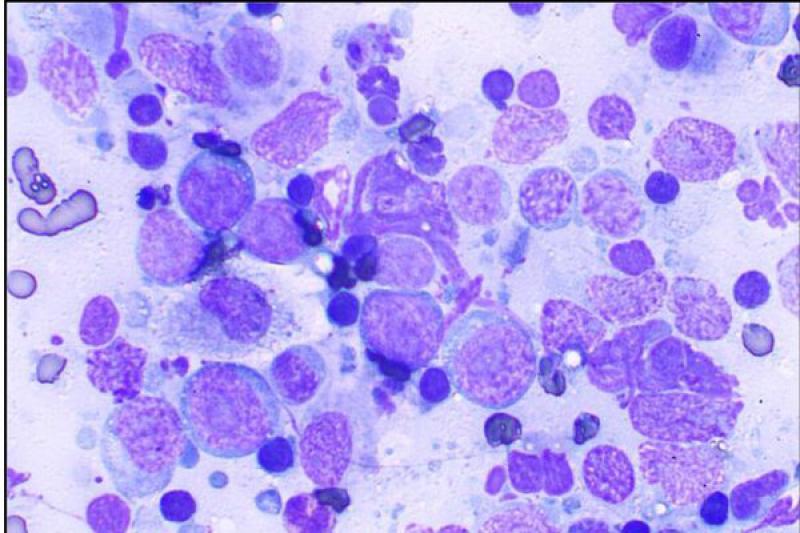
En los gatos, los tumores palpebrales suelen ser de carácter maligno y muy invasivos localmente. El más frecuente es el carcinoma de células escamosas (CCE). En la citología nos encontraremos con una población celular formada por epitelio escamoso inmaduro o displásico, pero se observan todas las fases de maduración (maduración asincrónica). Muchas veces se acompaña de inflamación purulenta.
Puede haber presencia de células en forma de renacuajo, las cuales presentan una proyección en forma de cola citoplasmática y un citoplasma azul-hialino. Las células pueden presentarse como células individuales o sábanas de células adheridas.
En los CCE bien diferenciados, predominan las células escamosas nucleadas, muy queratinizadas y con bordes angulares. Cuando estas células se colocan de manera concéntrica, se corresponden con la imagen histológica de perlas de queratina.
Los moderadamente diferenciados presentan pocas células angulares (poligonales) y más de un 50% de células displásicas redondas u ovaladas. En los pobremente diferenciados, predominan las células individuales, redondas, con un índice núcleo citoplasma elevado, a parte de un elevado pleomorfismo celular y nuclear.
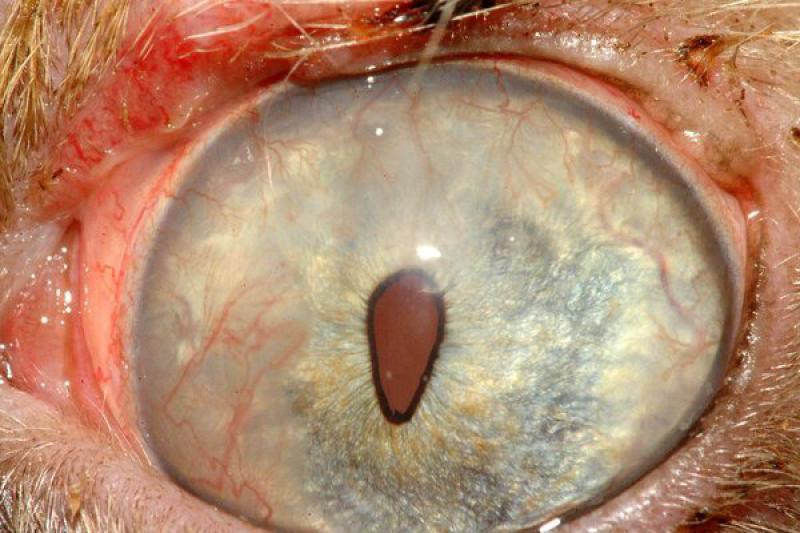
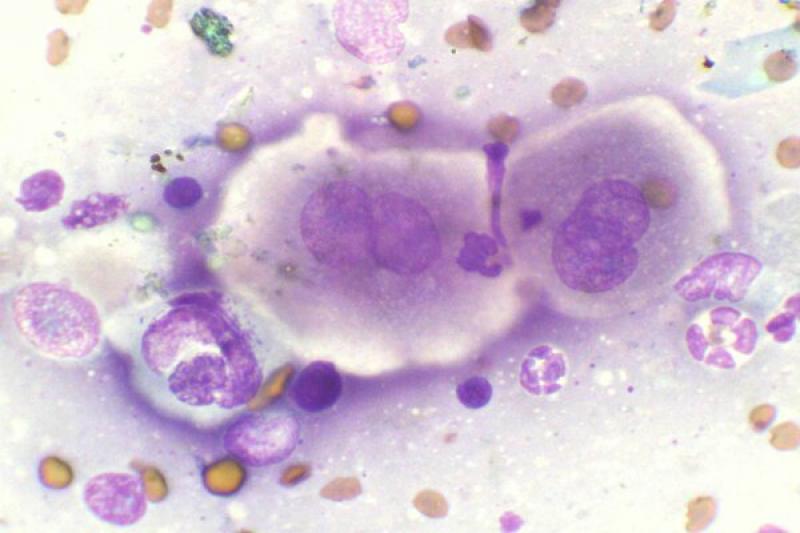
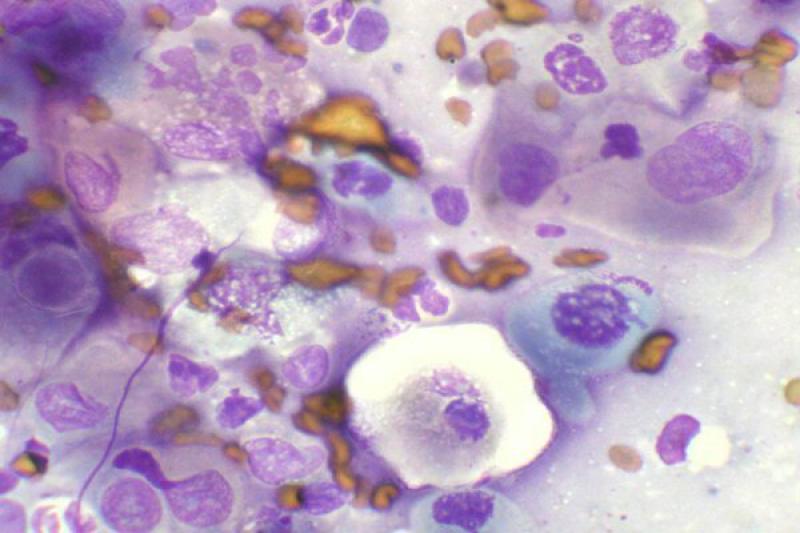
Humor acuoso
El aspirado de humor acuoso o acuocentesis puede estar indicado en el caso de ciertas uveítis, para obtener un diagnóstico específico, así como para determinar la presencia de ciertos tumores que exfolian sus células. Se realiza entrando en cámara anterior a través del limbo esclero-corneal o de córnea clara cerca del limbo, con una aguja de 25-30 G.
La aguja debe entrar paralela al iris. Se extrae 0,1 ml de humor acuoso habitualmente, pudiendo aspirarse hasta 0,7 ml en el perro y 0,6 ml en el gato (reemplazando el volumen por Ringer Lactato o una solución balanceada fisiológica).
Ante la presencia de un nódulo en el iris, se puede llevar a cabo aspiración con aguja fina del mismo, bajo anestesia general.
Ambas centesis (acuocentesis y vitreocentesis) se realizan en condiciones de asepsia, tras lavar con una solución de betadine diluido (5%) e instilación de anestésico tópico.
El estudio del humor acuoso puede estar indicado en diversos procesos de carácter infeccioso, inflamatorio o neoplásico. El linfoma es un tipo de neoplasia que puede diagnosticarse mediante el aspirado de humor acuoso, ya que se produce exfoliación de células linfoides a dicho humor.
Es característico un infiltrado neutrofílico en el humor acuoso en cuadros de uveítis anterior, incluidas infecciones víricas, pudiendo encontrar también linfocitos y monocitos, pero en baja proporción.
Ante la presencia una masa en la úvea anterior está indicado el estudio citológico mediante PAAF. El melanoma es el tumor intraocular primario más frecuente.
Para su diagnóstico debemos encontrar características citológicas de malignidad, porque la melanina libre y algunos melanocitos son un componente de todos los aspirados uveales. Las células normales tienen núcleos uniformes y pequeños nucleolos uniformes, existiendo variaciones en el tamaño y forma de estos como signos de malignidad. Pueden aparecer adenomas y adenocarcinomas en el iris y cuerpo ciliar, de forma primaria o metastásica.
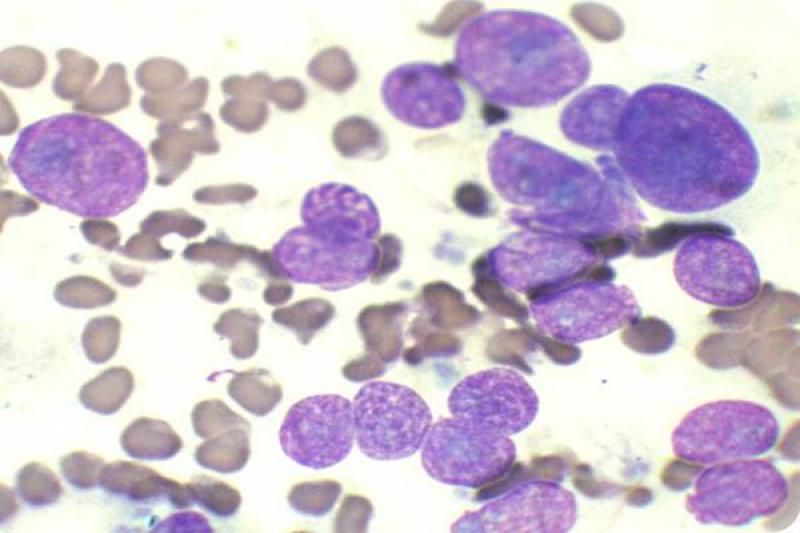
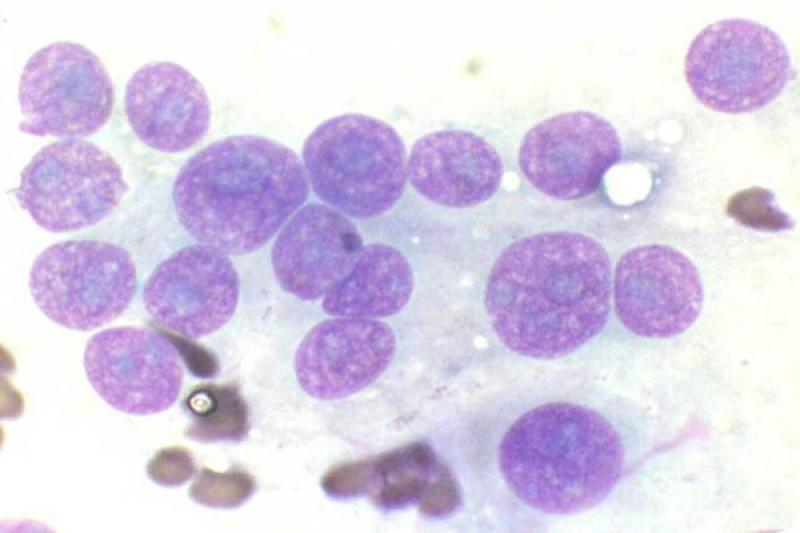
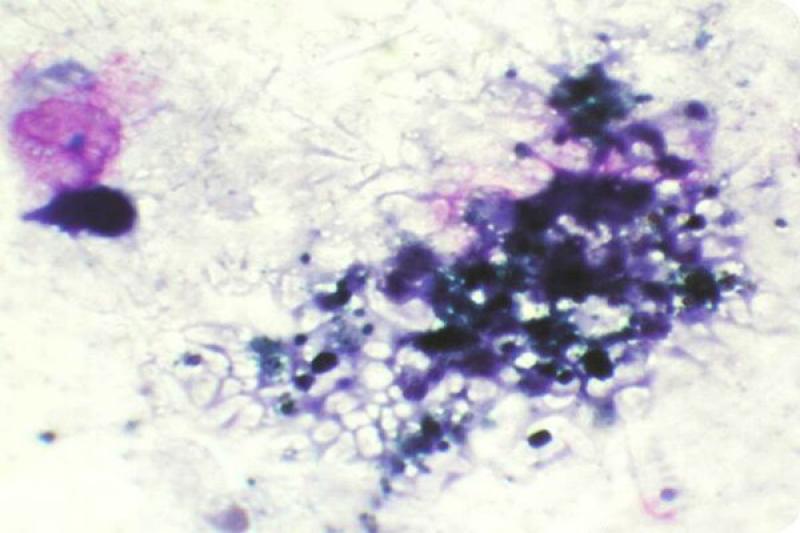
Vítreo
Se lleva a cabo vitreocentesis en el caso de endoftalmitis, así como procesos tumorales observados mediante ecografía. Se realiza bajo anestesia general, entrando por pars plana en la esclera, a 5-7 mm caudal al limbo esclero-corneal (detrás del cuerpo ciliar), con una aguja de 23-G o inferior. Se debe evitar el cristalino. Se aspiran 0,2 ml de muestra.
En condiciones normales el material del vítreo es acelular. Se pueden encontrar algunos eritrocitos y gránulos de melanina dispersos, cuya morfología en esta localización es alargada. El estudio citológico está indicado en cuadros inflamatorios y ante la sospecha de endoftalmitis, pudiendo llevar a cabo, con el material aspirado, el cultivo microbiológico del mismo.
La endoftalmitis puede ser de tipo bacteriano con presencia de un exudado purulento, de origen lenticular o traumático con un exudado neutrofílico, de origen micótico con presencia de exudado neutrofílico, así como el microorganismo en ocasiones.
Los tumores intraoculares se detectan mediante ecografía, pudiendo tomar muestras para su caracterización
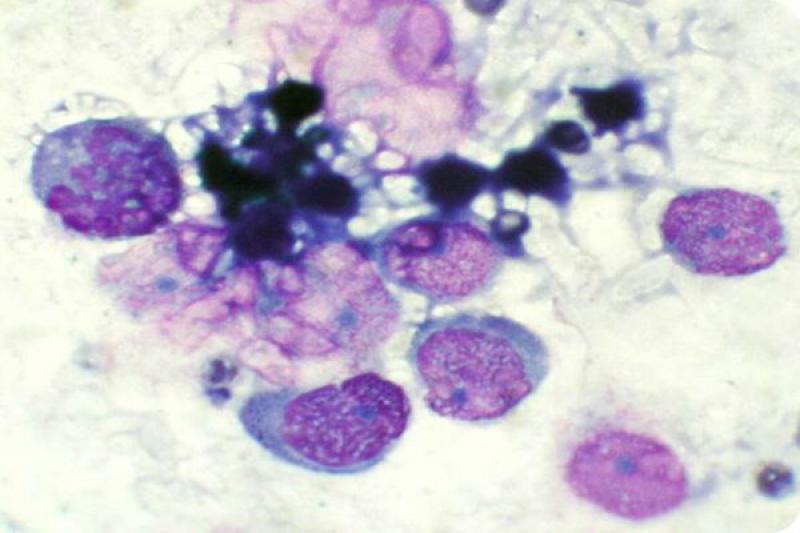
Órbita
En caso de lesiones que ocupan espacio en la órbita (abscesos, tumores…), está indicada la punción-aspiración con aguja fina (PAAF) del espacio retrobulbar. Preferentemente de manera ecoguiada, se realiza el aspirado a través de la piel, caudal al ligamento orbitario, o desde la boca, caudal al último molar. Las estructuras que se deben evitar en este procedimiento son el globo ocular, el nervio óptico y la arteria maxilar.
La muestra obtenida se extiende, haciéndola rodar, sobre un portaobjetos de manera cuidadosa para no llevar a cabo modificaciones en las células. Si es posible, se prepararán varios portaobjetos con un volumen adecuado de muestra. Es importante identificar las mismas, tanto el individuo al que pertenecen, como la localización de la lesión.
Los métodos de tinción más utilizados incluyen la tinción de Gram y varias tinciones del tipo Romanowsky (p.ej. Diff-Quick, Wright-Giemsa). Las alteraciones más frecuentes de la órbita son la celulitis orbitaria, los abscesos retrobulbares y las neoplasias.
En algunas lesiones inflamatorias de origen infeccioso, es posible identificar el microorganismo causante del proceso (libre o fagocitado por los neutrófilos y macrófagos). La citología en estos casos se caracteriza por la presencia de abundantes neutrófilos degenerados, así como fagocitos y linfocitos.
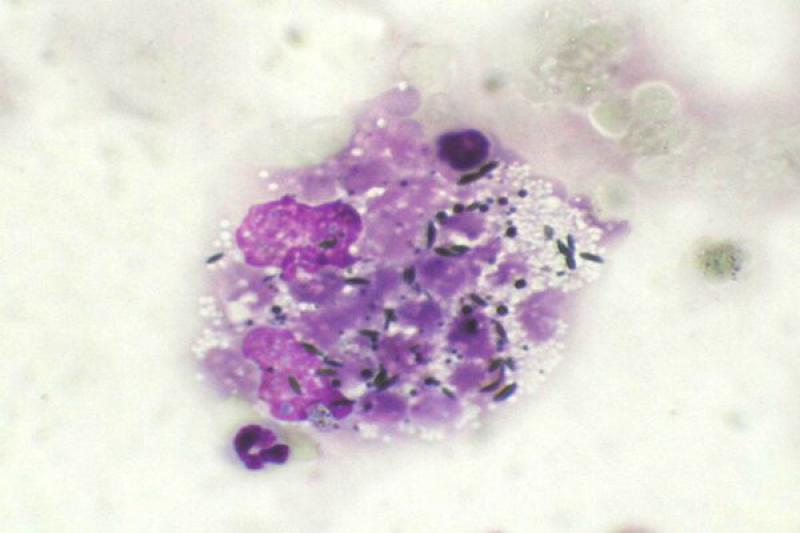
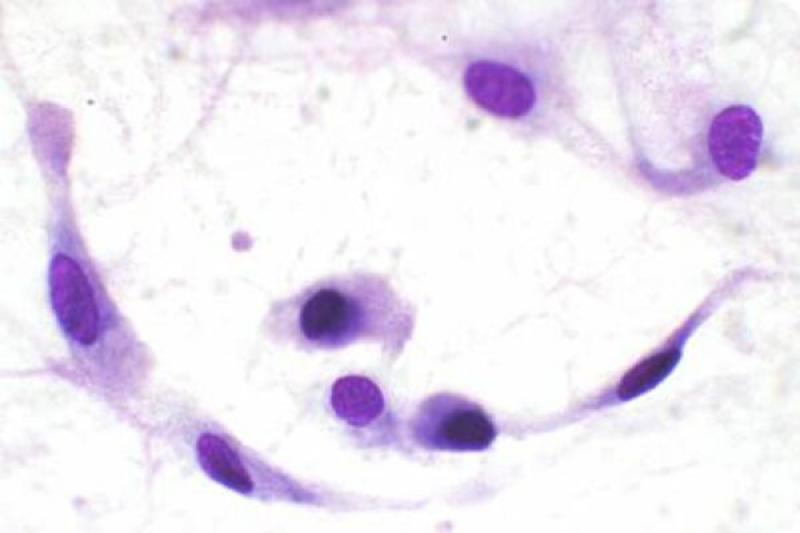
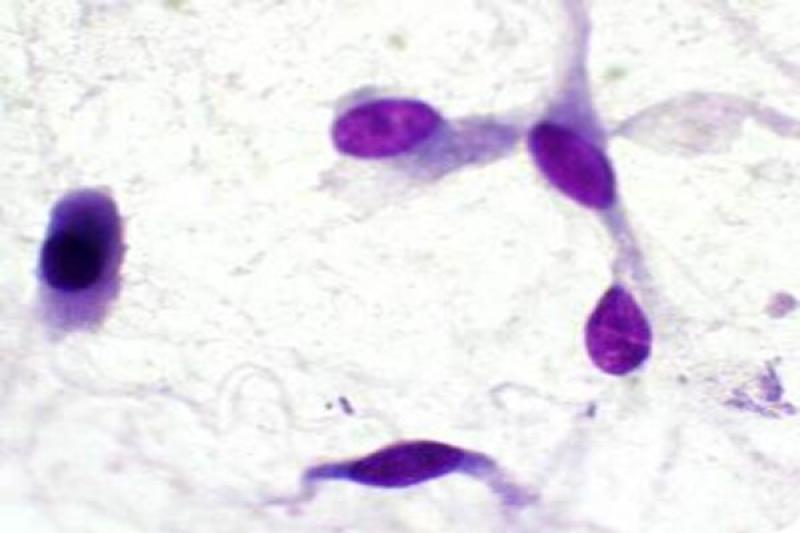
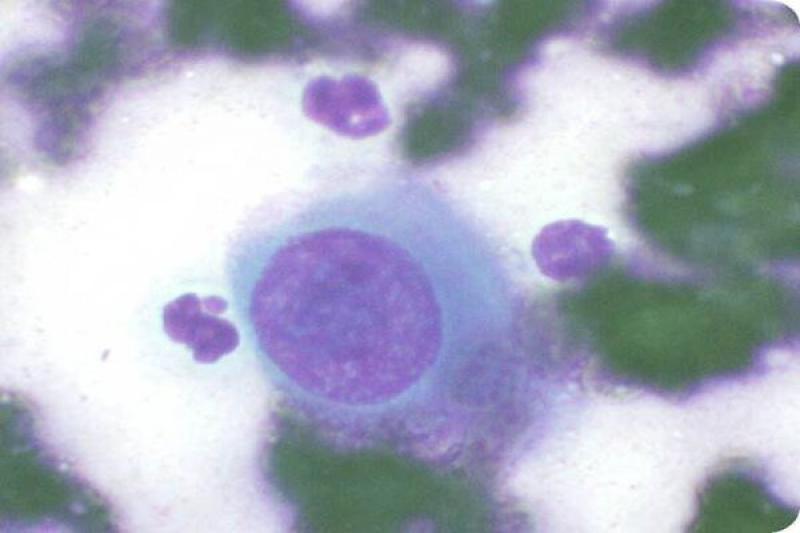
En cuanto a las neoplasias las retrobulbares, son malignas en la mayoría de los casos. Pueden ser primarias, más frecuentemente, o bien secundarias, por extensión de tumores de estructuras cercanas o por metástasis a distancia. Los tumores orbitarios pueden tener diferentes orígenes: osteosarcoma, fibrosarcoma, condrosarcoma multilobular, adenocarcinoma, meningioma, melanoma, linfoma y carcinoma de células escamosas.
Bibliografia
Agradecimientos: Se agradece a Cristina Fernández Algarra y Manuel Villagrasa Híjar la cesión de las imágenes.
- Rick L.Cowell, Ronald D.Tyler, James H. Meinkoth, Dennis B. DeNicola. Diagnostic Cytology and Hematology of the Dog and Cat. Mosby Elsevier Third Edition 2008.
- Elena M. Martínez de Merlo. Atlas de Citología Clínica del perro y del gato. Servet 2008.
- A. Gázquez Ortiz, A. Blanco Rodríguez. Tratado de Histología Veterinaria. Masson 2004.
- Keith Barnet. Diagnostic Atlas of Veterinary Ophtalmology. Mosby Elsevier. Second Edition 2006.
- Kirk N.Gelatt, Brian C. Gilger, Thomas J. Kern. Veterinary Ophtalmology. Wiley Blackwell. Fifth Edition 2013.
 by Multimédica
by Multimédica