Diagnóstico clínico laboratorial en medicina de peces
Resumen breve
En la clínica de peces hay varias técnicas laboratoriales sencillas que pueden ayudar mucho al diagnóstico. El raspado de piel es empleado fundamentalmente para la detección de ectoparásitos. La biopsia branquial aporta información sobre el estado branquial y permite diferenciar entre la gran variedad de afecciones respiratorias que pueden observarse en la clínica de peces.Índice de contenidos
Resumen
En la clínica de peces hay varias técnicas laboratoriales sencillas que pueden ayudar mucho al diagnóstico. El raspado de piel es empleado fundamentalmente para la detección de ectoparásitos. La biopsia branquial aporta información sobre el estado branquial y permite diferenciar entre la gran variedad de afecciones respiratorias que pueden observarse en la clínica de peces. La biopsia de aleta se emplea en casos de lesiones localizadas en esta zona. Las muestras de heces suelen emplearse para diagnosticar problemas del sistema digestivo como parasitosis internas. En el squash de órganos una pequeña muestra de tejido es aplastada y permite la detección de quistes, lesiones granulomatosas, congestiones locales y hemorragias difícilmente observables macroscópicamente. La toma de aspirados celómicos es empleada en casos de problemas de flotabilidad y de distensiones celómicas. Por último, la fluoresceína permite en el caso de los peces, no solo una evaluación a nivel ocular, sino de toda la integridad a nivel epidérmico.
Introducción
El campo de la medicina veterinaria de peces ha ido creciendo de manera exponencial en los últimos años y ello ha venido de la mano de un avance en las técnicas diagnósticas. Debido a la clínica inespecífica o sintomatología similar que pueden presentar las diferentes patologías en peces, es fundamental el empleo de diferentes técnicas para dar un diagnóstico lo más preciso y correcto posible. A continuación, se detallan las técnicas más empleadas en la clínica diaria de peces, en su mayoría se trata de técnicas fácilmente aplicables y de gran utilidad.
Técnicas de diagnóstico
Hay varias técnicas que pueden agruparse como “técnicas húmedas” en las que es necesario el empleo de agua para la evaluación y diagnóstico correcto. Esto es debido a que muchos agentes infecciosos son muy dependientes del medio acuático por lo que es imprescindible que las muestras se evalúen en un portaobjetos con un par de gotas de agua del acuario siempre que sea posible, o lo más similar en cuanto a características fisicoquímicas (pH, salinidad y temperatura) para evitar posibles choques osmóticos en los microorganismos presentes. Otro problema que puede estar presente a la hora de analizar estas muestras es la interferencia con agentes anestésicos disueltos en el agua para la manipulación del animal, ya que en muchas ocasiones estos medicamentos van a actuar sobre los patógenos produciendo un aletargamiento de los mismos y en algunos casos que se suelten del paciente siendo muy difícil su diagnóstico, por este motivo en caso de haber empleado cualquier anestésico disuelto en el agua se recomienda recoger el agua de muestreo del fondo (que será donde se depositen los parásitos aletargados) del recipiente donde se haya anestesiado el paciente1,2.
Raspado de piel
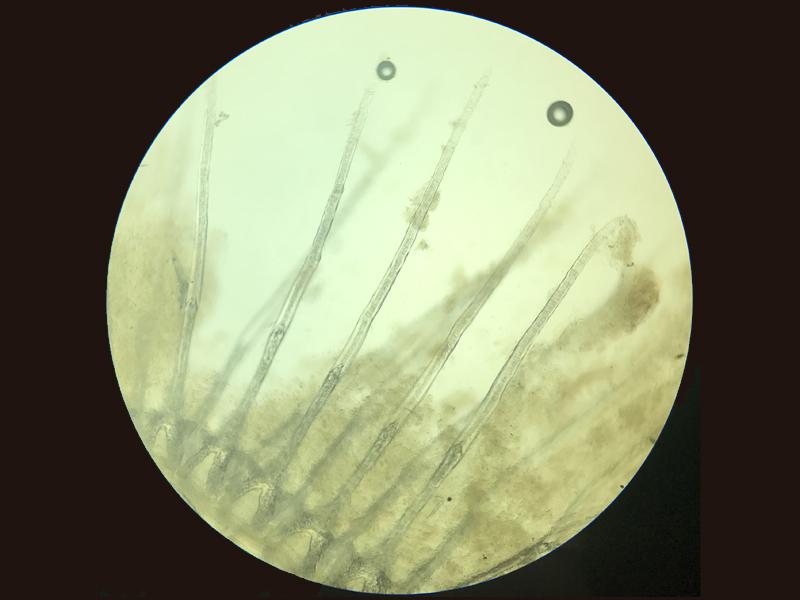
Para la obtención de muestras, se debe deslizar craneocaudalmente un cubreobjetos o la parte roma de una hoja de bisturí en las zonas a muestrear (Figura 1). Las lesiones que pueden encontrarse en la piel pueden ser: cambios de coloración, exceso de moco, erosiones, úlceras, masas o parásitos visibles. Los peces tienen una epidermis no queratinizada muy rica en células glandulares que producen un moco protector que contiene gran cantidad de inmunoglobulinas y lecitinas que actúan como primera línea de defensa frente a agentes infecciosos3. Además, este moco cumple la doble función de reducir la fricción con el agua y por tanto favorece el desplazamiento de los animales, y también sirve de barrera impermeable para mantener un equilibrio osmótico. Debido a ello es fundamental no ejercer demasiada presión en la toma de muestras de piel, porque se puede inducir una lesión ulcerativa, que puede ser fácilmente colonizada por algún patógeno oportunista y una vía de entrada o pérdida de solutos e hidratación. Por este motivo el autor prefiere el uso de cubreobjetos de cristal sobre todo las primeras veces que se realice esta técnica porque de ejercer demasiada fuerza tienden a romperse mientras que con el bisturí se podría ejercer mucha fuerza sin darse cuenta. En animales muy pequeños o cuando las lesiones se encuentran en la superficie ocular, el uso de cepillos citológicos o cepillos interdentales de púas de silicona blanda permitirá realizar una citología de la lesión o de la superficie ocular sin riesgo de crear lesiones.
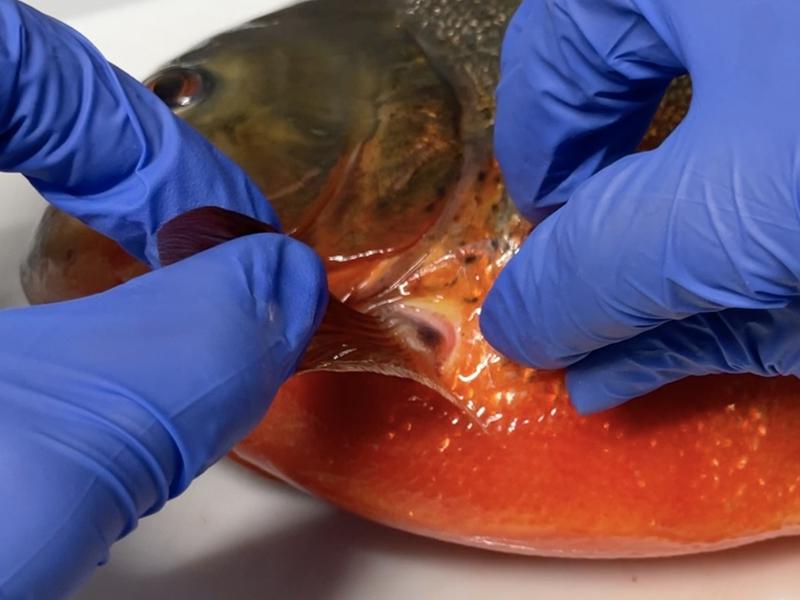
En la mayoría de las lesiones se recomienda muestrear la periferia ya que en muchos casos los agentes causales se hallarán en esta zona, siendo la zona central muchas veces colonizada por organismos oportunistas. En caso de no presentar lesiones se recomienda realizar los muestreos en las zonas con menos escamas y aquellas zonas donde haya menor fricción con el agua, como son: la parte interior de las aletas pectorales y pelvianas, y la superficie corporal protegida por ambos apéndices; la zona de inserción de la aleta dorsal y la zona perianal. Hay que tener especial cuidado al muestrear la zona perianal ya que en el caso de machos es frecuente la salida de semen que puede ser fácilmente confundible con parásitos flagelados, aunque a diferencia de estos los espermatozoides pocas veces mantienen actividad móvil durante varios minutos4.
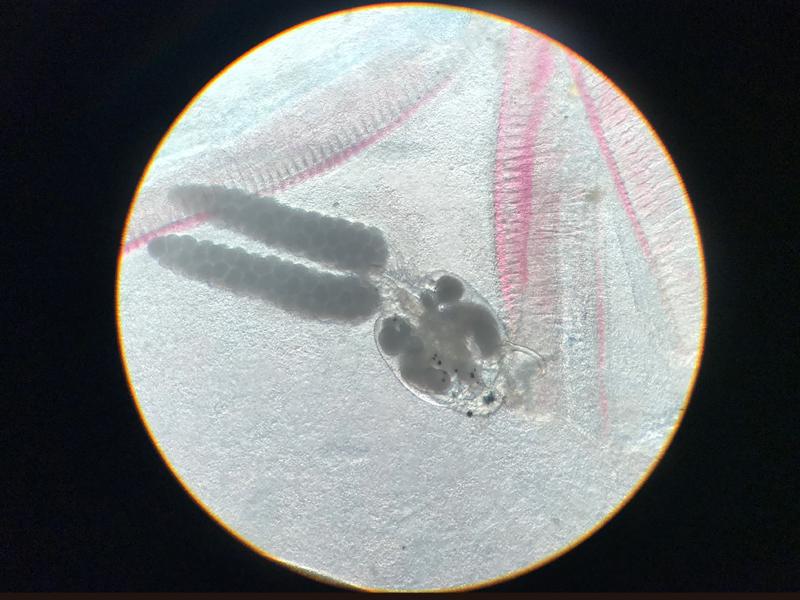
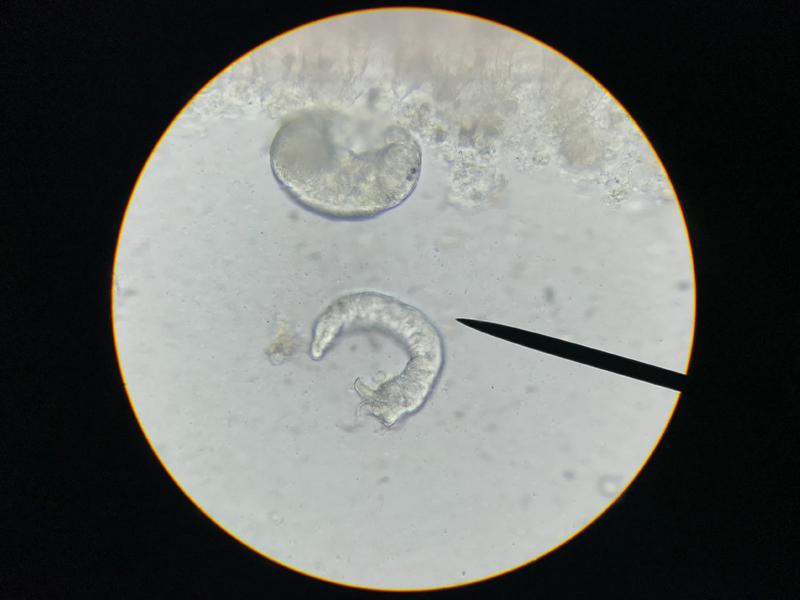
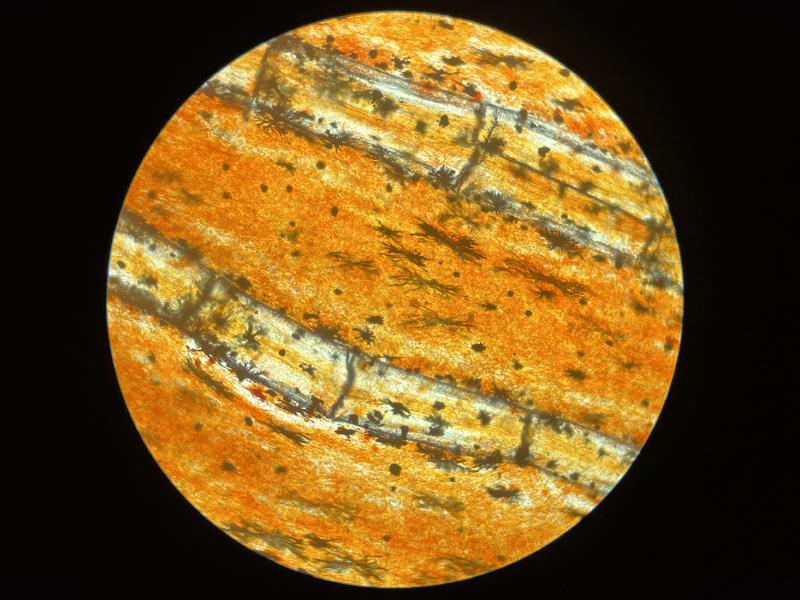
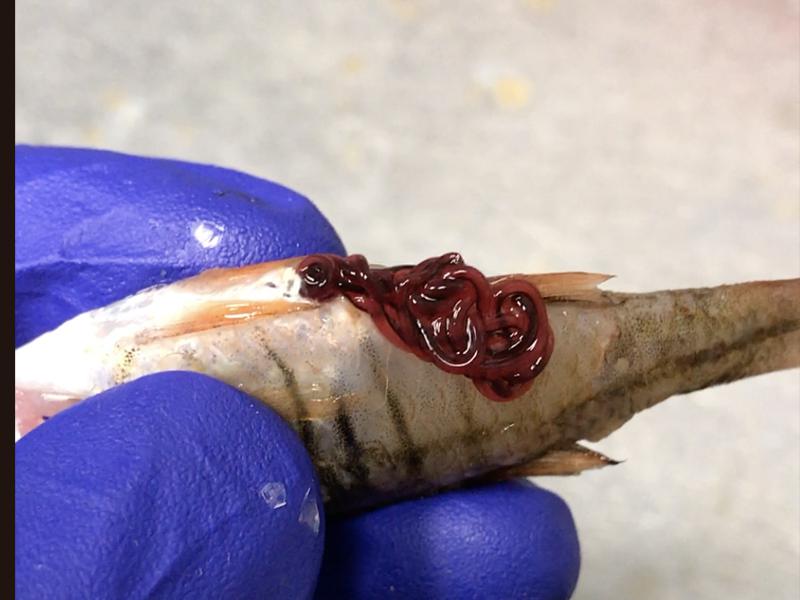
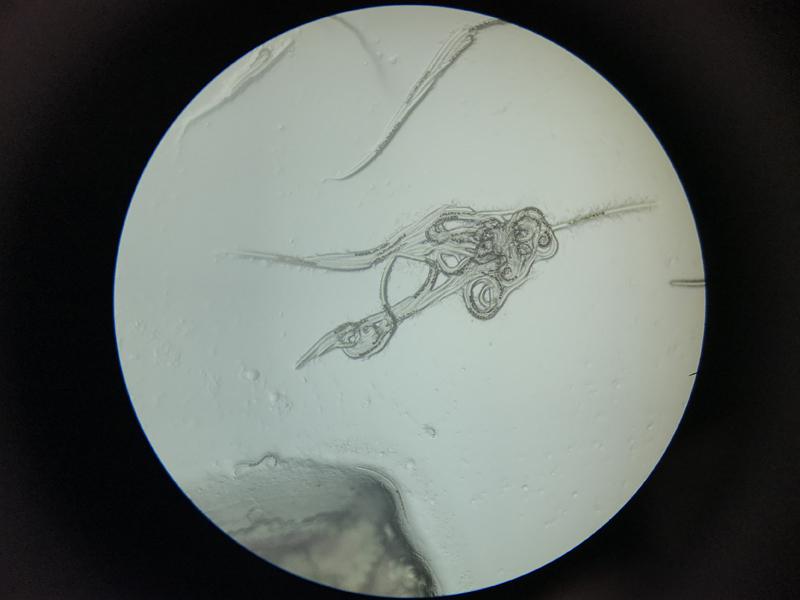
Con el raspado de piel normalmente se podrá identificar patologías de origen infeccioso, fundamentalmente ectoparásitos de diversa índole. Entre los que se pueden destacar protozoos como ciliados y flagelados, monogéneos, crustáceos y sanguijuelas (Figura 2). En caso de que los parásitos sean visibles macroscópicamente, como en el caso de sanguijuelas o copépodos y branquiuros se recomienda la retirada manual de los mismos con unas pequeñas pinzas para su evaluación, porque en muchos casos al realizar el raspado pueden romperse partes del parásito lo que dificultará la identificación. En el caso de infecciones bacterianas es muy difícil diferenciarlas salvo excepciones como el caso de Flavobacterium columnare que presenta una conformación muy característica y fácilmente identificable creciendo en formaciones columnares rizoides5. Para la mayoría serán necesarias pruebas complementarias como tinciones de las muestras y cultivos. De forma similar, se halla la misma problemática en el caso de las lesiones fúngicas excepto en aquellas con un crecimiento exuberante como las ocasionadas por Saprolegnia que tienen una apariencia algodonosa.
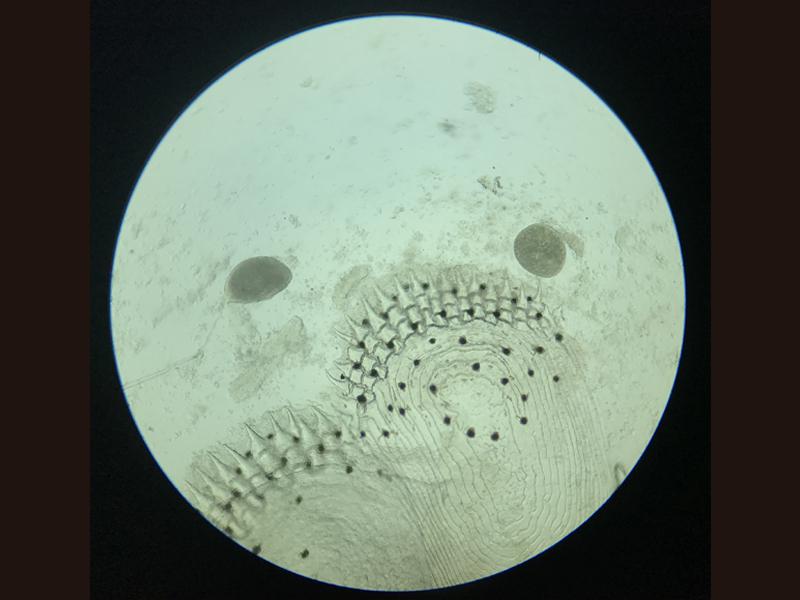
Biopsia branquial
La muestra de branquias requiere del uso de una técnica algo más agresiva, la cual se realiza evertiendo ligeramente el opérculo y cortando la punta de varios filamentos branquiales del primer arco branquial, no suele ser necesario el corte desde la base ya que en muchas ocasiones los parásitos van a encontrarse en los últimos dos tercios del filamento6 (Figura 3). Esta técnica no se debe de realizar en animales muy grandes sin hacer un clampado previo de los filamentos debido al riesgo de una hemorragia severa, en animales por encima del kilogramo de peso y con aberturas branquiales lo suficientemente grandes se puede realizar un raspado de las branquias y de ser visibles parásitos macroscópicamente que sean retirados con pinzas.
Debido al estrés que puede ocasionar el manejo durante la toma de muestras y la consiguiente vasodilatación periférica esta muestra se recomienda que se realice con el animal sedado. En animales que tienen la abertura branquial muy pequeña como son los signátidos, peces globo, anguilas y morenas la toma de muestras branquiales es prácticamente imposible por lo que se puede realizar un lavado con una pipeta, un catéter intravenoso o una sonda intranasal/uretral introducido por la cavidad oral o directamente en la abertura branquial. En los últimos años el uso de la endoscopia tanto para la toma de muestras branquiales como para la evaluación directa de las mismas ha ido creciendo, siendo útil también para hacer un seguimiento de tratamientos antiparasitarios y ver su efectividad en cuanto a la carga parasitaria.

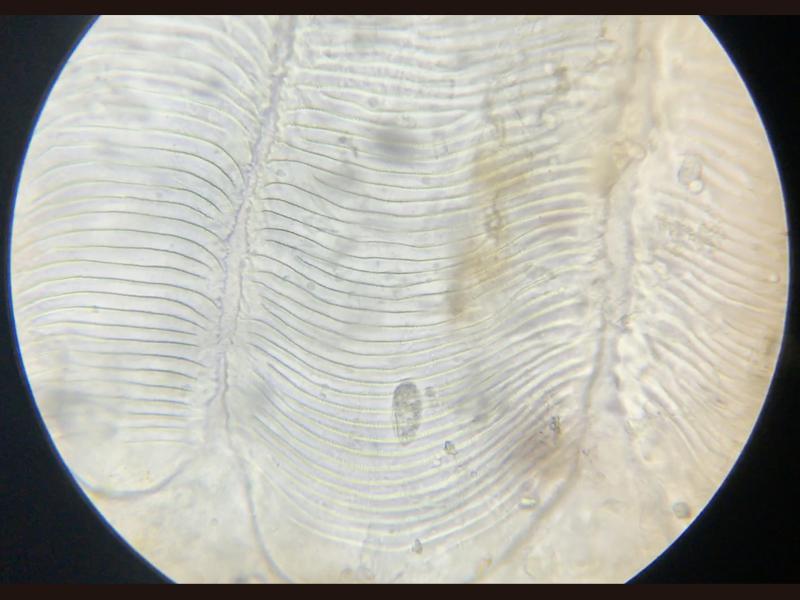
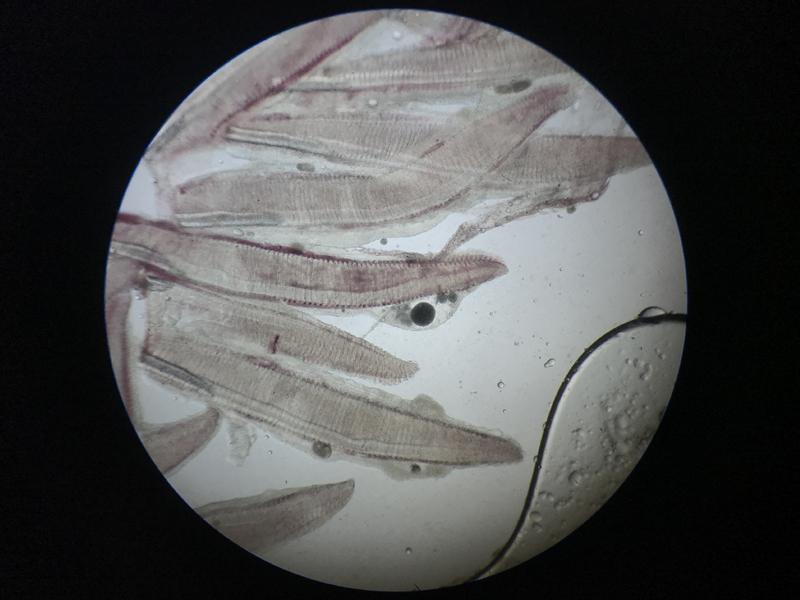
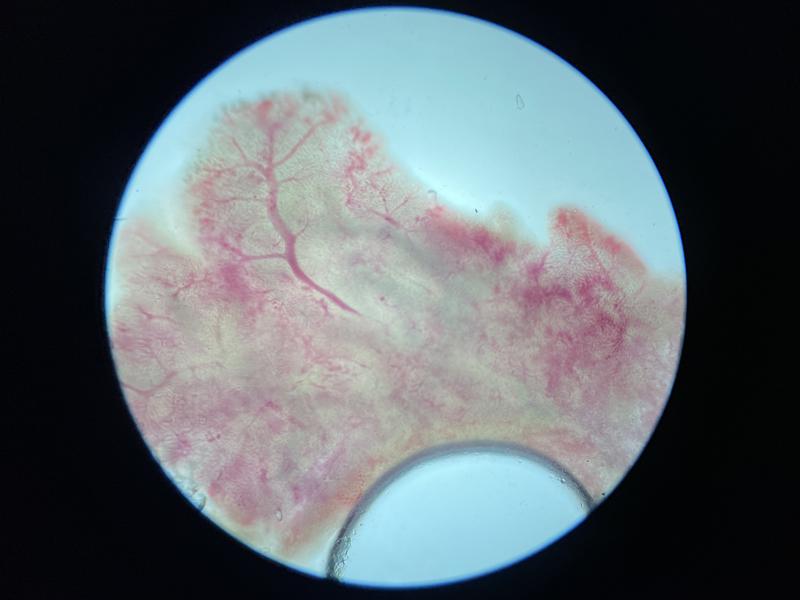
A la hora de evaluar la muestra de branquias lo primero que debe observarse es la coloración y morfología. A nivel macroscópico las branquias deben tener un color homogéneo rojo oscuro y una superficie lisa y brillante (Figura 4). A nivel microscópico esta coloración será siempre más pálida con el vaso principal lleno de sangre en uno de los lados, en algunos animales como el caso de los signátidos, es normal la presencia de melanina en las branquias.

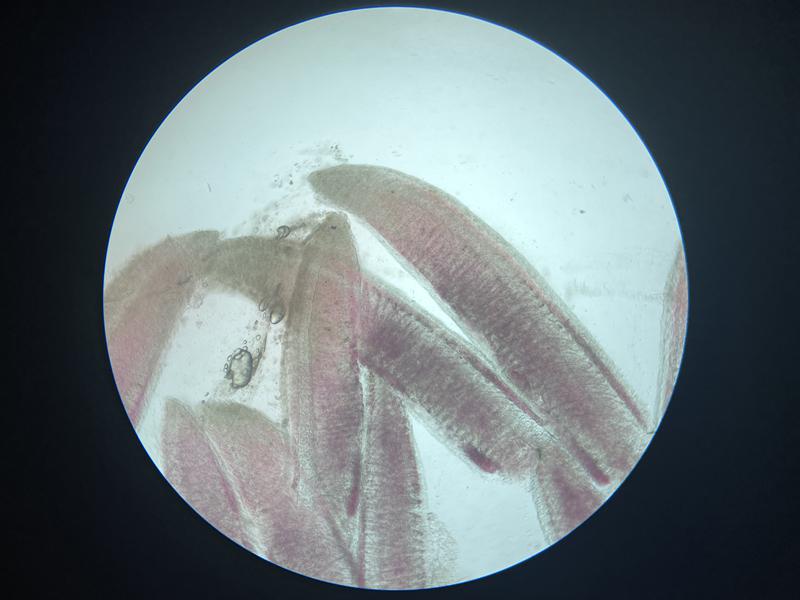
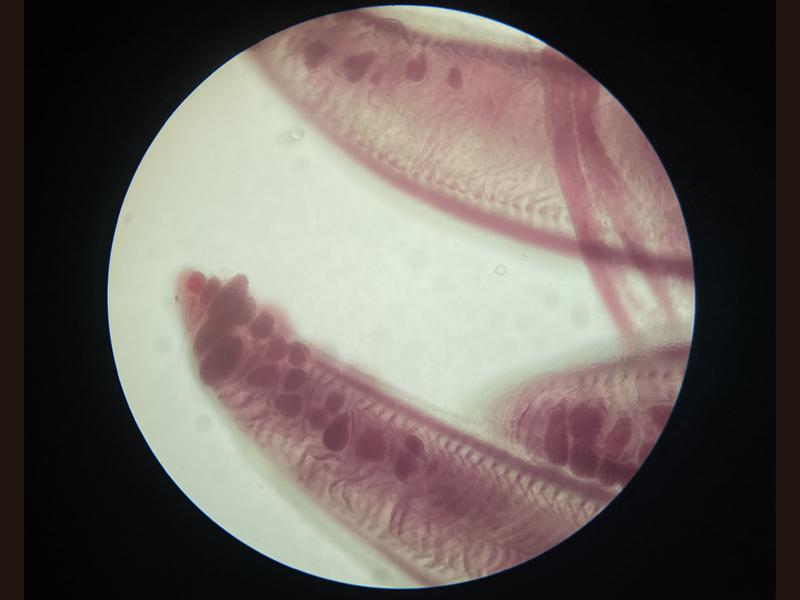
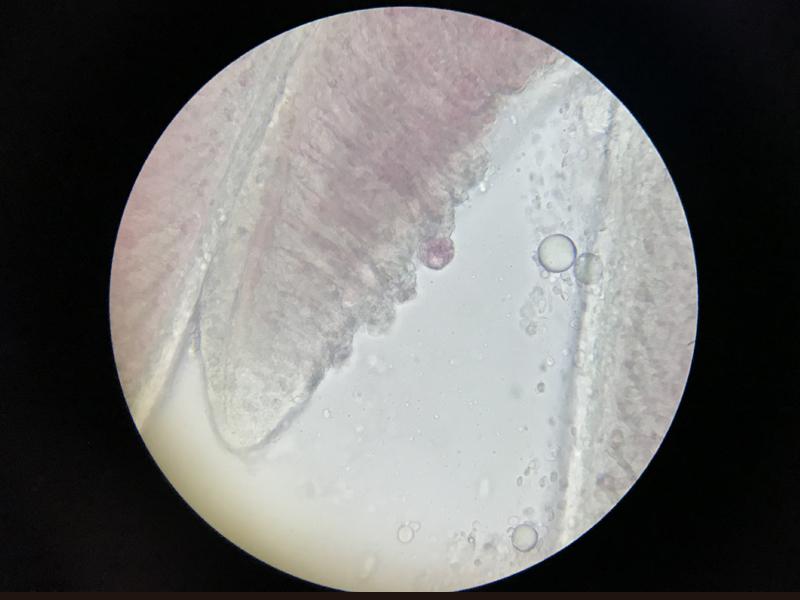
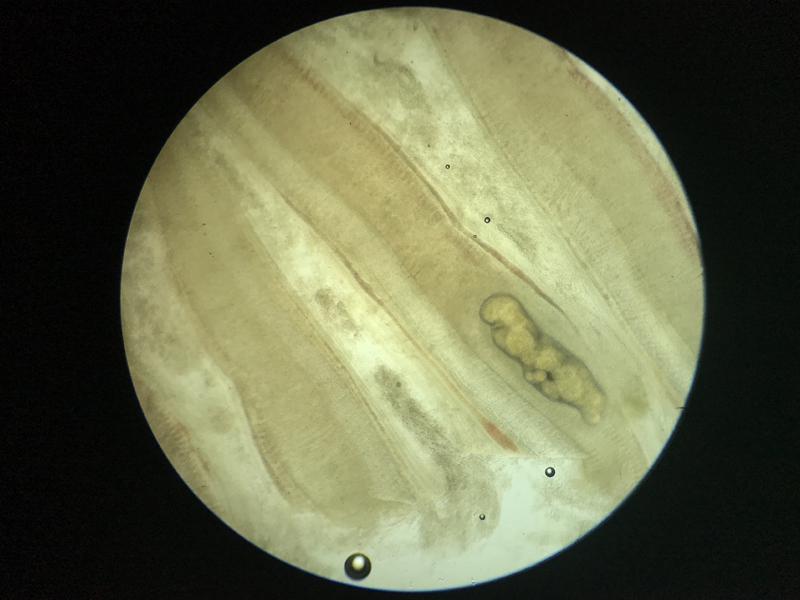
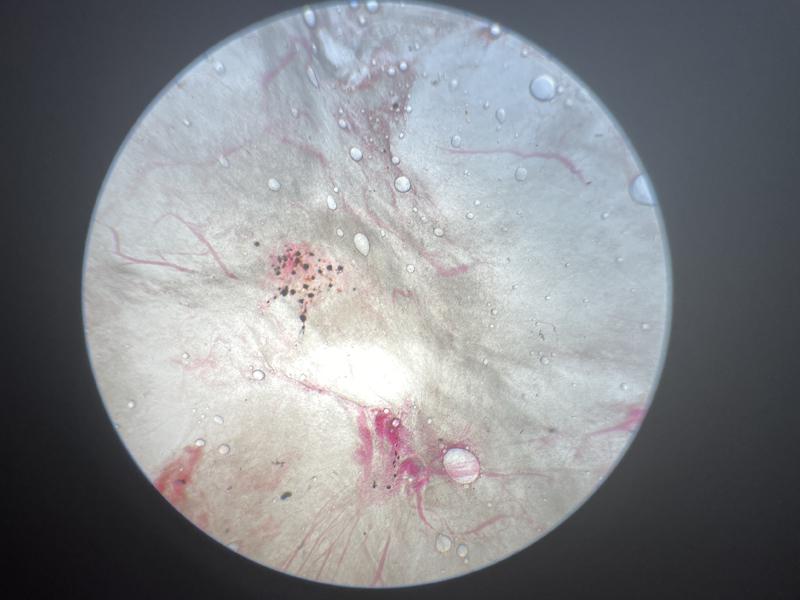
Debido a la alta incidencia de patologías a nivel branquial los cambios que pueden observarse son muy diversos. Uno de los más frecuentes es el exceso de moco, que se evidencia por la presencia de una película de color marrón alrededor de las branquias, este cambio suele producirse como defensa frente a cualquier irritante en el agua o frente a la presencia de parásitos dañando el tejido branquial (Figura 5). Los cambios de coloración suelen ir asociados a hemorragias, congestiones, anemias o cambios post mortem. Las hemorragias suelen presentarse como zonas de color rojo oscuro que a mayores aumentos presentan la liberación de gran cantidad de células sanguíneas, las hemorragias patológicas no deben de confundirse con las iatrogénicas producidas por el corte de la muestra. Las congestiones pueden ser locales o generales, con cambios de coloración evidentes hacia un rojo intenso. En el caso de las anemias lo que se suele ver es todo lo contrario, branquias muy pálidas, esta palidez no se debe confundir con la producida post mortem en el que las branquias rápidamente van a variar su color hacia el marrón, en el primer caso la estructura general se mantiene mientras que la palidez post mortem suele ir asociada a cambios estructurales. Los cambios post mortem suelen avanzar con velocidad y más si el animal no se conserva en refrigeración por lo que es fácil confundir la autolisis con necrosis de las puntas de los filamentos branquiales, en ambos casos las branquias suelen presentar una palidez marcada y la pérdida del tejido blando, siendo frecuente encontrar solo el cartílago del filamento branquial (Figura 6). Dentro de los cambios morfológicos más comunes se encuentran las telangiectasias, dilataciones de los capilares a nivel de las lamelas branquiales, microscópicamente se verán como abultamientos en los bordes, normalmente llenas de sangre (Figura 7). A nivel de los vasos sanguíneos puede encontrarse en algunas ocasiones la presencia de burbujas de aire, esta manifestación suele estar asociada a un aumento de los gases disueltos del acuario o a la presencia de microburbujas en el sistema, no se debe confundir estas burbujas con las que se forman al depositar el cubreobjetos sobre las muestras. (Figura 8). Hay otros cambios como la hiperplasia e hipertrofia branquial que se evidencian mejor en cortes histológicos, pero que de presenciarse en las muestras en fresco indican una gravedad importante. Por último, pueden verse cambios producidos por agentes infecciosos. En el caso de los parásitos muchas veces se observará su presencia directamente gracias al movimiento, aunque en ocasiones puede tratarse de formas enquistadas siendo más difícil su identificación (Figura 9). Estos quistes pueden confundirse con lesiones granulomatosas por lo que es necesario el estudio histológico en algunos casos dudosos (Figura 10).
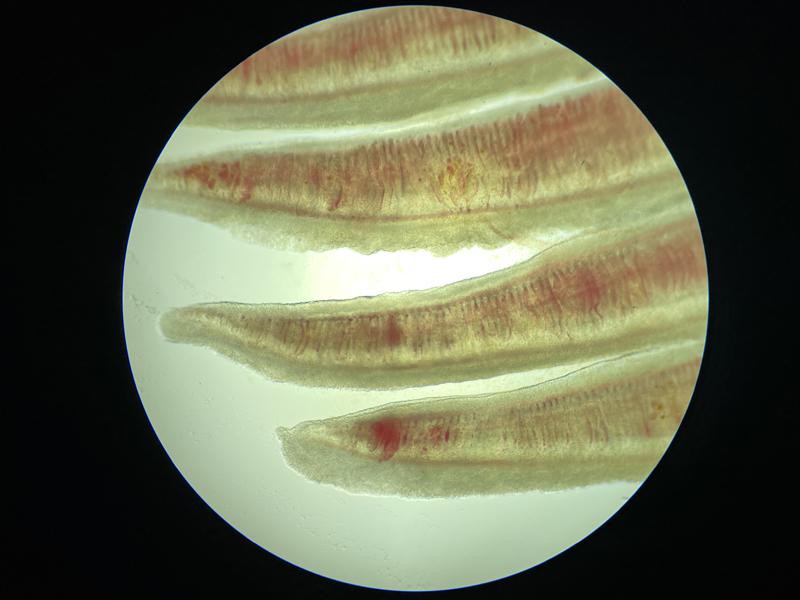


Biopsia de aletas
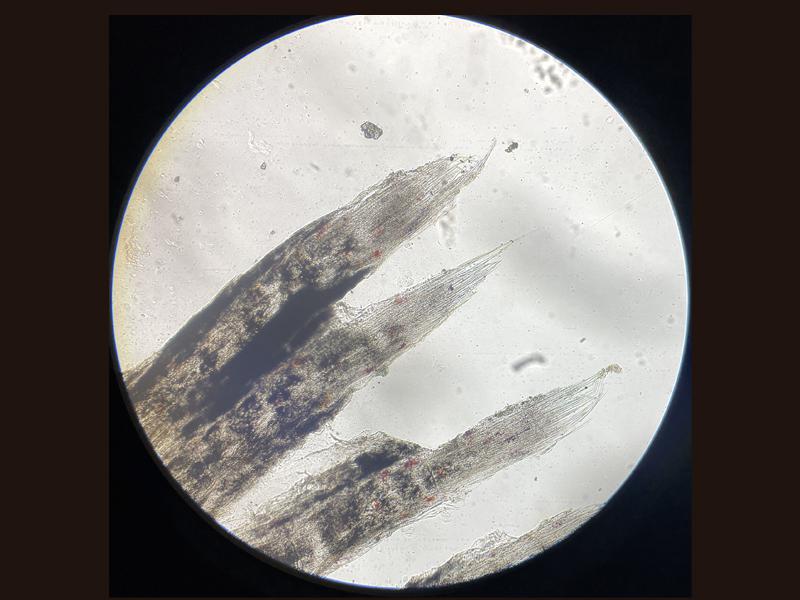
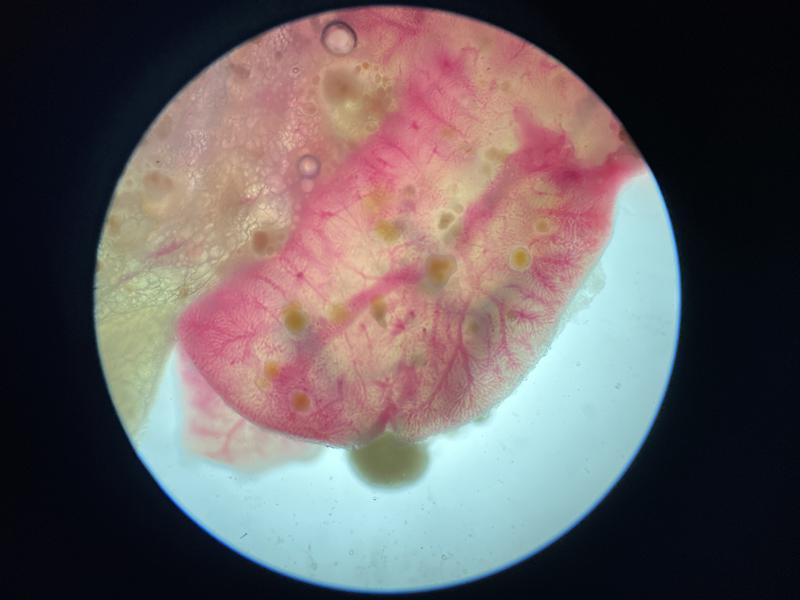
En casos concretos de lesiones a nivel de las aletas se puede realizar una biopsia de estas. Para ello se recomienda realizar un corte lo más limpio posible con unas tijeras afiladas y desinfectando bien el borde que se ha incidido (Figura 11). En caso de animales grandes no es necesario el corte de los radios espinosos pudiendo hacer un corte triangular entre ellos. A la hora de evaluar la muestra en el microscopio es importante evitar que se repliegue sobre si misma porque dificulta en gran medida la visualización (Figura 12). Una muestra normal presenta radios espinosos y una parte fibrosa entre ellos habitualmente llena de cromatóforos (Figura 13). Debido al grosor que suele tener esta muestra a veces es complicado identificar correctamente las lesiones, se recomienda evaluar el borde de las muestras donde suele ser más fino el tejido a evaluar. Entre los cambios que pueden verse en este tipo de muestras son erosiones, bordes deshilachados, ectoparásitos, lesiones granulomatosas, exceso de moco, masas y émbolos gaseosos (Figura 14).


Muestra de heces
Aunque de forma rutinaria no se realizan exámenes coprológicos como en otras especies es recomendable la toma de este tipo de muestras en animales que estén en periodos de cuarentena, hospitalizados o en los que se sospeche de alguna patología digestiva como la presencia de heces mucosas, largos filamentos a nivel de la cloaca, parásitos visibles a nivel anal, distensión celómica o anorexia (Figura 15). Las muestras de heces pueden obtenerse del fondo del tanque, aunque salvo que sean muy frescas se contaminan por organismos no patógenos rápidamente. Muchos animales tienden a defecar durante el manejo, en caso de no ser así puede realizarse una pequeña presión en la zona ventral del celoma cerca de la abertura anal para facilitar la eliminación de material fecal. Otra forma de obtener muestras de heces es haciendo un lavado rectal introduciendo una sonda rectal o catéter uretral en función del tamaño del animal previamente lubricada e introducir un poco de suero (hasta 0,5 ml/kg) para reabsorberlo con contenido fecal7. En las muestras de heces se pueden observar parásitos internos, sobrecrecimiento bacteriano o fúngico, así como material sin digerir, importante conocer el tipo de alimentación para no confundir quistes de la comida con huevos de parásitos.
Squash de tejidos
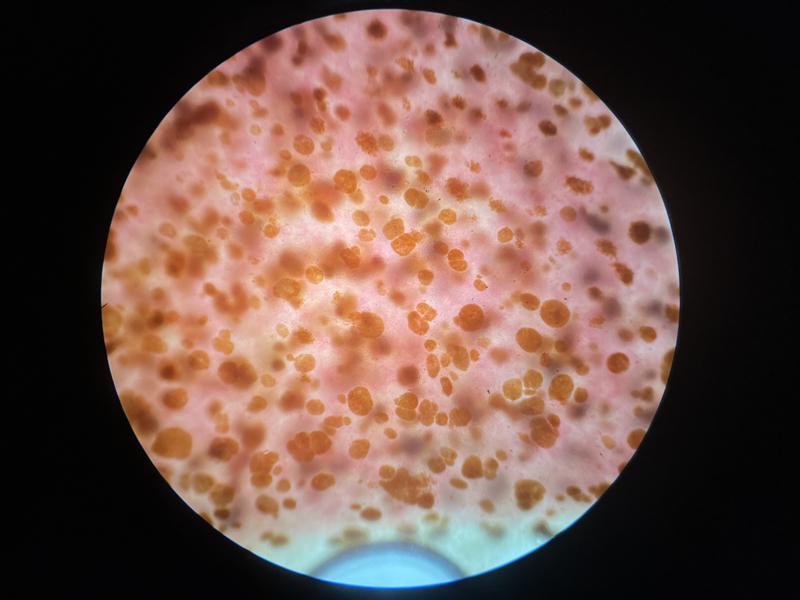
Esta técnica se puede emplear en tejidos de animales vivos, como masas o biopsias internas, pero tiene especial utilidad en el caso de tejidos de necropsias, sobre todo en aquellos animales con un tamaño muy reducido en los que los cambios macroscópicos son difícilmente identificables. Para su evaluación se toman pequeñas porciones de los órganos, que son colocados en un portaobjetos con un poco de agua y se aplastan con un cubreobjetos creando una lámina muy fina de tejido. Hay que tener cuidado a la hora de evaluar la arquitectura de muchos órganos ya que se verá notablemente alterada debido a la presión ejercida. Con esta técnica se pueden evaluar zonas de congestión, hemorragias, lesiones granulomatosas y quistes (Figura 17). Con relación a las lesiones granulomatosas es importante aprender a diferenciarlas de los centros de melanomacrófagos (CMM) o agregados de macrófagos pigmentados (AMP). Los CMM son zonas donde se puede ver gran cantidad de células pigmentadas, se trata de macrófagos con pigmentos en su interior (lipofucsina, melanina y hemosiderina), habitualmente se encuentran en los órganos hematopoyéticos como bazo, hígado y riñón; más frecuente en el caso de los teleósteos que en condrictios8,9 (Figura 18). Su presencia puede aumentar significativamente en casos de desnutrición y de inflamaciones crónicas. A diferencia de las lesiones granulomatosas tienen una coloración variable entre naranja, marrón y negro con los bordes mal definidos. Por el contrario, las lesiones granulomatosas presentan un borde bien delimitado con una coloración ambarina más clara en el centro y producen un efecto masa sobre el parénquima circundante. Es recomendable realizar citologías o improntas de estas muestras para determinar el origen de los granulomas. En el caso de los peces tiene especial relevancia el uso de la tinción de Ziehl-Neelsen por la alta prevalencia de bacterias ácido-alcohol resistentes en el agua (Figura 19).
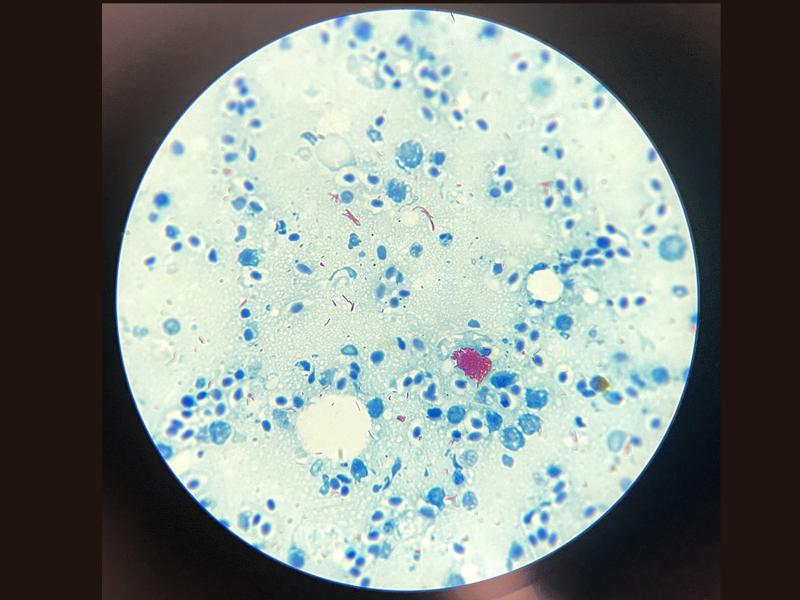
Aspirados celómicos
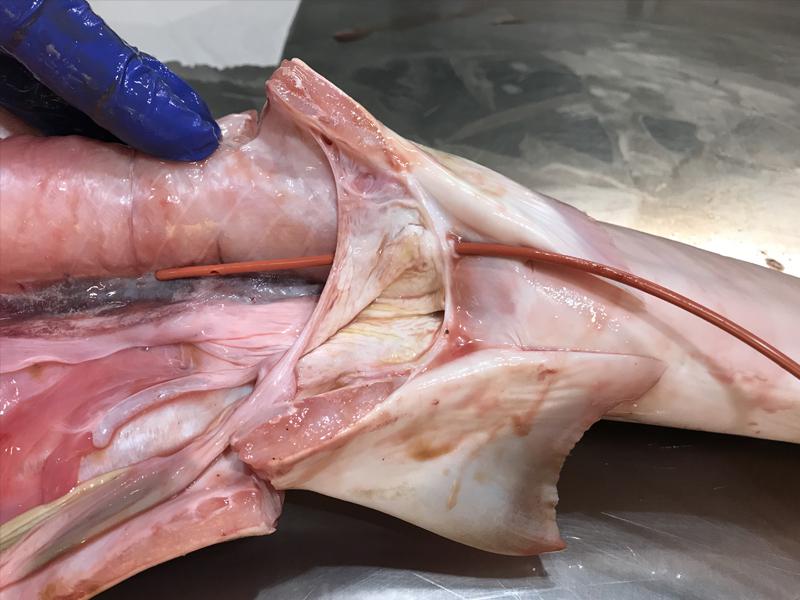
En animales con distensiones celómicas, con problemas de flotabilidad o con sospechas de patologías a nivel celómico se recomienda realizar punciones y aspirados celómicos, y la evaluación de líquido en caso de obtenerse10. En caso de teleósteos, aunque lo ideal es hacerlo ecoguiado se pueden minimizar los riesgos si se sitúa al animal con el vientre hacia arriba y con la cabeza inclinada hacia abajo lo que permitirá que las vísceras se muevan cranealmente. La aguja se debe introducir en el flanco, en el tercio ventral del animal en una zona cercana a cloaca aspirando para evitar puncionar órganos. En el caso de los elasmobranquios existe una característica anatómica que es la presencia de unos poros celómicos, se trata de unas aberturas a los lados de la cloaca que conectan directamente con el celoma11 (Figura 20). Esto permite que se puedan recoger muestras o la realización de endoscopias celómicas sin la necesidad de crear ninguna lesión en el paciente. Las muestras nos van a permitir evaluar la presencia de celomitis con infecciones bacterianas, fúngicas, problemas reproductivos y presencia de parásitos como protozoos, así como de lesiones neoplásicas12 (Figura 21) .
Fluoresceína
Debido a que como se ha mencionado con anterioridad la piel de los peces no presenta una epidermis queratinizada si no que se parece más a una mucosa, cualquier erosión en la misma puede ser evidenciada con el uso de fluoresceína. Se puede emplear directamente sobre la superficie del animal o diluida en el agua en el que nada el paciente a una concentración de 0,10 mg/ml de agua y dejar actuar durante 6 min13. Para una mejor valoración de la piel se puede exponer al paciente a una lámpara de luz ultravioleta haciéndose patente las zonas donde se ha fijado la fluoresceína, que presentarán una tonalidad verde brillante (Figura 22). Se ha demostrado la interacción entre el metanosulfonato de tricaína (MS222) y la fluoresceína disminuyendo la efectividad de la prueba dando posibles falsos negativos, por lo que se recomienda el uso de otros anestésicos para el uso de esta técnica diagnostica14.
Bibliografía
- Callahan HA, Noga EJ. Tricaine dramatically reduces the ability to diagnose protozoan ectoparasite (Ichthyobodo necator) infections. J Fish Dis. 2002;25(7):433-437.
- de Lima Boijink C, Queiroz CA, Chagas EC, Chaves FCM, Inoue LAKA. Anesthetic and anthelminthic effects of clove basil (Ocimum gratissimum) essential oil for tambaqui (Colossoma macropomum). Aquaculture. 2016;457:24-28.
- Sveen L, Karlsen C, Ytteborg E. Mechanical induced wounds in fish – a review on models and healing mechanisms. Rev Aquac. 2020;12(4):2446-2465.
- Soto E., Boylan S., Stevens B., Smith S., Yanong R., Subramaniam K., Waltzek T. Diagnosis of fish diseases. In: Fish Diseases and Medicine, Ed: Smith S., CRC Press, Boca Raton, Florida. 2014 pp 46-88.
- Pilarski F, Rossini AJ, Ceccarelli PS. Isolation and characterization of Flavobacterium columnare (Bernardet et al. 2002) from four tropical fish species in Brazil. Brazilian J Biol. 2008;68(2):409-414.
- Smith SA. Nonlethal clinical techniques used in the diagnosis of diseases of fish. J Am Vet Med Assoc. 2002;220(8):1203-1206.
- Seeley K. Clinical Examination and Diagnostic Sampling. In: Clinical Guide to Fish Medicine, Ed: Hadfield C, Clayton L, Wiley Blackwell, Hoboken, NJ. 2021 pp 109-128.
- Wolke RE. Piscine macrophage aggregates: A review. Annu Rev Fish Dis. 1992;2(C):91-108.
- Agius C, Roberts RJ. Melano-macrophage centres and their role in fish pathology. J Fish Dis. 2003;26(9):499-509.
- Stoskopf M. Clinical Pathology. In: Fish Medicine, Ed: Stoskopf M, W. B: Saunders Company, Philadelphia, Pennsylvania. 1993 pp 113-131.
- Donnelly KA, Stacy NI, Guttridge TL, Burns C, Mylniczenko N. Evaluation of Comprehensive Coelomic Fluid Analysis through Coelomic Pore Sampling as a Novel Diagnostic Tool in Elasmobranchs. J Aquat Anim Health. 2019;31(2):173-185.
- Andrew Stamper M, Lewbart GA, Barrington PR, Harms CA, Geoly F, Stoskopf MK. Eimeria southwelli infection associated with high mortality of cownose rays. J Aquat Anim Health. 1998;10(3):264-270.
- Noga EJ, Udomkusonsri P. Fluorescein: A Rapid, Sensitive, Nonlethal Method for Detecting Skin Ulceration in Fish. Vet Pathol. 2002;39(6):726-731.
- Davis MW, Stephenson J, Noga EJ. The effect of tricaine on use of the fluorescein test for detecting skin and corneal ulcers in fish. J Aquat Anim Health. 2008;20(2):86-95.
 by Multimédica
by Multimédica