El laboratorio en el diagnóstico de la eritrocitosis en el perro
Resumen breve
Se define como eritrocitosis el aumento del recuento de hematíes en sangre circulante, por encima del valor superior del intervalo de referencia para una especie y raza determinada. Este incremento de la masa eritroide se refleja analíticamente en un aumento de los valores de hematocrito (Htc), recuento de hematíes y concentración de hemoglobina (Hb). Tradicionalmente, se han utilizado los términos policitemia y poliglobulia, no obstante, estos aluden etimológicamente a un aumento de células…Índice de contenidos
Resumen
Se define como eritrocitosis el aumento del recuento de hematíes en sangre circulante, por encima del valor superior del intervalo de referencia para una especie y raza determinada. Este incremento de la masa eritroide se refleja analíticamente en un aumento de los valores de hematocrito (Htc), recuento de hematíes y concentración de hemoglobina (Hb). Tradicionalmente, se han utilizado los términos policitemia y poliglobulia, no obstante, estos aluden etimológicamente a un aumento de células o glóbulos en sangre, sin especificar que se trate de los eritrocitos.
El diagnóstico de la eritrocitosis resulta sencillo a partir de un hemograma, así como la identificación de la eritrocitosis relativa producida por hemoconcentración. Sin embargo, en muchos casos, el diagnóstico etiológico de la eritrocitosis absoluta supone un reto para el clínico, en el que las pruebas laboratoriales juegan un papel primordial. En este artículo, tras la exposición de la etiología de la eritrocitosis, se describe la validez clínica de las pruebas laboratoriales y su participación en la toma de decisiones en el árbol diagnóstico de la eritrocitosis.
Etiología
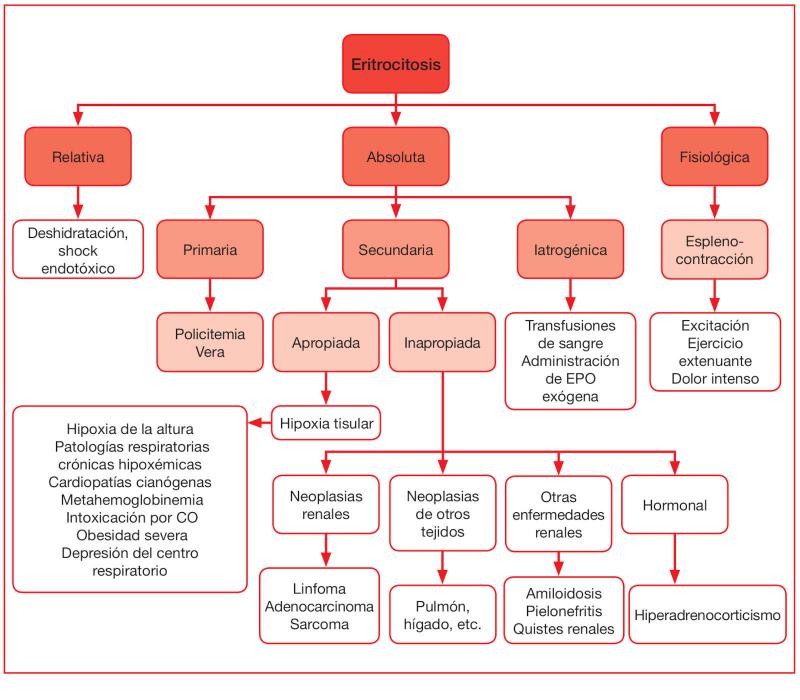
La clasificación etiológica de la eritrocitosis ha de comenzar diferenciando la eritrocitosis relativa de la absoluta (Figura 1).
- La eritrocitosis relativa es aquella que se da como consecuencia de un fenómeno de hemoconcentración, cuya causa más frecuente es la deshidratación, junto con los desórdenes en la distribución de fluidos orgánicos, como el shock endotóxico. En la eritrocitosis relativa la masa eritroide es normal, y es la disminución del volumen plasmático que la contiene lo que resulta en un aumento relativo del Htc, habitualmente acompañado de un incremento de proteínas totales plasmáticas o séricas. Este tipo de eritrocitosis es la que se diagnostica con mayor frecuencia en la clínica.
- En la eritrocitosis absoluta, por el contrario, existe un incremento real del número de eritrocitos circulantes, y se clasifica como primaria o secundaria.
La eritrocitosis absoluta primaria es aquella conocida como Policitemia Rubra Vera o Policitemia Vera, un desorden mieloproliferativo caracterizado por la proliferación clonal de precursores eritroides neoplásicos, con su consiguiente maduración eritrocitaria, que es independiente de la estimulación por la eritropoyetina (EPO). A día de hoy, no se ha esclarecido si el defecto se encuentra a nivel de las células madre hematopoyéticas pluripotentes o multipotentes1. Se trata de una enfermedad neoplásica rara, que afecta a perros jóvenes o de mediana edad2. Recientemente, se ha postulado como posible causa, en el perro, una mutación en el gen JAK2, similar a la que interviene en la patogenia de la enfermedad en humanos3.
En el perro, la eritrocitosis absoluta más frecuente es la secundaria a otras situaciones o patologías que conllevan un aumento en la producción de EPO. En este sentido, el incremento en la secreción de EPO puede formar parte de una respuesta apropiada, inducida por hipoxia sistémica, como aquella que se produce en animales que habitan en alturas o que padecen patologías que afectan a su capacidad de oxigenación tisular. Dentro de estas se incluyen las cardiopatías congénitas con cortocircuito venoarterial (p. ej., defecto interatrial o interventricular, Tetralogía de Fallot4, conducto arterioso persistente5-7 y Síndrome de Eisenmenger8), patologías respiratorias crónicas hipoxémicas, por alteración de la ventilación o por un desajuste entre la ventilación y la perfusión9, enfermedades neurológicas que cursen con depresión del centro respiratorio, obesidad severa, hemoglobinopatías como la metahemoglobinemia congénita por deficiencia de la metahemoglobina reductasa9-11 o adquirida por la ingestión de fármacos o tóxicos, y el incremento en sangre de la carboxihemoglobina en la intoxicación por monóxido de carbono12. Generalmente, estas dishemoglobinemias adquiridas no suelen cursar con aumento de la masa eritroide al ser cuadros clínicos agudos en los que no hay tiempo suficiente para incrementar la eritropoyesis.
La eritrocitosis secundaria puede ser, asimismo, consecuencia de un incremento en la producción de EPO sin que exista en el paciente un estímulo hipóxico sistémico que lo justifique (eritrocitosis secundaria inapropiada). La causa más frecuente es la neoplasia tanto benigna como maligna, siendo los tumores renales que provocan un aumento en la producción de EPO, los que producen con mayor incidencia este tipo de eritrocitosis, en especial, el linfoma13-16, adenocarcinoma17,18 y sarcoma renal19,20.
La eritrocitosis secundaria se ha descrito también en neoplasias de otros órganos como pulmón, hígado, útero, ovario, glándula adrenal, timo2, bazo21 e intestino22, así como en el sistema nervioso central23 y la cavidad nasal24. La eritrocitosis en este tipo de neoplasias extrarrenales se explica por la existencia de moléculas que estimulan la eritropoyesis (prostaglandinas, andrógenos, corticoides) derivadas del tumor2, así como por la posible hipoxia tisular secundaria a estas neoplasias, que induce la síntesis de EPO renal2.
Así mismo, se puede encontrar eritrocitosis secundaria en patologías renales no tumorales que ocasionan hipoxia local y estimulan la síntesis de EPO, como amiloidosis renal9, pielonefritis25, hidroneforisis y quistes renales2. También puede darse eritrocitosis en el hiperadrenocorticismo por estimulación hormonal de la eritropoyesis.
Por último, una sobrecarga eritroide transfusional o una sobredosificación de EPO exógena ocasionan una eritrocitosis iatrogénica, y la esplenocontracción en animales sometidos a excitación, ejercicio físico o dolor intenso produce una eritrocitosis fisiológica, que es transitoria26, ya que el Htc vuelve al valor inicial al eliminar la causa desencadenante. En este caso, la liberación de epinefrina provoca una contracción de la musculatura lisa del bazo y, en consecuencia, la liberación de sangre de este, con un elevado Htc (70-80 %), a la circulación sistémica. En realidad, en la eritrocitosis fisiológica no existe un aumento de la masa eritroide corporal, pero sí en sangre periférica.
Diagnóstico laboratorial
En el diagnóstico de la eritrocitosis, la historia clínica y, en especial, el examen físico, ofrecen datos que la sugieren, pero el diagnóstico definitivo se alcanza confirmando laboratorialmente el aumento de la masa eritroide. Los mínimos parámetros laboratoriales que inicialmente se han de obtener son: Htc, proteínas totales séricas o plasmáticas, densidad urinaria y urea sanguínea, que permitirán, junto a la historia clínica, descartar una eritrocitosis relativa. Habitualmente, esta base de datos laboratoriales iniciales se completa con un hemograma, un perfil bioquímico básico y un urianálisis. Descartada la eritrocitosis relativa, se han de realizar otras pruebas laboratoriales, junto a otros tipos de exploraciones complementarias, especialmente de imagen, para identificar la causa de la eritrocitosis absoluta.
Hemograma
El diagnóstico de la eritrocitosis comienza confirmando el aumento de la masa eritroide. El valor Htc correctamente obtenido, mediante centrifugación de la sangre introducida en capilares de microhematocrito (Htc centrifugado, packed cell volume -PCV-) se considera el mejor método para estimar la concentración de eritrocitos en sangre, aunque la concentración de hemoglobina es la medida más directa de la capacidad de transporte de oxígeno y, por tanto, de la oxigenación tisular.
En la eritrocitosis el aumento del Htc por encima del límite superior del intervalo de referencia es paralelo al aumento de la concentración de hemoglobina y el recuentro de hematíes, pero en determinadas situaciones existe una discrepancia entre estos los valores. En concreto, es muy frecuente que en la eritrocitosis la sangre se hemolice durante la extracción (p. ej., por aplicación de una succión excesiva para obtener el volumen deseado, dada la viscosidad sanguínea) observándose una falsa disminución del hematocrito y del recuento eritroide, mientras que la hemoglobina no se ve afectada, por lo que la hemoglobina corpuscular media (HCM) y la concentración corpuscular media de hemoglobina (CCMH) aumentan falsamente indicando hipercromía, que en la práctica es un marcador de hemólisis. Asimismo, si el VCM está disminuido, como se aprecia en algunos casos de eritrocitosis, el hematocrito no es un reflejo preciso de la concentración de hematíes.
Hay que tener en cuenta que el valor del Htc del analizador hematológico (calculado a partir del VCM y el recuento eritroide) y el obtenido por centrifugación deben coincidir en el rango de 3 puntos porcentuales. En la eritrocitosis es frecuente que el Htc obtenido por centrifugación presente valores falsamente aumentados si la fuerza centrífuga no es la correcta. Se recomienda realizar una doble centrifugación del capilar para lograr mayor exactitud.
Un número significativo de pacientes con eritrocitosis son pacientes críticos, en los que está indicado obtener una gasometría. Actualmente, numerosos analizadores de gases en sangre determinan el Htc por conductividad, pero este es un valor estimado ya que la conductividad de la sangre no depende únicamente de la concentración de hematíes.
En general, se considera un valor del 55 % el límite superior del intervalo de referencia para el Htc en el perro, pero en los diferentes tipos de galgos se ha descrito como fisiológico un valor de Htc mayor, habitualmente del 65 %35, y en ocasiones de hasta el 70 %30. Existen otras razas que también pueden presentar valores de Htc superiores de manera fisiológica, como los Teckel, Whippet36, Saluki, Pastor Alemán, Bóxer, Beagle, Chihuahua y Caniche37. Cabe destacar que, en estas razas, si el Htc se encuentra próximo al límite superior, una mínima situación de estrés en la toma de muestras podrá provocar eritrocitosis37.
El grado de elevación del Htc, junto a la historia clínica, puede ayudar a identificar el tipo de eritrocitosis. En general, esta elevación es ligera a moderada (Htc hasta del 65 %) en la eritrocitosis relativa y en la eritrocitosis por esplenocontracción. Por el contrario, en la eritrocitosis absoluta primaria y en la eritrocitosis secundaria inapropiada los aumentos de Htc suelen ser mayores, especialmente en la tumoral, en la que se han observado Htc de hasta el 81 %31.
No obstante, se han reportado algunos casos de eritrocitosis relativa por gastroenteritis hemorrágica con Htc del 70-80 %, por lo que no siempre puede utilizarse el grado de elevación del Htc como marcador para diferenciar los tipos de eritrocitosis35.
Existe la particularidad de que el aumento de la viscosidad sanguínea no sigue un patrón lineal respecto al aumento del Htc: la viscosidad aumenta considerablemente a partir de hematocritos de 50 % en términos generales en el perro, y esta se duplica cuando el hematocrito supera el 70 %9. Por tanto, el valor Htc no es un indicador directo del grado de hiperviscosidad.
Otras alteraciones observadas en el eritrograma son: microcitosis, debida a la menor disponibilidad de hierro como consecuencia del incremento de la eritropoyesis30, reticulocitosis, con recuentos de reticulocitos por encima de 40.000/µL,2 y ocasionalmente eritroblastosis por la elevada actividad eritropoyética. Estos hallazgos indican que la eritrocitosis es absoluta.
En relación al leucograma los hallazgos son muy variables y las posibles alteraciones de los leucocitos resultan de la enfermedad que induce la eritrocitosis secundaria, como un leucograma de estrés en la eritrocitosis del hiperadrenocorticismo o un leucograma inflamación cuando la eritrocitosis secundaria aparece por patologías inflamatorias. También puede observarse una neutrofilia fisiológica en la eritrocitosis por esplenocontracción. En la Policitemia Vera del perro, a diferencia del hombre, no se han reportado casos en los que la eritrocitosis vaya acompañada de leucocitosis2.
Al igual que en el leucograma, los hallazgos del trombograma son muy variables y obedecen a la enfermedad que provoca eritrocitosis secundaria (p. ej., trombocitosis tumoral o del hiperadrenocorticismo, trombocitopenia en shock endotóxico). Asimismo, en la eritrocitosis primaria del perro, a diferencia del hombre, no se observa trombocitosis2.
Determinación de la masa eritroide total
La técnica más precisa para diferenciar la eritrocitosis primaria de la secundaria es la determinación de la masa eritroide total, mediante el uso de radioisótopos (51Cr, 32P, 99Tc) que marcan los eritrocitos del paciente para poder cuantificarlos. No obstante, se trata de una técnica de elevado coste y no disponible para la práctica rutinaria. Además, desde el punto de vista clínico rara vez se precisa de ella2.
Perfil bioquímico
El primer parámetro que se ha de considerar para clasificar la eritrocitosis es la concentración de proteínas totales plasmáticas o séricas. Una eritrocitosis acompañada de hiperproteinemia y posible hiperalbuminemia, sugerirá una eritrocitosis relativa por hemoconcentración, salvo en algunos casos de gastroenteritis hemorrágicas donde los valores de proteínas totales son normales30. Además, la eritrocitosis relativa causada por deshidratación puede ir acompañada de azotemia prerrenal, hipernatremia si la deshidratación es hipertónica, y elevación de la densidad urinaria por encima de 1,0402. En términos generales, las eritrocitosis severas producen hipoglucemia por consumo de glucosa por los eritrocitos2,29.
Aparte de estos hallazgos, es posible observar otras alteraciones en el perfil bioquímico derivadas de la patología que genera la eritrocitosis secundaria (p. ej., azotemia renal, aumento de proteínas de fase aguda).
Gasometria
La gasometría constituye una herramienta fundamental en el abordaje diagnóstico de la eritrocitosis, al permitir la identificación de la eritrocitosis por hipoxemia y la producida por concentraciones elevadas de dishemoglobinas. Los parámetros de la gasometría que permiten estos diagnósticos son los parámetros de la oximetría: presión parcial de oxígeno (pO2), saturación de oxígeno de la hemoglobina (SO2) y la presión de oxígeno que corresponde a una SO2 del 50 % (p50), junto con los parámetros de la cooximetría: fracción de carboxihemoglobina (COHb) y fracción de metahemoglobina (MetHb) de la hemoglobina total.
Para valorar el estado de oxigenación se precisa de una muestra de sangre arterial obtenida en heparina de litio sólida38, al ser el anticoagulante que menos interfiere con la valoración de los gases y el pH sanguíneo. Esta muestra no debe contener burbujas de aire, que producen un aumento de la PO2, ni coágulos. El material óptimo para la extracción es la jeringa de vidrio al ser impermeable a los gases, a diferencia de la jeringa de plástico que permite cierto intercambio de O2 y CO2 con el medio ambiente. Este intercambio en jeringas de plástico es mayor cuanto mayor sea la diferencia entre la pO2 y la pCO2 ambientales y las de la sangre, cuanto más tiempo transcurra entre la toma de muestra y su análisis, y cuanto menor sea la temperatura del medio donde se encuentra la muestra. En la clínica habitualmente se utilizan jeringas de plástico específicas para gasometría que limitan el intercambio gaseoso con el medio. Por otro lado, en muestras de sangre con eritrocitosis la hiperviscosidad de la muestra puede interferir con la gasometría, en cuyo caso se recomendaría una segunda extracción tras realizar flebotomía9.
En cuanto a la conservación de la muestra, en medicina humana se recomienda efectuar el análisis lo antes posible tras la extracción, no superar los 30 minutos, y mantenerla durante este tiempo en anaerobiosis a temperatura ambiente38. Si el tiempo de almacenamiento se ha de prolongar, se recomienda mantener la muestra en baño de agua-hielo en jeringa de vidrio.
Aunque la gasometría constituye el estándar áureo para valorar el estado de oxigenación, en el caso de no disponer de un gasómetro, la SO2 puede determinarse mediante pulsioximetría35. Entre ambos métodos existe una buena correlación, excepto en pacientes con una disminución marcada de la perfusión tisular o con un aumento importante de la presión venosa central. Es importante recalcar que la pulsioximetría no es capaz de distinguir las dishemoglobinas. Una disminución de la pO2 y de la SO2 indica hipoxemia y apoya el diagnóstico de eritrocitosis secundaria apropiada. En general, valores de pO2 y SO2 inferiores a 80 mmHg y al 95 %, respectivamente, indican hipoxemia35. No obstante, con estos parámetros han de tenerse en cuenta las posibles variaciones entre razas, puesto que los galgos han demostrado tener mayor pO2 y SO2 fisiológicas39.
No todos los gasómetros valoran las dishemoglobinas, pero una disminución de la p50 sugiere la presencia de hemoglobinas con alta afinidad por el oxígeno, como la carboxihemoglobina y metahemoglobina. Por último, en la clínica es importante determinar la presencia de hiperlactatemia, que permite identificar estados de hipoxia tisular que pueden inducir una eritrocitosis secundaria.
Determinación de eritropoyetina
La eritropoyetina (EPO) es una hormona glucoproteica producida por el riñón para estimular la eritropoyesis, y, con ello, la oxigenación tisular. Su determinación en la eritrocitosis canina puede ser de utilidad, aunque tradicionalmente se ha visto condicionada por ciertas limitaciones tanto metodológicas como de interpretación clínica.
La medición de EPO puede realizarse por los siguientes métodos:
- In vivo: se considera como técnica estándar, con la que se comparan y validan otras técnicas, el ensayo sobre ratones policitémicos (polycythemic mouse assay), que permite medir la EPO bioactiva en cualquier mamífero40. No obstante, se trata de una técnica compleja y de alto coste.
- In vitro: se han descrito técnicas para la medición de EPO en base a cultivos de células hematopoyéticas murinas, aunque los resultados han sido contradictorios. Por tanto, las técnicas más utilizadas actualmente son la hemaglutinación, el radioinmunoensayo (RIAs)40 y el ELISA25,41,42. Algunos kits comerciales que utilizan estas técnicas tienen una sensibilidad limitada, puesto que utilizan anticuerpos monoclonales frente a la EPO humana2, que presenta diferencias antigénicas con la EPO canina. No obstante, actualmente se están comercializando kits de ELISA para la determinación de EPO específica canina43,44.
Además de estas consideraciones metodológicas, existen dificultades en cuanto al manejo de muestras, por lo que ciertos autores recomiendan que se contacte con el laboratorio para recibir indicaciones concretas, previamente a la extracción de la muestra2. Cabe destacar que, en cualquier caso, la medición de EPO debe efectuarse antes de la realización de cualquier flebotomía, ya que esta podría producir un aumento de EPO que invalidase los resultados40.
Para la clasificación de la eritrocitosis, el papel principal que tiene la determinación de EPO sanguínea es la diferenciación entre la eritrocitosis absoluta primaria de la secundaria.
Desde un punto de vista teórico, se esperaría un nivel alto de EPO sérica en la eritrocitosis secundaria, y un nivel normal o bajo en la eritrocitosis primaria. El incremento del nivel sérico de EPO es diagnóstico de eritrocitosis secundaria, no obstante, se estima que alrededor de un 50 % de los casos de eritrocitosis secundaria presentan un nivel de EPO bajo o normal, lo que limita su capacidad diagnóstica9. Incluso, se ha observado que pueden existir valores similares de EPO en animales sanos, animales con eritrocitosis primaria y animales con eritrocitosis secundaria35,37,40. Por lo tanto, la determinación de EPO es útil en algunos casos en los que no se esclarece la etiología de la eritrocitosis mediante otros métodos diagnósticos, pero es infrecuente que se alcance un diagnóstico únicamente con la medición de EPO2.
En cuanto a los valores de referencia de EPO en perros sanos, también se encuentran discrepancias considerables, por lo que se recomienda que cada laboratorio establezca sus propios intervalos de referencia.
Citología
A diferencia de otras patologías hematopoyéticas, la citología de médula ósea no suele ser de utilidad para el diagnóstico de la eritrocitosis30, puesto que no se encuentran hallazgos distintivos en la eritrocitosis primaria, tan solo una hiperplasia eritroide, y el resultado del cociente mieloide/eritroide no permite distinguir entre los diferentes tipos de eritrocitosis2.
Por otro lado, la citología puede ser útil en el caso de tumores secretantes de EPO, como es el caso de los linfomas renales45.
Plan diagnóstico: algoritmo de decisiones
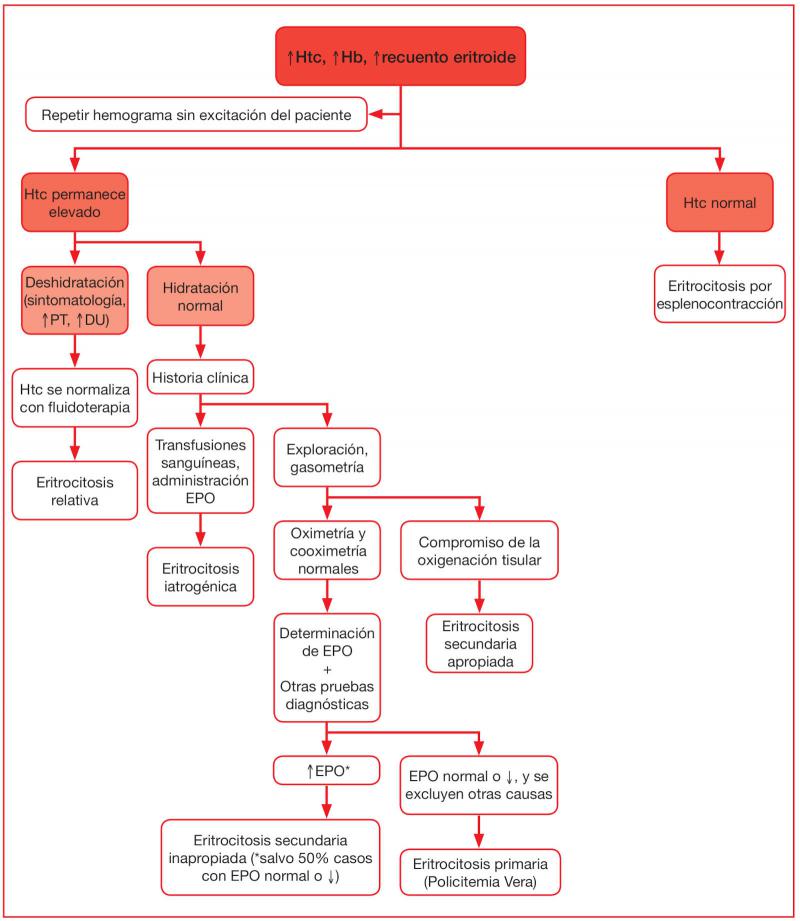
La Figura 3 muestra el algoritmo recomendado para el diagnóstico de la eritrocitosis, el cual debe orientarse a determinar si existen causas de eritrocitosis secundarias, puesto que la eritrocitosis primaria se diagnostica por exclusión del resto de subtipos9.
Ante un aumento del Htc, la Hb y el recuento de hematíes, se recomienda, primeramente, repetir el hemograma minimizando el estrés del paciente. En caso de que el Htc se normalice en esta segunda extracción, se pondrá de manifiesto que la eritrocitosis se produjo por esplenocontracción.
Si el Htc no se normaliza tras eliminar el estrés, se debe descartar una eritrocitosis relativa, mediante los hallazgos de la exploración física y del laboratorio.
En el caso de la eritrocitosis relativa por deshidratación, el diagnóstico también se apoyará con la normalización del Htc tras la instauración de fluidoterapia. Paralelamente, se habrá podido descartar la eritrocitosis iatrogénica si el paciente no ha recibido EPO exógena ni transfusiones sanguíneas.
A continuación, se recomienda realizar gasometría, ya que esta permite identificar la eritrocitosis secundaria apropiada cuando existe hipoxemia. En caso contrario, si la oximetría y la cooximetría son normales, se recomienda proseguir con la determinación de EPO, junto con otras pruebas complementarias (imagen, etc.), con el objetivo de identificar posibles causas de eritrocitosis secundaria inapropiada. Únicamente en caso de que se hayan descartado todas las causas de eritrocitosis secundaria, se podrá diagnosticar Policitemia Vera.
Bibliografía
- Vail DM, Young KM. Hematopoietic Tumors. In: Withrow SJ, Vail DM, eds. Withrow and MacEwen's Small Animal Clinical Oncology. St. Louis, Missouri: Elsevier Saunders; 2019:688–772.
- Nitsche EK. Erythrocytosis in dogs and cats: diagnosis and management. Compendium. 2004;104-119.
- Beurlet S, Krief P, Sansonetti A, Briend-Marchal A, Kiladjian J-J, Padua RA, et al. Identification of JAK2 mutations in canine primary polycythemia. Exp Hematol. 2011;39(5):542–5.
- Kirby D, Gillick A. Polycythemia and tetralogy of Fallot in a cat. Can Vet J. 1974;15(4):114–9.
- Turner E. Pentoxifylline as adjunct therapy to long-term clinical management of a right-to-left patent ductus arteriosus. Can Vet J. 2016;57(6):655–6.
- Moore KW, Stepien RL. Hydroxyurea for treatment of polycythemia secondary to right-to-left shunting patent ductus arteriosus in 4 dogs. J Vet Intern Med. 2001;15(4):418–21.
- Anderson TP, Walker MC, Goring RL. Cardiogenic hypertrophic osteopathy in a dog with a right-to-left shunting patent ductus arteriosus. J Am Vet Med Assoc. 2004;224(9):1464–6.
- Nakamura K, Yamasaki M, Ohta H, Sasaki N, Murakami M, Bandula Kumara WR, et al. Effects of sildenafil citrate on five dogs with Eisenmenger’s syndrome. J Small Anim Pract. 2011;52(11):595–8.
- Hasler AH. Policitemia. In: Ettinger SJ, Feldman EC, eds. Tratado de medicina interna veterinaria: enfermedades del perro y el gato. 6 ed. Vol. 1. Madrid: Elsevier Saunders; 2007:215-218.
- Zhou S, Tearle R, Jozani RJ, Winra B, Schaaf O, Nicholson A, et al. Genetic cause for congenital methemoglobinemia in an Australian Pomeranian dog. J Vet Intern Med. 2019;33(2):868–73.
- McKenna JA, Sacco J, Son TT, Trepanier LA, Callan MB, Harvey JW, et al. Congenital Methemoglobinemia in a Dog with a Promoter Deletion and a Nonsynonymous Coding Variant in the Gene Encoding Cytochrome b 5. J Vet Intern Med. 2014;28(5):1626–31.
- Erythrocytosis [Internet]. eClinpath. Available from: http://eclinpath.com/hematology/polycythemia/
- Taylor A, Finotello R, Vilar-Saavedra P, Couto CG, Benigni L, Lara-Garcia A. Clinical characteristics and outcome of dogs with presumed primary renal lymphoma. J Small Anim Pract. 2019;60(11):663–70.
- Snead EC. A case of bilateral renal lymphosarcoma with secondary polycythaemia and paraneoplastic syndromes of hypoglycaemia and uveitis in an English Springer Spaniel. Vet Comp Oncol. 2005;3(3):139–44.
- Durno AS, Webb JA, Gauthier MJ, Bienzle D. Polycythemia and inappropriate erythropoietin concentrations in two dogs with renal T-cell lymphoma. J Am Anim Hosp Assoc. 2011;47(2):122–8.
- Kotb S, Allende C, O’Neill TW, Bruckner K, DeMorais H, Gordon J, et al. A case of canine renal lymphoma of granular lymphocytes with severe polycythemia. BMC Vet Res. 2021;17(1):163.
- Klainbart S, Segev G, Loeb E, Melamed D, Aroch I. Resolution of renal adenocarcinoma-induced secondary inappropriate polycythaemia after nephrectomy in two cats. J Feline Med Surg. 2008;10(3):264–8.
- Troia R, Agnoli C, Fracassi F, Bettini G, Sfacteria A, Pisoni L, et al. Renal adenocarcinoma-associated erythrocytosis in a cat: clinicopathological features and immunohistochemical results. Open Vet J. 2017;7(4):294–9.
- Michael AE, Grimes JA, Volstad NJ, Osekavage KE, Koenig A. Inappropriate Secondary Erythrocytosis in a Dog With Renal Sarcoma. Top Companion Anim Med. 2019;36:9–11.
- Gorse MJ. Polycythemia associated with renal fibrosarcoma in a dog. J Am Vet Med Assoc. 1988;192(6):793–4.
- Seo KW, Hong H, An S, Lee JK, Rebhun R. Secondary inappropriate polycythemia with splenic hemangiosarcoma in a young adult cat. Can Vet J. 2018;59(12):1320–4.
- Sato K, Hikasa Y, Morita T, Shimada A, Ozaki K, Kagota K. Secondary erythrocytosis associated with high plasma erythropoietin concentrations in a dog with cecal leiomyosarcoma. J Am Vet Med Assoc. 2002;220(4):486–90.
- Yamauchi A, Ohta T, Okada T, Mochizuki M, Nishimura R, Matsunaga S, et al. Secondary erythrocytosis associated with schwannoma in a dog. J Vet Med Sci. 2004;66(12):1605–8.
- Couto CG, Boudrieau RJ, Zanjani ED. Tumor-associated erythrocytosis in a dog with nasal fibrosarcoma. J Vet Intern Med. 1989;3(3):183–5.
- Kessler M. Secondary polycythaemia associated with high plasma erythropoietin concentrations in a dog with a necrotising pyelonephritis. J Small Anim Pract. 2008;49(7):363–6.
- Hsia CCW, Johnson RL, Dane DM, Wu EY, Estrera AS, Wagner HE, et al. The canine spleen in oxygen transport: gas exchange and hemodynamic responses to splenectomy. J Appl Physiol Bethesda Md 1985. 2007;103(5):1496–505.
- Boes KM, Durham AC. Bone Marrow, Blood Cells, and the Lymphoid/Lymphatic System. In: Zachary JF, ed. Pathologic Basis of Veterinary Disease. 2ed. St. Louis, Missouri: Elsevier; 2017:724-804.
- Diogo CC, Fabretti AK, Camassa JA de A, Bonelli M de A, Arias MVB, Pereira PM. Diagnosis and Treatment of Primary Erythrocytosis in a Dog: A Case Report. Top Companion Anim Med. 2015;30(2):65–7.
- Kay W, Gambino JM, Lunsford KV, Mackin A, Shores A, Cooley J, et al. Acute cerebrovascular event in a dog with polycythemia vera. Can Vet J. 2018;59(7):755–8.
- Nelson RW, Couto CG. Erythrocytosis. In: Nelson RW, Couto CG, eds. Small animal internal medicine. 5ed. St. Louis, Missouri: Elsevier/Mosby; 2014:1227-1229.
- Weiss DJ, Tvedten H. Erythrocyte Disorders. In: Willard MD, Tvedten H, eds. Small Animal Clinical Diagnosis by Laboratory Methods. 5ed. St. Louis, Missouri: Elsevier Saunders;2012:38–62.
- Van Vonderen IK, Meyer HP, Kraus JS, Kooistra HS. Polyuria and Polydipsia and Disturbed Vasopressin Release in 2 Dogs With Secondary Polycythemia. J Vet Intern Med. 1997;11(5):300–3.
- Quesnel AD, Kruth SA. Polycythemia vera and glomerulonephritis in a dog. Can Vet J. 1992;33(10):671–2.
- Gray HE, Weigand CM, Cottrill NB, Willis AM, Morgan RV. Polycythemia vera in a dog presenting with uveitis. J Am Anim Hosp Assoc. 2003;39(4):355–60.
- Randolph JF, Peterson ME, Stokol T. Erythrocytosis and Polycythemia. In: Weiss DJ, Wardrop KJ, eds. Schalm’s Veterinary Hematology. 6ed. Ames, Iowa: Wiley-Blackwell;2010:162-166.
- Hematocrit/packed cell volume [Internet]. eClinpath. Available from: http://eclinpath.com/hematology/tests/hematocrit/
- Harvey JW. Evaluation of Erythrocytes. In: Harvey JW, ed. Veterinary Hematology: A Diagnostic Guide and Color Atlas. St. Louis, Missouri: Elsevier Saunders; 2011:49-121.
- Rodríguez Fraga O, Navarro Segarra X, Galán Ortega A, Rodríguez Cantalejo F, Gómez Rioja R, Altimira Queral L, et al. Recomendaciones preanalíticas para la medición del equilibrio ácido-base y los gases en sangre. Recomendación (2018). Revista del Laboratorio Clínico. 2019;12(4):66–74.
- Zaldivar-Lopez S, Chisnell HK, Guillermo Couto C, Westendorf-Stingle N, Marin LM, Iazbik MC, et al. Blood gas analysis and cooximetry in retired racing Greyhounds. J Vet Emerg Crit Care. 2011;21(1):10.
- Cook SM, Lothrop CD. Serum erythropoietin concentrations measured by radioimmunoassay in normal, polycythemic, and anemic dogs and cats. J Vet Intern Med. 1994;8(1):18–25.
- Pechereau D, Martel P, Braun JP. Plasma erythropoietin concentrations in dogs and cats: reference values and changes with anaemia and/or chronic renal failure. Res Vet Sci. 1997;62(2):185–8.
- Aronson LR, Preston A, Bhalerao DP, Drobatz KJ, Giger U. Evaluation of erythropoiesis and changes in serum erythropoietin concentration in cats after renal transplantation. Am J Vet Res. 2003;64(10):1248–54.
- Giampaoli S, Facciabene A, Mennuni C. A Protocol to Guide Development of a Sensitive ELISA for Canine Erythropoietin. Vet Clin Pathol. 2003;32(4):199–201.
- Zhang L, Zhuang X, Chen Y, Niu Z, Xia H. Plasma Erythropoietin, IL-17A, and IFNγ as Potential Biomarkers of Motor Function Recovery in a Canine Model of Spinal Cord Injury. J Mol Neurosci. 2020;70(11):1821–8.
- Froment R, Gara-Boivin C. Bilateral renal T-cell lymphoma with hepatic infiltration and secondary polycythemia in a dog: Utility of cytology slides. Can Vet J. 2015;56(12):1287–91.
 by Multimédica
by Multimédica