Hallazgos normales y patológicos en lavados traqueales y broncoalveolares en caballos. El examen citológico.
Resumen breve
El diagnóstico de la enfermedad respiratoria en caballos puede convertirse en algo complicado para el veterinario equino. Esto es debido a la variedad de signos inespecíficos que muestran los animales que sufren patologías respiratorias, así como las limitaciones en las pruebas diagnósticas de las que disponemos hasta ahora. El examen citológico junto con los signos clínicos es la mejor herramienta a día de hoy para enfrentarnos a este tipo de patologías. En este artículo se revisarán…Índice de contenidos
Resumen
El diagnóstico de la enfermedad respiratoria en caballos puede convertirse en algo complicado para el veterinario equino. Esto es debido a la variedad de signos inespecíficos que muestran los animales que sufren patologías respiratorias, así como las limitaciones en las pruebas diagnósticas de las que disponemos hasta ahora. El examen citológico junto con los signos clínicos es la mejor herramienta a día de hoy para enfrentarnos a este tipo de patologías. En este artículo se revisarán las técnicas de lavado traqueal (TW) y broncoalveolar (BAL), la toma, preparación y conservación de las muestras, así como hallazgos citológicos normales y patológicos asociados a los desórdenes respiratorios más comúnmente encontrados en caballos.
Toma de la muestra
Tanto para lavados traqueales como broncoalveolares existen estudios que afirman que hacer ejercicio suave o provocar tos en un paciente antes de la recolección de la muestra ayuda a obtener una muestra representativa1. Generalmente y de un modo estandarizado, la toma de muestra debe realizarse 30 minutos después de la finalización de ejercicio suave.
TW
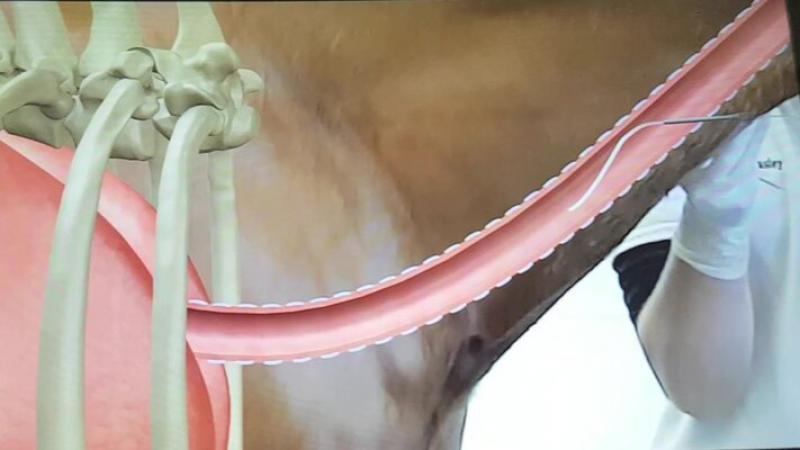
Puede realizarse mediante el uso de un endoscopio o usando el método transtraqueal (Figura 1). En este último método, se realiza una pequeña incisión en el segundo tercio del cuello previamente rasurado y preparado mediante un lavado quirúrgico. Antes de la incisión, se recomienda inyectar una pequeña cantidad de anestésico local subcutáneo para evitar dolor y por tanto movimientos bruscos mientras se realiza la incisión.
Tras ello, se utiliza un trócar con guía para perforar entre dos anillos cartilaginosos y se usa éste para introducir un catéter el cual se continúa hasta estar en la zona de recolección (suelo de la bifurcación traqueal).
Inmediatamente después, se infunden de 30 a 60 ml de solución salina estéril y se comienza a aspirar lo más rápidamente posible.
Complicaciones de la técnica
Las complicaciones del lavado traqueal son raras, aunque en ocasiones puede dar lugar a enfisemas subcutáneos, peritraqueales o mediastínicos. Por ello, es recomendable realizar un lavado post extracción del trócar y el catéter para evitar posibles infecciones en la zona de incisión2.
BAL
Para la realización de un lavado broncoalveolar dispondremos de dos técnicas. Mediante endoscopio, el cual debe tener una longitud de entre 2 y 2.5 metros para un caballo de tamaño estándar (500 kg); y la otra posibilidad es la de realizarse de manera ciega (Figura 2). Esta última se realiza utilizando una sonda estilo Bivona® de unos 11 mm de diámetro y de la misma longitud que el endoscopio.

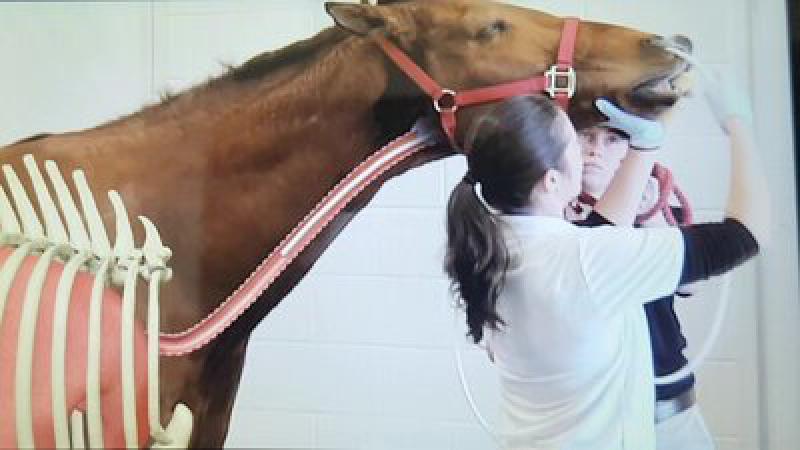
En ambos casos, se necesitará la sedación previa del paciente. Es recomendable avisar al propietario de que el animal puede toser durante el proceso y se considera normal. Para reducir la tos, se puede utilizar anestésico local, el cual se deposita a la altura de la laringe cuando pasemos con la sonda/endoscopio.
En el caso de la sonda, se deberá calcular cuándo estará en este punto antes de introducirla, para así lograr ser lo más certero posible al depositar el anestésico.
Si la técnica escogida es la técnica a ciegas, es más probable debido a la anatomía del animal que la sonda termine en el bronquio derecho. Esto no ocurre con la técnica endoscópica, donde puede escogerse la zona en la que se realizará el lavado.
Para el lavado se utilizará entre 250 y 500 ml de suero salino. Se procederá a su extracción inmediata intentando recuperar el máximo volumen posible (normalmente entre un 50-70 %).
Complicaciones de la técnica
Aunque no suele tener complicaciones, la gran desventaja frente al lavado traqueal es que el animal deberá estar sedado para la su realización. Además, la cantidad de suero utilizado para el lavado y el volumen recuperado afectarán a la dilución de la muestra, por lo que debe tenerse en cuenta a la hora de analizar la muestra y compararla con los valores de referencia ofrecidos por cada laboratorio.
Conservación y preparación para citología
TW
Como ya se ha mencionado, esta muestra debe tomarse de manera aséptica, ya que su utilidad principal será la de su uso para estudio microbiológico. El estudio citológico de esta muestra puede darnos información, pero la falta de estandarización hace que no sea la muestra recomendada cuando se sospecha de enfermedad respiratoria no infecciosa.
Por lo tanto, la muestra deberá colocarse en tubos de EDTA (si se desea un estudio citológico), o en hisopo con medio de cultivo (si lo que se desea es un estudio microbiológico). Los tubos de suero no son estériles por lo que no se recomienda su uso para muestras en las que se quiera realizar cultivo.
BAL
La muestra recolectada debe introducirse en tubos de EDTA. El lavado broncoalveolar puede suponer una contaminación de las vías respiratorias bajas, por lo que, si se decide realizar lavado traqueal también, este deberá realizarse con anterioridad para que los resultados del estudio microbiológico sean válidos.
Como se demuestra en el estudio de K. Pickles y colaboradores (2002)3, las muestras mantenidas a temperatura ambiente presentan cambios significativos en la morfología de las células a las 24 horas, afectando, por tanto, al estudio citológico. Además, se produce un incremento en el crecimiento bacteriano a las 8 horas, afectando también al estudio microbiológico. Para el estudio microbiológico, igual que ocurría en el lavado traqueal, lo ideal será el uso de hisopos con medio.
Por tanto, las condiciones de almacenamiento idóneas tanto para lavados traqueales como para lavados broncoalveolares, serán refrigeradas a 4°C, en donde podrán mantenerse hasta 48 horas para el estudio citológico. Mayor temperatura se ha asociado a una reducción del número de células y viabilidad de las mismas (cambios morfológicos).
Preparación
Para la preparación tanto de lavados traqueales como broncoalveolares, existen dos métodos diferenciados.
El primero y más sencillo sería una extensión directa del fluido obtenido. En ciertas ocasiones, el fluido contiene suficiente moco y otras proteínas para poder ser examinado mediante extensión directa. El problema con este método es que debido a que las muestras se encuentran diluidas en suero y contienen baja cantidad de proteínas, la morfología celular no se mantiene a la hora de realizar la extensión.
En la mayoría de los casos se necesita de su centrifugado para aumentar la celularidad y mantener la morfología. Las preparaciones directas de BAL poseen mayor porcentaje de linfocitos y un menor número de macrófagos en el recuento diferencial en comparación a las que se obtienen por citocentrifugado4.
La explicación para este cambio la encontramos en la literatura de humana. Thompson y colaboradores (1996)5 ya describieron que el centrifugado de lavados broncoalveolares disminuía el número de linfocitos y aumentaba (al tratarse de la otra población predominante) el número de macrófagos.
Esto se cree que es debido a que los linfocitos muestran una menor capacidad de adherencia al portaobjetos además de una mayor susceptibilidad al centrifugado, lo que dará lugar a la lisis de linfocitos y por tanto a su disminución6.
La conclusión es que ambas técnicas pueden ser válidas a la hora de valorar una muestra de lavado traqueal o broncoalveolar de un paciente, pero hay que tener en cuenta la técnica mediante la cual se ha realizado la citología para su correcta valoración.
Examen citológico: Hallazgos normales
En la Tabla 1 se exponen los hallazgos considerados normales en lavados traqueales y broncoalveolares de acuerdo con F. Cian y colaboradores (2015)7. El sistema establecido para el recuento diferencial de células consiste en contar 400 leucocitos. Un método alternativo propuesto por Fernández y colaboradores (2013)8 con resultados equivalentes es el de realizar el diferencial basándose en 5 campos diferentes a gran aumento (x50) y calcular la media de los mismos.
TW
No existen valores de referencia estándar para el estudio citológico de lavados traqueales, pero sí para lavados broncoalveolares. Los valores de referencia usados por el laboratorio del autor son los que se adjuntan en la Tabla 1.
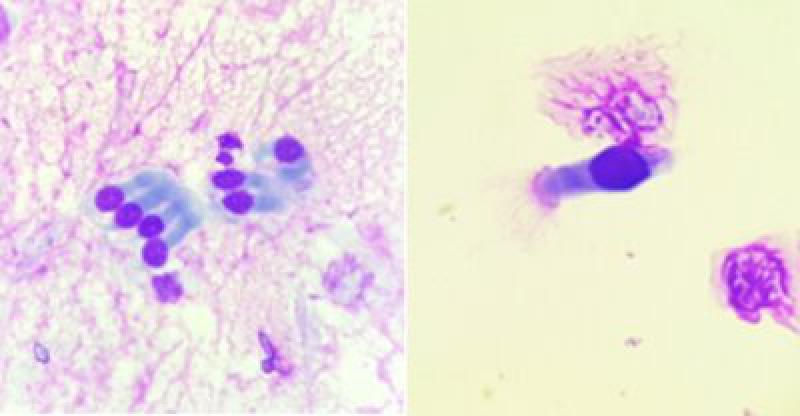
Los hallazgos más comúnmente encontrados son las células respiratorias columnares ciliadas y no ciliadas (Figura 3). Éstas pueden encontrarse de manera individual o en grupo. Se caracterizan por poseer un núcleo pequeño y redondo con cromatina fina granular y una cantidad moderada de citoplasma. Dependiendo de su orientación en el portaobjetos los cilios pueden ser o no visibles y la forma de las células puede variar de rectangulares a cuboidales.
| Tabla 1. Valores de referencia según F.Cian y colaboradores (2015) en BAL y TW. |
| Células | BAL | TW |
| Células epiteliales | Ocasionales | Alto número |
| Macrófagos | 50-70% | 79.6% ± 8.2% |
| Linfocitos | 30-50% | 9.3% ± 5.8% |
| Neutrófilos | <5% | 9.3% ± 4.9% |
| Eosinófilos | <0.1% | 0.2% ± 0.6% |
| Mastocitos | <2% | <1% |
Además, se encontrará un alto número de macrófagos, y un menor número de linfocitos y neutrófilos. En general, los neutrófilos deben representar menos del 20% de la población celular de la muestra en caballos sanos y en ambientes libres de polvo o contaminantes/irritantes de las vías respiratorias9.
Sin embargo, estos hallazgos deben siempre considerarse en función de la historia clínica y presentación del animal, ya que en el estudio de Robinson y colaboradores (2006)10 se encontró que más de un 70 % de caballos sin sintomatología ni historia clínica compatible con enfermedad pulmonar, presentaban más del 20 % de neutrófilos en su lavado traqueal.
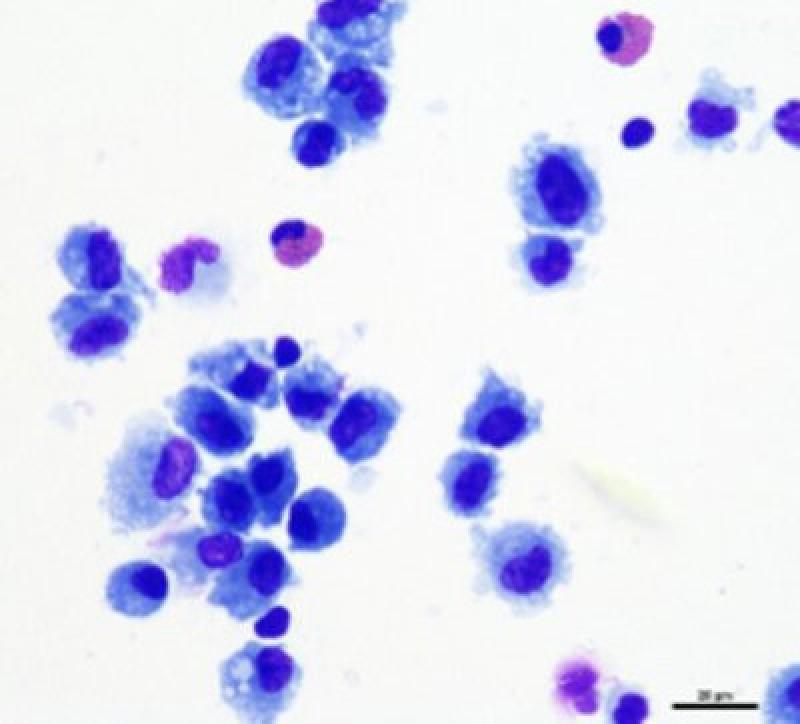
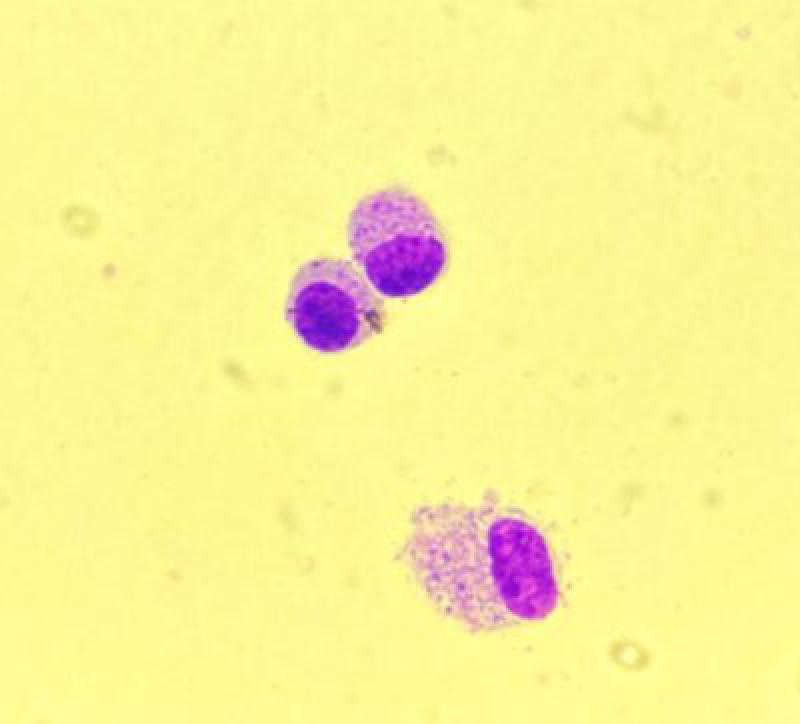
Por último, en una muestra de lavado traqueal de un caballo sano encontraremos también un pequeño número de eosinófilos y mastocitos (Figuras 4 y 5). Las muestras provenientes de potros y caballos jóvenes tendrán de manera fisiológica, un número mayor de neutrófilos, eosinófilos y mastocitos11.
BAL
El lavado broncoalveolar será más representativo cuando la patología afecte de manera generalizada al pulmón. Si no es así, la muestra podría tomarse de la zona no afectada y por tanto no tener valor diagnóstico12.
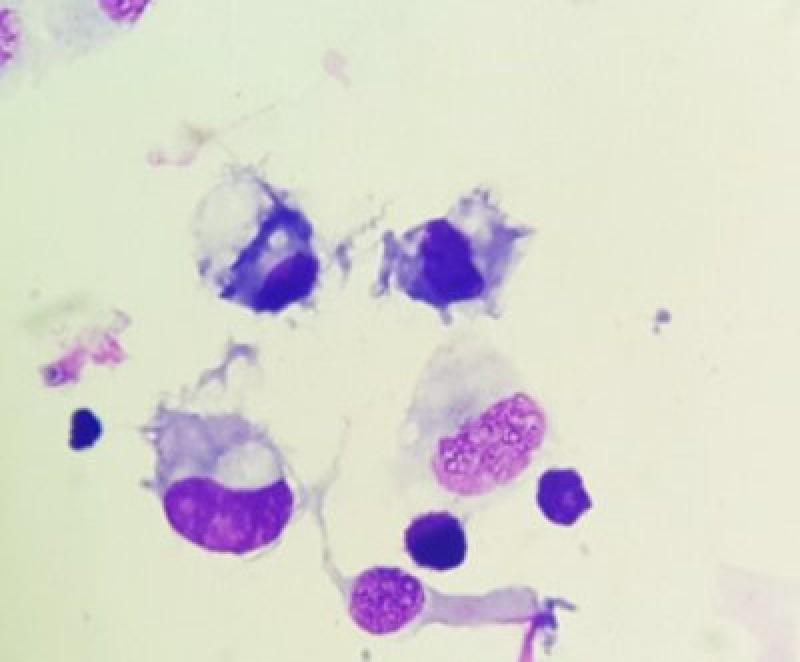
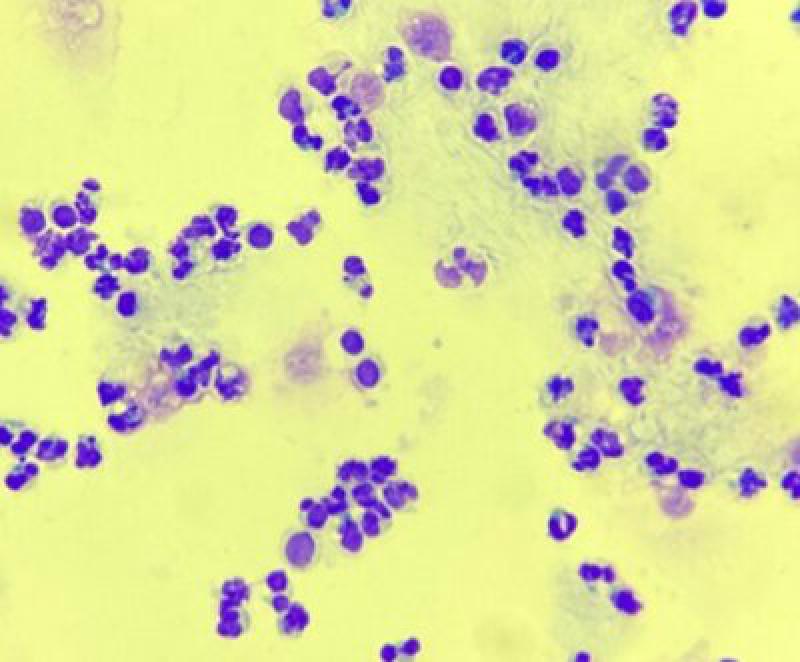
El análisis de líquido broncoalveolar se considera, en comparación con el lavado traqueal, de mayor sensibilidad y especificidad para detectar inflamación de las vías respiratorias bajas13.
Las células más comúnmente encontradas serán, como ya se ha descrito en la Tabla 1, macrófagos y linfocitos (Figura 6). Los neutrófilos deberán representar menos del 5 % de la población celular. Los mastocitos y eosinófilos aparecen raramente, aunque se ha descrito un mayor número de mastocitos en muestras obtenidas con poco volumen o muestras del pulmón izquierdo14.
La causa de este incremento se encuentra aún bajo estudio. Aunque menos habituales que en lavado traqueal, también encontraremos células epiteliales columnares y cuboidales. Las células columnares provienen de las vías aéreas mayores (tráquea y bronquio) y las células cuboidales de las vías aéreas menores (bronquio-bronquiolo).
Estas últimas se caracterizan por una alta relación núcleo:citoplasma, con núcleos redondos y centrales de pequeño a mediano tamaño, cromatina fina granular y citoplasma moderado13.
Examen citológico: Hallazgos patológicos
Inflamación séptica
La inflamación séptica de las vías respiratorias bajas del caballo se asocia generalmente a signos sistémicos como la fiebre, depresión, disminución del apetito o pérdida de peso. La hematología, bioquímica y ultrasonido/radiografía nos ayudan a la identificación del proceso y a su localización.
Toda esta información debe evaluarse junto al examen citológico, ya que, el examen citológico por si solo puede resultar confuso y dar lugar a diagnósticos erróneos. La inflamación séptica se caracteriza principalmente por un aumento marcado de neutrófilos en las vías aéreas.
Estos tienden a aumentar por encima del 40 % en el diferencial pudiendo incluso llegar a representar el 100 % de la muestra15. En este artículo se hablará de inflamación séptica de origen bacteriano, fúngico, protozoario, vírico y parasitario.
Bacteriana
Cuando el animal sufre de una neumonía bacteriana, los neutrófilos del lavado aparecerán degenerados debido a las toxinas bacterianas, mostrando núcleos inflamados que pierden parte de su lobulación característica (cariolisis), pudiendo aparecer vacuolas citoplasmáticas (Figura 7).
Sin embargo, es importante destacar que en muestras antiguas también se observan neutrófilos degenerados que no se deben a infección bacteriana, por lo cual, será importante ver o remitir la muestra a un laboratorio especializado lo antes posible.
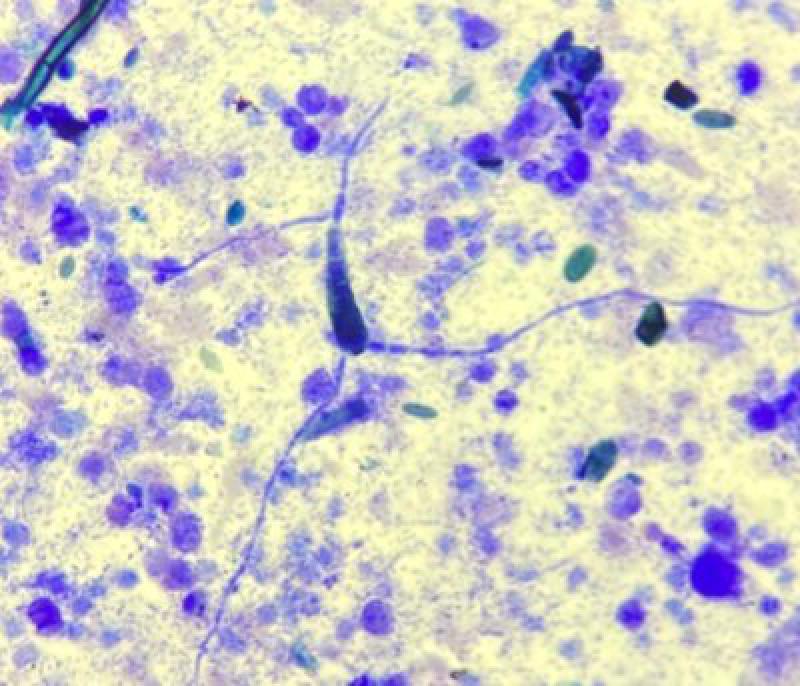
En algunos casos podrán observarse bacterias en la citología, ya sea de manera intra o extra celular. La presencia intracelular de bacterias confirma la infección, mientras que su presentación extracelular puede deberse también a contaminación ambiental u orofaríngea.
Por otro lado, la ausencia de bacterias en la citología no descarta una infección, por lo que si aparecen neutrófilos degenerados y el animal muestra signos clínicos compatibles, debe descartarse su presencia mediante cultivo bacteriano.
La inflamación séptica con predominio neutrofílico es normalmente debida a causa bacteriana, pero puede ocurrir en infecciones fúngicas, protozoarias, virales y parasíticas.
Fúngica
La mayoría de las infecciones respiratorias causadas por agentes fúngicos son secundarias a inmunodepresión o a otra enfermedad concomitante primaria como endotoxemia o septicemia (Figura 7)16.
La imagen citológica se caracteriza por un predominio de neutrófilos, pero ocasionalmente puede aparecer mayor número de macrófagos que neutrófilos. El hongo patógeno que en más ocasiones se aísla del tracto respiratorio del caballo es Aspergillus spp.
Sin embargo, se han descrito otras especies como Coccidioides immitis, Histoplasma capsulatum o Cryptococcus neoformans (Figura 8).
Es importante diferenciar estas especies de otras como Alternaria spp. la cual puede aparecer en lavados y no representar hallazgo patológico alguno al tratarse de hongos que se encuentran de forma habitual en la cavidad orofaríngea en caballos sanos17. Es posible diferenciar Alternaria de otras especies debido a sus macroconidias septadas de manera horizontal y vertical y a su aumento de tamaño en la zona de unión a la hifa.
Protozoaria
Pneumocystis carinii puede causar neumonía en potros inmunosuprimidos o secundaria a infección bacteriana18. La imagen citológica se caracteriza por ser inflamatoria mixta de neutrófilos y macrófagos. Cuando el parásito se encuentra en forma de quiste puede ser identificado en citologías de lavados broncoalveolares y traqueales, pero los trofozoítos libres son difíciles de localizar. Los quistes poseen un diámetro de 5 a 10 μm y contienen de 4 a 8 cuerpos intraquísticos basófilos.
Vírica
Aunque existen en la bibliografía atipias celulares descritas las cuales son características de infección vírica (marginación de la cromatina, ciliocitoftoria y multinucleación), lo cierto es que estos cambios rara vez se reconocen y pueden ser inespecíficos.
Con mucha frecuencia, las infecciones virales graves se acompañan de una infección bacteriana secundaria. Los hallazgos citológicos por lo tanto no serán significativamente diferentes en los que encontramos en una neumonía bacteriana primaria, es decir muestras con un mayor número de neutrófilos.
Parasitaria/hipersensibilidad
Un aumento de eosinófilos en la citología nos informa de una reacción a alérgenos inhalatorios o a parásitos pulmonares. Caballos que sufren una infestación de Dictyocaulus arnfieldi presentarán eosinofilia en el lavado broncoalveolar o traqueal y se pueden identificar larvas de este parásito en heces mediante el método de Baermann19.
| Tabla 2. Diferencias más significativas entre asma leve y severo. |
| Asma leve | Asma severo |
| Generalmente caballos jóvenes | Generalmente caballos adultos |
| Signos clínicos sólo durante el ejercicio e intolerancia leve | Intolerancia al ejercicio severa y signos clínicos en reposo |
| Inflamación neutrofilica leve (<20%), posible incremento de eosinófilos y mastocitos | Inflamación neutrofilica severa (>25%) con aumento marcado de moco |
La causa de este incremento se encuentra aún bajo estudio. Aunque menos habituales que en lavado traqueal, también encontraremos células epiteliales columnares y cuboidales. Las células columnares provienen de las vías aéreas mayores (tráquea y bronquio) y las células cuboidales de las vías aéreas menores (bronquio-bronquiolo).
Estas últimas se caracterizan por una alta relación núcleo:citoplasma, con núcleos redondos y centrales de pequeño a mediano tamaño, cromatina fina granular y citoplasma moderado13.
Inflamación no séptica
La inflamación no séptica de las vías respiratorias inferiores equinas se caracteriza por la presencia de células inflamatorias sin (aparentemente) ningún agente etiológico causante. Distinguiremos dos tipos:
- Asma leve: anteriormente conocido como enfermedad inflamatoria de vías respiratorias (IAD por sus siglas en inglés).
- Asma severo: antes conocido como enfermedad pulmonar obstructiva crónica (COPD) u obstrucción recurrente de vías aéreas (RAO).
La característica principal que comparten estas dos enfermedades es que son causas comunes de bajo rendimiento, caracterizadas por una respuesta estéril mediada por neutrófilos en las vías respiratorias. Las diferencias más marcadas entre las dos patologías se recogen en la Tabla 2.
Asma leve
Caballos de cualquier edad pueden verse afectados por esta patología, sin embargo, se describe con mayor frecuencia en caballos jóvenes (de 2 a 4 años) de carreras13. Los signos clínicos se observan durante el ejercicio y permanecen ocultos cuando el caballo está en reposo.
La causa etiológica es aún desconocida, pero se cree que puede ser multifactorial y se barajan las siguientes hipótesis:
- Una infección leve de tipo bacteriana o vírica permanente.
- Una reacción a la sangre producida debido a una hemorragia pulmonar inducida por ejercicio (HPIE).
- Alérgenos ambientales, polvo o moho procedente de la cuadra o del heno.
El diagnóstico de esta enfermedad se realiza principalmente mediante lavado broncoalveolar. Los caballos que padecen asma leve mostrarán un incremento celular en los lavados compuesto principalmente por un número elevado de neutrófilos (5-20 %), linfocitos y monocitos. En caballos jóvenes que padecen esta enfermedad también se observa un incremento de mastocitos y eosinófilos13.
Asma severo
Se da más en caballos adultos y se caracteriza por un aumento excesivo de moco, aumento de neutrófilos en el recuento diferencial, hiperreactividad bronquial, broncoespasmo e intolerancia al ejercicio mostrando signos respiratorios incluso en reposo.
Aunque la etiología no está claro aún, se cree que es una reacción al polvo y moho que se encuentra en la paja y heno, lo que da lugar a una respuesta inflamatoria excesiva20. En los últimos años se ha descrito también una variante denominada enfermedad pulmonar obstructiva asociada a pastos de verano (SPAOPD).
Esta ocurre en animales que no se encuentran estabulados y los síntomas ocurren en el verano y el otoño cuando se alojan en el pasto. Se cree que el causante de la hiperreactividad en estos caballos es el polen inhalado21.
La imagen citológica muestra un aumento de los neutrófilos (>25 %), con una reducción del número de linfocitos y macrófagos. Esto normalmente se ve acompañado de un aumento de moco y en ocasiones en procesos crónicos se pueden observar espirales de Curschmann (Figura 9).
En la mayoría de los casos, los mastocitos y eosinófilos (a diferencia del asma leve) no se ven aumentados21. Otra característica que nos podría indicar que estamos ante un caso de asma severo es encontrar acúmulos de células epiteliales hiperplásicas y un aumento de células caliciformes22.
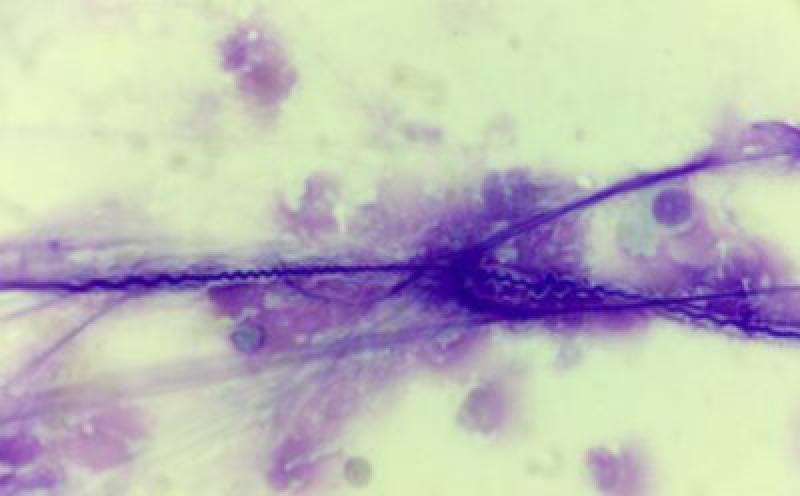
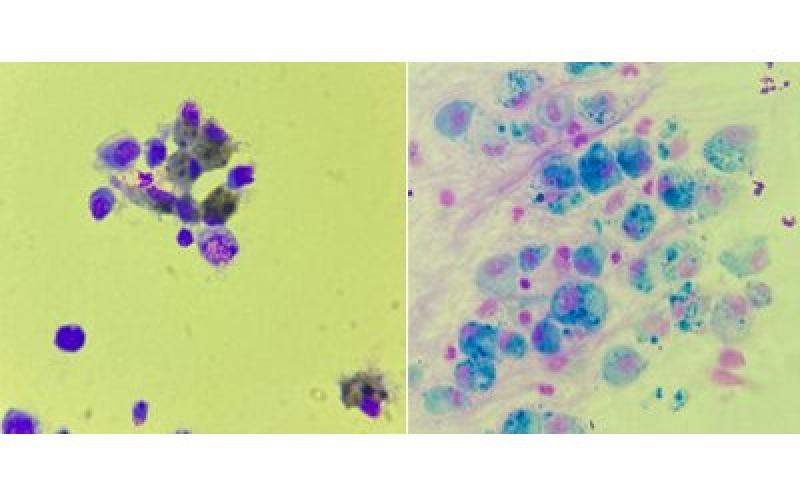
Se ha descrito una superposición citológica entre caballos con asma leve y casos en remisión de asma severa7, por lo que los hallazgos citológicos también deben interpretarse junto con la historia clínica y los hallazgos endoscópicos para un diagnóstico más específico. El examen de lavado broncoalveolar se considera superior al lavado traqueal en términos de especificidad y sensibilidad para confirmar el diagnóstico de asma leve/severo20.
Debe tenerse en cuenta que, aunque existe la hipótesis de que el asma leve es la fase inicial de asma severo, aún no se ha demostrado. No se debe interpretar por tanto como una única enfermedad, pero sin embargo, caballos con asma leve tendrán más posibilidades de desarrollar asma severo23.
Otras afecciones respiratorias
Hemorragia pulmonar inducida por ejercicio
La hemorragia pulmonar inducida por ejercicio (HPIE) es una patología común en caballos de carreras, la cual da lugar a disminución del rendimiento. Algunos caballos pueden mostrar epistaxis además de sangrado de las vías respiratorias bajas, pero no es lo habitual24.
La confirmación del diagnóstico puede realizarse mediante lavados traqueales en los que se observen eritrocitos o lavados alveolares con eritrocitos o macrófagos con hemosiderina (Figura 10). Como ya hemos mencionado la relación entre asma leve y HPIE no se encuentra clara y debe ser objeto de estudio.
Aspiración de humo
Debido a que la vida media de los macrófagos es muy prolongada, se pueden encontrar partículas de carbón en los macrófagos alveolares de animales que hayan sufrido inhalación de humo en los últimos meses e incluso años25.
Artefactos y contaminación
Otras observaciones normales en lavados traqueales y broncoalveolares de caballos clínicamente sanos incluyen cantidades variables de moco (generalmente no abundante) y células caliciformes en pequeñas cantidades. Elementos vegetales (polen) y fúngicos pueden estar presentes debido a la inhalación naso-orofaríngea y no ser patológicos (Figura 11).
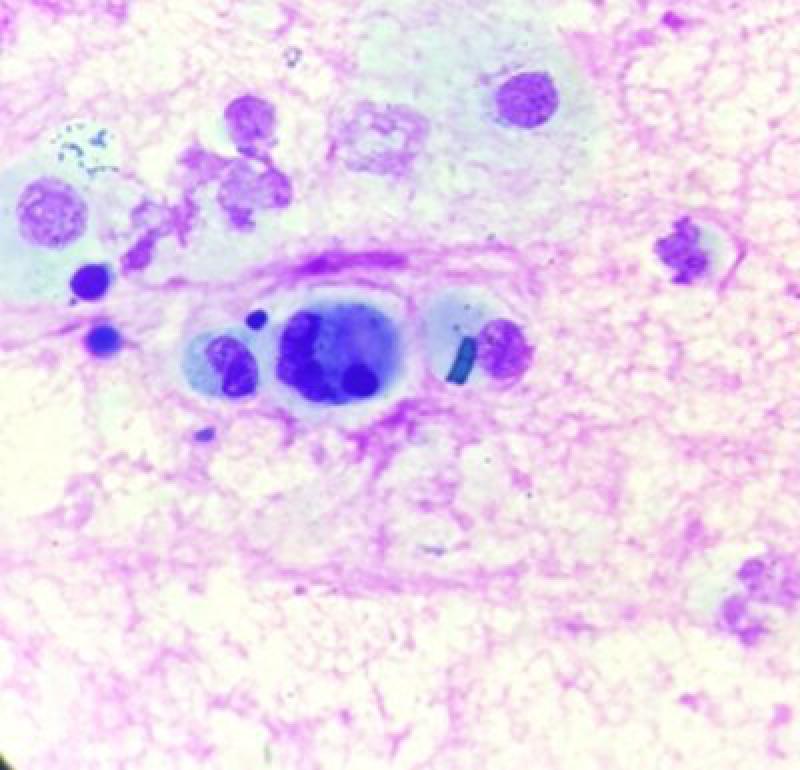
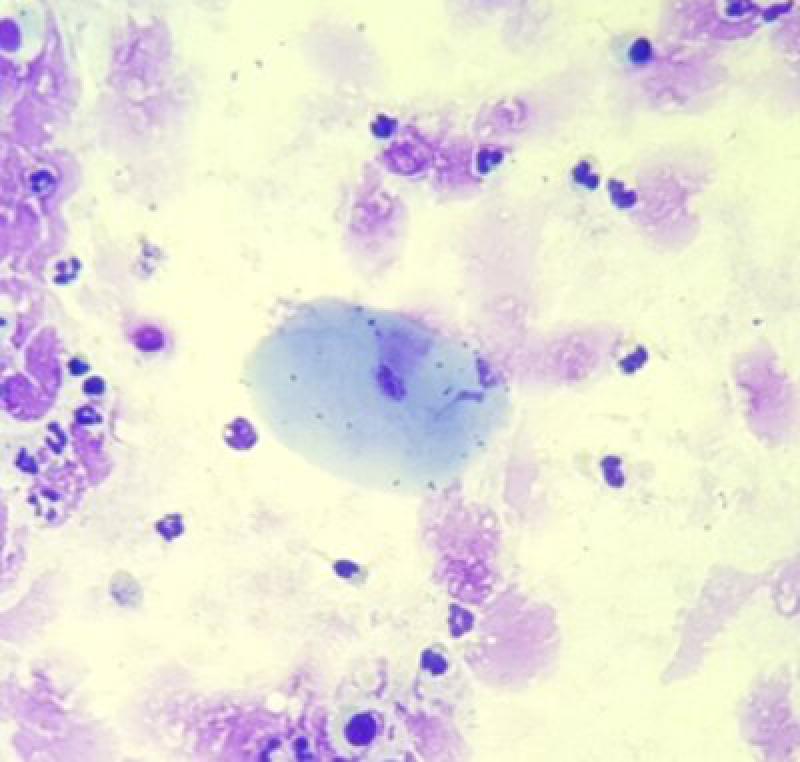
Un hallazgo frecuentemente encontrado cuando se realiza un lavado con endoscopio son células epiteliales escamosas, provenientes de cavidad orofaríngea o nasal. Estas células son aplanadas, grandes, con bordes afilados y en ocasiones pueden presentar bacterias en su superficie (Figura 12).
Bibliografia
- Hoffman and Viel: Techniques for sampling the respiratory tract of horses. Vet Clin North Am 13:463-475, 1997.
- Whitwell and Greet: Collection and evaluation of tracheobronchial washes in the horse. Equine Vet J 16:499-508, 1984.
- Pickles K, Pirie RS, Rhind S, et al. Cytological analysis of equine bronchoalveolar lavage fluid. Part 3: the effect of time, temperature and fixatives. Equine Vet J 2002;34:297–301.
- Pickles, K.J., Pirie, R.S., Rhind, S., Dixon, P.M. and McGorum, B.C. (2002) Part 2: comparison of smear and cytocentrifuged preparations Equine vet. J. 34, 288-291.
- Thompson, A.B., Teschler, H., Wang, Y.M., Konietzko, N. and Costabel, U. (1996) Preparation of bronchoalveolar lavage fluid with microscope slide smears. Eur. resp. J. 9, 603-608.
- Fleury-Feith, J., Escudier, E., Pochelle, M.-J., Carre, C. and Bernaudin, J.-F. (1987) The effects of cytocentrifugation on differential cell counts in samples obtained by bronchoalveolar lavage. Acta. Cytologica. 31, 606-610.
- Cian, Francesco & Monti, Paola & Durham, Andy. (2015). Cytology of the lower respiratory tract in horses: An updated review. Equine Veterinary Education. early view. 10.1111/eve.12376.
- Fernandez, N.J., Hecker, K.G., Gilroy, C.V., Warren, A.L. and Leguillette, L. (2013) Reliability of 400-cell and 5-field leukocyte differential counts for equine bronchoalveolar lavage fluid. Vet. Clin. Pathol. 42, 92-98.
- Bain, F.T. (1997) Cytology of the respiratory tract. Vet. Clin. North Am. Equine Pract. 3, 477-486.
- Robinson, N.E., Karmaus, W., Holcombe, S.J., Carr, E.A. and Derksen, F.J. (2006) Airway inflammation in Michigan pleasure horses: Prevalence and risk factors. Equine Vet. J. 38: 293-299
- Crane, S.A., Zieler, E.L. and Sweeney, C.R. (1989) Cytologic and bacteriologic evaluation of tracheobronchial aspirates from clinically normal foals. Am. J. Vet. Res. 50, 2042-2048.
- Piviani, M. (2014) Cytology of the lower respiratory tract. In: Equine Clinical Pathology, 2nd edn. Ed: R.M., Walton, Wiley Blackwood, Ames, Iowa. pp 233-251.
- Couetil, L.L., Hoffman, A.M., Hodgson, J., Beuchner-Maxwell, V., Viel, L., Wood, J.L. and Lavoie, J.P. (2007) Inflammatory airway disease of horses. J. Vet. Intern. Med. 21, 356-361.
- Jean, D., Vrins, A., Beauchamp, G. and Lavoie, J.P. (2011) Evaluation of variations in bronchoalveolar lavage fluid in horses with recurrent airway obstruction. Am. J. Vet. Res. 72, 838-842.
- Bain, F.T. (1997) Cytology of the respiratory tract. Vet. Clin. North Am. Equine Pract. 3, 477-486.
- Sweeney: in Smith: Large Animal Internal Medicine. St Louis,1996,Mosby, pp 576-577.
- Guida N, Mesplet M, Di Gennaro E, Digilio P, Moras EV. 2005. Presencia de Aspergillus fumigatus en la cavidad nasofaríngea de equinos. Rev Iberoam Micol 22: 160-162. doi: 10.1016/S1130- 1406(05)70031-0
- Ainsworth et al: Recognition of Pneumocystis carinii in foals with respiratory distress. Equine Vet J 25:103-108, 1993.
- Dixon et al: Equine pulmonary disease: a case control study of 300 referred cases. Part 3:Ancillary diagnostic findings. Equine Vet J 27:428-435, 1995.
- Pirie, R.S. (2014) Recurrent airway obstruction: A review. Equine Vet. J. 46, 276-288.
- Wilkins, P.A. and Woolums, A.R. (2009) Diseases of the respiratory system. In: Large Animal Internal Medicine, 4th edn. Ed: B.P., Smith, Mosby, Elsevier, St Louis, Missouri. pp 568-576.
- Zinkl, J.G. (2002) Lower respiratory tract. In: Diagnostic Cytology and Hematology of the Horse, 2nd edn. Eds: R.L., Cowell and R.D., Tyler, Mosby, Elsevier, St Louis, Missouri. pp 73-86.
- Couëtil LL, Cardwell JM, Gerber V, Lavoie JP, Léguillette R, Richard EA. Inflammatory airway disease of horses – revised consensus statement. J Vet Intern Med (2016) 30:503–15. doi:10.1111/jvim.13824
- Pasco et al: Exercise-induced pulmonary hemorrhage in racing thoroughbreds: a preliminary study. Am J Vet Res 42:703-707, 1981.
- Murphy J, Summer R, Wilson AA, Kotton DN, and Fine A. 2008. The prolonged life‐span of alveolar macrophages. Am J Resp Cell Mol Biol, 38(4): 380–385.
 by Multimédica
by Multimédica