Hematología en animales exóticos. Parte I: introducción y frotis sanguíneo en pequeños mamíferos
Resumen breve
La hematología es una herramienta fundamental en el diagnóstico laboratorial, al tratarse de una prueba moderadamente económica, poco invasiva y rápida de realizar. Nos aporta información sobre el estado del paciente como la detección de anemias y la clasificación de estas, así como la detección de estados de sepsis, problemas autoinmunes, estados de infección o inflamación activa tanto aguda como crónica, visualización de células neoplásicas o hemoparásitos.Índice de contenidos
Resumen
La hematología es una herramienta fundamental en el diagnóstico laboratorial, al tratarse de una prueba moderadamente económica, poco invasiva y rápida de realizar. Nos aporta información sobre el estado del paciente como la detección de anemias y la clasificación de estas, así como la detección de estados de sepsis, problemas autoinmunes, estados de infección o inflamación activa tanto aguda como crónica, visualización de células neoplásicas o hemoparásitos.
Al igual que en perros y gatos, en animales exóticos, un hemograma completo siempre debe incluir la valoración de un frotis sanguíneo. Éste se utiliza para realizar el diferencial de los leucocitos, la evaluación de la morfología celular y de los cambios tóxicos, la presencia de parásitos hemáticos, y cuerpos de inclusión. Siendo el frotis sanguíneo de especial interés en aves y reptiles, ya que la presencia de eritrocitos y trombocitos nucleados en su sangre dificulta la interpretación de los resultados obtenidos con contadores automatizados. En el presente artículo se realizará una revisión de la hematología en animales exóticos, enfatizando en la morfología y las características de las células sanguíneas en pequeños mamíferos para una correcta evaluación del frotis sanguíneo.
Introducción
Las pruebas de laboratorio se emplean de forma conjunta a otras pruebas complementarias para poder establecer un diagnóstico definitivo. Antes de utilizarlos es imprescindible obtener una historia clínica completa y realizar un examen físico al paciente, lo que nos permitirá seleccionar que test debemos realizar para identificar o clasificar los problemas que presenta el paciente.
Los tests laboratoriales nos permiten detectar un estado patológico sin identificar; definir, clasificar o confirmar alteraciones fisiopatológicas o enfermedades; descartar posibles causas de enfermedad; o evaluar cambios en estados patológicos tanto en la progresión natural de una enfermedad o sometidos a tratamiento médico o quirúrgico. Siendo de especial interés en las especies que enmascaran los signos clínicos por su carácter presa, hecho que dificulta obtener una información fiable durante la anamnesis o el examen físico.
La hematología es una herramienta fundamental en el diagnóstico laboratorial, al tratarse de una a prueba moderadamente económica, con poco efecto invasivo y rápida de realizar. Permite la detección de anemias y la clasificación de las mismas, así como la detección de estados de sepsis, problemas autoinmunes, estados de infección o inflamación activa tanto aguda como crónica, visualización de células neoplásicas o hemoparásitos1.
El presente artículo, publicado en dos partes, pretende realizar una revisión de la hematología en animales exóticos. En la primera parte ‘’Introducción y frotis sanguíneo en pequeños mamíferos’’, se describen las generalidades de la hematología en animales exóticos, material necesario, volumen total a extraer, accesos venosos, técnicas de realización y tinción del frotis sanguíneo; y, por último, se centra en la descripción de las células sanguíneas en pequeños mamíferos.
En la segunda parte ‘’Frotis sanguíneo en aves y reptiles e interpretación del frotis en animales exóticos” se describirán las características de las células sanguíneas del frotis de aves y reptiles, y como interpretar la información que nos proporciona el frotis en animales exóticos.
Técnicas para toma de muestra sanguíneas
El volumen de sangre que podemos extraer a un animal se calcula a partir del volumen sanguíneo de la especie y se expresa como un porcentaje del peso vivo o bien como mL/kg. Es importante calcular el volumen que podemos extraer de forma segura a un paciente, sobre todo en animales de pequeño tamaño. El volumen sanguíneo equivale a un:
- 5-8 % del peso vivo en reptiles2.
- 6-12 % del peso vivo en aves3.
- 6-8 % del peso vivo en roedores4.
- 5-7 % del peso vivo en hurones5.
- 5-7 % del peso vivo en cobayas6.
- 4,5-8.1 %, 5,5-7% del peso vivo en conejos7.
- 5,4-8,2 % del peso vivo en ratones8.
- 6,5-8 % del peso vivo en el hámster sirio 8.
- 5-7,1 % del peso vivo en ratas8.
Como norma general podemos asumir que se puede realizar la extracción del 10 % del volumen total de sangre (“1 % del peso corporal”, expresado en mililitros) en animales sanos. En animales enfermos se aconseja que éste no supere el 0,5 % del peso corporal. Cuidado con la formación de hematomas (pérdida de sangre adicional)9.
Material necesario
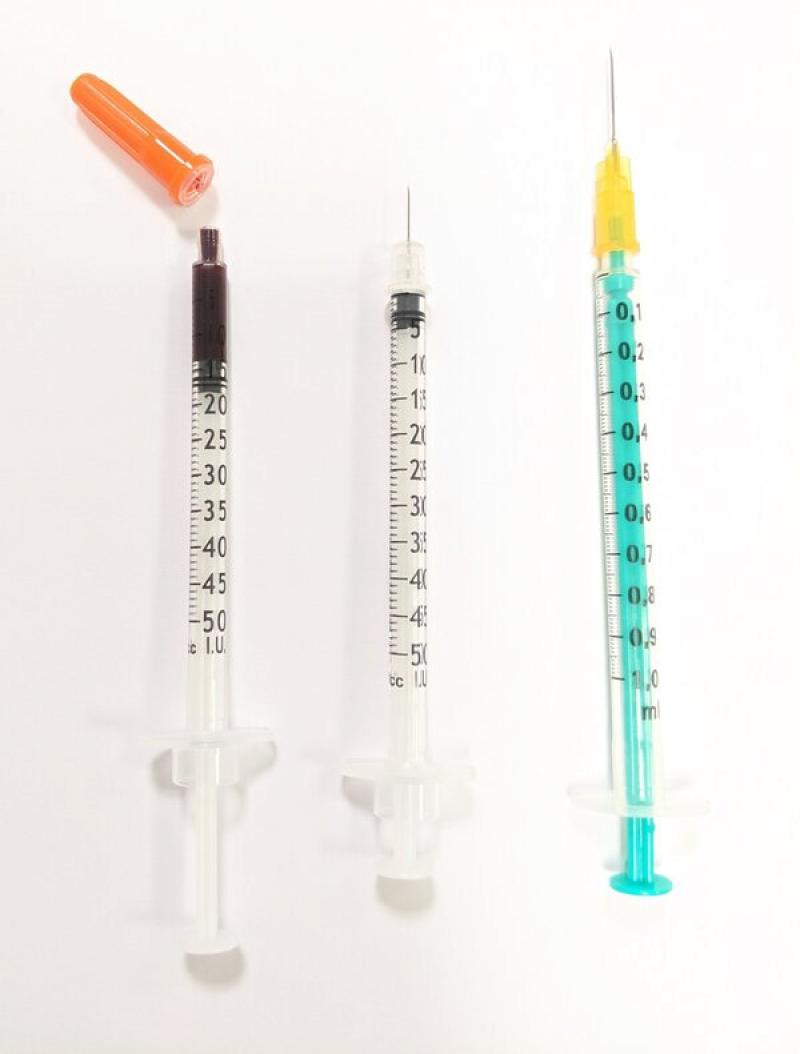
Dado el pequeño diámetro de las venas de uso común en la mayoría de los animales exóticos, deben seleccionarse agujas de pequeño calibre (22 -30G), así como jeringuillas de 0,5, 1 o 2 mL6. Se pueden emplear jeringuillas de insulina de 0,5-1 mL con aguja extraíble de 29-30G en pacientes de pequeño tamaño (Figura 1)9.
El uso de agujas de calibre 25G aumenta la incidencia de hemólisis, elevándose de forma artefactual la concentración media de hemoglobina y provocando interferencia en la medición de parámetros bioquímicos como glucosa, proteínas, albúmina, colesterol, potasio, fósforo, magnesio, lactato deshidrogenasa, creatinfosfoquinasa, aspartato aminotransferasa, alanino aminotransferasa, lipasa, sodio, cloro, fosfatasa alcalina y amilasa, entre otros10.
Existen en el mercado tubos pediátricos con anticoagulantes de 0,25 mL, 0,5 mL o 1 mL (Microtainer®, Vacutainer®, Sarstedt®, Tapval ®)9.
Para facilitar la extracción sanguínea además de la compresión de la vena, aumentar la temperatura de la zona a puncionar puede ayudar a la vasodilatación y facilitar la recolección de sangre. Para ello podemos, aplicar un guante con agua templada encima de la zona de venopunción durante alrededor de un minuto6.
Técnica de extracción de sangre
En determinados animales puede ser necesario el uso de anestesia o sedación para la obtención de una muestra sanguínea por su pequeño tamaño, imposibilidad de realizar una buena inmovilización por su carácter agresivo o mecanismos de defensa muy eficaces (como los erizos al enrollarse o las tortugas de caja con su caparazón con extremos en bisagra)2,9.
Deberemos tener en cuenta las alteraciones laboratoriales que dicha anestesia o sedación puede provocar. De la misma forma, que se deben considerar las alteraciones provocadas por el estrés asociado al manejo del paciente.
En conejos se han descrito elevaciones de un 15-30 % en el recuento de leucocitos, con heterofilia y linfopenia secundarias al estrés7. En hurones se ha descrito una reducción del hematocrito, del recuento de glóbulos rojos y blancos, proteínas plasmáticas y hemoglobina en animales anestesiados con isoflurano5.
En ratones y ratas los parámetros hematológicos están influenciados por varios factores como la zona de recolección (en ratas la sangre obtenida mediante punción cardiaca presenta menos concentración de leucocitos, eritrocitos, hemoglobina y hematocrito que la obtenida de la cola), la edad, el género, el método de sujeción, la anestesia o estrés (en ratones con estrés se ha observado menos concentración total de leucocitos) y el ritmo circadiano (el cual afecta a la concentración periférica de leucocitos, con un incremento durante el día y una disminución durante la noche)8.
Es importante realizar una buena sujeción para preservar la seguridad del paciente y del personal. En conejos es importante evitar movimientos bruscos, peligrosos debido a la potente musculatura del tercio posterior en comparación con la frágil estructura de su columna, asegurando una buena sujeción de la columna y del tercio posterior del animal, para evitar fracturas o luxaciones vertebrales.
En aves, se debe tener precaución de no restringir los movimientos respiratorios, estas dependen de los movimientos pectorales para realizar una respiración correcta7,9. Una toalla puede ser útil para envolver el ave y restringir el movimiento de las alas y de las extremidades posteriores9.
Dependiendo del tamaño del animal se necesitarán dos personas para poder realizar la extracción de forma segura. En reptiles la sujeción varía en función de la especie y también dependiendo del tamaño del animal se necesitarán dos personas para poder realizar la extracción de forma segura.
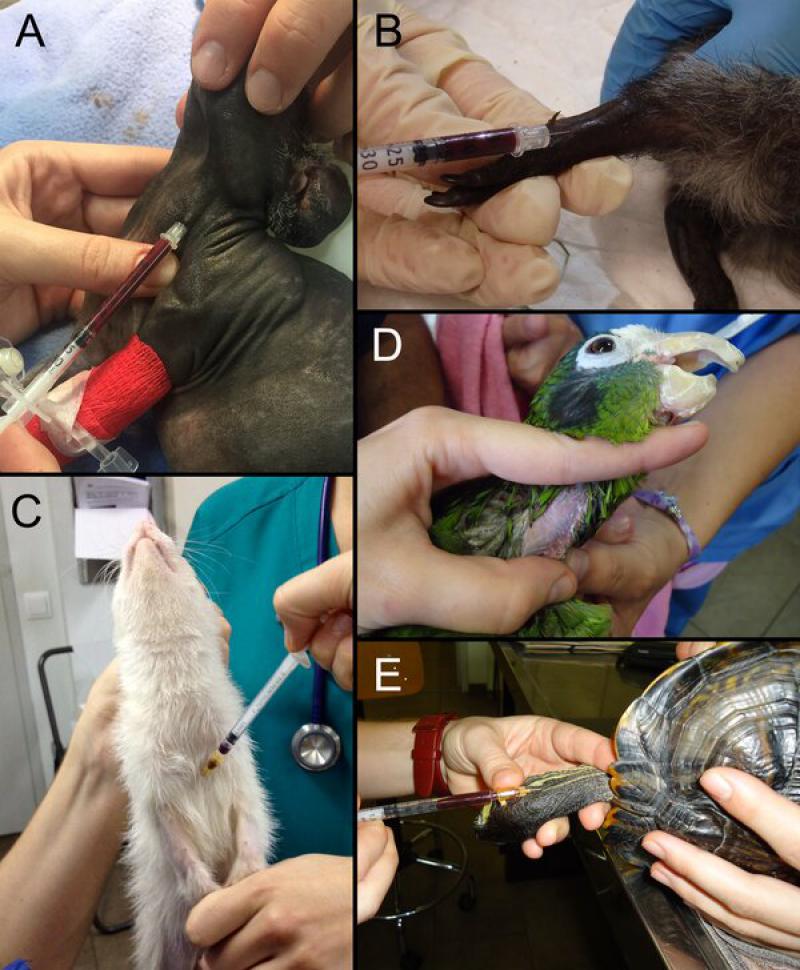
En anfibios es importante la manipulación con guantes para no producir abrasiones en su piel. Además, los guantes deben ser lavados con agua destilada para eliminar cualquier polvo dañino y proporcionar una superficie lisa8. En la figura 2 se muestran algunos ejemplos de sujeción y extracción de sangre.
Previo a la extracción sanguínea, debe realizarse rasurado de la zona en el caso de los mamíferos y la desinfección de la piel con productos antisépticos2. En algunas aves (psitácidas y paseriformes) podemos aprovechar las zonas que de forma fisiológica no poseen plumas (zonas apterigias), como por ejemplo la zona lateral del cuello para tener un mejor acceso a la vena yugular. En el resto de aves puede ayudar a la visualización el uso de alcohol para apartar las plumas adyacentes9.
La extracción debe hacerse de manera lenta para evitar colapsar el vaso. Posteriormente se debe aplicar una presión suave en la zona de punción venosa para detener el flujo de sangre y prevenir la formación de hematomas6.
Puntos de extracción de sangre
La elección del punto de punción depende de varios factores como la especie, el sexo, el tamaño o temperamento del animal, el estado de salud, el volumen necesario, y la experiencia o preferencia de la persona que realiza la extracción.
Mamíferos
Vena cefálica. Generalmente se reserva para la colocación de catéteres.
- Es bastante móvil, por lo que requiere buena sujeción. En algunas especies como pequeños roedores el acceso es difícil por el pequeño tamaño del antebrazo6.
Vena safena lateral.
- De fácil acceso y visualización, permite recolección de volúmenes de sangre de pequeños a moderados en función del tamaño del paciente6.
- En conejos es una de las venas con más fácil acceso. Con una buena técnica de sujeción la extracción se puede realizar sin sedación.
Vena yugular.
- Venas grandes y accesibles en la mayoría de las especies, aunque muchas veces no visibles. Permite la recolección de volúmenes moderados de sangre6.
- En conejos puede tener un acceso complicado, sobre todo en animales obesos o en hembras que presentan una papada grande.
- En hurones se encuentra algo más lateral que en gatos9.
- En erizos y cobayas es complicado de visualizar por su predisposición a la obesidad. Se localiza a medio camino entre el hombro y la rama de la mandíbula9.
Vena marginal de la oreja (Conejos). Fácilmente visible, pero colapsa con facilidad y solo permite la obtención de una pequeña cantidad de sangre. Puede ser irritante o producir necrosis en la zona6.
Vena cava craneal.
- Se puede utilizar en todas las especies, aunque generalmente es la vía más utilizada en hurones, debido al mínimo de riesgo de cardiocentesis por la localización caudal del corazón en esta especie9. Permite la recolección de volúmenes moderados de sangre6. No puede visualizarse o palparse6.
- Posibles complicaciones: hemorragia en mediastino / tórax / saco pericárdico, o punción cardiaca. En cobayas y otros roedores se debe utilizar con precaución y con sedación o anestesia, ya que existe riesgo de punción del pericardio.
Vena lateral de la cola (Hurones, Roedores). Generalmente se necesita sedación.
Vena metatarsiana lateral (Cobayas).
- De fácil visualización y acceso, permite recolectar pequeños volúmenes de sangre6. Pequeño calibre, fácilmente colapsable si se realiza una rápida aspiración6.
Vena femoral (Erizos, Ratas, Conejos, Hurones): obtención de pequeñas cantidades de sangre, generalmente se necesita sedación8,9.
Vena gingival (Cobayas, Ratas, Hámsteres). Acceso descrito recientemente, necesidad de anestesia para realizar el procedimiento. Mínimamente invasivo y traumático, proporciona un fácil acceso para la extracción de muestras sanguíneas de leve a moderada cantidad.
Aves
Vena yugular.
- Sitio de elección para la mayoría de las especies, muy útil en aves de pequeño tamaño en las cuales el calibre de otras venas no permite la obtención de un volumen de sangre suficiente9.
- Es más sencillo realizar hemostasia para prevenir la formación de hematomas. Se debe tener precaución ya que el espacio subcutáneo alrededor es fácilmente distensible, permitiendo una cantidad significativa de pérdida de sangre9.
- Generalmente se utiliza la yugular derecha, típicamente más grande que la izquierda9.
- Excepción: columbiformes, su visualización no es sencilla, ya que presentan un plexo venoso utilizado para la regulación de la temperatura corporal9.
Vena cubital. En aves de tamaño medio a grande. Se encuentra en el aspecto medial del codo y se visualiza mejor con el paciente en decúbito dorsal y el ala extendida9 Frecuente formación de hematomas, se debe realizar compresión durante varios minutos para lograr una adecuada hemostasia.
Vena metatarsiana medial. En aves de tamaño medio a grande. Se localiza en la zona medial del metatarso. No se producen tantos hematomas, pero sí que suele sangrar, por lo que requiere compresión de varios minutos9.
Reptiles y anfibios
En reptiles, en el momento de elegir el punto de punción es importante valorar:
- La hemodilución con linfa al realizar una extracción sanguínea es frecuente. El riesgo de hemodilución varía según la anatomía vascular, siendo menor en las venas yugulares y en el corazón. Los vasos linfáticos son generalmente más superficiales comparados con los sanguíneos. La linfa aparece como un fluido transparente justo antes de la entrada de sangre.
Las alteraciones que observaremos en el hemograma asociadas a una hemodilución con linfa son las siguientes: diminución del hematocrito, de la concentración de hemoglobina, del recuento eritrocitario y del recuento de leucocitos2. - La punción venosa en reptiles es una técnica que frecuentemente se realiza a ciegas, ya que en muchos casos visualizar la vena o ingurgitarla no es posible. El conocimiento anatómico sobre la posición de los vasos es esencial2.
- Seno cervical dorsal (Quelonios): exclusivos de tortugas marinas, en algunos casos puede ser necesaria la sedación, acceso mediante la flexión de la cabeza ventralmente 90°2.
- Seno subcarapacial (Quelonios): de fácil acceso, útil en los casos en que el acceso al cuello o las extremidades sea difícil2. Formado por la unión de los vasos intercostales más craneales y la anastomosis de las venas yugulares izquierda y derecha, localizado en la unión craneal del caparazón con la piel del cuello. La aguja se inserta en la piel ventralmente al borde craneal del caparazón en la zona media manteniendo una presión negativa mientras se introduce. Gran probabilidad de contaminación linfática9.
- Vena yugular (Quelonios, Saurios y Ofidios): en quelonios se encuentra a lo largo del cuello a nivel de la membrana timpánica y se dirige caudalmente. Puede visualizarse mejor al girar la cabeza hacia el lado contrario al lugar de extracción. Permite recolectar volúmenes moderados de sangre con contaminación mínima de linfa2,9.
- Venas palatinas o sublinguales (Ofidios): fácil visualización en el aspecto dorsal de la cavidad oral. En general desaconsejada debido al riesgo de contaminación bacteriana, además tiene un acceso difícil y es un lugar propenso a la formación de hematomas que ocasionalmente pueden causar anorexia9.
- Vena abdominal ventral (Anfibios, Saurios, Ofidios): se encuentra dorsal a la línea media ventral entre el ombligo y el esternón. Existe riesgo de laceración del vaso sin capacidad de aplicar presión después del procedimiento y punción de vísceras2.
- Vena coccígea ventral (Urodelos, Saurios, Ofidios). Precaución en especies con autotomía, y con los hemipenes en machos (se extienden de 14 a 16 escamas subcaudales en ofidios) y las glándulas almizcleras de las hembras (que se extienden hasta 6 escamas subcaudales en ofidios). Se localiza en la zona ventral de la cola, caudal a la cloaca, no es posible la visualización directa. La extracción se realiza insertando la aguja en la línea media ventral a la cola, entre las escamas, con una inclinación de 45-60° hasta tocar la vértebra y retirar lentamente mientras se mantiene una ligera presión negativa9. Existe riesgo de contaminación linfática2. En saurios se puede acceder desde el aspecto ventral o lateral de la cola, aunque con el último hay más riesgo de contaminación linfática.
- Vena coccígea dorsal (Quelonios): fácil acceso mediante la extensión de la cola. La extracción se realiza insertando la aguja inclinada con un ángulo de 45-90° avanzando hacia craneal con presión negativa retrocediendo al llegar a la vértebra. Recolección de volúmenes pequeños, riesgo de contaminación linfática9.
- Plexo braquial (Saurios, Quelonios): localizado cerca del tendón del tríceps, pudiéndose palpar cerca de la cara caudal de la articulación del codo9.
- Plexo venoso lingual (Anfibios): fácil visualización, ventral a la lengua, precaución con fracturas mandibulares a la apertura bucal. Posible contaminación con secreciones orales9.
- Cardiocentesis (Ofidios, Anfibios): riesgo de laceración cardiaca y contaminación con líquido pericárdico. Permite recolectar grandes volúmenes, importante ejercer una presión negativa leve, no redirigir y acompañar a los movimientos del corazón2. Se coloca al paciente en decúbito dorsal y se visualiza el corazón al observar el impulso cardiaco. Se estabiliza el corazón entre dos dedos y se introduce la aguja caudalmente al choque de punta en un ángulo de 45°9.
Procesado de las muestras
La selección del anticoagulante depende de la especie considerada. En pequeños mamíferos, al igual que en perros y gatos, el anticoagulante de elección es el EDTA. En aves se recomienda el uso de citrato y EDTA, ya que la heparina puede causar agregación de leucocitos y trombocitos. El EDTA puede causar hemólisis o poseer un efecto anticoagulante incompleto en determinadas aves como son los córvidos, algunas anátidas, grullas, avestruces y cucaburras, entre otras1.
En reptiles, existe una gran heterogeneidad de opiniones en cuanto a la elección del anticoagulante. Muchos trabajos publicados utilizan la heparina de sodio o de litio como anticoagulante de elección en hematología de reptiles. Aunque puede causar aglutinación de leucocitos y de trombocitos. Además, da una coloración azulada a los frotis sanguíneos que puede dificultar la evaluación de la morfología celular2.
En reptiles el EDTA puede causar hemólisis, especialmente en quelonios, por lo que en estas especies su uso está desaconsejado. En cambio, se considera el anticoagulante de elección en iguanas (Iguana iguana) y en dragones de agua chinos (Physignathus cocincinus) y posiblemente la mayoría de lagartos2.
Algunos autores prefieren el uso de citrato en reptiles, otros los desaconsejan debido a que provoca cristalización de la hemoglobina y produce hemólisis.
Aunque aparece ampliamente descrita en la bibliografía, la práctica de impregnar con heparina la jeringa antes de la extracción de sangre no es una técnica adecuada debido a la inexactitud de la misma y a los artefactos que causa en el hemograma.
Hematología clínica
La hematología es una prueba fundamental para la evaluación general de la salud del paciente, la progresión clínica de la enfermedad y la respuesta al tratamiento12,13.Incluye:
- Hematocrito
- Hemoglobina
- Recuento total de eritrocitos
- Valores corpusculares medios
- MCV: volumen corpuscular medio
- MCH: hemoglobina corpuscular media
- MCHC: concentración media de hemoglobina corpuscular
- Recuento de reticulocitos
- Recuento total de leucocitos
- Recuento diferencial de leucocitos
- Recuento de trombocitos
- Morfología celular de eritrocitos, leucocitos y trombocitos
Al igual que en perros y gatos, en animales exóticos, un hemograma completo siempre debe incluir la valoración de un frotis sanguíneo. Éste se utiliza para realizar el diferencial de los leucocitos, la evaluación de la morfología celular y de los cambios tóxicos, la presencia de parásitos hemáticos, y cuerpos de inclusión. Siendo el frotis sanguíneo de especial interés en aves y reptiles, ya que la presencia de eritrocitos y trombocitos nucleados en su sangre dificulta la interpretación de los resultados obtenidos con contadores automatizados1.
Frotis sanguíneo: recuento estimado sobre el frotis sanguíneo y valoración de la morfología celular
Para la evaluación del frotis sanguíneo es necesario un microscopio binocular con alta calidad y objetivos 10x, 40x y 100x. Se puede emplear portaobjetos de vidrio liso o esmerilado en un extremo, que facilita el etiquetado con la información del paciente12. Los frotis sanguíneos deberían ser uniformes con el objetivo de crear una monocapa de células. Las células más grandes, como monocitos y heterófilos, se concentran en los márgenes de la extensión1.
Para la estimación total de glóbulos blancos, se realiza el contaje de 100 leucocitos consecutivos en el área monocapa del frotis sanguíneo, obteniendo un porcentaje relativo de cada tipo celular clasificándose en: neutrófilos o heterófilos (según la especie), eosinófilos, basófilos, linfocitos y monocitos8,14.
También es importante evaluar la morfología y las características de los eritrocitos, describiendo cambios en la forma celular, cambios de color, presencia de inclusiones y en el caso de los vertebrados inferiores cambios en la posición del núcleo celular.
En el caso de las plaquetas es necesaria su estimación mediante el contaje en 10 campos de 100x, realizando la media y multiplicando el número resultante por 15.000; comprobando la presencia de agregados plaquetarios y evaluando su morfología, con especial atención a su tamaño14,15. La observación de 5-10 plaquetas por campo de 100X se interpreta como un número adecuado.
Técnicas para realizar frotis sanguíneos
La preparación del frotis consiste en colocar una gota de sangre (de 2 a 3 mm de diámetro) en uno de los extremos de un portaobjetos de vidrio y a continuación, extender la misma empleando diferentes técnicas: portaobjetos-portaobjetos (el más utilizado), portaobjetos-cubreobjetos o cubreobjetos-cubreobjetos12.

El frotis perfecto debe ocupar la mitad o dos terceras partes de la superficie del portaobjetos, ser más grueso al inicio y progresivamente más fino hacia la cola, ser uniforme, tener una forma de llama y no alcanzar los bordes del portaobjetos (Figura 3). En el frotis sanguíneo se distinguen tres zonas: cabeza, cuerpo (donde encontraremos el área de recuento o zona en monocapa) y cola.
En la cabeza y la parte más proximal del cuerpo las células están superpuestas, salvo en las muestras con un valor hematocrito bajo, siendo difícil observar los detalles celulares. El área de recuento o zona en monocapa es un área elíptica que comienza donde el frotis empieza a adquirir forma de llama.
En ella, las células se sitúan próximas entre sí, lo que permite apreciar con claridad los detalles celulares; es aquí donde se debe estudiar la morfología de las células y hacer el recuento diferencial leucocitario.
La cola del frotis no es una buena zona para apreciar la morfología celular, ya que muchas células aparecen distorsionadas o rotas; sin embargo, es importante evaluarla, así como los bordes, ya que es donde tienden a localizarse los agregados plaquetarios, las células grandes anormales y los parásitos sanguíneos extracelulares o intracelulares14. Para obtener la máxima información de los tres componentes celulares sanguíneos, es preciso efectuar el examen microscópico del frotis sanguíneo de forma sistemática:
Realizar un barrido del frotis con el objetivo de 10x y observar:
- Si la tinción es correcta.
- Si existe una correlación entre el recuento eritrocitario y la distribución de los eritrocitos en el frotis (en casos de anemia la separación entre los hematíes es mayor y la zona de monocapa se amplía).
- La presencia de aglutinación o de pilas de monedas.
- Si la distribución de los leucocitos en la zona de monocapa es uniforme. Si aplicamos una presión excesiva al realizar la extensión la mayoría de leucocitos se acumularán en los bordes y en la cola1.
Examinar la zona en monocapa del frotis con el objetivo de 100x para:
- Observar los eritrocitos: distribución y morfología. Así como la presencia de parásitos eritrocitarios.
- Realizar el recuento diferencial leucocitario. Y detectar posibles alteraciones morfológicas.
- Realizar una estimación del número de plaquetas/trombocitos, y estudiar su morfología1.
Tinciones
Las tinciones Romanowsky a base de metanol como Giemsa, Wright, o Wright-Giemsa, son las más utilizadas. Aunque son más laboriosas, ofrecen mejor calidad de frotis y menos artefactos12.
Las tinciones acuosas Romanowsky como la Diff-Quick® posen la ventaja de realizarse en muy poco tiempo y aunque permiten distinguir los diferentes tipos celulares, pueden alterar la tinción de linfocitos, ofrecen un menor detalle de las características nucleares y de los gránulos citoplasmáticos (los gránulos de los heterófilos aparecen más fusionados, siendo más complicado diferenciar por ejemplo heterófilos y eosinófilos) y tienden a subestimar los eritrocitos inmaduros. Pueden dar lugar a artefactos como degranulación12.
Valoración de la morfología celular
La evaluación celular en animales exóticos requiere un buen conocimiento de la morfología celular en las diferentes especies y mucha práctica1. En el presente artículo, se explicarán las características de las células sanguíneas de pequeños mamíferos.
Eritrocitos
Los eritrocitos tienen 3 funciones principales: el transporte de oxígeno a los tejidos, el transporte de CO2 a los pulmones y el tamponamiento de iones hidrógeno. Vida media: roedores: 45-68 días, jerbos: 9-10 días, conejos: 45-70 días7,8.
La vida media de los eritrocitos, generalmente, se relaciona con el peso corporal y la tasa metabólica, por lo que los animales más pequeños (con mayor tasa metabólica) tienen una menor vida media de sus eritrocitos. Los eritrocitos envejecidos son fagocitados por los macrófagos del sistema mononuclear fagocitario.
Morfología: discos bicóncavos sin núcleo, por ello se observa una palidez central cuando se observan frotis al microscopio. La gran ventaja de esta forma es que presenta una mayor superficie lo que permite que puedan sufrir deformaciones durante su circulación sin romperse.
Tamaño: cobayas: 6,6-7,9 µm (mayor que en otros roedores)6, conejos: 6,8 µm (aunque la anisocitosis es frecuente)7, hurones: 4,6-7,7 µm8.
Anormalidades morfológicas de los eritrocitos: se pueden encontrar las mismas que las descritas en perros y gatos: pilas de moneda, aglutinación, policromasia, anisocitosis, hipocromasia, poquilocitosis, eritrocitos nucleados e inclusiones eritrocitarias.
La presencia de un bajo número de cuerpos de Howel-Jolly, punteado basofílico (característica frecuente en jerbos) o células nucleadas es común en frotis de roedores. En hámsteres hasta un 2 % de células nucleadas se considera normal. En conejos se puede observar ocasionalmente eritrocitos nucleados o cuerpos de Howell-Jolly7.
Eritrocitos policromatófilos vs reticulocitos: “Todos los policromatófilos son reticulocitos. No todos los reticulocitos son policromatófilos” (Figura 4).Los eritrocitos policromatófilos son el penúltimo estadio de desarrollo de los eritrocitos, los cuales han sido liberados de forma temprana a la circulación. Si los comparamos con los eritrocitos maduros, tiene un citoplasma más azulado y un patrón de cromatina menos denso y son de mayor tamaño.
El recuento de reticulocitos presente en la sangre periférica es un indicador de la actividad eritropoyética. Mediante tinciones vitales como el azul de metileno o el azul cresil brillante se pueden evidenciar los restos de ARN en forma de gránulos de precipitados basófilos en el citoplasma del eritrocito. En la práctica clínica, un método sencillo de detectar evidencia de regeneración consiste en examinar el frotis y cuantificar la presencia de células policromáticas e inmaduras.
Roedores. Generalmente tienen mayor concentración de reticulocitos comparados con otros mamíferos, presentando de forma fisiológica un grado mayor de policromasia y anisocitosis en su frotis sanguíneo. Se cree que es debido a la corta vida media de sus eritrocitos. Los eritrocitos policromatófilos representan entre 2-18 % del número total de eritrocitos (ratas y ratones sanos). En animales adultos los porcentajes varían entre 2-7 % pero en ratas/ratones jóvenes pueden alcanzar el 10-20 %.
En general para todos los roedores hablamos entre 1-5 % (recuento absoluto 150.000-300.000/µL). En cobayas se observan un 25 % de eritrocitos policromatófilos en neonatos, 4,5 % en juveniles y 1,5 % en adultos6. En conejos la policromasia también es frecuente (2-4 % del total de eritrocitos), siendo más elevada en animales jóvenes (2,7-12,1 %, en animales de 2 meses)7.
Leucocitos
Podemos distinguir 2 grupos de leucocitos: los granulocitos o polimorfonucleares, que comprenden neutrófilos/heterófilos, basófilos y eosinófilos; y los agranulocitos o mononucleares, formado por monocitos y linfocitos (en menor medida células plasmáticas).
Linfocitos (Figura 5)
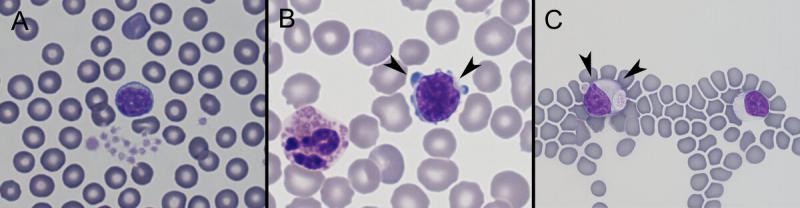
Producción: órganos linfoides y otros tejidos linfoides (nódulo linfático, timo, bazo y médula ósea).
Vida media: larga, son las únicas células que pueden recircular, con una vida media de meses a años16.
Distribución: órganos linfoides y sangre; tejidos: tonsilas, BALT, GALT.
Tipos de linfocitos:
- linfocitos B: células plasmáticas (producen anticuerpos).
- linfocitos T (CD4, CD8, Natural Killer): regulan respuesta inmune, destrucción células tumorales o infectadas por virus.
Los linfocitos reactivos: suelen observarse en sangre periférica como respuesta a un estímulo antigénico. Pueden ser de mayor tamaño y presentar cambios como citoplasma más basófilo, más abundante, en ocasiones con vacuolas y también pueden observarse nucléolos en el núcleo.
Morfología: generalmente el citoplasma es de azul claro a oscuro.
Tamaño: variable. En conejos la mayoría de los linfocitos en sangre periférica son de pequeño tamaño (7-10 µm), en menor número: linfocitos grandes (10-15 µm). En hurones: 6-10 µm (linfocitos pequeños), 11-12 µm (linfocitos grandes).
Los linfocitos son los leucocitos mayoritarios en ratas (70-80 %), ratones (60-75 %) y cobayas (40-80 %)6.
En cobaya y capibaras. Aproximadamente entre el 3-4% de los leucocitos en sangre periférica son células mononucleares grandes, que contienen una inclusión citoplasmática, única y grande denominada cuerpo de Kurloff, el cual desplaza el núcleo a la periferia.
Tiene un aspecto granular, color rojizo y un tamaño que varía entre 1 y 8 μm. Estas células parecen estar influenciadas por hormonas sexuales (están presentes en menor número en animales inmaduros) y su producción parece aumentar bajo la influencia del aumento de estrógenos. Su función exacta es desconocida, pero se cree que tienen una función parecida a las células Natural Killers6,15.
Monocitos (Figura 6)
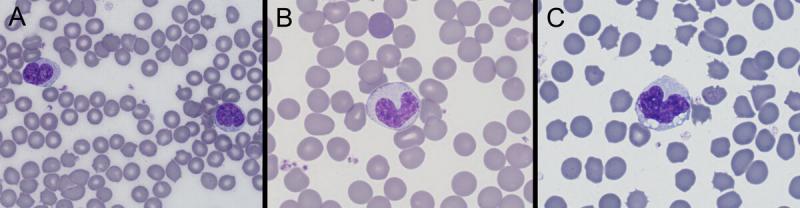
Los monocitos en sangre periférica se corresponden con los macrófagos en los tejidos.
Producción: médula ósea (1-3 días). No se almacenan, son liberados a medida que se producen.
Vida media: no descrita para estas especies, sin embargo, en perros suele ser de 18 a 23 horas circulando en sangre17.
Distribución: no está claro que exista un pool marginal, pero existen macrófagos propios de determinados tejidos.
Funciones: fagocitar y digerir partículas extrañas o material de desecho de células muertas, menos eficaces contra los microorganismos que los neutrófilos/heterófilos, producen sustancias que regulan hematopoyesis y modulan respuesta inflamatoria (citoquinas), presentan antígenos a linfocitos T, citotoxicidad: eliminan células infectadas con virus o células tumorales.
Tamaño: roedores 17 μm (1,6 % total de leucocitos en ratas y 0,2 % en ratones), conejos: 15-18 μm7, hurones: 12-18 μm5.
Morfología: núcleo de forma variable (redondo, ovalado, indentado o lobulado). Típicamente estas células contienen un abundante citoplasma, color azul claro-gris, pueden presentar vacuolas. Pueden tener finos gránulos basofílicos en el citoplasma.
Neutrófilos/Heterófilos (Figura 7)
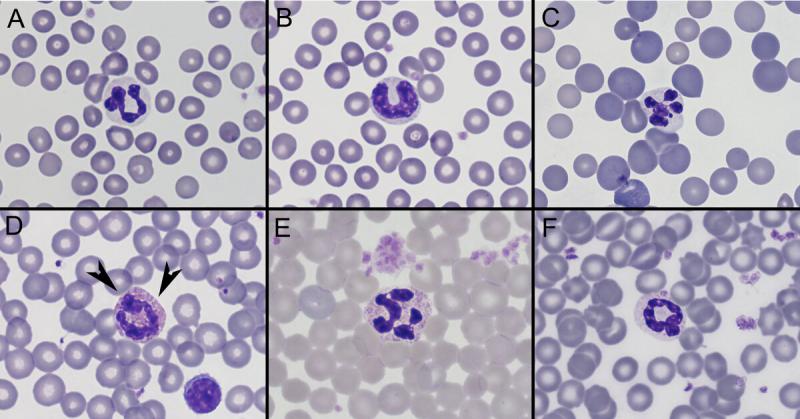
Producción: médula ósea
Vida media la vida media no está descrita en estas especies, pero en perros su periodo de vida es extremadamente corto (de horas a días, unas 10h en sangre)18.
Destrucción: macrófagos en bazo, hígado, médula ósea u otros tejidos. También excreciones y secreciones.
Distribución: Los neutrófilos se distribuyen entre el pool circulante (circulando en sangre periférica), pool marginal (adheridos a las paredes de los vasos) y en los tejidos inflamados.
Funciones: fagocitosis y acción antimicrobiana; adherencia y migración a través de vasos sanguíneos; quimiotaxis: ingestión y degranulación.
Tamaño: rata 11 µm, cobaya: 10-12 µm6, conejos: 10-15 µm7, hurones: 9-13 µm5.
Morfología: se pueden identificar 2 tipos de neutrófilos (segmentados y en banda). Los neutrófilos en banda son neutrófilos inmaduros (núcleo sin segmentaciones).
- Desviación a la izquierda: es la presencia de neutrófilos inmaduros en sangre periférica, sobre todo neutrófilos con núcleos en banda y en alguno casos neutrófilos más inmaduros (metamielocitos o mielocitos). La desviación a la izquierda suele asociarse a procesos inflamatorios infecciosos o no infecciosos.
Los heterófilos inmaduros presentan basofília citoplasmática aumentada, núcleo no segmentado, gránulos citoplasmáticos inmaduros. - Hipersegmentación o desviación a la derecha: se define como la presencia de 5 o más lobulaciones nucleares en los neutrófilos. Es un proceso normal de envejecimiento de los neutrófilos en sangre periférica y puede reflejar un incremento de su tiempo en circulación que puede ocurrir en inflamación crónica en resolución, administración de glucocorticoides o hiperadrenocorticismo.
- Cambios tóxicos: basofília citoplasmática aumentada, vacuolización y/o cuerpos de Döhle. Alteraciones nucleares: cariolisis, cariorrexis, hiposegmentación, núcleos en anillos y binucleación. Estas alteraciones morfológicas se producen en la médula ósea antes de su liberación al torrente sanguíneo. Los neutrófilos tóxicos se ven principalmente asociados a condiciones inflamatorias graves.
Conejos, cobayas, hámsteres y jerbos los neutrófilos poseen unos gránulos que se tiñen intensamente eosinófilos, de ahí que algunos autores denominan a estas células heterófilos. Para diferenciarlos de los “eosinófilos verdaderos” hay que comparar el tamaño de los gránulos, que es mayor en eosinófilos.
En ratas los neutrófilos típicamente tienen pocos segmentos (aunque tienen indentaciones: forma de herradura de caballo, salchicha o anillo), a diferencia de los ratones, que generalmente son segmentados. El núcleo en forma de anillo también es típico en ratones y jerbos. Los neutrófilos en chinchillas son típicamente hiposegmentados. En cobayas los gránulos eosinófilos de los heterófilos son redondeados, diferenciándose de los gránulos de los eosinófilos que son alargados6.
Eosinófilos (Figura 8)
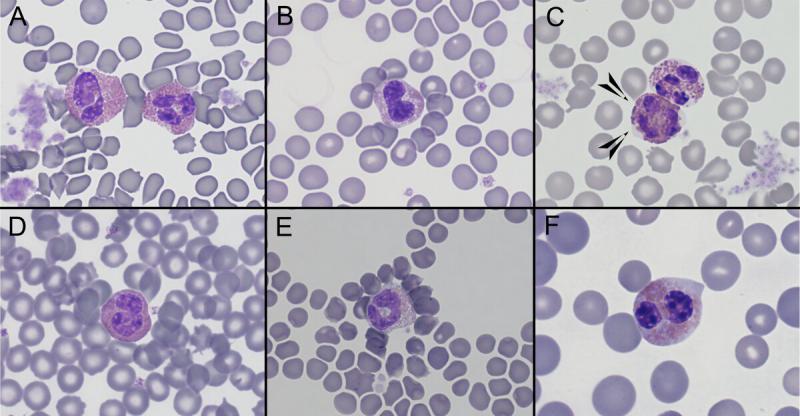
Producción: médula ósea
Vida media: no está descrita en estas especies, pero en perros es mucho menor a la de los neutrófilos [de minutos a varias horas (unos 30 minutos en circulación), en comparación con las 4 a 8 horas de los neutrófilos]18.
Distribución: pool marginal y mínima recirculación.
Funciones: destrucción de parásitos (junto a otras células del sistema inmune), promueve inflamación (asma y alergia), actividad fagocítica similar a neutrófilos per menos efectiva.
Tamaño: cobayas: 10-15 µm6, conejos: 12-16 µm (más grandes que los heterófilos)7, hurones 12-14 µm5.
Morfología:
- Roedores. Gránulos intensamente eosinofílicos. Núcleo en forma de anillo o de U, citoplasma basófilo y número elevado de gránulos redondos en el citoplasma. Los gránulos de los ratones son grandes, uniformes con márgenes poco definidos. En las ratas son pequeños y numerosos. Los gránulos de los hámsteres tienen una forma alargada.
- Cobayas. Los gránulos de los eosinófilos son más grandes que los de los heterófilos, y el núcleo presenta una segmentación nuclear menor6.
- Conejos. Los gránulos de los eosinófilos son entre 3 y 4 veces más grandes y más numerosos que los de los heterófilos7, siendo una de las especies donde la diferenciación de estas células es más complicada.
Basófilos (Figura 9)
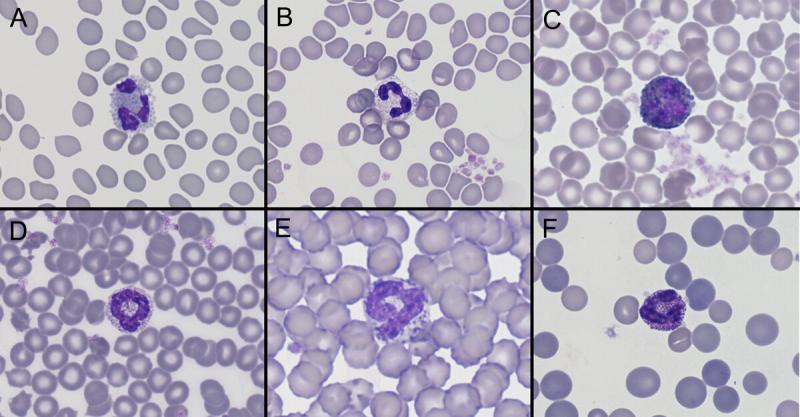
Producción: en médula ósea.
Vida media: no está descrita en estas especies.
Distribución: sangre.
Funciones: destrucción de parásitos junto a otras células del sistema inmune, interviene en la hemostasia (liberan heparina), promueven el metabolismo de lípidos.
Tamaño: en cobayas tienen el mismo tamaño que los heterófilos. En hurones presentan un tamaño de unos 14 µm independientemente del sexo del individuo1.
Morfología: gránulos basófilos (variación de color en algunas especies).
- Cobayas: son ligeramente más grandes que los heterófilos con núcleos lobulados y gránulos intracitoplasmáticos de color púrpura rojizo a negro de tamaño variable6.
Plaquetas
Las plaquetas se forman de fragmentos citoplasmáticos que provienen de los megacariocitos en la médula ósea, y participan en la hemostasia. Son discos planos, redondeados, aunque pueden variar enormemente de forma y tamaño. No contienen núcleo. El citoplasma contiene un número variable de gránulos púrpuras pequeños.
Las plaquetas de los mamíferos son mucho más pequeñas que los eritrocitos. La vida media no está descrita en estas especies, pero en perros es de aproximadamente de cinco a siete días, mientras que en gatos sobreviven poco más de un día18.
La concentración de plaquetas en la mayoría de los mamíferos es superior a 100.000/mL.
- en roedores tiende a ser mayor comparada con el resto de mamíferos. 1x106/µL
- en hámsteres y jerbos: rango 400-600x103/µL.
- en cobayas 120.000-850.000/µL6.
- en hurones: 245.000/µL-910.000/µL5.
- en conejos: el número total puede variar, pero generalmente oscila entre 200.000-1.000.000/µL7.
Tamaño: en cobayas de 2-3 µm de diámetro6.
Bibliografia
- Campbell TW. Peripheral blood of mammals; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 3-36.
- Sykes JM, Klaphake E. Reptile hematology. Vet Clin Exot Anim; 2015; 63–82.
- Campbell TW. Blood sample collection and preparation in samall mammals; En: Campbell TW. Exotic animal hematology and cytology. Fourth edition. Oxford: Wiley Blackwell; 2015; 157-163.
- Rodrigues MV, de Castro SO, de Albuquerque CZ, Mattaraia VGdM, Santoro ML. The gingival vein as a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. Plos One; 2017; 1-16.
- Smith SA, Zimmerman K, Moore DM. Hematology of the domestic ferret (Mustela putorius furo). Vet Clin Exot Anim; 2015; 1–8.
- Zimmerman K, Moore DM, Smith SA. Hematological Assessment in pet guinea pigs (Cavia porcellus). Blood simple collection and blood cell identification. Vet Clin Exot Anim; 2015; 33–40.
- Moore DM, Zimmerman K. Hematological assessment in pet rabbits. Vet Clin Exot Anim; 2015; 9–19.
- Pinly AA. Clinical hematology of rodent species. Vet Clin Exot Anim; 2008; 523–533.
- Dyer SM, Cervasio EL. An overview of restraint and blood collection techniques in exotic pet practice. Vet Clin Exot Anim; 2008; 423–443.
- Saldaña O Ítalo Moisés. Interferencia causada por hemólisis en la determinación de 25 constituyentes bioquímicos en el autoanalizador ADVIA 1800. An. Fac. med; 76: 377-384. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1025-55832015000500008&lng=es.
- Oliveira D, Souza-Silva E, Tonussi C. Technical Report: Gingival Vein Punction: A New Simple Technique for Drug Administration or Blood Sampling in Rats and Mice. SCAND J LAB ANIM SCI; 2009; 109-113.
- Zabolotzky SM, Walker DB. Peripheral blood smears. Cowell RL, Valenciano AC. Diagnostic Cytology and Hematology of the Dog and Cat; Fourth edition; Missouri; Elsevier; 2014; 457 – 488.
- Jones MP. Avian haematology. Vet Clin Exot Anim; 2015; 51–61.
- Campbell TW. Evaluation of the blood film. Vet Clin Exot Anim; 2015; 117–135.
- Siegel A, Loar AS, Walberg J; Hematology and cytology of small mammals; En: Quesenberry KE, Carpenter JW. Ferrets, rabbits and rodents. Clinical Medicine and Surgery; Third edition; Missouri; Elsevier; 2012; 511-522.
- Viadel L, Morales MJ, Borràs D. Atlas clínico de hematología del perro y el gato. Barcelona; Esmonpharma: 2004; 91-95.
- Cuno JR. Parámetros hematológicos en perros juveniles de altura. Tesis Doctoral Universidad Nacional del Altiplano; Puno; 2017; 18-23.
- Rebar AH. Leucocitos en periodos de salud y enfermedad. En: Rebar AH. Interpretación del hemograma canino y felino. Clinical Handbook Series. Missouri: The Gloyd Gtoup. Inc; 2003; 11-20.
- Lindstrom NM, Moore DM, Zimmerman K, Smith SA. Hematology assessment in pet rats, mice, hamsters and gerbils. Blood sample collection and blood cell identification. Vet Clin Exot Anim; 2015; 21–32.
Anexo I. Imágenes de frotis sanguíneo por especies
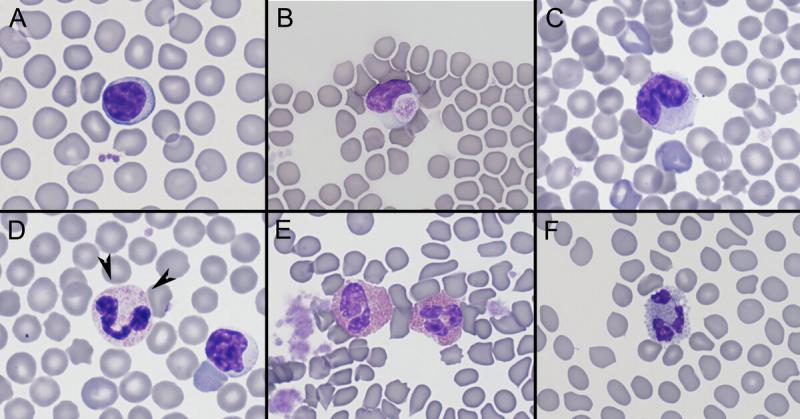
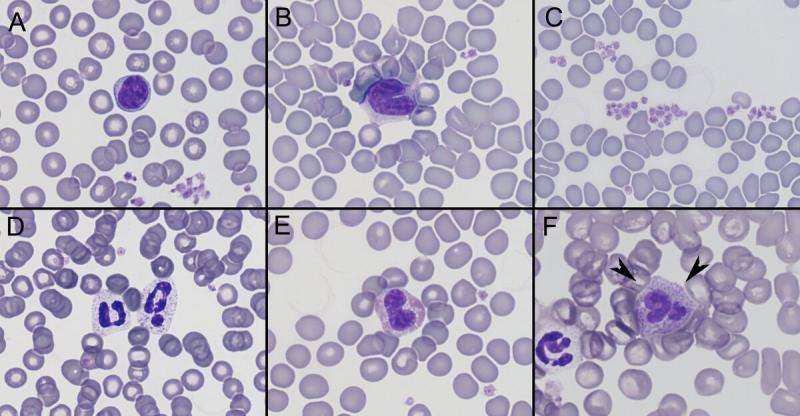
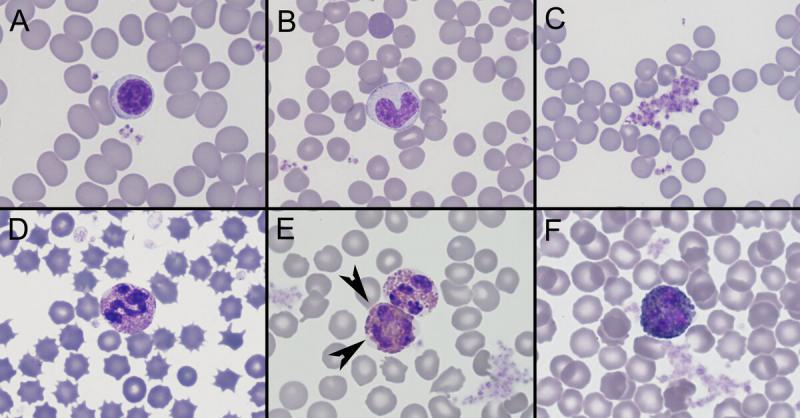
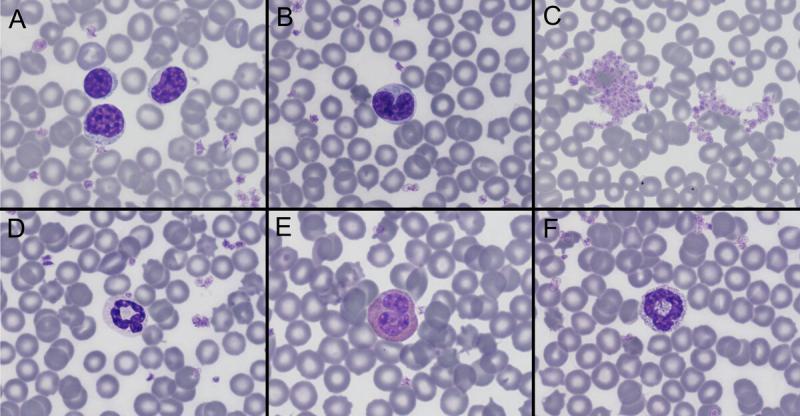
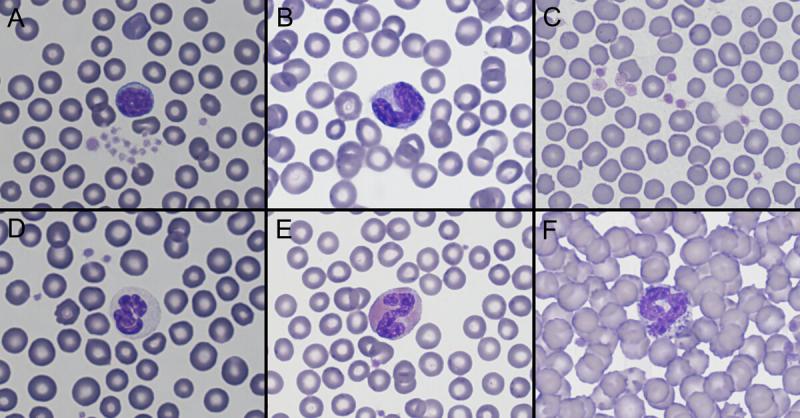
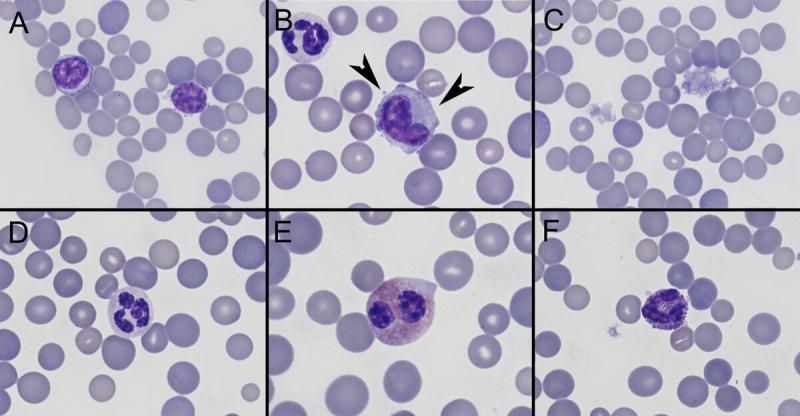
Anexo II. Valores de referencia por especies
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A1. Ratón (Mus musculus) 19 . |
| Variable | Macho adulto | Hembra adulta |
| RBC (x106/µL) | 6,90-11,70 | 6,86-11,30 |
| PVC (%) | 33,10-49,90 | 39,70-44,50 |
| Hgb (g/dL) | 11,10-11,50 | 10,70-11,10 |
| MCV (fL) | 47,50-50,50 | 47-52 |
| MCH (pg) | 11,70-12,70 | 11,10-12,70 |
| MCHC (%) | 23,20-31,20 | 22,30-29,50 |
| Plaquetas (x103/µL) | 157-412 | 170-410 |
| WBC (x103/µL) | 12,50-15,90 | 12,10-13,70 |
| Neutrófilos (%) | 13,20-21,60 | 15,70-18,50 |
| Linfocitos (%) | 62,40-82,80 | 65,90-77,90 |
| Eosinófilos (%) | 1,37-2,81 | 2,05-2,77 |
| Basófilos (%) | 0,22-0,82 | 0,13-0,85 |
| Monocitos (%) | 2,22-2,47 | 0,98-1,11 |
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A2. Hámster 19 . |
| Variable | Macho adulto | Hembra adulta |
| RBC (x106/µL) | 4,70-10,30 | 3,96-3,96 |
| PVC (%) | 47,90-57,10 | 39,20-58,80 |
| Hgb (g/dL) | 14,40-19,20 | 13,10-18,90 |
| MCV (fL) | 64,80-77,60 | 64-76 |
| MCH (pg) | 19,90-24,90 | 20,20-25,80 |
| MCHC (%) | 27,50-36,50 | 27,80-37,40 |
| Plaquetas (x103/µL) | 367-573 | 300-490 |
| WBC (x103/µL) | 5,02-10,20 | 6,48-10,60 |
| Neutrófilos (%) | 17,10-27,10 | 22,80-35,20 |
| Linfocitos (%) | 54,70-92,30 | 50,90-84,90 |
| Eosinófilos (%) | 0,26-1,54 | 0,22-1,18 |
| Basófilos (%) | 0-5 | 0-2,10 |
| Monocitos (%) | 0,90-4,10 | 0,40-4,40 |
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A3. Jerbo (Meriones unguculatus) 19 . |
| Variable | Macho adulto | Hembra adulta |
| RBC (x106/µL) | 7,10-8,60 | 8,00-9,40 |
| PVC (%) | 42-49 | 43-50 |
| Hgb (g/dL) | 12,10-13,80 | 13,10-16,90 |
| MCV (fL) | 46,60-60 | 46,64-60,04 |
| MCH (pg) | 16,10-19,40 | 16,30-19,40 |
| MCHC (%) | 30,60-33,30 | 30,60-33,30 |
| Plaquetas (x103/µL) | 432-710 | 540-632 |
| WBC (x103/µL) | 4,30-12,30 | 5,60-12,80 |
| Neutrófilos (%) | 9,30-23,60 | 10,70-25,80 |
| Linfocitos (%) | 68-76,80 | 58,90-78,10 |
| Eosinófilos (%) | 0-1,60 | 0-2,30 |
| Basófilos (%) | 0-1,60 | 0-0,80 |
| Monocitos (%) | 0-6,50 | 1,70-6,20 |
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A4. Rata (Rattus norvegicus) 19 . |
| Variable | Macho adulto | Hembra adulta |
| RBC (x106/µL) | 8,15-9,75 | 6,76-9,20 |
| PVC (%) | 44,40-50,40 | 37,60-50,60 |
| Hgb (g/dL) | 13,40-15,80 | 11,50-16,10 |
| MCV (fL) | 49,80-57,80 | 50,90-65,50 |
| MCH (pg) | 14,30-18,30 | 15,60-19 |
| MCHC (%) | 26,20-35,40 | 26,50-36,10 |
| Plaquetas (x103/µL) | 150-450 | 160-460 |
| WBC (x103/µL) | 8,00-11,80 | 6,60-12,60 |
| Neutrófilos (%) | 6,20-42,60 | 4,40-49,20 |
| Linfocitos (%) | 57,60-83,20 | 50,20-84,50 |
| Eosinófilos (%) | 0,10-0,63 | 0-1,96 |
| Basófilos (%) | 0-0,60 | 0-0,40 |
| Monocitos (%) | 0-0,65 | 0-1,81 |
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A5. Cobaya (Cavia porcellus) 19 . |
| Variable | Macho adulto | Hembra adulta | 2-90 días edad |
| RBC (x106/µL) | 4,36-6,84 | 3,35-6,15 | 4,06-6,02 |
| PVC (%) | 37-47 | 40,90-49,90 | 33,80-48,80 |
| Hgb (g/dL) | 11,60-17,20 | 11,40-17 | 10,13-15,10 |
| MCV (fL) | 71-83 | 86,10-95,90 | 77,50-88,70 |
| MCH (pg) | 24,20-27,20 | 23,10-26,30 | |
| MCHC (%) | 29,70-38,90 | 28,20-34,40 | 28,30-32,40 |
| Plaquetas (x103/µL) | 260-740 | 266-634 | |
| WBC (x103/µL) | 5,50-17,50 | 5,20-16,40 | 2,66-10,10 |
| Neutrófilos (%) | 28-56 | 20,30-41,90 | 14,80-42,60 |
| Linfocitos (%) | 40-62,50 | 46,40-80,40 | 52,60-83,20 |
| Eosinófilos (%) | 1-7 | 0-7 | 0,10-3,60 |
| Basófilos (%) | 0-1,70 | 0-0,80 | 0-0,58 |
| Monocitos (%) | 3,30-5,30 | 1-2,60 | 0-3,70 |
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A6. Conejo blanco neozelandés (Oryctolagus cuniculus) 7 . |
| Variable | Macho adulto | Hembra adulta | 2-90 días edad |
| RBC (x106/µL) | 5,46-7,94 | 5,11-6,51 | 5,15-6,48 |
| PVC (%) | 33-50 | 31,00-48,60 | 38,10-44,10 |
| Hgb (g/dL) | 10,40-17,40 | 9,80-15,80 | 10,70-13,90 |
| MCV (fL) | 58,50-66,50 | 57,80-65,40 | 66,20-80,30 |
| MCH (pg) | 18,70-22,70 | 17,10-23,50 | 19,50-22,70 |
| MCHC (%) | 33-50 | 28,70-35,70 | 24,20-32,60 |
| Plaquetas (x103/µL) | 304-656 | 270-630 | |
| WBC (x103/µL) | 5,50-12,50 | 5,20-10,60 | 4,10-9,79 |
| Neutrófilos (%) | 38-54 | 36,40-50,40 | 18,80-46,40 |
| Linfocitos (%) | 28-50 | 31,50-52,10 | 44,60-77,80 |
| Eosinófilos (%) | 0,50-3,50 | 0,80-3,20 | 0-2,40 |
| Basófilos (%) | 2,20-7,50 | 2,40-6,20 | 0,10-4,50 |
| Monocitos (%) | 4-12 | 6,60-13,40 | 0-13,10 |
A continuación, se adjuntan valores hematológicos de referencia en sangre de diferentes especies, distinguiendo por género y edad. Abreviaciones: Hgb: hemoglobin = hemoglobina, MCH: Mean Cell Hemoglobin = hemoglobina cospuscular media, MCHC: Mean Cell Hemoglobin Concentration = concentración de hemoglobina corpuscular media, MCV: Mean Cell Volume = volumen celular medio, PCV: Packed Cell Volume = volumen celular, RBC: Red Blood Cells = células rojas sanguíneas, WBC: White Blood Cells = células blancas sanguíneas.
| Tabla A7. Hurón (Mustela putorius furo) 5 . |
| Variable | Macho adulto | Hembra adulta | 2-90 días edad |
| RBC (x106/µL) | 6,50-13,20 | 6,70-9,34 | 4,80-7,80 |
| PVC (%) | 33,60-49,80 | 35,60-55 | 27-38,50 |
| Hgb (g/dL) | 12-18,20 | 12,90-17,40 | 9,60-13,80 |
| MCV (fL) | 44,10-52,50 | 44,40-53,70 | 47,80-57,60 |
| MCH (pg) | 16,50-19,70 | 16,40-19,40 | 17,50-22,80 |
| MCHC (%) | 33,70-42,40 | 33,20-35,30 | 34,70-37 |
| Plaquetas (x103/µL) | 297-730 | 310-910 | |
| WBC (x103/µL) | 4,40-15,40 | 2,50-18,20 | 5,30-12,60 |
| Neutrófilos (%) | 24-76 | 43-78 | 46,10-76,60 |
| Linfocitos (%) | 12-66,60 | 12-67 | 42,20-68,20 |
| Eosinófilos (%) | 0-8,50 | 0-8,50 | 2,10-6,90 |
| Basófilos (%) | 0-3 | 0-2,90 | 0-1,30 |
| Monocitos (%) | 0-8,20 | 1-6,30 | 0,70-4,70 |
 by Multimédica
by Multimédica