Hiperaldosteronismo primario en un gato por masa adrenal
Resumen breve
Se describe un caso clínico de un gato macho castrado común europeo de 10 años que se presenta por vómitos, anorexia y apatía, y es diagnosticado de pancreatitis aguda e hiperaldosteronismo primario por posible tumor adrenal. Se expone el caso incluyendo sus signos clínicos, pruebas diagnósticas y tratamiento establecido, así como su evolución.Índice de contenidos
Resumen
Se describe un caso clínico de un gato macho castrado común europeo de 10 años que se presenta por vómitos, anorexia y apatía, y es diagnosticado de pancreatitis aguda e hiperaldosteronismo primario por posible tumor adrenal. Se expone el caso incluyendo sus signos clínicos, pruebas diagnósticas y tratamiento establecido, así como su evolución.
El hiperaldosteronismo primario es una enfermedad endocrina que puede estar infradiagnosticada en la clínica diaria. Se caracteriza por un exceso de aldosterona circulante e inhibición de la producción de renina y es causada principalmente por una neoplasia adrenocortical solitaria unilateral. Los gatos afectados suelen presentar signos clínicos relacionados directamente con la hipokalemia e hipertensión sistémica que provoca.
En este artículo se exponen las claves para el diagnóstico de esta endocrinopatía, incluyendo una revisión de los principales signos clínicos y hallazgos en las pruebas diagnósticas. Además, se realiza un repaso de las diferentes opciones terapéuticas disponibles para esta enfermedad.
Caso clínico
Un macho castrado común europeo de 10 años se presentó por un cuadro de vómitos, anorexia y apatía de 2 días de evolución. El examen físico mostró membranas mucosas, conjuntivas y piel ictéricas, soplo IV/VI con ritmo de galope, ventroflexión cervical (Figura 1), presión arterial sistólica (PAS) 200 mmHg, molestia a la palpación abdominal y una deshidratación del 6 %. El resto de examen físico fue normal. El hemograma reveló anemia normocítica normocrómica no regenerativa junto a una leve leucocitosis neutrofílica (Tabla 1).
| Tabla 1. Hemograma . |
| Parámetro | Día 0 | Día 3 | Día 30 | Valores de referencia |
| Eritrocitos | 6,34 | 5,65 | 9,47 | 6,54-12,20 M/µL |
| Hematocrito | 28 | 27 | 35 | 30,3-52,3% |
| Hemoglobina | 9 | 8,9 | 11 | 9,8-16,2 g/dL |
| VCM | 40 | 37,4 | 40,1 | 35,9-53,1 fL |
| CHCM | 33,2 | 34 | 30,2 | 28,1-35,8 g/dL |
| Reticulocitos | 37,5 | 28 | 15,2 | 3,0-50,0 K/µL |
| Leucocitos | 19,34 | 11,84 | 8,08 | 2,87-17,02 K/µL |
| Neutrófilos segmentados | 13,07 | 9,47 | 6,72 | 2,30-10,29 K/µL |
| Linfocitos | 2,95 | 1,45 | 0,92 | 0.92-6,88 K/µL |
| Monocitos | 0,28 | 0,56 | 0,44 | 0,05-0,67 K/µL |
| Eosinófilos | 0,34 | 0,18 | 0,24 | 0,17-1,57 K/µL |
| Basófilos | 0,03 | 0,01 | 0,08 | 0,01-0,26 K/µL |
| Plaquetas | 270 | 307 | 311 | 151-600 K/µL |

La bioquímica mostró una bilirrubina total de 3,8 mg/dL (0-0,9) y el ionograma un potasio de 2,1 mmol/L (3,5-5,8) (Tabla 2). El resto de los parámetros bioquímicos se hallaron dentro de los valores de referencia. Los hallazgos más significativos en la ecografía abdominal fueron reactividad en la zona pancreática con linfadenopatía peripancreática marcada (1,3 x 0,93 cm), una masa heterogénea en la glándula adrenal izquierda de 2,1 x 2 cm y una leve cantidad de líquido libre en la proyección hepatodiafragmática. El test rápido de lipasa pancreática específica felina fue anormal (Tabla 3). En el urianálisis se detectó una densidad urinaria de 1,040, pH 7, bilirrubinuria máxima, y un sedimento manual inactivo. Las radiografías de tórax fueron compatibles con la normalidad.
| Tabla 2. Bioquímica . |
| Parámetro | Día 0 | Día 1 | Día 2 | Día 3 | Día 7 | Día 30 | Valores de referencia |
| Glucosa | 105 | 111 | 71-159 mg/dL | ||||
| Creatinina | 1,3 | 1,1 | 1,4 | 1,2 | 0,8-2,4 mg/dL | ||
| Urea | 20 | 17 | 16-36 mg/dL | ||||
| Fósforo | 3,9 | 3,4 | 3,1-7,5 mg/dL | ||||
| Calcio total | 9 | 8,5 | 7,8-11,3 mg/dL | ||||
| Proteínas totales | 7,2 | 8,0 | 5,7-8,9 g/dL | ||||
| Albumina | 3,0 | 2,5 | 2,8 | 2,3-3,9 g/dL | |||
| Globulinas | 4,2 | 4,8 | 2,8-5,1 g/dL | ||||
| ALT | 65 | 53 | 114 | 116 | 12-130 U/L | ||
| ALKP | 24 | 55 | 62 | 14-111 U/L | |||
| GGT | 0 | 0 | 0-4 U/L | ||||
| Bilirubina total | 3,8 | 2,8 | 0,5 | 0,5 | 0,0-0,9 mg/dL | ||
| Colesterol | 116 | 86 | 65-225 mg/dL | ||||
| Na+ | 157 | 156 | 157 | 155 | 162 | 153 | 150-165 mmol/L |
| K+ | 2,1 | 3,2 | 2,9 | 3 | 2,7 | 2,4 | 3,5-5,8 mmol/L |
| CI- | 115 | 113 | 113 | 112 | 113 | 117 | 112-129 mmol/L |
| Tabla 3. Analíticas complementarias. |
| Analítica | Resultado | Valores de referencia |
| Test rápido fPLI | Anormal | Normal |
| fPLI cuantitativa | 11,7 | > 5,4 µg/l incremento severo de la concentración del suero fPLI asociado con una pancreatitis |
| Renina | 0,52 | 0,4-1,9 ng/ml |
| Aldosterona | 1158,84 | 15-102 pg/ml |
Una vez estabilizado el paciente, se envió al laboratorio una muestra para analizar la lipasa pancreática específica cuantitativa felina (fPLI), y los niveles de renina y aldosterona séricas. Los resultados mostraron un incremento de la fPLI compatible con pancreatitis y un aumento muy marcado de la aldosterona, junto con niveles normales de renina, lo que es compatible con hiperaldosteronismo primario (Tabla 3). Por consiguiente, se diagnosticó una posible pancreatitis como causa del cuadro digestivo e incremento de la bilirrubina y un hiperaldosteronismo primario (HAP) por posible tumor adrenal, como causa de la hipokalemia e hipertensión sistémica.
Se realizó también una ecocardiografía para evaluar el soplo y ritmo de galope donde se identificó una cardiomiopatía hipertrófica (CMH) obstructiva concomitante, con dilatación auricular izquierda moderada sin presencia de trombos.
A la espera de todos los resultados, se procedió al ingreso del paciente para estabilización. Se instauró a su llegada una infusión continua de cloruro potásico (KCl) puro a 0,3 mEq/kg/h durante 4 horas con monitorización periódica del animal. Se colocó tubo esofágico de alimentación y se instauró tratamiento a base de fluidoterapia cristaloide, maropitant (1 mg/kg/24 horas intravenoso), mirtazapina (3,75 mg/gato/cada 3 días por vía oral), buprenorfina (15 µg/kg/6 horas intravenoso), atenolol (6,25 mg/gato/24 horas por vía oral) y clopidogrel (18,75 mg/gato/24 horas por vía oral). Pasadas las 4 horas con la infusión de KCl puro se revaluaron de nuevo los electrolitos con un valor de potasio de 3,2 mmol/l, así que se decidió parar y añadir suplementación de KCl a la fluidoterapia establecida, según su nivel sanguíneo (Tabla 4).
| Tabla 4. Suplementación parenteral de potasio. Fuente: DiBartola SP; Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice; 2012; Elsevier Saunders. |
| K+ sérico | mEq KCI para 1 L |
| < 2,0 | 80 |
| 2,0 – 2,5 | 60 |
| 2,5-3,0 | 40 |
| 3,0-3,5 | 30 |
| 3,5-4,0 | 20 |
| 4,0-5,5 | 10 |
| > 5 | Sin suplementación |
Se monitorizó de forma periódica la PAS con valores sostenidos alrededor de 180-200 mmHg, con lo que se añadió al tratamiento amlodipino (0,625 mg/gato/24 horas por vía oral).
Durante la hospitalización, y a pesar de la suplementación intravenosa de potasio y alimentación por el tubo esofágico, los valores de potasio se mantuvieron en valores entre 2,9-3,2 mmol/l. La PAS también persistió elevada, y a la espera de los resultados de los niveles sanguíneos de renina y aldosterona, se instauró tratamiento con espironolactona (2 mg/kg/12 horas por vía oral) debido a la alta sospecha clínica de hiperaldosteronismo.
Por motivos económicos, el paciente se dio de alta tras 3 días de ingreso: se encontraba hemodinámicamente estable, sin presentar ventroflexión cervical, pero con un valor de potasio de 3 mmol/l. Se mantuvo la medicación previamente establecida y se añadió suplementación de potasio por vía oral (2 mEq/gato/12 horas).
Se revaluó 4 días después. El paciente había empezado a comer por sí solo, la PAS fue de 150 mmHg, el valor de potasio de 2,7 mmol/l (3,5-5,8) y la bilirrubina total se había normalizado (0,5 mg/dl, valor de referencia 0-0,9). Se decidió mantener el mismo tratamiento y aumentar la suplementación de potasio oral (2 mEq/gato/8 horas).
Se monitorizó 1 mes más tarde. Clínicamente permanecía asintomático y comiendo de forma voluntaria desde hacía 10 días sin necesidad de mirtazapina, pero la PAS era de 180 mmHg con un valor de potasio de 2,4 mmol/l (3,5-5,8), aunque el resto de los parámetros bioquímicos estaban dentro de los valores de referencia. Se retiró el tubo esofágico de alimentación, se aumentó la dosis de espironolactona (3 mg/kg/12 horas por vía oral), amlodipino (1,25 mg/gato/24 horas por vía oral) y la de suplementación de potasio oral (3 mEq/gato/8 horas). Se discutió en ese momento la opción quirúrgica (adrenalectomía unilateral izquierda), sin embargo, los propietarios la rechazaron.
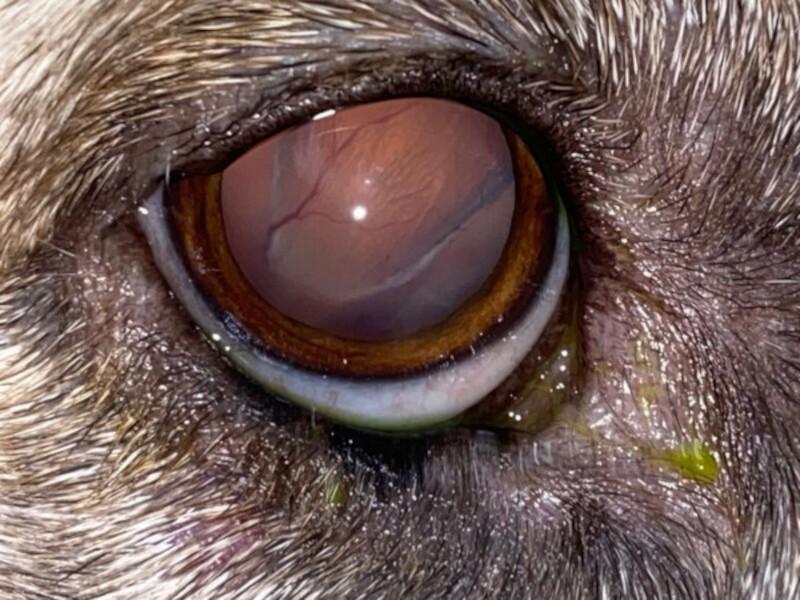
Dos meses después del diagnóstico, el paciente acudió de urgencias por midriasis bilateral aguda con una PAS de 200 mmHg. En el examen oftalmológico se diagnosticó un desprendimiento bilateral de retina (Figura 2). A nivel de la ecografía abdominal se observó un crecimiento marcado de la masa adrenal izquierda (5 cm de grosor) respecto a la ecografía inicial. Debido a las limitaciones económicas y al deterioro del paciente, los propietarios optaron por la eutanasia humanitaria.
Discusión
El hiperaldosteronismo es una enfermedad endocrina causada por el aumento de la producción de aldosterona por parte de las glándulas adrenales y puede ser de etiología primaria o secundaria1.
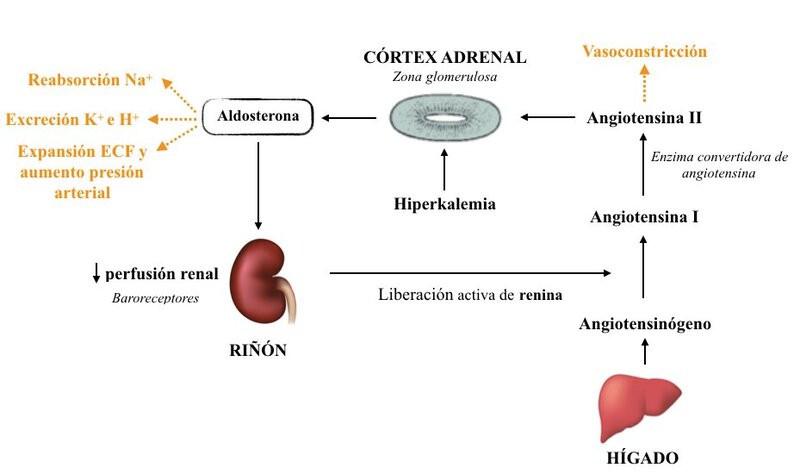
La aldosterona, principal mineralocorticoide, se sintetiza a partir del colesterol y es secretado por la zona glomerulosa, la zona más externa de la corteza adrenal, cuyas células carecen de capacidad para fabricar cortisol1,2. Las principales funciones de la aldosterona son regular las concentraciones circulantes de sodio y potasio y la homeostasis del volumen del fluido intravascular. Actúa sobre la nefrona distal promoviendo la reabsorción de sodio y la excreción de iones potasio e hidrógeno. Al conservar sodio se retiene indirectamente agua que va a expandir el volumen del fluido extracelular, así como elevar la presión arterial (Figura 3)1,2.
El hiperaldosteronismo primario (HAP) se debe a la secreción autónoma de la aldosterona por células anormales dentro de la corteza adrenal, independiente del sistema renina-angiotensina-aldosterona (RAAS de las siglas en inglés renin–angiotensin–aldosterone system), y se caracteriza por un exceso de aldosterona circulante junto con la supresión de renina2. Los pacientes normalmente no presentan anomalías en la producción de cortisol, en sus concentraciones plasmáticas o su metabolismo2.
Por otro lado, el hiperaldosteronismo secundario (HAS) ocurre como respuesta a condiciones que estimulan el RAAS, dando como resultado la síntesis y secreción de aldosterona1. Por lo tanto, el HAS se asocia con un aumento de las concentraciones de renina2.
El RAAS se activa para mantener el volumen del fluido extracelular, la presión arterial y el equilibrio electrolítico, de tal manera que cualquier enfermedad que provoque una disminución en la perfusión renal y/o aumente los niveles séricos de potasio va a promover la activación del RAAS (Figura 3).2 Así pues, enfermedades que causen deshidratación, hipotensión, perfusión renal reducida [principalmente por enfermedad renal crónica (ERC) o fallo cardiaco] o falta de sodio (por ingesta reducida o aumento de su pérdida) serán las principales causas de hiperaldosteronismo secundario.1,2
En el presente caso, la sospecha principal es que se tratara de un hiperaldosteronismo primario.
Se descartó un HAS por varios motivos. A pesar de que el animal se presentó deshidratado, debido a los signos digestivos por la sospecha de pancreatitis, las muestras para la realización de los niveles de aldosterona y renina se obtuvieron 24 horas después de estar con fluidos y el paciente hidratado. Por ello, parece poco probable que la deshidratación afectara a los resultados. Aunque hubiera habido cierto componente de HAS, los niveles de renina deberían haber estado aumentados y no observarse unos resultados tan dispares entre los valores de renina y aldosterona.
Lo mismo sucede con la CMH diagnosticada, que a pesar de que pudo contribuir a un HAS, el paciente no se encontraba en fallo cardíaco y teniendo en cuenta los resultados analíticos y del resto de pruebas, también hacían poco probable que el problema cardíaco fuera la causa del hiperaldosteronismo. Es más, es muy posible que la CMH fuera secundaria a la hipertensión provocada por el HAP.
No se pudo descartar inicialmente cuanta implicación tuvo la pancreatitis en la hipokalemia manifiesta, pudiendo ser en parte agravada por los vómitos y anorexia que presentaba el paciente.
El hiperaldosteronismo primario (HAP) se ha sugerido que es el trastorno adrenocortical más común en esta especie3. Su infradiagnóstico parece probable y se atribuye a que la progresión de la ERC (muy común en gatos geriátricos) conlleva a hipertensión y/o hipokalemia; ambas alteraciones también causadas por el hiperaldosteronismo2. A su vez, la ERC también puede ser resultado del hiperaldosteronismo, debido a la pérdida de función renal por la hipertensión sistémica y la hipokalemia persistentes2.
El HAP es causado principalmente por una neoplasia adrenocortical solitaria unilateral, ya sea un adenoma o carcinoma1-4, aunque la incidencia de tumores malignos supera la de adenomas benignos2,4. También se han identificado adenomas adrenales bilaterales en 2 gatos1-4. Existe un hiperaldosteronismo no relacionado con enfermedad tumoral, referido en 13 gatos2, donde la histopatología reveló una hiperplasia adrenocortical bilateral y la mayoría de ellos con evidencia de ERC2,4. Por último, de forma anecdótica se ha descrito un hiperaldosteronismo e hiperestrogenismo concomitantes por neoplasia adrenal en 2 gatos1,2.
En cuanto a su presentación, no se ha observado predisposición racial ni de género1,2. La mayoría de estos gatos tienen más de 10 años, siendo la edad media comprendida entre 12 y 13 años en el momento del diagnóstico1,2; aunque se han descrito casos que oscilan entre los 5 y los 20 años1.
Los principales signos clínicos de presentación inicial se relacionan directamente con el aumento de la concentración de aldosterona y se dividen en dos grupos principales: polimiopatía hipokalémica e hipertensión sistémica1,2,4. Estos signos clínicos principales son similares, se trate de un hiperaldosteronismo resultado de un adenoma, carcinoma o hiperplasia adrenal1.
La polimiopatía hipokalémica, usualmente observada con concentraciones séricas de potasio menores a 3 mmol/l, se presenta con ventroflexión cervical, debilidad persistente y progresiva, ataxia de los miembros pélvicos y apatía1,2. En menor frecuencia, se pueden presentar con rigidez de las extremidades, disfagia o colapso1,2. Estos signos clínicos aparecen de forma episódica o bien de forma repentina1,2. Cabe destacar, que la debilidad parece menos común y menos preocupante en los gatos con hiperplasia adrenal1,2. La insuficiencia respiratoria secundaria a la debilidad de los músculos respiratorios es muy poco común4.
En el caso presentado aquí, el único signo clínico asociado a polimiopatía hipokalémica fue la ventroflexión cervical. Muchas veces puede ser el único signo observado, y es bastante común en gatos, debido a la ausencia del ligamento nucal en esta especie.
La hipertensión sistémica puede ir asociada a distintos signos clínicos en función del órgano diana al que afecte. A nivel ocular pueden presentarse con ceguera aguda y/o cambios repentinos en el color de los ojos, generalmente debidos a hemorragia intraocular o desprendimientos de retina1,2. Los signos oculares se observan con menos frecuencia en gatos con tumores adrenales, en comparación con aquellos con hiperplasia adrenal1,2. La afectación en el sistema nervioso central incluye signos clínicos comprendidos dentro de lo que se denomina encefalopatía hipertensiva, tales como crisis epilépticas, ataxia y cambios de comportamiento, como resultado de edema vasogénico, hemorragia o isquemia en el encéfalo1,5.
A su vez, la hipertensión subclínica puede ser común en estos pacientes1.
También se han descrito otros signos clínicos como hiporexia, polifagia o poliuria/polidipsia (PU/PD), aunque esta última en menos del 20 % de los gatos con HAP1,2. Esta PU/PD puede deberse a enfermedades concomitantes (p. ej., diabetes mellitus y/o ERC)2.
Pueden detectarse soplos cardíacos y arritmias, y es que la presencia de miocardiopatías, por hipertrofia ventricular izquierda, puede observarse como consecuencia de la hipertensión, enfermedades concomitantes (hipertiroidismo) y/o enfermedad cardíaca primaria1. La enfermedad cardíaca asociada únicamente a HAP no se ha descrito en gatos1, por lo que, si un paciente con insuficiencia cardíaca congestiva tiene una concentración plasmática de aldosterona elevada un HAS debe ser la consideración principal1. Como ya se ha comentado anteriormente, esta causa quedó descartada en el paciente de este caso.
A nivel laboratorial, no se han identificado anomalías hematológicas específicas para el HAP1. En el presente caso, la anemia y la leve leucocitosis que presentó inicialmente probablemente se debieran a la pancreatitis concomitante, y se resolvieron con el tratamiento sintomático. La única alteración bioquímica típica es la hipokalemia, sin embargo, el grado es variable1,2 y, especialmente en gatos, se presenta por otras causas que deben excluirse primero. Los principales diagnósticos diferenciales de hipokalemia a tener en cuenta son: ERC, cetoacidosis diabética, problemas gastrointestinales agudos (vómitos, diarrea y anorexia) y HAP2. En cuanto a la gravedad de la hipokalemia, en la mayoría de los casos diagnosticados de HAP debido a neoplasia adrenocortical esta fue de moderada a grave1.
Por lo tanto, es importante recordar en los casos de hipokalemia persistente, a pesar de la suplementación con potasio, que se debería siempre considerar el HAP como posible diagnóstico diferencial1. En los casos descritos de hiperplasia adrenal, la hipokalemia, por lo general, es menos común y de menos magnitud1,2. Así pues, incluso en casos con normokalemia se tiene que considerar el HAP igualmente como diagnóstico diferencial de hipertensión sistémica1.
Las concentraciones séricas de sodio suelen ser normales y la hipernatremia no es frecuente, presumiblemente debido a que los mecanismos del equilibrio hídrico permanecen intactos1-3.
Los niveles de urea y creatinina pueden estar elevados en el momento del diagnóstico, sobre todo, en aquellos gatos con hiperplasia adrenal, ya que los gatos con tumores adrenales, generalmente, no tienen evidencia de ERC2. El resto de los parámetros bioquímicos no suelen verse alterados en el HAP.
La ecografía abdominal permite la detección de tumores adrenales1,2, y a su vez también proporciona información sobre la anatomía renal, la posible presencia y extensión de la invasión de la vena cava caudal por el tumor o trombo asociado, y la valoración del resto del abdomen con el objetivo de buscar otras enfermedades concomitantes o evidencia de metátasis1,2.
Los gatos descritos con un tumor adrenal, por lo general, suelen tener una masa de entre 1 a 5 cm de diámetro y la adrenal contralateral suele estar disminuida de tamaño2. Es vital que se evalúe siempre la glándula contralateral, porque aunque los tumores adrenales bilaterales no son comunes, pueden ocurrir1. Los animales con hiperplasia adrenal pueden presentarse con glándulas de tamaño normal o con aumentos sutiles en la ecogenicidad1.
Dado que pueden producirse metástasis pulmonares, aunque con poca frecuencia, la realización de radiografías torácicas debe realizarse especialmente en los casos en que se considere la opción quirúrgica1.
Se han reportado otras modalidades de imagen, como la resonancia magnética (RM) y la tomografía computarizada (TC), que detectaron correctamente una masa o hiperplasia adrenal en 32 de 38 gatos con HAP confirmado. Sin embargo, en un estudio en personas, el 38 % de las TC / RM no identificaron con precisión la fuente del exceso de aldosterona. Por lo tanto, aunque son extremadamente útiles, las imágenes no son una prueba de detección perfecta de HAP2.
Un HAP debe considerarse en cualquier gato con un nódulo adrenal identificado en la ecografía e hipokalemia y/o hipertensión inexplicables y refractarios al tratamiento2. Esto sucedió en este caso, donde una vez obtenidas las muestras para las pruebas endocrinas, y debido a la persistencia de valores bajos de potasio y PAS elevadas se añadió al tratamiento espironolactona (bloqueante del receptor de la aldosterona).
En cuanto a las pruebas endocrinas, la confirmación del diagnóstico se basa principalmente en la demostración de una concentración elevada de aldosterona, que por sí sola, no distingue entre hiperaldosteronismo primario y secundario. De tal manera que las concentraciones séricas de aldosterona circulante deben evaluarse juntamente con la actividad plasmática de renina. Los animales con tumores adrenales deberían tener niveles elevados de aldosterona y niveles normales o bajos de renina. En el caso del HAS, tanto los niveles de aldosterona como los de renina estarán aumentados, ya que la secreción de aldosterona es consecuencia de la activación de la renina por el RAAS1,2.
El ratio aldosterona/renina (RAR) se considera el gold stantard y se ha utilizado para mejorar la sensibilidad y especificidad. El RAR puede aumentar de forma importante en gatos con tumores adrenales y ser menos elevado en casos de hiperplasia nodular1,2. Es importante tener en cuenta que para realizar estas pruebas se necesitan volúmenes grandes de sangre y un manejo apropiado de las muestras (congelación inmediata, mantenerse congeladas durante 24 horas y transportarse en recipientes congelados previamente) para que no se alteren los resultados.
Existen otras pruebas endocrinas como el ratio aldosterona/creatinina en orina y pruebas de función mineralocorticoide que pueden ayudar en casos dudosos. El manejo de este tipo de pacientes puede ser médico o quirúrgico, siendo este último el de elección en casos de masas adrenales únicas solitarias1-3.
El tratamiento farmacológico está enfocado principalmente a controlar la hipokalemia y la hipertensión. Para el control de la hipokalemia que provoca signos clínicos, se recomienda la suplementación de potasio en la fluidoterapia administrada al paciente en forma de KCl y en función de los niveles sanguíneos que se tenga (Tabla 4). Una vez controlados los signos clínicos y si el animal tolera la vía oral, se puede continuar la suplementación con potasio oral a dosis de 2-6 mEq/gato/8-12 horas1.
Para el tratamiento de la hipertensión secundaria al hiperaldosteronismo, se usa como fármaco de elección el amlodipino (bloqueante de los canales de calcio) a dosis de 0,625-1,25 mg/gato cada 24 horas por vía oral. Con esta dosis generalmente se controla la hipertensión en la mayoría de los casos, aunque en ocasiones es necesaria una dosis más elevada o administrarlo con mayor frecuencia1,2.
La espironolactona es el fármaco antagonista del receptor de la aldosterona y se añade al tratamiento para ayudar en el control tanto de la hipokalemia como de la hipertensión sistémica. La dosis recomendada es de 2-4 mg/kg cada 12 horas por vía oral2. Dosis superiores a 4 mg/kg se han asociado con anorexia, vómitos y diarrea. Otros efectos adversos descritos incluyen dermatitis facial y excoriación6. En casos de hipertensión refractaria se puede sumar al tratamiento bloqueantes beta-adrenérgicos, inhibidores de la enzima convertidora de angiotensina o bloqueantes del receptor de la angiotensina II2.
El tratamiento quirúrgico consiste en la adrenalectomía unilateral y es la opción de elección en los casos que presentan una única masa adrenal sin evidencia de metástasis, y especialmente si no hay invasión local en otros órganos y/o vasos sanguíneos2. Se trata de un procedimiento de riesgo elevado con una mortalidad perioperatoria de alrededor del 30 % según algunos estudios7, por lo que estos animales deben ser estabilizados de forma correcta por el equipo de hospitalización, y el procedimiento debe ser realizado por cirujanos expertos.
En el posoperatorio, la hiperkalemia es la complicación más frecuente, que puede controlarse mediante la administración temporal de fludrocortisona oral (mineralocorticoide sintético) o la inyección de pivalato de desoxicorticosterona, pero generalmente no suele ser necesario1. Otras posibles complicaciones posoperatorias descritas son sepsis, dehiscencia de sutura o enfermedades tromboembólicas.
El pronóstico en gatos con HAP asociado a neoplasia adrenal y en los que se realiza adrenalectomía, depende de la naturaleza de dicho tumor, siendo excelente en caso de adenoma (con supervivencias de entre 1 y varios años) y reservado en caso de que se trate de un carcinoma2. Si se opta exclusivamente por el manejo médico en esto animales, el pronóstico es mucho más reservado.
Las causas del fallecimiento suelen ser atribuibles a hipertensión refractaria, tromboembolismo o enfermedad renal crónica. Finalmente, para los casos de hiperaldosteronismo primario no asociado a neoplasia el pronóstico es incierto debido a que no hay información suficiente y concluyente.
En este caso se declinó la opción quirúrgica y se manejó médicamente al animal con amlodipino, espironolactona, atenol y suplementación oral de potasio. A pesar de ello, no se controlaron los niveles de potasio ni la hipertensión sistémica, conllevando esta última a un empeoramiento del cuadro clínico con la aparición del desprendimiento bilateral de retina que desembocó finalmente en la decisión, por parte de los propietarios, de la eutanasia humanitaria del gato.
Bibliografía
- Behrend EN, Gunn-Moore D, Campbell-Ward ML; Primary Hyperaldosteronism; Clinical Endocrinology of Companion Animals; 2013; Wiley-Blackwell.
- Feldman EC, Nelson RW, Reusch CE, Scott-Moncrieff JRS, Behrend EN; Hyperadrenocorticism in Cats; Canine&Feline Endocrinology; 2015; Elsevier Saunders.
- Vail DM, Thamm DH, Liptak JM; Tumors of the Endocrine System; Withrow & MacEwen’s small animal clinical oncology; 2020; Elsevier.
- Ettinger SJ, Feldman EC, Côté E; Non-Cortisol-Secreting Adrenocortical Tumors and Incidentalomas; Textbook of Veterinary Internal Medicine; 2017; Elsevier.
- Morales C, Montoliu P; Encefalopatías; Neurología Canina y Felina; 2012; Multimédica Ediciones Veterinarias.
- MacDonald KA, Kittleson MD, Kass PH; Effect of Spironolactone on Diastolic Function and Left Ventricular Mass in Maine Coon Cats with Familial Hypertrophic Cardiomyopathy; Journal of Veterinary Internal Medicine; 2008.
- Lo AJ, Holt DE, Brown DC, Schlicksup MD, Orsher RJ, Agnello KA; Treatment of Aldosterone-Secreting Adrenocortical Tumors in Cats by Unilateral Adrenalectomy: 10 Cases (2002-2012); Journal of Veterinary Internal Medicine; 2014.
 by Multimédica
by Multimédica