Las plaquetas en el caballo. El punto de vista del laboratorio
Resumen breve
Las plaquetas o trombocitos son pequeños fragmentos citoplasmáticos, irregulares, carentes de núcleo, derivados de la fragmentación de sus células precursoras, los megacariocitos. Las plaquetas desempeñan un papel fundamental en la hemostasia. En caballos es frecuente encontrar variaciones tanto de aumento (trombocitosis) como de disminución (trombocitopenia).Índice de contenidos
RESUMEN
Las plaquetas o trombocitos son pequeños fragmentos citoplasmáticos, irregulares, carentes de núcleo, derivados de la fragmentación de sus células precursoras, los megacariocitos. Las plaquetas desempeñan un papel fundamental en la hemostasia. En caballos es frecuente encontrar variaciones tanto de aumento (trombocitosis) como de disminución (trombocitopenia). En este artículo se hablará de las posibles causas de trombocitopenia y trombocitosis, así como la fase preanalítica y el diagnóstico de estas patologías en el laboratorio.
INTRODUCCIÓN
Las plaquetas, también llamadas trombocitos, son una parte fundamental de la coagulación. Estas presentan bordes irregulares, forma de redonda a oval, color azulado con gránulos azurófilos1 y no presentan núcleo. En ciertas ocasiones se pueden observar “pseudópodos” en plaquetas activadas.
Las plaquetas se forman en la médula ósea a partir de megacariocitos. Estas grandes células se fragmentan dando lugar a las plaquetas y macroplaquetas2 (Figura 1).
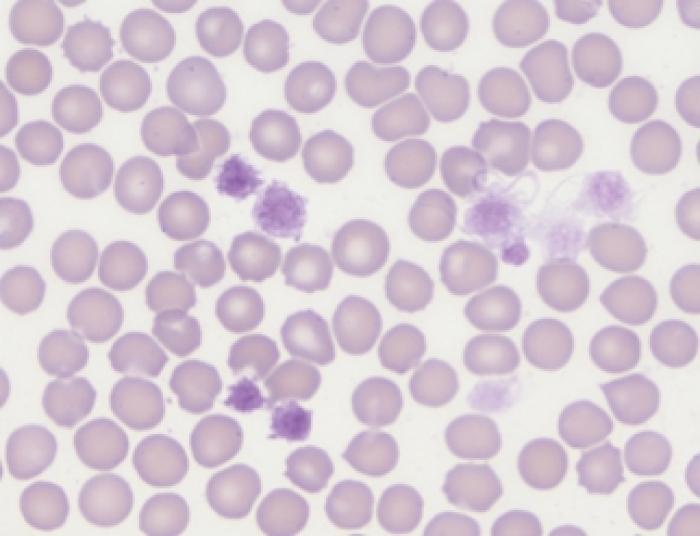
Figura 1. Macroplaquetas (x1000 hpf). Teñidas con Giemsa.
El tiempo medio de supervivencia de las plaquetas, conforme a lo descrito en la bibliografía1, puede variar entre 3 y 9 días. Comparado con otros mamíferos, los caballos suelen tener un recuento de plaquetas más bajo. En un frotis, a x1000hpf de aumentos, un recuento entre 6 y 10 plaquetas se considerará adecuado1.
Los niveles normales de plaquetas en animales sanos pueden varias de 90 a 350 G/L1 (intervalos referencia de LABOKLIN 90-300 G/L).
FASE PREANALÍTICA
La fase preanalítica es muy importante a nivel laboratorial, no únicamente por la medición de plaquetas, sino por todos los parámetros hematológicos. Una toma de muestra no realizada de manera correcta; por demasiada presión, demasiado tiempo hasta su procesado o una incorrecta secuencia de llenado cuando se utilizan varios tubos, puede dar lugar a una activación de las plaquetas. Esta serie de incidentes puede iniciar un proceso en el que la formación de agregados plaquetarios dará lugar a un recuento erróneo de las plaquetas. Además, la recolección de la sangre debe realizarse en condiciones libres de estrés y, a poder ser, sin haber realizado ejercicio extenuante previo. La secuencia de llenado en el caso de que se disponga de varios tubos debe ser la siguiente: el tubo sin anticoagulante deberá llenarse primero, dejando el tubo de EDTA para el último. En caballos, se ha descrito que el recuento plaquetar puede variar marcadamente en función del tiempo que se tarde en realizar su medición3.
El recuento de plaquetas debe realizarse a partir de sangre entera con anticoagulante. Al comparar los anticoagulantes ácido etilendiaminotetraacético (EDTA), heparina de litio (heparina) y citrato de sodio (citrato), se pueden detectar desviaciones significativas con respecto a los parámetros plaquetarios, siendo principalmente afectados estos en sangre heparina3.
El uso de heparina como anticoagulante resultó en una mayor formación de agregados plaquetarios y, por lo tanto, se midieron niveles de plaquetas falsamente reducidos4. El EDTA es el anticoagulante más adecuado para análisis hematológico en caballos4. La sangre debe analizarse dentro de las 24 horas post-extracción y almacenarse refrigerada, si es posible.
En el caso de ser veterinario de campo, se recomienda colocar las muestras de sangre en una caja de poliestireno para protegerlas del calor y frío hasta su medición.
La pseudotrombocitopenia inducida por EDTA también se ha descrito en casos individuales en caballos, lo que conlleva una mayor formación de agregados plaquetario5. Se puede lograr un número reducido de agregados midiendo rápidamente (dentro de las 2 horas posteriores a la extracción de sangre) y calentando la muestra a 37 °C antes de la medición6.
DIAGNÓSTICO EN EL LABORATORIO
El recuento de las plaquetas es una medida incluida en todos los hemogramas. Sin embargo, se pueden también solicitar de manera individual.
Además, siempre es recomendable preparar un frotis de sangre antes de enviar la sangre para el recuento plaquetar. El frotis sanguíneo realizado debe dejarse secar y posteriormente teñirse para su evaluación. Se pueden utilizar diferentes tinciones para su visualización (Figura 2A-B).
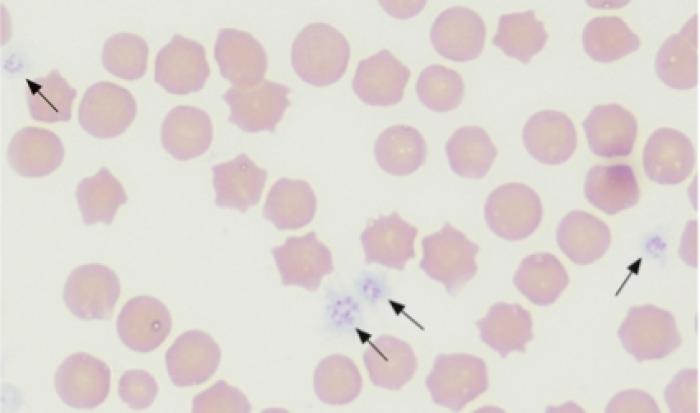
Figura 2A. Eritrocitos y plaquetas teñidos con Giemsa.
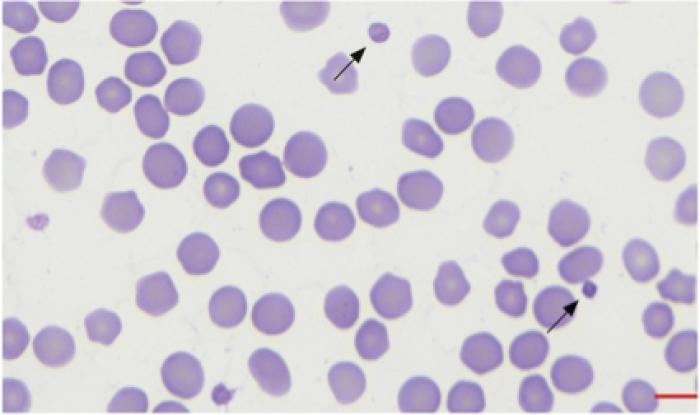
Figura 2B. Eritrocitos y plaquetas teñidos con Diff-quick.
Para una correcta evaluación, el estudio del frotis debe siempre acompañarse de una historia clínica detallada, así como información sobre las pruebas complementarias realizadas previamente.
El examen microscópico de las plaquetas debe empezar a baja magnificación (x100hpf), observando el borde del frotis para intentar localizar agregados plaquetarios. Posteriormente, se debe acudir a la monocapa y a gran aumento (x1000hpf) realizar el recuento plaquetar por campo. Se recomienda realizar el contaje al menos en 10 campos diferentes. A continuación, el recuento medio de esos campos, debe multiplicarse por 15-20 para obtener el número total de plaquetas. Si se encuentran agregados plaquetarios (Figura 3) debe tenerse en cuenta que el recuento plaquetar puede encontrarse disminuido y, por tanto, deberá interpretarse con cautela.
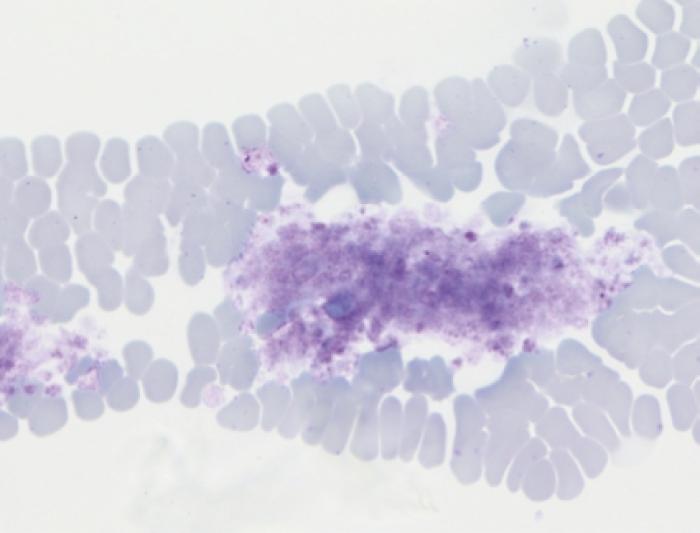
Figura 3. Agregado de plaquetas en el borde del frotis.
Si la trombocitopenia se confirma en el frotis sanguíneo se recomienda realizar pruebas adicionales (PCR, coagulación, serologías, etc.) para identificar la causa de la trombocitopenia.
TROMBOCITOPENIA
En la mayoría de los casos la trombocitopenia será un hallazgo incidental durante la hematología o el estudio de frotis. La trombocitopenia consiste en una disminución de los niveles normales de plaquetas circulantes según los intervalos descritos en la especie analizada7. Si la trombocitopenia es mantenida, o su reducción es severa, puede dar lugar a problemas en la coagulación8.
A menudo existe más de una causa responsable de la trombocitopenia9. Lo primero que debe hacerse es distinguir entre pseudotrombocitopenia y trombocitopenia verdadera. La pseudotrombocitopenia ocurre debido a que no todas las plaquetas presentes en la muestra son incluidas en el recuento. Por lo tanto, siempre se recomienda el examen microscópico manual como primer mecanismo de control en la trombocitopenia.
Las causas de una verdadera trombocitopenia son la reducción de la producción por parte de la médula ósea, el aumento del consumo, la destrucción de plaquetas o el aumento del secuestro (Tabla 1).
| Pseudotrombocitopenia |
|
| Reducción de la producción | Aplasia médula ósea Leucemia megacariocítica Mielofibrosis
|
| Aumento del consumo |
|
| Destrucción |
|
| Secuestro |
|
Tabla 1. Resumen de las posibles causas de trombocitopenia.
Cabe destacar que, en ciertas enfermedades infecciosas (como la piroplasmosis), se produce trombocitopenia debido a un aumento de la destrucción. La trombocitopenia es un hallazgo que
se encuentra con frecuencia, y se ha descrito en el 39 % de las infecciones por T.equi, el 80 % de las infecciones por B. caballi y el 100 % de las infecciones mixtas10.
Signos clínicos de trombocitopenia
Así como la trombocitopenia puede tener numerosas causas, los signos clínicos en el caballo dependerán de la causa o causas responsables de la trombocitopenia. Así pues, con una trombocitopenia leve a moderada (30 – 90 G/L) los signos clínicos son a menudo inexistentes o muy leves para ser reconocidos.
Cuando la trombocitopenia es marcada (< 30 G/L), se producen cambios en la hemostasia primaria, dando lugar a petequias y equimosis principalmente en las mucosas y esclerótica. También se ha descrito un aumento de la epistaxis, así como tiempos de sangrado prolongado después del muestreo de sangre.
TROMBOCITOSIS
La trombocitosis se define como un incremento en el número de plaquetas circulantes según los intervalos descritos en la especie analizada. Como ocurre con la trombocitopenia, la trombocitosis puede clasificarse entre pseudotrombocitosis (principalmente debido a una lisis de eritrocitos los cuales son contados de manera errónea como plaquetas) y trombocitosis verdadera (Tabla 2). Para diferenciar entre ambos tipos, el visualizar los escatergramas puede ayudar.
| Pseudotrombocitosis |
|
| Redistribución |
|
| Aumento de la producción |
|
| Neoplasia | Trombocitemia esencial Neoplasias crónicas mieloproliferativas |
Tabla 2.
Durante el ejercicio y tras un momento de estrés o agitación (p. ej., extracción de la muestra sanguínea) una trombocitosis leve puede ser fisiológica. Esto se produce por una contracción del bazo donde lugar a la liberación de plaquetas almacenadas a la circulación11.
La trombocitosis verdadera se puede clasificar en trombocitosis primaria y secundaria. En la mayoría de los casos en los que el aumento del recuento de plaquetas se debe a una trombocitosis secundaria, este aumento es únicamente de leve a moderado (300 - 500 G/L). Sin embargo, en trombocitosis primaria el recuento suele ser mayor12. Además, la trombocitosis primaria se asocia con mayor frecuencia a presencia de hemorragias y trombosis, mientras que la trombocitosis secundaria ocurre principalmente en la inflamación y debido a infecciones13.
CONCLUSIÓN
Los recuentos de plaquetas son una parte indispensable de los hemogramas y pueden proporcionar información extra de una enfermedad subyacente. Su recuento debe siempre comprobarse manualmente bajo el microscopio, y la trombocitopenia o la trombocitosis deben ser interpretadas junto a los signos clínicos y acompañarse de un correcto examen y anamnesis.
Bibliografía
- Grondin TM, Dewitt SF. Normal hematology of the horse and donkey. In: Feldman BF, Zinkl JG, Jain NC, ed. Schalmʼs Veterinary Hematology. Philadelphia: Lippincott Williams & Wilkins; 200: 824–825
- Boudreaux MK. Thrombopoesis: Feldman BF, Zinkl JG, Jain NC, ed. Schalmʼs Veterinary Hematology. Philadelphia: Lippincott Williams & Wilkins; 2010: 56
- Dura A. Blutzellzählung und ‑differenzierung bei Pferd und Schwein mit dem Hämatologiesystem Advia 120: Gerätevalidierung und Softwareadaptation. Dissertation. Gießen: Justus- Liebig-Universität, 2005
- Kingston JK, Bayly WM, Sellon DC et al. Effects of sodium citrate, low-molecular weight heparin, and prostaglandin E1 on aggregation, fibrinogen binding, and enumeration of equine platelets. Am J Vet Res 2001; 62: 547–554
- Hinchcliff KW, Kociba GJ, Mitten LA. Diagnosis of EDTA-dependent pseudothrombocytopenia in a horse. J Am Vet Med Assoc 3993; 203(12): 1715–1716
- Satué K, Gardón JC, Muñoz A. Interpretation of platelets in the horse. J Hematol Res 2017; 4: 19–25
- Pschyrembel W. Pschyrembel – Klinisches Wörterbuch. Berlin/ Boston: De Gruyter 2017
- Stockham SL, Scott MA. Platelets. In: Fundamentals of veterinary clinical pathology, Blackwell Publishing, Aimes 2008:233–243
- Stockham SL, Scott MA. Platelets. In: Fundamentals of veterinary clinical pathology, Blackwell Publishing 2008: 244–246
- Zobba R, Ardu M, Niccolini S, et al: Clinical and laboratory findings in equine piroplasmosis. J Equine Vet Sci 28:301–308, 2008
- Morris DD. Diseases of the hemolymphatic system. In: Reed SM, Bayly WM, eds. Equine Internal Medicine. WB Saunders 1998: 558–601
- Buss DH, Cashell AW, OʼConnor ML et al. Occurrence, etiology, and clinical significance of extreme thrombocytosis: A study of 280 cases. Am J Med 1994; 96: 247–253
- Sellon DC et al. Thrombocytosis in 24 horses (1989–1994) J Vet Intern 1997; 11: 24–29
 by Multimédica
by Multimédica