¿Qué se sabe sobre las resistencias bacterianas a los antibióticos? Revisión de los aspectos principales e importancia en medicina veterinaria
Resumen breve
La resistencia a los antimicrobianos supone una amenaza cada vez mayor para la salud pública a nivel mundial. Desde su descubrimiento, los antibióticos han constituido durante décadas el tratamiento más efectivo frente a múltiples infecciones.Índice de contenidos
Resumen
La resistencia a los antimicrobianos supone una amenaza cada vez mayor para la salud pública a nivel mundial. Desde su descubrimiento, los antibióticos han constituido durante décadas el tratamiento más efectivo frente a múltiples infecciones.
Sin embargo, el uso indebido e indiscriminado de los mismos ha llevado a la aparición de cepas resistentes, haciéndolos ineficaces en muchos casos. Algunas especies de bacterias, que se encuentran dentro de la lista de prioridad para la investigación de nuevos antibióticos de la OMS, están dando más problemas de resistencias frente a los antibióticos. Así, bacterias grampositivas, como Staphylococcus aureus, Enterococcus faecium, E. faecalis y Streptococcus pneumoniae y gramnegativas, como Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y Acinetobacter baumannii, constituyen las especies más problemáticas en la actualidad. En medicina veterinaria, el uso irracional de los antibióticos ha llevado a la aparición de múltiples casos de infecciones nosocomiales en animales hospitalizados, producidas por muchas de las especies de bacterias antes mencionadas. La producción de antibióticos se ha ralentizado considerablemente, con lo que las alternativas terapéuticas para tratar infecciones se ven limitadas. La instauración de medidas preventivas, junto con el uso prudente de antibióticos se han convertido en la principal herramienta para limitar la aparición de resistencias. A ellas se deben sumarle otras acciones prioritarias para luchar contra este problema a nivel mundial, que incluyen la concienciación de la población, la mejora de las medidas de saneamiento e higiene, el fomento de la vacunación y desarrollo de terapias alternativas, el diagnóstico precoz y adecuado, y un mayor reconocimiento del capital humano dedicado a las enfermedades infecciosas.
Introducción
Los antibióticos son fármacos que se utilizan para combatir las infecciones causadas por bacterias, de allí que se les conozca también como “antibacterianos”. A lo largo del tiempo, se han empleado múltiples antibióticos con fines terapéuticos, no sólo en medicina humana y veterinaria, sino también en agricultura1-3. A mediados del siglo XX, los antibióticos se consideraban el "medicamento milagroso". El comienzo de la moderna "era de los antibióticos" se asoció con dos nombres: Alexander Fleming y Paul Ehrlich. En aquellos tiempos, los antibióticos se consideraban una solución mágica frente a los microorganismos responsables de la enfermedad, sin que afectaran al huésped. Además, el período comprendido entre los años 50 y 60 se consideró la época dorada para el descubrimiento de nuevas clases de antibióticos. Sin embargo, Fleming había advertido ya en 1945 sobre la posibilidad de aparición de resistencias bacterianas a la penicilina si se usa en bajas dosis o durante un período de tiempo demasiado corto1-3.
La resistencia a los antibióticos aparece cuando un medicamento pierde su capacidad de inhibir eficazmente el crecimiento bacteriano y las bacterias continúan multiplicándose en presencia de niveles terapéuticos del antimicrobiano1-3. La mayoría de los genes que codifican los mecanismos de resistencia se encuentran en la naturaleza, por lo que el fenómeno de resistencia a los antimicrobianos se produce de manera natural en las bacterias. Sin embargo, la presión antibiótica por el uso excesivo e inadecuado de los mismos en sanidad y agricultura, junto con la gestión inadecuada de residuos y la transmisión al medio ambiente, favorece y acelera el proceso, de manera que contribuye de forma importante a la aparición de cepas resistentes y aumenta con ello la mortalidad debida a enfermedades infecciosas1-3. Como consecuencia de esto, ha cambiado de manera drástica la situación en la medicina actual, y se vuelven a encontrar infecciones que presentan pocas alternativas terapéuticas y a un aumento de la mortalidad como consecuencia de éstas.
Las bacterias pueden desarrollar resistencias a uno o varios antibióticos. Según el género y cantidad de familias de antibióticos a las que sean resistentes las bacterias, pueden denominarse como multirresistentes, de resistencia extensa o panresistentes. A todas ellas se las denomina comúnmente como bacterias multirresistentes. Para considerar las bacterias como “multirresistentes”, deben cumplir dos requisitos: presentar resistencia a más de un grupo o familia de antimicrobianos y que la resistencia tenga una relevancia clínica y epidemiológica, es decir, que pueda suponer o suponga una dificultad para el tratamiento, así como causar brotes epidémicos y transmitir el mecanismo de resistencia1,2.
Antiguamente, la producción de nuevos antibióticos era directamente proporcional al desarrollo de cepas resistentes. Hoy en día, su producción se ve dificultada, y tan sólo una pequeña fracción de los antibióticos aprobados en los últimos 40 años representa nuevas clases de compuestos, la mayoría derivados de estructuras químicas ya conocidas. La nueva clase de antibióticos más reciente se descubrió durante la década de los 803,4. Por ello, el abordaje principal para combatir las resistencias a nivel mundial se centra hoy en día en la modificación de los antibióticos existentes (Figura 1).
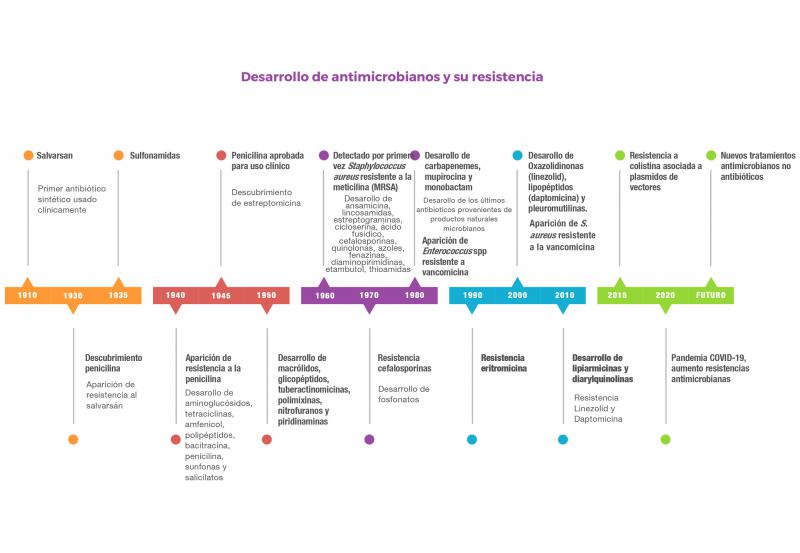
Por otro lado, la resistencia a los antibióticos prolonga las estancias hospitalarias, incrementa los costes médicos y aumenta la mortalidad. Por todo esto, y según la Organización Mundial de la Salud (OMS), la resistencia antimicrobiana se ha convertido en uno de los problemas emergentes más importantes en todo el mundo, que afectan tanto a la salud pública y animal como al medio ambiente5,6. Se calcula que al menos 700.000 personas en todo el mundo mueren cada año como consecuencia de infecciones producidas por bacterias resistentes a los medicamentos, y esta cifra podría aumentar hasta 10 millones en 2050 si no se aborda este problema7,8 (Figura 2), con lo que para entonces se espera que no haya antibióticos efectivos disponibles para muchas infecciones.7,8
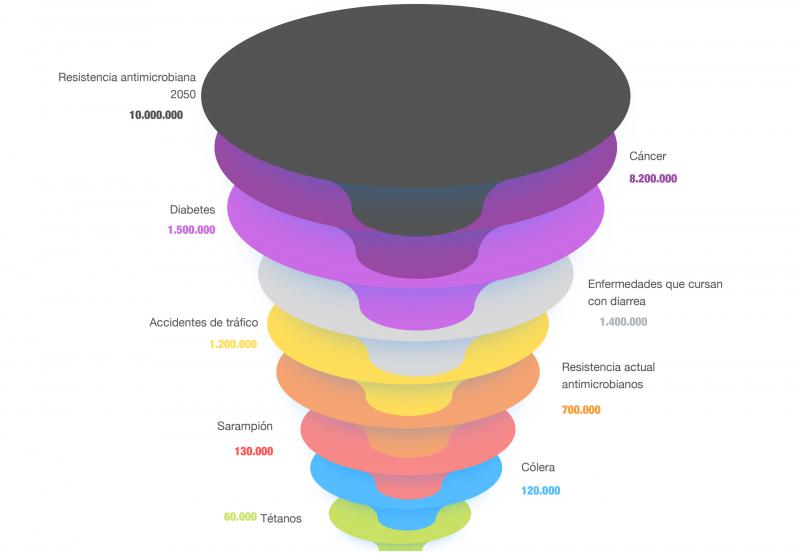
Además, durante la pandemia de COVID-19, el uso de antibióticos aumentó considerablemente, debido a las complicaciones derivadas de la infección por el virus SARS-CoV-2, que ha favorecido las infecciones bacterianas secundarias. En concreto, la utilización de azitromicina en los hospitales españoles aumentó en un 400 % en marzo de 2020, en comparación con su uso en febrero del mismo año10. Otros antibióticos alcanzaron también una elevada tasa de utilización en marzo de 2020, como son ceftaroline fosamil, ceftolozane/tazobactam, cefditoren, ceftriaxona, colistina, doxiciclina y linezolid. Esta situación puede conducir a un aumento de las resistencias bacterianas en la época post-COVID-1910.
Mecanismos de resistencia antimicrobiana
Las bacterias se definen como clínicamente resistentes a los fármacos antimicrobianos cuando, tras administrar el fármaco a la dosis y por la vía recomendada, no alcanza una concentración adecuada en el lugar de la infección que inhiba el crecimiento de la bacteria o que la elimine5. Las bacterias han desarrollado a lo largo de los años distintas formas de resistencia mediante la adquisición de genes de resistencia a través de mecanismos de transferencia horizontal o gracias a mutaciones, que forman parte de la selección natural5,11,12.
Los antibióticos no distinguen entre bacterias beneficiosas y patógenas. Siempre que se utilizan fármacos antimicrobianos en medicina humana o veterinaria, se establece una presión selectiva sobre las bacterias susceptibles, inhibiendo su crecimiento o eliminándolas, mientras que las bacterias resistentes pueden propagarse a expensas de estas. Los antibióticos inhiben o eliminan a todas aquellas bacterias para las que la concentración mínima inhibitoria sea igual o inferior a la concentración antimicrobiana en el respectivo compartimento corporal. Como consecuencia, la proporción de bacterias resistentes aumenta durante la terapia antimicrobiana y la composición de la microbiota intestinal se altera. Bajo esta presión selectiva, los genes de resistencia también pueden diseminarse dentro del mismo huésped. Cuando las bacterias resistentes se transfieren entre humanos o animales, pueden intercambiar sus genes de resistencia con otras bacterias que ya residen en el nuevo huésped5. En este punto, es importante mencionar la diferencia entre colonización e infección bacteriana, debido a que numerosos estudios muestran resultados de colonización o de infección en el momento del ingreso y tras su paso por el centro u hospital, respectivamente. La colonización implica la presencia de bacterias en piel, boca, intestino o vías respiratorias, pero sin producir enfermedad. Sin embargo, la infección se produce por la invasión de los tejidos corporales de un hospedador por microorganismos causantes de enfermedades. Las bacterias colonizadoras no patógenas pueden convertirse en bacterias patógenas, provocando infección, bajo determinadas condiciones que implican, entre otros, tanto al patógeno como al sistema inmune del hospedador13. Con todo esto, es importante entender cómo evolucionan las bacterias, sus mecanismos de resistencia y la transmisión de estos, con el fin de predecir la aparición de nuevos medios de propagación y mecanismos de resistencia, frenando así su avance.
El papel de las resistencias bacterianas en el concepto One Health
El concepto One health o “Una salud”14–16 se refiere al vínculo existente entre los seres humanos, los animales y el medio ambiente que los rodea, orientado a una mejora de la salud y el bienestar de toda la comunidad6,14–16. En el fenómeno de resistencia antimicrobiana, participan distintos ecosistemas para la aparición, adquisición y diseminación de las resistencias6,15,16, por lo que se requieren actuaciones interdisciplinares para abordarlas, siendo necesaria la colaboración de profesionales de los ámbitos de la salud humana, animal y ambiental. Aunque la resistencia a los antimicrobianos existe de forma previa al descubrimiento de antibióticos, el aumento de la resistencia se ha producido de forma secundaria al desarrollo y empleo de estos fármacos, debido a varios factores que han contribuido al aumento de la presión de selección genética en las bacterias: la producción intensiva de alimentos, la globalización, el cambio climático, el aumento de la densidad de población, los conflictos bélicos y la urbanización, entre otros6,15,16.
La diseminación a nivel mundial de las resistencias antibióticas se ha visto favorecida por la utilización inapropiada de antibióticos en animales y personas, la contaminación del medio y unas políticas de control de uso de antibióticos ineficaces, que ha propiciado la persistencia de residuos farmacológicos y de genes de resistencia en el medio ambiente15, en reservorios como la tierra, el agua, los desechos derivados de la actividad hospitalaria, fábricas y granjas, así como los nichos ecológicos contaminados por aguas residuales, estiércol de granjas y residuos derivados de la industria farmacológica6,15,16.
Dentro del concepto “One Health”, la salud humana se considera prioritaria, con interdependencia con la salud animal y ambiental17. En 2017, la OMS publicó una lista de bacterias resistentes a los antibióticos prioritarias para la investigación de nuevos tratamientos antimicrobianos17. Entre esos microrganismos, destaca el grupo denominado “ESKAPE”, acrónimo para las siguientes bacterias: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa y Enterobacter spp.17–21. Así, todos los esfuerzos para reducir los fenómenos de resistencia van dirigidos, de forma prioritaria, al desarrollo de nuevos tratamientos frente a estas especies bacterianas, además de otros microorganismos implicados en la producción de infecciones.
Las infecciones nosocomiales suponen un gran problema en medicina humana y veterinaria. Incluyen tanto las infecciones contraídas en el hospital, pero manifiestas después del alta hospitalaria, como aquellas infecciones ocupacionales del personal del centro. Se asocian con mayor frecuencia a infecciones de heridas quirúrgicas22, torrente sanguíneo, vías respiratorias, vías urinarias y aparato digestivo23,24. Según la OMS, el 7 % de los pacientes hospitalizados sufrirán una infección nosocomial, pudiendo aumentar hasta el triple en caso de infecciones por bacterias resistentes a los antibióticos23,24. En medicina humana, este tipo de infecciones supone un problema creciente y se ha asociado a distintos factores de riesgo: pacientes de mayor edad, malnutrición, patologías crónicas, estancia hospitalaria o intervenciones más complejas, entre otros24. Las medidas de higiene en el ambiente y en el personal hospitalario pueden reducir a más de la mitad el riesgo de fallecimiento por infecciones producidas por bacterias resistentes, así como reducir en un 40 % las complicaciones a largo plazo y la carga sanitaria asociada24.
En medicina veterinaria, el uso irracional de los antibióticos condujo, a finales de los años 90, a la aparición de múltiples casos de infecciones nosocomiales en animales hospitalizados, producidas por bacterias multirresistentes, como Acinetobacter baumannii, Escherichia coli, Enterobacter spp., Klebsiella spp. y Salmonella enterica, sobre todo en las áreas de cuidados intensivos23. Además, diversos estudios describen la presencia de Staphylococcus spp. resistente a la meticilina (SRM), Enterococcus spp. resistentes a la vancomicina (ERV), Pseudomonas aeruginosa, Enterobacterias productoras de betalactamasas de espectro extendido (BLEE) (del inglés: Extended Spectrum Beta-Lactamase o ESBL) y carbapenemasas (EPC) (Carbapenemase-Producing Enterobacteriaceae o CPE) en perros y el ambiente en hospitales veterinarios25–31. Todas ellas se encuentran incluidas en la lista de bacterias prioritarias de la OMS para la investigación de nuevos antibióticos. Las enterobacterias constituyen una familia de bacterias responsable de gran parte de las infecciones nosocomiales a nivel mundial, y cada vez están mostrando más resistencia frente a antibióticos de último recurso, sobre todo las Enterobacterias productoras de NDM-1 (New Delhi metallo-β-lactamase-1), algunas de las cuales producen infecciones que no presentan alternativas terapéuticas frente a ellas, consideradas como bacterias “panresistentes”32.
Además, su importancia viene ligada al hecho de que gran parte de las enterobacterias son comensales del ser humano y los animales y, por tanto, la propagación de estas entre los diferentes ambientes se ve favorecida.
En veterinaria, la hospitalización y su duración, la administración previa de corticosteroides y antimicrobianos o la aplicación combinada de varios antibióticos, entre otros, se consideran factores que pueden predisponer a la colonización y adquisición de bacterias resistentes33,34.
La transferencia de bacterias (incluidas las cepas resistentes) puede producirse entre humanos y animales en ambas direcciones, ya sea por contacto, inhalación de polvo y aerosoles que contienen bacterias, o a través de la cadena alimentaria.
El contacto directo es, con mayor probabilidad, la forma más rápida y fácil de transferencia bacteriana, y constituye la vía más frecuente de transmisión de estafilococos que residen en las superficies corporales. En este sentido, los perros y gatos son considerados en la actualidad como miembros de la familia en muchos hogares, sobre todo en los países más industrializados, existiendo un contacto estrecho entre ellos, lo que facilita este tipo de transmisión. Así, se han producido numerosos casos de transmisión de bacterias resistentes, sobre todo SRM y E. coli, entre los animales de compañía y sus propietarios35–38. Algunos estudios están basados en la evidencia de trabajos de tipificación genética que identifican aislados similares de animales y humanos en contacto con ellos, por lo que la dirección de transmisión entre hospedadores en raras ocasiones puede probarse39. En aislados de bacterias gram-positivas, como Staphylococcus aureus resistente a la meticilina (SARM) de perros y gatos, la dirección de transmisión es predominantemente desde el humano al animal, debido a que la mayoría de estos aislados pertenecen a linajes clonales prevalentes en medicina humana40,41. Sin embargo, debido a su predilección por los queratinocitos caninos, la especie S. pseudintermedius resistente a la meticilina (SPRM) es más frecuente en animales42, por lo que las infecciones suelen producirse desde el perro a su propietario. Además, las transmisiones de genes de resistencia se pueden intercambiar entre especies de SARM y el SPRM, y entre SARM y otras bacterias de distintos géneros. Así, aunque los genes de resistencia adquirida a la vancomicina (entre los que se encuentra el gen vanA) se han notificado en enterococos resistentes a este antibiótico, estos genes se pueden transferir a otros aislados bacterianos, como S. aureus43. En cuanto a las bacterias gram-negativas que pueden transmitirse entre animales y humanos, se incluyen algunos patógenos nosocomiales muy resistentes a los medicamentos, como E. coli BLEE44–46. Así, se han descrito aislados de E. coli pertenecientes al mismo grupo filogenético y con los mismos patrones de polimorfismo entre los miembros de una misma familia y sus perros47.
Además, las personas que por su profesión tienen un mayor contacto con animales, como los veterinarios, agricultores, ganaderos, trabajadores de mataderos o cuidadores de animales, presentan un mayor riesgo de adquirir bacterias resistentes por contacto con ellos48–51.
Los antibióticos han sido empleados de manera terapéutica y profiláctica en animales de compañía, pero también para prevenir y tratar enfermedades infecciosas en ganadería, y como promotores de crecimiento, aplicando pequeñas cantidades de antibiótico a dosis subterapéutica para conseguir una ganancia de peso del animal. Un ejemplo es el de la colistina, antibiótico perteneciente al grupo de las polimixinas, que fue descubierto en los años 40, y es poco utilizado en medicina humana debido a la nefro y neurotoxicidad que produce. Hasta hace unos años, la resistencia a la colistina era un fenómeno ocasional, y se reservaba su utilización para el tratamiento de infecciones por bacterias resistentes a carbapenemes, como K. pneumoniae, A. baumannii y P. aeruginosa. Sin embargo, su uso como promotor de crecimiento ha favorecido la aparición de resistencias frente a este antibiótico52. Desde el año 2006, está prohibido el uso de los antibióticos como promotores de crecimiento en Europa, pero aún se permite su uso en otros países, como Estados Unidos, y a pesar de que cada vez se está regulando más su utilización, su consumo está en aumento en muchos lugares53, sobre todo aquellos de renta baja y media6.
El futuro de los tratamientos con antibióticos
Los antibióticos se han considerado los fármacos fundamentales para el control de las infecciones bacterianas. Sin embargo, la tasa de crecimiento de la resistencia bacteriana supera la de creación de nuevos antibióticos, y por ello es necesario reevaluar los tratamientos actuales disponibles, valorar la utilización de fármacos antimicrobianos que se encontraban en desuso y, sobre todo, desarrollar nuevas terapias alternativas al uso de antimicrobianos que permitan reducir su empleo en medicina humana y veterinaria54,55. Entre ellas, se encuentran los probióticos, las vacunas, los aceites esenciales, los bacteriófagos, los anticuerpos, los péptidos antimicrobianos o los inhibidores del Quorum Sensing (Figura 3) .
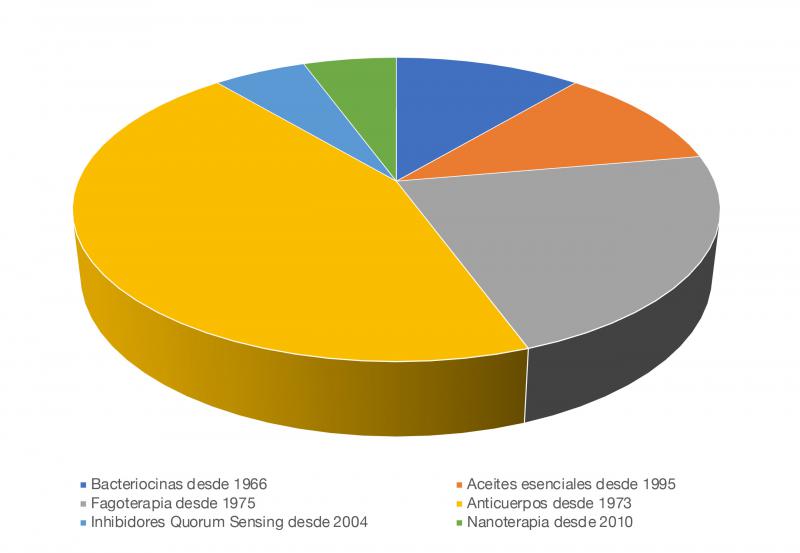
La modulación de la microbiota mediante la utilización de prebióticos, probióticos y simbióticos, el trasplante fecal o la mejora de la nutrición se ha propuesto tanto en medicina humana como veterinaria como alternativa para mantener la integridad de la flora habitual, imprescindible para preservar su función, además de estimular la respuesta inmunitaria y producir fármacos antimicrobianos. Los probióticos modulan la microbiota intestinal y otras enfermedades, como las infecciones vaginales y pulmonares, además de presentar otras propiedades, como actividad anticancerosa, reductor del colesterol, prevención de enfermedades cardiovasculares, reversión de los síntomas de ansiedad y depresión, mejora de los síntomas de la diabetes y la obesidad, etc.11,57 Sin embargo, se han descrito algunos problemas de resistencia en algunas bacterias empleadas como probióticos, dentro del género Lactobacillus 58, o en especies de Bifidobacterium59. Por otro lado, el trasplante fecal se basa en la introducción del microbioma desde un donante sano a un receptor, con el fin de tratar infecciones bacterianas o alteraciones gastrointestinales que producen disbiosis intestinal. En medicina humana, se utiliza sobre todo en infecciones por Clostridium difficile que no responde al tratamiento convencional. Deben realizarse más estudios, pero parece una alternativa plausible en pacientes con infecciones por enterobacterias resistentes, o infecciones por SARM o ERV60. En medicina veterinaria, se han observado resultados satisfactorios empleando trasplante fecal en perros con parvovirus canino, que mejoran la diarrea, disminuyen la estancia hospitalaria y aumentan la supervivencia del animal61,62.
Las vacunas se emplean en la prevención de enfermedades, y protege frente a bacterias resistentes o sensibles a los antibióticos, evitando infecciones futuras y reduciendo así el empleo de antibióticos para su tratamiento. Por lo tanto, una vacunación adecuada puede sustituir el uso de antibióticos, y supone el método más eficaz para prevenir enfermedades infecciosas54.
Los aceites esenciales son compuestos volátiles extraídos de plantas o sus extractos. Los aceites esenciales se han reconocido desde hace tiempo por su actividad antimicrobiana y han ganado mucha atención por su potencial como alternativas a los antibióticos. Han mostrado actividad antimicrobiana in vitro contra el SARM, cepas resistentes de Klebsiella oxytoca, Enterobacterias BLEE y EPC, como E. coli, y cepas resistentes de A. baumannii, entre otros. No se han descrito resistencias frente a los mismos, pero son difíciles de utilizar en productos de base acuosa y tienen tendencia a volatilizarse con el tiempo, lo que reduce su actividad antimicrobiana63.
Los bacteriófagos son virus que se replican en las bacterias, destruyéndolas64. Fueron descubiertos décadas antes que los antibióticos, y eran utilizados para tratar infecciones en humanos, lo que se conoce como “terapia de fagos”. Tras la era de los antibióticos, se consideró que los fagos eran demasiado específicos y complicados, por lo que se dejó de utilizarlos como antimicrobianos durante una época. Se han descrito muchos fagos para tratar infecciones por bacterias multirresistentes problemáticas, incluidos los patógenos ESKAPE, los más peligrosos para los humanos60. Existen algunos estudios que describen resistencias a los fagos65.
Por otro lado, el sistema inmune del individuo produce anticuerpos para neutralizar a los patógenos, por lo que constituyen una alternativa de tratamiento frente a bacterias resistentes o sus toxinas. La terapia sérica se ha empleado desde hace muchos años en infecciones tetánicas, fiebre escarlatina y neumonía neumocócica. Hoy en día, existen terapias con anticuerpos comercializadas frente a Bacillus anthracis y Clostidium difficile. La principal limitación de este tipo de tratamientos es el coste de producción66.
Los péptidos antimicrobianos (PAM) son producidos por diversos organismos y presentan un amplio espectro frente a distintas bacterias, hongos y protozoos. Ejercen su efecto por daño en la membrana celular, además de afectar al DNA, RNA y enzimas reguladoras67. Pueden ser naturales y sintéticos y según su mecanismo de acción se dividen en péptidos de defensa del huésped y bacteriocinas. Debido a que los microorganismos pueden desarrollar resistencia frente a ellos, son necesarios mayores estudios para valorar su uso67,68.
Se han desarrollado muchos otros métodos alternativos al uso de los antibióticos, como el uso de nanopartículas, las técnicas de edición genética y transgénicas, compuestos antibiofilms o inhibidores del Quorum Sensing, entre otros69–71.
Todos ellos son tratamientos muy prometedores, aunque se encuentran aún en investigación y muchos no están disponibles en el mercado.
Acciones para la restricción del uso de antimicrobianos y situación actual en la clínica veterinaria
Como se ha señalado anteriormente, la resistencia a los antimicrobianos de uso humano y veterinario constituye un problema sanitario complejo, que conlleva una repercusión sanitaria y económica, afectando a todo el conjunto de la sociedad, y requiriendo una acción coordinada dentro del planteamiento “One Health”. Para ello, se han desarrollado desde hace unos años una serie de medidas a nivel mundial, dirigidas a regular el uso de los antimicrobianos, sobre todo aquellos que se emplean para el tratamiento de infecciones que amenazan la vida de las personas (Figura 4).
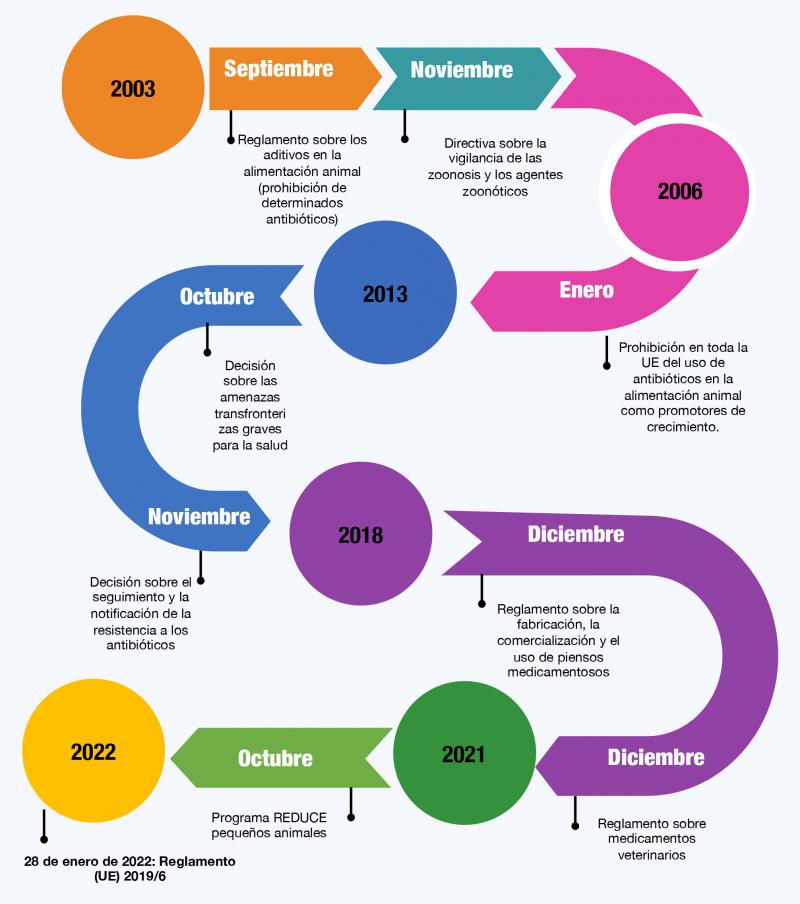
En 2016, la OMS, junto con la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y la Organización Mundial de la Salud Animal (OIE), adoptaron un plan conjunto mundial sobre la resistencia a antimicrobianos 73, con los siguientes objetivos:
- Mejorar la concienciación en materia de resistencia antibiótica.
- Aumentar la vigilancia del uso de antimicrobianos y fomentar la investigación.
- Aumentar las medidas de higiene, saneamiento y prevención para evitar infecciones.
- Utilizar de forma racional y óptima los medicamentos antimicrobianos, tanto en medicina humana como en veterinaria.
- Aumentar la inversión en nuevos medicamentos, medios de diagnóstico, vacunas, etc.
En 2017 (con una última actualización en 2021), la OMS lanzó la herramienta “AWaRe” (acrónimo de “Access”, “Watch”, “Reserve”)74, destinada a promover el uso racional de antibióticos en medicina humana, categorizando los antibióticos en tres grupos (Tabla 1):
- “Access” - Antibióticos accesibles: antibióticos de elección frente a las infecciones más comunes, activos frente a un amplio rango de patógenos que presentan bajo potencial de resistencias. Deben estar disponibles en todo momento74.
- “Watch” - Antibióticos bajo vigilancia: recomendados sólo frente a determinadas infecciones. Incluye la mayoría de los antibióticos de elevada prioridad, con alto potencial de resistencia. Deben usarse con moderación74.
- “Reserve” - Antibióticos de reserva: deben utilizarse sólo en infecciones producidas por organismos multirresistentes. Su uso está restringido a último recurso, en aquellos pacientes en los que han fallado otras alternativas74.
| Tabla 1. Sistema de clasificación de antibióticos “AWaRe”74. |
| Access | WAtch | Reserve | ||
| Amikacina Amoxicilina Amoxicilina-ácido clavulánico Ampicilina Ampicilina + sulbactam Azidociclina Bacampicilina Bencilpenicilina Bencilpenicilina benzatina Bromidoprim Carpreomicina Cefacetrilo Cefadroxilo Cefalexina Cefaloridina Cefalotina Cefapirina Cefatrizine Cefacedona Cefazolina Cefradine Cefroxadina Ceftezole Cloranfenicol Clindamicina Clometocilina Cloxacilina Dicloxacilina Doxiciclina Epicilina Espectinomicina Fenoximetilpenicilina Flucloxacilina Furacidina Gentamicina Hetaciclina Mecilinam Metampicilina Meticilina Metronidazol | Nafcilina Nifurtoinol Nitrofurantoina Ornidazol Penamecilina Pivampicilina Pivmecilinam Procaina bencilpenicilina Propicilina Secnidazol Sulbactan Sulfadiacina Sulfadiacina + tetroxoprim Sulfadiacina + trimetoprim Sulfadimetoxina Sulfafurazol Sulfaisodiidina Sulfaleno Sulfamazona Sulfameracina Sulfametizol Sulfametoxazol Sulfametoxipiridacina Sulfametomidina Sulfametoxidiacina Sulfamoxol Sulfanilamida Sulfaperin Sulfafenazol Sulfapiridina Sulfatiazol Sulfatiourea Sultamicilina Talampicilina Tetraciclina Tiamfenicol Tinidazol Trimetoprim | Ácido fusidico Ácido oxolinico Ácido pipemidico Ácido piromídico Arbecacina Aspoxicilina Azitromicina Azlocilina Bekanamicina Biapenem Carbenicilina Carindacilina Cefaclor Cefamandol Cefbuperazona Cefcapene Cefdinir Cefditoren Cefepime Cefetamet Cefixima Cefmenoxima Cefmetazol Cefminox Cefodizima Cefonicid Fefoperazona Ceforanida Cefoselis Cefotaxima Cefotetan Cefotiam Cefotixina Cefozopran Cefpiramida Cefpiroma Cefpodoxime Cerprozilo Cefsulodina Ceftacidima Cefteram Ceftibuteno Ceftizoxima Ceftriaxona Cefuroxima Clortetraciclina Cinoxacina Ciprofloxacina Claritromicina Clofoctol Clomociclina Delafloxacina Demeclociclina Dilbekacina Diritromicina Doripenem Enoxacina Ertapenem Eritromicina Espiramicina Estreptomicina Feneticilina Fidaxomicina Fleroxacina Flomoxef Flumequina Fluritromicina | Fosfomicina (oral) Garenoxacina Gatifloxacina Gemifloxacina Grepafloxacina Imipenen/cilastatina Isepamicina Josamicina Kanamicina Lascufloxacina Latamoxef Levofloxacino Levonadifloxacino Lincomicina Lomefloxacina Loracarbef Lymeciclina Meropenem Metaciclina Mezlocilina Micronomicina Midecamicina Minociclina (oral) Miocamicina Moxifloxacino Nemonoxacina Neomicina Netilmicina Norfloxacino Orfloxacino Oleandomicina Oxitetraciclina Panipenem Pazufloxacina Perfloxacina Penimepiciclina Piperacilina Pristinamicina Prulifloxacino Ribostamicina Rifabutin Rifampicina Rifaximina Rokitamicina Rolitetraciclina Rosoxacina Roxitromicina Rufloxacina Sareciclina Sisomicina Sitafloxacina Sparfloxacina Streptoduocina Sulbenicilina Tazobacan Tebipenem Teicoplanina Telitromicina Temafloxacino Temocilina Ticarcilina Tobramicina Tosufloxacina Troleandomicina Trovafloxacina Vancomicina | Aztreonam Carumonam Cefiderocol Ceftarolina Ceftacidima + avibactam Ceftobiprol Ceftolozane + tazobactam Colistina Dalbavancina DAlfopristin + quinupristin Daptomicina Iclaprim Daptomicina Eravaciclina Faropenem Fosfomicina (inyectable) Imipenen/cilastatina/ relebactam Lefamulina Linezolid Meropenem + vaborbactam Minociclina (inyectable) Omadaciclina Oritavancina Polimixina B Tedizolid Telavancina Tigeciclina |
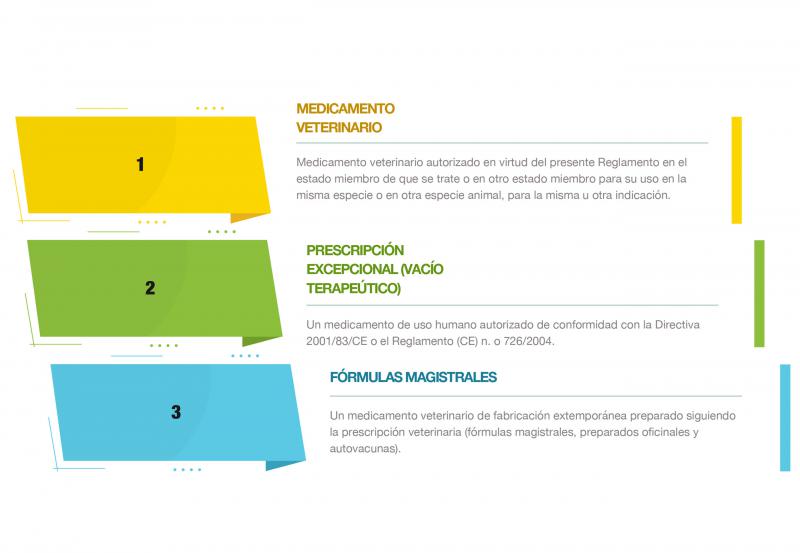
El 28 de enero de 2022 entró en vigor el Reglamento (UE) 2019/6, que afecta a la prescripción de medicamentos y a la receta veterinaria en animales productores y no productores de alimentos75. En este RD se destaca, entre otros temas, la importancia de la resistencia bacteriana a los antimicrobianos, además de regular su prescripción. Se agrupan los medicamentos veterinarios en distintos niveles (prescripción “en cascada”), lo que implica que, si existe un medicamento autorizado en un determinado nivel, este debe ser el antibiótico de elección, evitando descender en la cascada a otros niveles o grupos de medicamentos75 (Figura 5).
En España, los programas desarrollados para la reducción del uso de antimicrobianos en sanidad animal se engloban dentro del Plan Nacional de Resistencia a los Antibióticos77 (PRAN), coordinado por la Agencia Española del Medicamento y
Productos Sanitarios (AEMPS). El PRAN establece seis líneas estratégicas que abarcan diferentes objetivos, englobando la vigilancia del consumo de antibióticos, el control de las resistencias antibacterianas, las medidas de prevención y tratamiento, el fomento de la investigación, la formación de los profesionales sanitarios y la comunicación y sensibilización de la población general y específica77. Entre estas medidas del PRAN se incluye la monitorización del consumo de antibióticos en salud animal, para lo cual se han desarrollado sistemas informáticos de control de los tratamientos de antibióticos en ganadería78 (Sistema informático Central de Control de Prescripciones Veterinarias de Antibióticos – PRESVET-). En relación con los planes de control del uso de antibióticos en este sector, en 2016 la AEMPS desarrolló el plan “REDUCE Colistina” 52,79, dentro del PRAN, junto con representantes de asociaciones nacionales de veterinarios y profesionales del sector de producción porcina. El objetivo de este plan era reducir el consumo de colistina, así como controlar el consumo alternativo de neomicina y/o apramicina Este programa ha tenido gran éxito en el sector porcino, reduciéndose el uso de colistina en casi un 100 % desde su implantación hace 6 años. Debido al éxito de este programa, se han firmado otros acuerdos REDUCE, con representantes de profesionales de otros sectores (cunicultura, pollos broiler, bovino de carne y leche, ovino y caprino)77.
En pequeños animales, hasta hace relativamente poco tiempo no existían datos contabilizados con respecto al consumo de antimicrobianos en España, por lo que se desconocía la realidad del uso de estos fármacos en este sector. En octubre de 2021, se puso en marcha un proyecto piloto PRAN de pequeños animales para cuantificar el consumo real de antibióticos en pequeños animales80. En este proyecto participan distintos centros veterinarios de forma voluntaria, los cuales aportan datos de consumo total de antibióticos, así como el número de animales tratados (incluyendo perros y gatos).
Por otro lado, el PRAN pone a disposición a través de la página web www.resistenciaantibioticos.es, información detallada sobre los planes actuales de lucha frente a las resistencias a los antimicrobianos, incluyendo mapas de consumo de antibióticos, los programas de reducción en sanidad animal, así como la “Guía terapéutica de antimicrobianos veterinarios”81 disponible como aplicación informática para diferentes dispositivos, que reúne información necesaria para realizar una prescripción adecuada de antimicrobianos, aportando datos sobre:
- Tratamiento aconsejado.
- Categorización de antibióticos.
- Recomendaciones para la forma de administración.
- Situación epidemiológica de su zona.
EL PRAN también ha creado la PRANteca, una biblioteca online con recursos sobre antibióticos y resistencias, dirigida a profesores y alumnos de facultades biosanitarias82.
Además de estos planes de acción, las asociaciones veterinarias de pequeños animales están ofreciendo directrices y formaciones constantes sobre el uso racional de antimicrobianos en el sector veterinario. Así, la Federación de Asociaciones Europeas de Veterinarios de Animales de Compañía (FECAVA, por sus siglas en inglés: Federation of European Companion Animal Veterinary Associations), junto con la Asociación Veterinaria de Pequeños Animales de España (AVEPA) y Laboklin España, han publicado diferentes materiales, como infografías, para el uso responsable de antibióticos, que se encuentran disponibles de forma gratuita online para su descarga.83 En ellas se recalca la importancia de la toma de muestras para realizar un cultivo bacteriano y posterior antibiograma siempre que sea posible, la elección, en caso de que sea imprescindible, del tratamiento antibiótico considerando los resultados laboratoriales obtenidos, recomendaciones y referencias bibliográficas actualizadas (Tabla 2).
En todos estos materiales informativos también se recalca la importancia de evitar la antibioterapia preventiva en animales sanos para procedimientos como limpiezas de boca, cirugías electivas en pacientes sanos o en tejidos no contaminados (como esterilizaciones, cesáreas, tumores no infectados, cirugías ortopédicas limpias de duración menor a 1,5 horas, neurocirugía, etc.), entre otros83. Tampoco se recomienda su uso en enfermedades de origen vírico no complicadas (traqueítis canina, infecciones gastrointestinales agudas, infecciones en vías respiratorias superiores en gatos, calicivirus felino, leucemia/inmunodeficiencia felina, etc.). Las infecciones superficiales en piel, así como otitis externa y enfermedad periodontal, suelen responder al uso de antisépticos u otros fármacos tópicos, por lo que se desaconseja la utilización de antimicrobianos sistémicos.83 Además, para la selección responsable del antibiótico más adecuado, se aconseja conocer siempre el mecanismo de acción del antibiótico, su vía de administración preferente, conocer su clasificación en función de si se trata de un antibiótico de primer, segundo o último recurso, priorizar los de espectro reducido, etc.
Existen, además, otras herramientas para los veterinarios de pequeños animales desarrollados por otras instituciones y empresas que ayudan al veterinario en su elección del tratamiento más adecuado, como la “Guía para el uso racional de los antimicrobianos (GRAM)”84.
Por último, además de conocer los patógenos y su capacidad de resistencia, se considera primordial tomar medidas para evitar este tipo de infecciones. Así, similar a como se observa en medicina humana, los principales métodos para reducir estas infecciones, sobre todo en hospitales y clínicas veterinarias son23,83:
- Higiene de las manos y la utilización de equipos de protección personal (EPIs), que incluye ropa y guantes para reducir la contaminación del personal, los pacientes y el entorno;
- Limpieza y desinfección de las superficies;
- Gestión de los pacientes (p. ej., agrupación de los pacientes en función del riesgo);
- Vigilancia (identificación de los pacientes infectados o colonizados, de las infecciones nosocomiales y de los factores de riesgo);
- Administración de antimicrobianos (uso prudente);
- Educación y formación (propietarios, profesionales).
Conclusiones
Debido a la problemática creciente de resistencias antimicrobiana a nivel mundial, es necesario continuar implementando estrategias desde el concepto One Health para un uso racional de estos fármacos, aumentar las medidas preventivas para evitar las infecciones, así como desarrollar nuevas estrategias que permitan luchar frente a estos patógenos. Se requiere un abordaje holístico que desarrolle la educación a nivel mundial frente a este problema, concienciando tanto a la población en general como a los profesionales de la salud humana, animal y medioambiental, para la comprensión del problema y la aplicación de medidas conjuntas que contrarresten el crecimiento de estas resistencias.
Bibliografía
- Red Nacional de Vigilancia Epidemiológica (RENAVE). Protocolo general de vigilancia y control de microorganismos multiresistentes o de especial relevancia clínico-epidemiológica (protocolo MMR). 2016.
- Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: An international expert proposal for interim standard definitions for acquired resistance. Clinical Microbiology and Infection. 2012;18(3):268–81.
- Clatworthy AE, Pierson E, Hung DT. Targeting virulence: A new paradigm for antimicrobial therapy. Vol. 3, Nature Chemical Biology. Nature Publishing Group; 2007. p. 541–8.
- Hutchings M, Truman A, Wilkinson B. Antibiotics: past, present and future. Vol. 51, Current Opinion in Microbiology. Elsevier Ltd; 2019. p. 72–80.
- Schwarz S, Loeffler A, Kadlec K. Bacterial resistance to antimicrobial agents and its impact on veterinary and human medicine. Veterinary Dermatology. 2017 Feb 1;28(1):82-e19.
- Hernando-Amado S, Coque TM, Baquero F, Martínez JL. Defining and combating antibiotic resistance from One Health and Global Health perspectives. Vol. 4, Nature Microbiology. Nature Publishing Group; 2019. p. 1432–42.
- Rolain JM, Abat C, Jimeno MT, Fournier PE, Raoult D. Do we need new antibiotics? Vol. 22, Clinical Microbiology and Infection. Elsevier B.V.; 2016. p. 408–15.
- O’Neill J. Securing new drugs for future generations: the pipeline of antibiotics. Review on Antimicrobial Resistance. 2015.
- O´Neill J. Tackling drug-resistant infections globally: final report and recommendations. 2016.
- Gonzalez-Zorn B. Antibiotic use in the COVID-19 crisis in Spain. Vol. 27, Clinical Microbiology and Infection. Elsevier B.V.; 2021. p. 646–7.
- Nataraj BH, Mallappa RH. Antibiotic Resistance Crisis: An Update on Antagonistic Interactions between Probiotics and Methicillin-Resistant Staphylococcus aureus (MRSA). Vol. 78, Current Microbiology. Springer; 2021. p. 2194–211.
- Liu G, Elif L, Elmerdahl J. Antimicrobial-induced horizontal transfer of antimicrobial resistance genes in bacteria: a mini-review. J Antimicrob Chemother . 2022;77:556–67.
- Dani A. Colonization and infection. Vol. 67, Central European Journal of Urology. Polish Urological Association; 2014. p. 86–7.
- One Health Commission. One Health [Internet]. 2022. Available from: https://www.onehealthcommission.org/en/why_one_health/what_is_one_health/
- Aslam B, Khurshid M, Arshad MI, Muzammil S, Rasool M, Yasmeen N, et al. Antibiotic Resistance: One Health One World Outlook. Vol. 11, Frontiers in Cellular and Infection Microbiology. Frontiers Media S.A.; 2021.
- McEwen SA, Collignon PJ. Antimicrobial Resistance: a One Health Perspective. Aarestrup FM, Schwarz S, Shen J, Cavaco L, editors. Microbiology Spectrum. 2018 Apr 6;6(2).
- World Health Organization. Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. 2017.
- de Oliveira DMP, Forde BM, Kidd TJ, Harris PNA, Schembri MA, Beatson SA, et al. Antimicrobial Resistance in ESKAPE Pathogens. 2020.
- Du H, Puri S, McCall A, Norris HL, Russo T, Edgerton M. Human salivary protein histatin 5 has potent bactericidal activity against ESKAPE pathogens. Frontiers in Cellular and Infection Microbiology. 2017 Feb 15;7(FEB).
- Lozano C, Torres C. Actualización en la resistencia antibiótica en Gram positivos. Enfermedades Infecciosas y Microbiología Clínica. 2017 Jan 1;35:2–8.
- Du W, Chen H, Xiao S, Tang W, Shi G. New insight on antimicrobial therapy adjustment strategies for gram-negative bacterial infection: A cohort study. Medicine (United States). 2017;96(13).
- Lee JT, Audrey Adams MB, W Chinn RY, Memorial Hospital San Diego S, Alfred DeMaria C, Forlenza SW, et al. Guideline for Prevention of Surgical Site Infection, 1999.
- Stull JW, Weese JS. Hospital-Associated Infections in Small Animal Practice. Vol. 45, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2015. p. 217–33.
- World Health Organization. Global report on infection prevention and control [Internet]. 2022. Available from: http://apps.who.int/bookorders.
- Chung YS, Kwon KH, Shin S, Kim JH, Park YH, Yoon JW. Characterization of veterinary hospital-associated isolates of Enterococcus species in Korea. Journal of Microbiology and Biotechnology. 2014;24(3):386–93.
- Ortiz-Díez G, López R, Sánchez-Díaz AM, Turrientes MC, Baquero MR, Luque R, et al. Epidemiology of the colonization and acquisition of methicillin-resistant staphylococci and vancomycin-resistant enterococci in dogs hospitalized in a clinic veterinary hospital in Spain. Comparative Immunology, Microbiology and Infectious Diseases. 2020 Oct 1;72.
- Sasaki T, Kikuchi K, Tanaka Y, Takahashi N, Kamata S, Hiramatsu K. Methicillin-resistant Staphylococcus pseudintermedius in a veterinary teaching hospital. Journal of Clinical Microbiology. 2007 Apr;45(4):1118–25.
- Eliasi UL, Sebola D, Oguttu JW, Qekwana DN. Antimicrobial resistance patterns of Pseudomonas aeruginosa isolated from canine clinical cases at a veterinary academic hospital in South Africa. Vol. 91, Journal of the South African Veterinary Association. AOSIS Ltd; 2020.
- So JH, Kim J, Bae IK, Jeong SH, Kim SH, Lim S kyung, et al. Dissemination of multidrug-resistant Escherichia coli in Korean veterinary hospitals. Diagnostic Microbiology and Infectious Disease. 2012 Jun;73(2):195–9.
- Stella AE, Lima TF, Moreira CN, de Paula EMN. Characterization of Staphylococcus aureus Strains Isolated from Veterinary Hospital. International Journal of Microbiology. 2020;2020.
- González-Torralba A, Oteo J, Asenjo A, Bautista V, Fuentes E, Alós JI. Survey of carbapenemase-producing Enterobacteriaceae in companion dogs in Madrid, Spain. Vol. 60, Antimicrobial Agents and Chemotherapy. American Society for Microbiology; 2016. p. 2499–501.
- Walsh TR, Toleman MA. The emergence of pan-resistant gram-negative pathogens merits a rapid global political response. Journal of Antimicrobial Chemotherapy. 2012 Jan 1;67(1):1–3.
- Ortiz-Díez G, López R, Sánchez-Díaz AM, Turrientes MC, Baquero MR, Luque R, et al. Epidemiology of the colonization and acquisition of methicillin-resistant staphylococci and vancomycin-resistant enterococci in dogs hospitalized in a clinic veterinary hospital in Spain. Comparative Immunology, Microbiology and Infectious Diseases. 2020 Oct 1;72.
- Lehner G, Linek M, Bond R, Lloyd DH, Prenger-Berninghoff E, Thom N, et al. Case-control risk factor study of methicillin-resistant Staphylococcus pseudintermedius (MRSP) infection in dogs and cats in Germany. Veterinary Microbiology. 2014 Jan 10;168(1):154–60.
- Scott GM, Thomson R, Malone-Lee J, Ridgway GL. Cross-infection between animals and man: Possible feline trarismission of Staphylococcus aureus infection in humans? Vol. 12, Journal of Hospital Infection. 1988.
- Nienhoff U, Kadlec K, Chaberny IF, Verspohl J, Gerlach GF, Schwarz S, et al. Transmission of methicillin-resistant Staphylococcus aureus strains between humans and dogs: Two case reports. Vol. 64, Journal of Antimicrobial Chemotherapy. 2009. p. 660–2.
- Sing A, Tuschak C, Hörmansdorfer S. Methicillin-Resistant Staphylococcus aureus in a Family and its pet cat. The New England Journal of Medicine. 2008;358(11):1200–1.
- van Duijkeren E, Moleman M, Sloet van Oldruitenborgh-Oosterbaan MM, Multem J, Troelstra A, Fluit AC, et al. Methicillin-resistant Staphylococcus aureus in horses and horse personnel: An investigation of several outbreaks. Veterinary Microbiology. 2010 Feb 24;141(1–2):96–102.
- Soares Magalhães RJ, Loeffler A, Lindsay J, Rich M, Roberts L, Smith H, et al. Risk factors for methicillin-resistant Staphylococcus aureus (MRSA) infection in dogs and cats: A case-control study. Veterinary Research. 2010 Sep;41(5).
- Paterson GK, Harrison EM, Murray GGR, Welch JJ, Warland JH, Holden MTG, et al. Capturing the cloud of diversity reveals complexity and heterogeneity of MRSA carriage, infection and transmission. Nature Communications. 2015;6.
- Lefebvre SL, Weese JS. Contamination of pet therapy dogs with MRSA and Clostridium difficile. Vol. 72, Journal of Hospital Infection. 2009. p. 268–9.
- Geoghegan JA, Smith EJ, Speziale P, Foster TJ. Staphylococcus pseudintermedius expresses surface proteins that closely resemble those from Staphylococcus aureus. Veterinary Microbiology. 2009 Sep 18;138(3–4):345–52.
- Chang S, Sievert DM, Hageman JC, Boulton ML, Tenover FC, Downes FP, et al. Infection with Vancomycin-Resistant Staphylococcus aureus Containing the vanA Resistance Gene. Vol. 348, N Engl J Med. 2003.
- Schaufler K, Semmler T, Wieler LH, Wöhrmann M, Baddam R, Ahmed N, et al. Clonal spread and interspecies transmission of clinically relevant ESBL-producing Escherichia coli of ST410-another successful pandemic clone? FEMS Microbiology Ecology. 2016 Jan 1;92(1).
- Schmiedel J, Falgenhauer L, Domann E, Bauerfeind R, Prenger-Berninghoff E, Imirzalioglu C, et al. Multiresistant extended-spectrum β-lactamase-producing Enterobacteriaceae from humans, companion animals and horses in central Hesse, Germany. BMC Microbiology. 2014 Jul 12;14(1).
- Ewers C, Bethe A, Stamm I, Grobbel M, Kopp PA, Guerra B, et al. CTX-M-15-D-ST648 Escherichia coli from companion animals and horses: Another pandemic clone combining multiresistance and extraintestinal virulence? Journal of Antimicrobial Chemotherapy. 2014;69(5):1224–30.
- Damborg P, Nielsen SS, Guardabassi L. Escherichia coli shedding patterns in humans and dogs: Insights into within-household transmission of phylotypes associated with urinary tract infections. Epidemiology and Infection. 2009 Oct;137(10):1457–64.
- Weiß S, Kadlec K, Feßler AT, Schwarz S. Identification and characterization of methicillin-resistant Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus haemolyticus and Staphylococcus from a small animal clinic. Veterinary Microbiology. 2013 Dec 27;167(3–4):680–5.
- Cuny C, Nathaus R, Layer F, Strommenger B, Altmann D, Witte W. Nasal colonization of humans with methicillin-resistant Staphylococcus aureus (MRSA) CC398 with and without exposure to pigs. PLoS ONE. 2009 Aug 27;4(8).
- Groves MD, Crouch B, Coombs GW, Jordan D, Pang S, Barton MD, et al. Molecular epidemiology of methicillin-resistant Staphylococcus aureus isolated from Australian veterinarians. PLoS ONE. 2016 Jan 6;11(1).
- Feßler AT, Olde Riekerink RGM, Rothkamp A, Kadlec K, Sampimon OC, Lam TJGM, et al. Characterization of methicillin-resistant Staphylococcus aureus CC398 obtained from humans and animals on dairy farms. Veterinary Microbiology. 2012 Nov 9;160(1–2):77–84.
- Ministerio de Agricultura y Pesca A y MA. Plan de Vigilancia Colistina. 2014.
- Economou V, Gousia P. Agriculture and food animals as a source of antimicrobial-resistant bacteria. Vol. 8, Infection and Drug Resistance. Dove Medical Press Ltd.; 2015. p. 49–61.
- Salim HM, Huque KS, Kamaruddin KM, Beg MAH. Global restriction of using antibiotic growth promoters and alternative strategies in poultry production. Science Progress. 2018 Mar 1;101(1):52–75.
- Aslam B, Wang W, Arshad MI, Khurshid M, Muzammil S, Rasool MH, et al. Antibiotic resistance: a rundown of a global crisis. Vol. 11, Infection and Drug Resistance. Dove Medical Press Ltd.; 2018. p. 1645–58.
- Vivas R, Barbosa AAT, Dolabela SS, Jain S. Multidrug-Resistant Bacteria and Alternative Methods to Control Them: An Overview. Microbial Drug Resistance. 2019 Jul 1;25(6):890–908.
- Daniali M, Nikfar S, Abdollahi M. Antibiotic resistance propagation through probiotics. Vol. 16, Expert Opinion on Drug Metabolism and Toxicology. Taylor and Francis Ltd.; 2020. p. 1207–15.
- Das DJ, Shankar A, Johnson JB, Thomas S. Critical insights into antibiotic resistance transferability in probiotic Lactobacillus. Vol. 69, Nutrition. Elsevier Inc.; 2020.
- Gueimonde M, Flórez AB, van Hoek AHAM, Stuer-Lauridsen B, Strøman P, de Los Reyes-Gavilán CG, et al. Genetic basis of tetracycline resistance in Bifidobacterium animalis subsp. lactis. Applied and Environmental Microbiology. 2010 May;76(10):3364–9.
- Ghosh C, Sarkar P, Issa R, Haldar J. Alternatives to Conventional Antibiotics in the Era of Antimicrobial Resistance. Vol. 27, Trends in Microbiology. Elsevier Ltd; 2019. p. 323–38.
- Tuteja D, Banu K, Mondal B. Canine Parvovirology-A Brief Updated Review on Structural Biology, Occurrence, Pathogenesis, Clinical Diagnosis, Treatment and Prevention. Comparative Immunology, Microbiology and Infectious Diseases. 2022 Feb 11;82(101765):1–15.
- Mazzaferro EM. Update on Canine Parvoviral Enteritis. Vol. 50, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2020. p. 1307–25.
- Wińska K, Mączka W, Łyczko J, Grabarczyk M, Czubaszek A, Szumny A. Essential oils as antimicrobial agents—myth or real alternative? Vol. 24, Molecules. MDPI AG; 2019.
- Patel DR, Bhartiya SK, Kumar R, Shukla VK, Nath G. Use of Customized Bacteriophages in the Treatment of Chronic Nonhealing Wounds: A Prospective Study. International Journal of Lower Extremity Wounds. 2021 Mar 1;20(1):37–46.
- Labrie SJ, Samson JE, Moineau S. Bacteriophage resistance mechanisms. Vol. 8, Nature Reviews Microbiology. 2010. p. 317–27.
- Raj GM, Priyadarshini R, Murugesan S, Adhimoolam M. Monoclonal Antibodies Against Infectious Microbes: So Long and Too Little! Infectious Disorders - Drug Targets. 2021 Apr 14;21(1):4–27.
- Parachin NS, Franco OL. New edge of antibiotic development: Antimicrobial peptides and corresponding resistance. Frontiers in Microbiology. 2014;5.
- Drider D. Gut Microbiota is an Important Source of Bacteriocins and Their In Situ Expression Can Be Explored for Treatment of Bacterial Infections. Vol. 13, Probiotics and Antimicrobial Proteins. Springer; 2021. p. 1759–65.
- Santhakumari S, Ravi A v. Targeting quorum sensing mechanism: An alternative anti-virulent strategy for the treatment of bacterial infections. Vol. 120, South African Journal of Botany. Elsevier B.V.; 2019. p. 81–6.
- Hajipour MJ, Saei AA, Walker ED, Conley B, Omidi Y, Lee KB, et al. Nanotechnology for Targeted Detection and Removal of Bacteria: Opportunities and Challenges. Vol. 8, Advanced Science. John Wiley and Sons Inc; 2021.
- Proudfoot C, Lillico S, Tait-Burkard C. Genome editing for disease resistance in pigs and chickens. Animal Frontiers. 2019 Jun 25;9(3):6–12.
- Tribunal de cuentas europeo. Actuación contra la resistencia a los antimicrobianos: Pese a los avances en el sector animal, esta amenaza sanitaria sigue siendo un reto para la UE. 2019.
- WHO. Plan de acción mundial sobre la resistencia a los antimicrobianos. WHO Library Cataloguing-in-Publication Data; 2016.
- WHO. 2021 AWaRe classification [Internet]. https://www.who.int/publications/i/item/2021-aware-classification. 2021 [cited 2022 May 22]. Available from: https://www.who.int/publications/i/item/2021-aware-classification
- Parlamento Europeo, Consejo de la Unión Europea. Reglamento (UE) 2019/ del Parlamento Europeo y del Consejo, de 11 de diciembre de 2018, sobre medicamentos veterinarios y por el que se deroga la Directiva 2001/82/CE. Diario Oficial de la Unión Europea 2019.
- Ilustre Colegio Oficial de Veterinarios de Valencia. Novedades en la prescripción de medicamentos veterinarios: reglamentos europeos 2019/6 y 2019/4. Ilustre Colegio Oficial de Veterinarios de Valencia. 2022;
- Plan Nacional de Resistencia a Antibióticos. PRAN [Internet]. https://resistenciaantibioticos.es/es. 2022 [cited 2022 Jun 6]. Available from: https://resistenciaantibioticos.es/es
- Ministerio de Agricultura P y A. PRESVET [Internet]. https://servicio.mapama.gob.es/presvet/Account/Login?ReturnUrl=%2Fpresvet%2F. 2022 [cited 2022 Jun 6]. Available from: https://servicio.mapama.gob.es/presvet/Account/Login?ReturnUrl=%2Fpresvet%2F
- Plan Nacional de Resistencia a antibióticos. Plan REDUCE colistina [Internet]. https://www.resistenciaantibioticos.es/es/programa-reduce-porcino. 2022 [cited 2022 Jun 6]. Available from: https://www.resistenciaantibioticos.es/es/programa-reduce-porcino
- Plan Nacional de Resistencia a Antibióticos. Proyecto Piloto PRAN pequeños animales [Internet]. https://www.resistenciaantibioticos.es/es/proyecto-piloto-pran-pequenos-animales. 2022 [cited 2022 Jun 6]. Available from: https://www.resistenciaantibioticos.es/es/proyecto-piloto-pran-pequenos-animales
- Plan Nacional de Resistencia a Antibióticos. Guía terapéutica de antimicrobianos veterinarios. https://resistenciaantibioticos.es/es/lineas-de-accion/control/guia-terapeutica-antimicrobianos-veterinarios. 2022.
- Plan Nacional de Resistencia a Antibióticos. PRANteca [Internet]. https://resistenciaantibioticos.es/es/pranteca. 2022 [cited 2022 Jun 6]. Available from: https://resistenciaantibioticos.es/es/pranteca
- FECAVA. Antimicrobial resistance [Internet]. https://www.fecava.org/policies-actions/guidelines/. 2022 [cited 2022 Jun 6]. Available from: https://www.fecava.org/policies-actions/guidelines/
- Laboratorios CEVA. Guía para uso racional de los antimicrobianos [Internet]. https://www.ceva-gram.com/es/private. 2022 [cited 2022 Jun 6]. Available from: https://www.ceva-gram.com/es/private
 by Multimédica
by Multimédica