Revisión sobre el uso del proteinograma en medicina de animales exóticos
Resumen breve
El estudio del patrón electroforético del paciente es una herramienta útil para el diagnóstico, el pronóstico y la monitorización en medicina humana y veterinaria, y también es interesante incluirlo en los chequeos de salud rutinarios ya que puede señalar anomalías no detectadas mediante otras pruebas habituales.Índice de contenidos
Resumen
La electroforesis de proteínas o proteinograma es una técnica habitualmente usada en muestras de suero o plasma en medicina humana y veterinaria, principalmente para ayudar en la identificación de trastornos que inducen en el organismo una reacción de fase aguda y de procesos malignos, así como para monitorizar la respuesta al tratamiento y ofrecer información sobre el pronóstico. La aplicación de esta técnica laboratorial en medicina de animales exóticos ha demostrado notable utilidad en múltiples especies de mamíferos, aves y reptiles. Generalmente podemos guiarnos por los conceptos aprendidos de especies tradicionales para la interpretación de los resultados, aunque existen una serie de limitaciones y consideraciones específicas que debemos tener en cuenta. Es importante conocer el método utilizado por el laboratorio, comparar con valores de referencia apropiados y examinar siempre el gráfico además de los valores numéricos del paciente. Este artículo revisa las generalidades del uso del proteinograma en medicina veterinaria y discute las particularidades en el campo de los animales exóticos.
Introducción
Centenares de proteínas con diferentes funciones circulan por el torrente sanguíneo: efecto coloide osmótico para mantener el volumen de la sangre, transporte (hormonas, lípidos, vitaminas, minerales, fármacos, etc.), tampón del pH sanguíneo, coagulación, reacción inflamatoria, sistema inmunitario, reparación tisular, catalización de reacciones bioquímicas, etc.1,2. La mayoría de las proteínas sanguíneas son producidas y secretadas por los hepatocitos, aunque otros tejidos como intestino, tejido adiposo, pulmones y glándula mamaria pueden sintetizar algunas proteínas sanguíneas para funciones específicas. Las inmunoglobulinas, sin embargo, son fabricadas por el sistema inmunitario (tejido reticuloendotelial, células plasmáticas, células linfoides)2.
Existen test laboratoriales disponibles para la determinación específica de un buen número de ellas (proteína C reactiva, haptoglobina, proteína amiloide A sérica, transferrina, α1-glicoproteína ácida, α1-antitripsina, lipoproteínas, inmunoglobulinas, etc.), aunque estas pruebas no siempre se hallan disponibles en pacientes exóticos por cuestiones como falta de validación de la técnica, volumen de muestra requerido excesivamente grande o motivos económicos3,4.
El proteinograma o electroforesis de proteínas es un tipo de analítica que proporciona información sobre el estado de componentes proteicos presentes en la muestra en cantidades elevadas5. En este artículo haremos referencia al proteinograma en sangre (suero/plasma), aunque puede realizarse también sobre otros líquidos corporales como líquido peritoneal, fluido cerebroespinal u orina2. La electroforesis de proteínas consiste en la separación de las proteínas séricas o plasmáticas en varios grupos (fracciones) en base a su carga y consecuente particular capacidad de migrar en un campo eléctrico. Cada especie muestra un patrón característico de migración de las proteínas en las distintas fracciones en individuos sanos. Pueden producirse alteraciones en los niveles de proteínas (disproteinemias) por múltiples motivos, como inflamación (asociada o no a procesos infecciosos/parasitarios), neoplasias, enfermedades con pérdida de proteínas, inmunodeficiencias, alteraciones genéticas, así como en algunas condiciones fisiológicas. El estudio del patrón electroforético del paciente es una herramienta útil para el diagnóstico, el pronóstico y la monitorización en medicina humana y veterinaria, y también es interesante incluirlo en los chequeos de salud rutinarios ya que puede señalar anomalías no detectadas mediante otras pruebas habituales1–8. Debemos tener en cuenta que el patrón de electroforetograma característico para la especie varía entre autores y métodos, pudiendo hallar diferencias en el número de fracciones y subfracciones y en los porcentajes de estas; se han descrito discordancias intraespecie en perros, gatos, cerdos, caballos, ovejas, cabras, etc. así como en un gran número de especies no convencionales1–3.
Este artículo resume las bases generales de la electroforesis de proteínas en sangre y discute sus aplicaciones y limitaciones en animales exóticos. Se muestran algunos electroforetogramas de casos tratados en el centro de trabajo de la autora a modo de ejemplo, todos se han obtenido mediante electroforesis de zona capilar en muestras de plasma EDTA en los mamíferos y plasma heparina en el resto, la medición de proteínas totales se ha realizado mediante espectrofotometría en plasma heparina.
Fundamentos técnicos
Existen principalmente 3 métodos para llevar a cabo la electroforesis de proteínas: mediante tiras de acetato de celulosa o de gel de agarosa, y electroforesis de zona capilar. El primer sistema ya no está disponible en la mayoría de los laboratorios, aunque existe bibliografía sobre especies exóticas utilizándolo que puede ser de interés. Los sistemas comerciales semiautomatizados de electroforesis en gel de agarosa se utilizan ampliamente en los laboratorios clínicos debido a la buena resolución y relativa sencillez de la técnica, aunque en los últimos años los métodos automatizados de electroforesis de zona capilar se han ido extendiendo por su simplicidad, mayor resolución y menor coeficiente de variación3,5. Generalmente el volumen de muestra requerido es pequeño y el coste bajo. Actualmente en el laboratorio LABOKLIN el proteinograma se lleva a cabo mediante electroforesis de zona capilar en muestras de suero o plasma a partir de 100 µl.
La electroforesis en gel de agarosadiscrimina las proteínas en función de su carga eléctrica y tamaño. El patrón de migración de las proteínas al ser sometidas a un campo eléctrico se representa gráficamente de modo curvilíneo, de manera que la extensión y altura de cada pico se corresponde con la amplitud y densidad de cada fracción proteica en el substrato de migración. Por convención se establece un punto intermedio entre el final de una curva y el principio de las siguiente para establecer el límite entre las diferentes fracciones1. Se obtiene un resultado en porcentaje para cada fracción, el cual posteriormente se multiplica por el valor de proteínas totales de la muestra para calcular el valor absoluto de cada fracción. Las fracciones clásicamente obtenidas en mamíferos son: albúmina, α1-globulinas, α2-globulinas, β-globulinas y γ-globulinas; cada pico de globulinas está originado por el conjunto de diversas proteínas (Tabla 1).
| Prealbúmina | *presencia normal en algunas especies, en otras asociada a trastornos |
| α1-globulinas | α1-glicoproteína ácida, α1-antitripsina, globulina fijadora de tiroxina, α1-lipoproteínas, transcortina, α1-antiquemotripsina, proteína sérica amiloide A, α1-fetoproteína, etc. |
| α2-globulinas | α2-macroglobulina, α2-microglobulina, α2-lipoproteína, α2-antiplasmina, haptoglobina, ceruloplasmina, proteína ligante de retinol, globulina-Gc, etc. |
| β-globulinas | Transferrina, ferritina, transcobalamina, complemento (C3, C4), β1-lipoproteína, β2-microglobulina, β1-glicoproteína específica de gestación, proteína C-reactiva, hemopexina, plasminógeno, β2-microglobulina, angiostatina, fibrinógeno (plasma) etc. *a menudo se identifican subfracciones |
| γ-globulinas | Principalmente inmunoglobulinas (IgG, IgM, IgA, IgE, IgD) *algunas inmunoglobulinas pueden hallarse en la interzona β-γ, migrar a la fracción β, o incluso a la α2 |
Tabla 1. Composición habitual de las fracciones del proteinograma. Adaptado de Tóthová 2016, Depauw 2014, Vavricka 2009, O’Connell 2005 y Tóthová 20172,4,19,23,84.
La albúmina es la fracción predominante en individuos sanos; tiene alta carga negativa y bajo peso molecular, por lo que migra al ánodo (electrodo positivo) y se representa de manera convencional en el lado izquierdo de la gráfica. En el extremo derecho se hallarán las γ-globulinas, que poseen baja carga negativa y alto peso molecular y migran cerca del cátodo (electrodo negativo). Las α1, α2 y β se hallan en medio, de izquierda a derecha respectivamente. Podemos observar también una fracción a la izquierda de la albúmina de manera frecuente en aves y reptiles, y en algunas condiciones que afectan a mamíferos: la denominada prealbúmina1,3.
La electroforesis de zona capilar se basa en diluir la muestra en una solución tampón de electrolitos en un capilar que es sometido a un alto voltaje. Se producen dos procesos: las proteínas séricas/plasmáticas, de carga negativa, migran hacia el ánodo (electroforesis), pero los cationes cercanos a la pared del capilar migran hacia el cátodo arrastrando la solución de electrolitos con ellos (efecto electroendosmótico). El flujo electroendosmótico excede la capacidad de movilidad electroforética, lo cual genera una migración neta de las fracciones proteicas hacia el cátodo. La resistencia a la migración al cátodo es proporcional a la ratio carga:masa de las proteínas, de manera que la prealbúmina y la albúmina son las últimas en llegar a la zona del cátodo del capilar. La medición de las proteínas se conduce a tiempo real y se basa en determinar su absorbancia a una determinada longitud de onda (ultravioleta) en una ventana óptica en el capilar, obteniéndose en general las mismas fracciones que en gel de agarosa (Figura 1) 9.
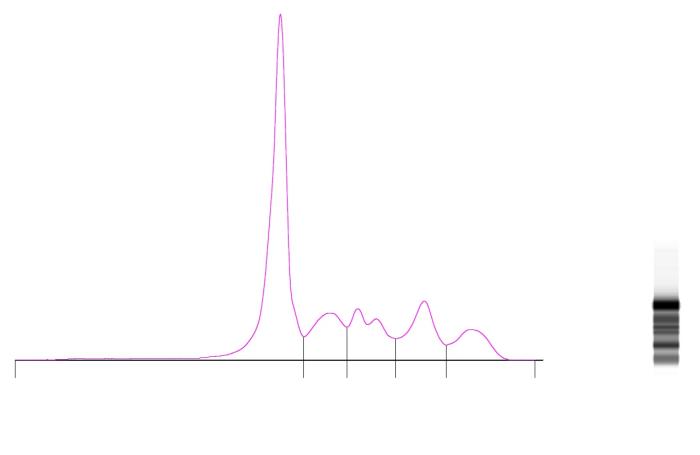
Figura 1. Electroforetograma de una cobaya (Cavia porcellus) obtenido mediante electroforesis de zona capilar en plasma EDTA.
La comparación sobre eficiencia, resolución y precisión entre los diferentes métodos se ha discutido en múltiples estudios y distintas especies como humanos, perros, gatos, visones, titís, ratones, ratas, cobayas, rinocerontes blancos, delfines, yacos, águilas, cigüeñas, palomas, tortugas verdes, etc. Generalmente la electroforesis de zona capilar genera proteinogramas con una identificación de picos más precisa, picos más estrechos y en mayor número, lo cual puede relacionarse con una mayor capacidad de discriminación de diferentes proteínas e isoformas proteicas, aunque la interpretación de los resultados debe llevarse a cabo con cautela. Adicionalmente, algunos componentes no proteicos pueden aparecer como irregularidades en la gráfica, ya que todas las substancias que absorben a la longitud de onda programada del aparato son detectadas, lo cual en algunos casos puede reducir la especificidad y complicar la interpretación de muestras patológicas. En este sentido, se recomienda especialmente la lectura de la revisión publicada por Regeniter en 20183,5,6,10–16.
Es conveniente saber qué técnica de electroforesis de proteínas está utilizando el laboratorio para tratar de comparar los valores con datos de referencia obtenidos para la especie en condiciones lo más similares posibles.
Tal y como se ha indicado previamente, la electroforesis de proteínas genera resultados en forma de porcentajes de las diferentes fracciones que posteriormente se multiplican por el valor de proteínas totales. Es conveniente recordar que el refractómetro mide los sólidos totales de la muestra, no solo las proteínas totales, y que, aunque es un método sencillo y que utiliza muy poco volumen de muestra puede verse afectado por múltiples factores como hemólisis, lipemia, hiperbilirrubinemia, azotemia, hiperglucemia marcada, niveles muy altos de sodio y cloro y la administración de coloides1. Por lo tanto, en la interpretación del proteinograma también es conveniente consultar de qué manera se han medido las proteínas totales y la calidad de la muestra. En general, se recomienda registrar el grado de hemólisis, lipemia e ictericia de todas las muestras y tenerlo en cuenta en la interpretación de los diversos tipos de analíticas sanguíneas ya que la calidad de la muestra puede influir en multitud de parámetros.
Aplicaciones generales del proteinograma
Medición de albúmina
La determinación de albúmina mediante el método clásico de verde de bromocresol puede generar resultados imprecisos en varias especies de animales, por lo que el uso de electroforesis de proteínas para cuantificar su concentración puede ser más fiable. Existen varias publicaciones comparando métodos en diversas especies, aunque las conclusiones sobre precisión varían entre trabajos3.
Disproteinemias
La identificación e interpretación de alteraciones relevantes en la electroforesis proteica requiere que el clínico conozca la localización de las proteínas fisiológicamente presentes en el proteinograma y el significado de los cambios. Algunos de los factores que influyen son: variantes genéticas, edad, estado nutricional, capacidad de síntesis (función hepática, estados y síndromes de deficiencias), condiciones con pérdida de proteínas (nefropatías, enteropatías, daño cutáneo, etc.), procesos inflamatorios (de origen infeccioso/parasitario o no), neoplasias, factores hormonales (gestación, función tiroidea, etc.) y tratamientos farmacológicos (vacunas, inmunosupresores, terapia hormonal, antibióticos, agentes radioopacos, etc.)5,17. La interpretación del proteinograma debe realizarse teniendo en cuenta la especie, el examen físico y la historia clínica del paciente junto con el resultados de otras pruebas diagnósticas. La Tabla 2 ilustra algunos de los trastornos que con mayor frecuencia alteran las distintas fracciones del proteinograma. Estos son cambios típicamente descritos en la bibliografía, pero, así como su hallazgo no determina de manera definitiva el diagnóstico, el hecho de obtener valores normales de las fracciones tampoco descarta la afección.
| - | Aumento/irregularidades | Disminución |
|---|---|---|
| Albúmina |
|
|
| α1 |
|
|
| α2 |
|
|
| β |
|
|
| γ |
|
|
Tabla 2. Causas habituales de alteraciones en las fracciones del proteinograma (adaptado de Tóthová 2016, Regeniter 2018, Marinho 2012, Vavricka 2009 y O’Connell 2005 2,5,17,19,23.)
Albúmina y prealbúmina
Los niveles aumentados de albúmina se asocian básicamente a deshidratación, aunque se ha descrito también en un perro con carcinoma hepatocelular2,18.
La hipoalbuminemia es uno de los trastornos más habitualmente hallados en el proteinograma, debido a condiciones que disminuyan su producción o aumenten su pérdida, como: enfermedad hepática, malnutrición crónica, alimentación insuficiente en consumo de proteína, parasitismo intestinal, enteropatía o nefropatía con pérdida de proteínas, quemaduras, etc. La albúmina es la mayor proteína de fase aguda negativa: su tasa de síntesis puede verse reducida en procesos inflamatorios ya que se prioriza el uso de aminoácidos para incrementar la producción de proteínas de fase aguda positiva2,19.
La bisalbuminemia es un trastorno en el que se observa una curva bicúspide en la fracción de la albúmina. Los dos picos pueden ser de intensidad igual o desigual. En humanos puede originarse por una anomalía genética hereditaria, o bien producirse de manera adquirida o transitoria asociada a enfermedad renal crónica, síndrome nefrótico, cirrosis, diabetes mellitus, digestión tríptica (pseudoquistes pancreáticos, pancreatitis, neoplasia pancreática), mieloma múltiple, Alzheimer, meningitis por meningococos, sepsis, intoxicación por metales pesados, hiperlipidemia masiva (lipoproteínas), hiperbilirrubinemia (ligación a bilirrubina), presencia de ácidos grasos no esterificados, penicilina, ácido acetilsalicílico, β-lactámicos, sulfametoxazol, ceftriaxona. El uso de capilares viejos también puede generar un pico catodal2,5,6,19.
La analbuminemia es una condición muy infrecuente en la que se observa ausencia de albúmina19.
La prealbúmina, denominada también transtiretina, se produce principalmente por los hepatocitos y transporta hormonas tiroideas e indirectamente vitamina A. Los valores reducidos se consideran un indicador de malnutrición en humanos y también se asocian a cuadros inflamatorios por disminución de la síntesis y aumento de la pérdida transcapilar debido a incremento de la permeabilidad vascular; también se trata, pues, de una proteína de fase aguda negativa. Los valores pueden verse afectados también por la edad, el sexo y la técnica utilizada. La prealbúmina no siempre se visualiza en el electroforetograma y es posible que no exista en todas las especies; los conocimientos sobre su papel en veterinaria son escasos1,2,20.
Reacción de fase aguda - Fracciones α1, α2y β
Las proteínas de fase aguda (APPs) son proteínas sanguíneas que podemos utilizar para evaluar la respuesta sistémica del sistema inmunitario frente a inflamación (traumatismo, cirugía, quemadura, daño químico, inyección de agentes proinflamatorios, necrosis, exposición a toxinas, infección bacteriana/fúngica/vírica, parasitismo, estrés marcado incluyendo estrés por transporte, alergia, autoinmunidad, neoplasia, etc.). Estas proteínas cambian su concentración sanguínea (suero/plasma) al menos en un 25 % en respuesta a la producción de citoquinas proinflamatorias, por lo que son biomarcadores altamente sensibles para el diagnóstico precoz y el seguimiento de procesos inflamatorios. Su tiempo de respuesta y estabilidad analítica pueden ser superiores a los del recuento de glóbulos blancos. Las APPs mayores aumentan sus niveles en 100-1000x con un pico a las 24-48 h tras la estimulación y disminuyen rápidamente en la fase de recuperación; las APPs moderadas y menores incrementan menos intensamente (2-10x y 1.25-2x, respectivamente) y muestran una normalización de valores más lenta en el tiempo, suelen aumentar en procesos crónicos. Las APPs negativas (básicamente albúmina y prealbúmina) disminuyen durante la respuesta inflamatoria. Las distintas globulinas tienen un diferente comportamiento como APP en función de la especie, la Tabla 3 muestra algunos ejemplos7,21,22.
| Especie | APP mayor | APP moderada |
|---|---|---|
| Gallina | - | Transferrina, proteína sérica amiloide A, ceruloplasmina, α1-glicoproteína ácida |
| Ratón | Haptoglobina, proteína sérica amiloide A, proteína sérica amiloide P | Proteína C reactiva, fibrinógeno |
| Rata | α1-glicoproteína ácida, α2-macroglobulina | Proteína C reactiva, fibrinógeno, haptoblobina |
| Conejo | Haptoglobina, proteína sérica amiloide A | α1-glicoproteína ácida, proteína C-reactiva, fibrinógeno |
| Primates no humanos | Proteína C reactiva | α2-macroglobulina, fibrinógeno, proteína sérica amiloide A |
Tabla 3. Proteínas de fase aguda en algunas especies no convencionales. Adaptado de Cray 200921.
Los procesos inflamatorios cursan típicamente con la producción APPs y por tanto con un aumento inicial de las fracciones en las que migran: α1, α2 y/o β. Conforme la condición se va cronificando, podemos hallar disminución de albúmina, normalización de las fracciones α1, α2 y β y en algunos trastornos aumento de la banda de γ-globulinas en respuesta a la formación de inmunoglobulinas por respuesta inmunitaria (p. ej.: en infecciones crónicas, enfermedad intestinal inflamatoria, artritis reumatoide, enfermedades de tejido conectivo, etc.). Las fases avanzadas de inflamación aguda o los procesos inflamatorios crónicos activos pueden cursar con hipoalbuminemia y aumento de algunas o todas las bandas de globulinas. Debemos tener en cuenta que en las enfermedades inflamatorias crónicas podemos hallar de manera alterna diferentes patrones de inflamación según la fase en la que se encuentre el paciente2,19.
A la hora de interpretar los cambios en el proteinograma debemos tener en consideración que el paciente puede estar padeciendo diversos procesos concomitantes que pueden causar múltiples efectos en los niveles de proteínas. Así, por ejemplo, en la anemia hemolítica podemos ver una disminución de las α2-globulinas debido a que la haptoglobina de esta fracción forma complejos con la hemoglobina liberada por la destrucción de eritrocitos, los cuales son rápidamente eliminados por fagocitos, pero a la vez los trastornos inflamatorios asociados a la anemia hemolítica tienden a incrementar la concentración de haptoglobina, lo cual puede generar un aumento de α2-globulinas2,19.
En humanos se ha observado aumento de β1 en anemia ferropénicadebido a niveles elevados de transferrina libre, así como en gestación y en terapia con estrógenos. En el síndrome nefrótico la fracción α2 puede aumentar en comparación con las otras fracciones por la elevada síntesis de α2-macroglobulina, la cual no puede atravesar el glomérulo debido a su gran tamaño por lo que permanece en el torrente sanguíneo; en ocasiones se produce también un leve incremento de β2,19.
Los procesos que comprometen la función hepática (cirrosis, hepatitis necrotizante aguda, hepatitis crónica activa, etc.) pueden generar un proteinograma con hipoalbuminemia, fracciones α y β normales o reducidas y γ normales o incrementadas (típicamente gammapatía policlonal)19.
La hipercolesterolemia puede generar un aumento en la fracción β debido al aumento de β-lipoproteínas2.
La reducción marcada de la fracción α1 suele asociarse con deficiencia de α1-antitripsina19.
El carcinoma hepatocelular puede cursar con elevados niveles de α-fetoproteína que generen una banda estrecha entre albúmina y α119.
Algunos procesos producen la disminución o desaparición de la depresión entre las fracciones β y γ (fusión β-γ o β-γ bridging). Existe discordancia sobre el significado de este hallazgo. Puede deberse a concentraciones elevadas de IgM o IgA, que pueden migrar en la zona entre las dos fracciones. Algunos autores lo consideran patognomónico de enfermedad hepática crónica (cirrosis, alcoholismo), mientras que otros sostienen que también puede deberse a enfermedades infecciosas como leishmaniasis o ehrlichiosis, artritis reumatoide u otras condiciones en las que se produzca un aumento policlonal intenso. Asimismo, se ha propuesto que se deba a la presencia de fibrinógeno en muestras de plasma2,5,19.
Gammapatías
Las inmunoglobulinas se fabrican generalmente en respuesta a estimulación antigénica. Los picos de γ-globulinas elevados en el proteinograma son un hallazgo habitual y pueden relacionarse con múltiples condiciones patológicas. El examen de la forma del pico puede ayudar a orientar el diagnóstico diferencial, y es uno de los motivos por los que debemos solicitar siempre el gráfico al laboratorio, no solo los resultados en valores numéricos2.
Gammapatía policlonal: se genera un incremento en la producción dediferentes inmunoglobulinas que forman varios picos o más habitualmente uno único de base ancha. Generalmente se asocia a condiciones no malignas como procesos reactivos, procesos inflamatorios crónicos, infecciones (virus, bacterias, hongos, parásitos), enfermedades del sistema inmunitario (artritis reumatoide, lupus sistémico, miositis, etc.) aunque también puede ser un hallazgo en neoplasias. En ocasiones el proceso es inicialmente monoclonal por predominio de un tipo de inmunoglobulina y posteriormente evoluciona a policlonal2,23.
Gammapatía monoclonal: se producen de manera elevada uno o escasos tipos de inmunoglobulinas o un tipo de fragmento de inmunoglobulinas, que generan un pico de base estrecha. Algunos sinónimos para este hallazgo son: paraproteína, gradiente extra, banda extra, pico extra, fracción monoclonal, proteína monoclonal, inmunoglobulina monoclonal, proteína-M, pico M, etc.5. Se ha descrito en neoplasias de células B secretoras de inmunoglobulinas (leucemia linfocítica, linfoma) o de células plasmáticas (mieloma múltiple, plasmocitoma), ehrlichiosis y leishmaniasis (frecuentemente policlonales), gastroenterocolitis plasmocítica, pioderma crónica, amiloidosis, artritis reumatoide, etc. La gammapatía monoclonal esencial o de significado incierto es un trastorno en el que no se logra diagnosticar claramente la asociación del pico monoclonal con ningún estado patológico, sin embargo, se ha visto que es un factor de riesgo de progresión a un proceso maligno de células plasmáticas2.
La hipogammaglobulinemia puede observarse en pacientes que padecen infecciones recurrentes o con inmunodeficiencias por diversas causas. La agammaglobulinemia es una condición hereditaria descrita en humanos, caballos y perros principalmente2.
Ratio albúmina:globulinas
La ratio albúmina:globulinas es un parámetro calculado adicional a tener en cuenta en el que el valor de la albúmina se divide entre el valor de la suma de globulinas. La disminución de la ratio puede deberse a incremento de la pérdida o reducción de la síntesis de albúmina, o aumento en la producción de globulinas. Una ratio incrementada suele deberse a la infraproducción de globulinas2.
Consideraciones sobre el proteinograma en animales exóticos
La electroforesis de proteínas es una herramienta diagnóstica ampliamente utilizada en medicina de animales exóticos, existiendo múltiples publicaciones científicas en una gran variedad de especies no tradicionales, aunque su uso presenta una serie de limitaciones y desafíos más marcados que en humanos o animales domésticos. La autora recomienda especialmente leer las revisiones de Cray 2021, Melillo 2013 y Walton 20221,3,24.
Las generalidades sobre las aplicaciones del proteinograma en humanos y especies tradicionales sirven de guía para orientar su uso en animales menos convencionales. Se identifican fracciones de manera similar: albúmina, α y β-globulinas con o sin subfracciones, γ-globulinas y, en algunas especies y condiciones, prealbúmina. Sin embargo, debemos tener en cuenta que los datos no son completamente extrapolables entre especies. Así, por ejemplo, las distintas proteínas pueden migrar de diferente manera entre especies distintas, localizándose en puntos diferentes del electroforetograma, y una proteína puede comportarse como APP en una especie y no en otra4.
Los métodos de electroforesis habitualmente están optimizados para el uso en suero humano, por lo que puede ser necesario realizar diferentes modificaciones en las diluciones, el tampón, el voltaje, la temperatura, etc. para optimizar la técnica para diferentes especies3,10.
La interpretación de los resultados es más fiable cuando disponemos de valores de referencia en la misma especie de nuestro paciente y con el mismo método y aparato, que incluyan tanto los intervalos numéricos de las fracciones como al menos un electroforetograma representativo. Las diferencias entre técnicas y la necesidad de disponer de intervalos de referencia específicos para el método y la especie se han documentado en múltiples mamíferos, aves y reptiles16,25–30.
La carencia de referencias bibliográficas específicas que encajen de manera precisa con las necesidades del clínico es una de las principales limitaciones en medicina de animales exóticos. Adicionalmente, los estudios que proporcionan valores de referencia en especies no convencionales a menudo se han realizado en base a un número de animales relativamente bajo y, en opinión de la autora, cuyo estado de salud considerado como sano es con frecuencia cuestionable. El rango de edad de los individuos, su sexo y fase reproductiva, las condiciones de mantenimiento, la localización geográfica e incluso la estacionalidad son factores que pueden influir en los resultados e idealmente deberían indicarse en las publicaciones científicas, así como el tipo de muestra utilizado (suero, plasma con diversos anticoagulantes)3,12. En cuanto a los estudios en animales enfermos, no siempre se logra establecer el diagnóstico de manera definitiva, y debemos considerar que puede haber varios procesos concomitantes influyendo en los niveles de albúmina y globulinas.
La falta de estandarización sobre la colocación de los puntos de corte y límites es otro de los retos en el uso del proteinograma en animales exóticos. La delimitación de las fracciones se lleva a cabo mediante software pero en última instancia se realiza de manera manual3. Debemos solicitar al laboratorio con el que trabajamos que indique el método utilizado y que proporcione los resultados numéricos, así como el gráfico del paciente, tanto para comparar los valores con las fuentes de referencia como para ver la evolución en el propio animal. La evaluación seriada de los valores en un mismo paciente (idealmente utilizando siempre el mismo tipo de muestra) y la comparación con resultados de otros animales de la misma especie procesados por el mismo laboratorio con la misma técnica puede ayudar cuando no dispongamos de referencias bibliográficas, por lo que llevar un registro de los resultados es conveniente. Además de revisar las publicaciones científicas, podemos consultar con el laboratorio en los casos que nos generen dudas en cuanto a la colocación de los puntos de corte o la interpretación de anomalías.
En medicina de animales exóticos se usa con frecuencia plasma (obtenido utilizando anticoagulantes) en vez de suero ya que genera un mayor volumen de fracción líquida a partir de la muestra de sangre, hecho especialmente importante en pacientes de tamaño pequeño1. Además, en algunas especies utilizando tubos de suero solo se obtiene un producto de consistencia gelatinosa que no puede ser procesado por las máquinas. La concentración de sólidos totales en las muestras de plasma es ligeramente mayor que en las de suero (aproximadamente un 5 %) debido a la presencia de fibrinógeno en plasma, que suele migrar en la fracción de β-globulinas. Esta diferencia, aunque mínima, puede impactar ligeramente en los resultados1.
Mamíferos
La electroforesis de proteínas en pequeños mamíferos exóticos genera electroforetogramas similares a los de perro y gato, y los cambios frente a diversas condiciones patológicas suelen ser semejantes a lo expuesto previamente3. Disponemos de un notable número de fuentes bibliográficas sobre valores de referencia y la respuesta a la inducción experimental de procesos inflamatorios e infecciosos en animales de laboratorio, así como alteraciones en procesos patológicos espontáneos. En ratones inyectados con lipopolisacárido, por ejemplo, se han observado incrementos en proteína C reactiva, proteína sérica amiloide A, proteína sérica amiloide P y haptoglobina, así como en las fracciones β y α2. De similar manera, en ratas inyectadas con adyuvante completo de Freund se observó el aumento de proteína C reactiva, haptoglobina y fibrinógeno, así como las fracciones α2 y β. El incremento de la fracción α2 se observó también en cobayas inoculadas con Mycobacterium bovis10,31–34. La interpretación de la electroforesis de proteínas en conejos se lleva a cabo bajo las pautas generales descritas previamente (Figuras 2 y 3).
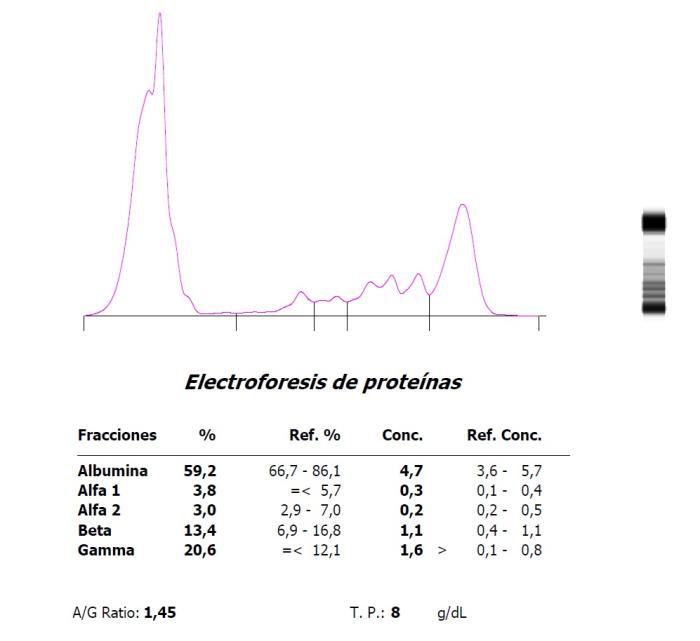
Figura 2. Hipergammaglobulinemia en una coneja (Oryctolagus cuniculus) con parotiditis
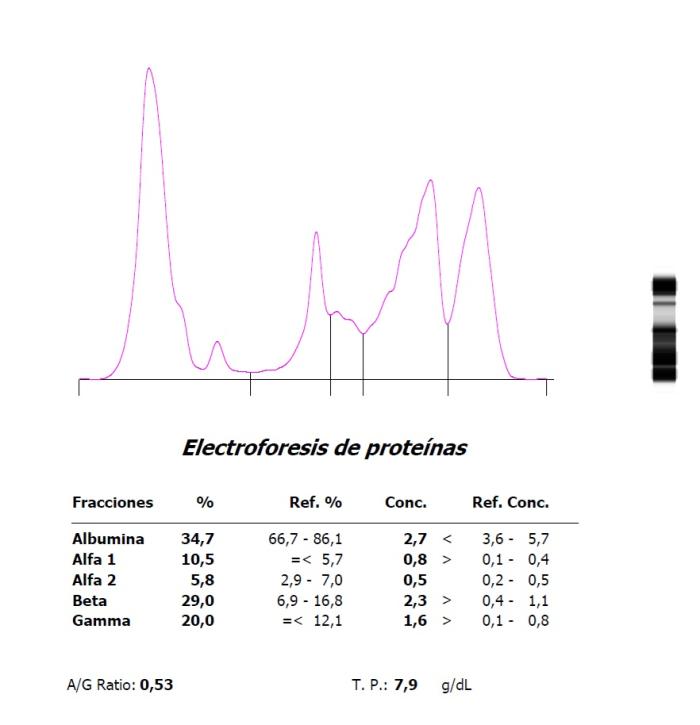
Figura 3. Hipoalbuminemia, aumento de proteínas de fase aguda e hipergammaglobulinemia en una coneja con neoplasia pulmonar y metástasis hepática. El pico tras la albúmina es de origen incierto, aunque podría deberse a la antibioterapia que la paciente estaba recibiendo.
En esta especie puede ser especialmente interesante cursar una serología con medición de IgM e IgG frente a Encephalitozoon cuniculi en pacientes que muestran alteraciones en el proteinograma (típicamente hipergammaglobulinemia leve a moderada, aunque puede producirse también elevación de proteínas de fase aguda). Existe abundante literatura disponible al respecto y debemos recordar que las elevaciones de IgG pueden persistir durante años1,3,35. Es fundamental tener en cuenta que la seroprevalencia de E. cuniculi en conejos es muy elevada y un resultado positivo no descarta directamente que el paciente pueda estar padeciendo otras enfermedades concomitantes que alteren el proteinograma, incluso en animales con sintomatología neurológica, ocular o renal.
El uso de la electroforesis de proteínas en hurones es un recurso habitual, habiéndose descrito valores de referencia y cambios en diversas condiciones patológicas como coronavirus sistémico y entérico, enfermedad aleutiana, moquillo, micobacteriosis, enfermedad hepática inflamatoria crónica, miofascitis, anemia hemolítica inmunomediada, mieloma, etc. (Figura 4).
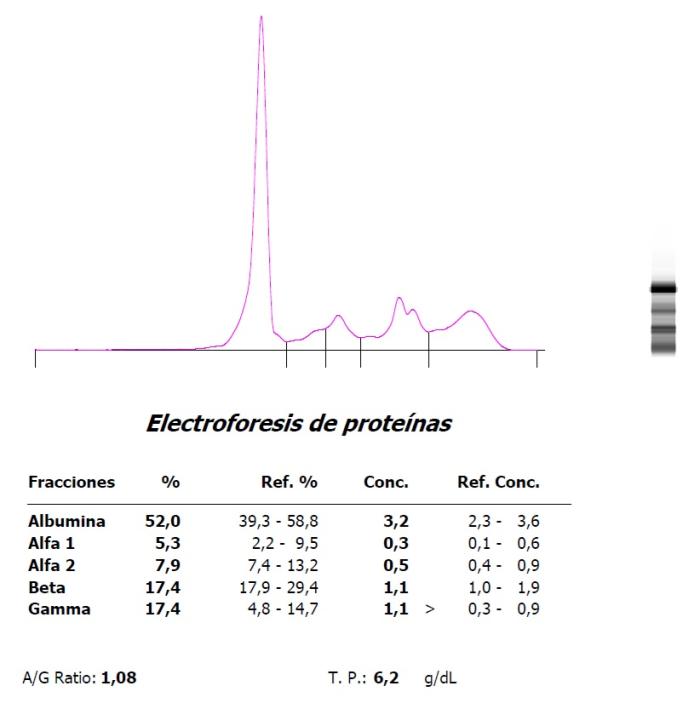
Figura 4. Hipergammaglobulinemia policlonal en un hurón (Mustela putorius furo) con neumonía.
La dramática elevación de γ-globulinas en enfermedad aleutiana y coronavirus sistémico es especialmente reseñable, aunque puede producirse por otras causas y debemos tratar de obtener un diagnóstico definitivo (Figuras 5 y 6). Se han estudiado de manera individual proteínas de fase aguda como proteína C reactiva, haptoglobina y proteína sérica amiloide A1,3,22,36–39.
Se han publicado valores de referencia de electroforesis de proteínas en Chinchilla lanigera, incluyendo un estudio sobre variaciones estacionales en el que se hallaron elevaciones de α1- y γ-globulinas en primavera y otro sobre variaciones circadianas en el que se observaron cambios en proteínas totales y γ-globulinas1,40,41. Los datos sobre variaciones fisiológicas sirven como referencia, pero es conveniente llevar a cabo un plan diagnóstico en animales con alteraciones en el proteinograma.
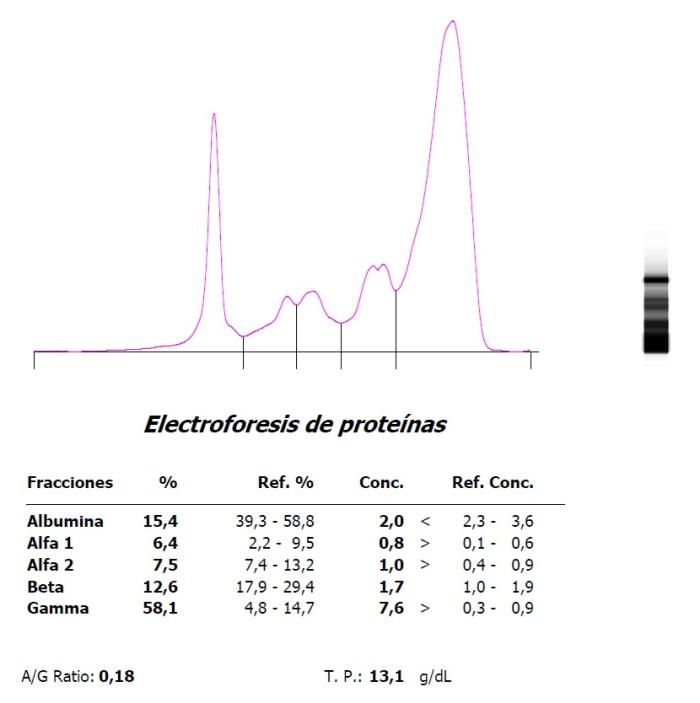
Figura 5. Marcada hipergammaglobulinemia e hipoalbuminemia en un hurón con coronavirus sistémico (FSCV) en (A) la presentación inicial y (B) evolución a finales de un ciclo de tratamiento antiviral.
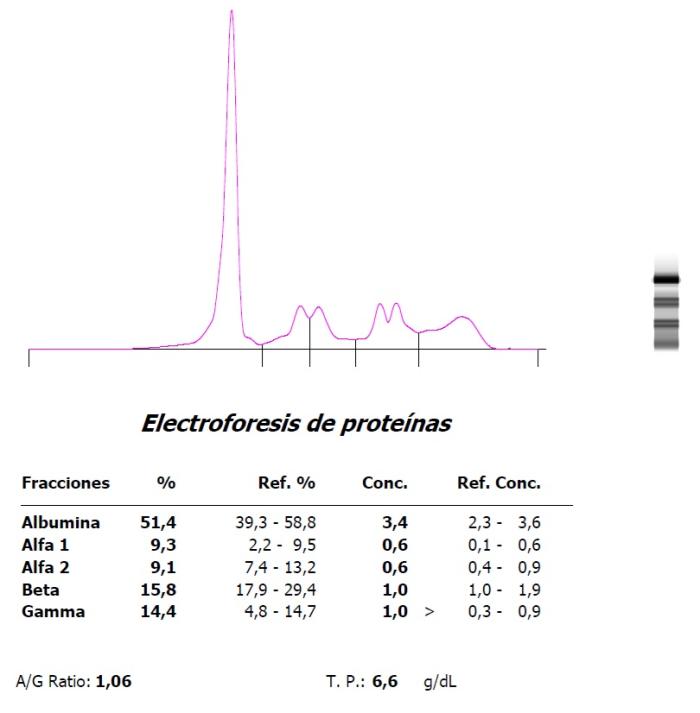
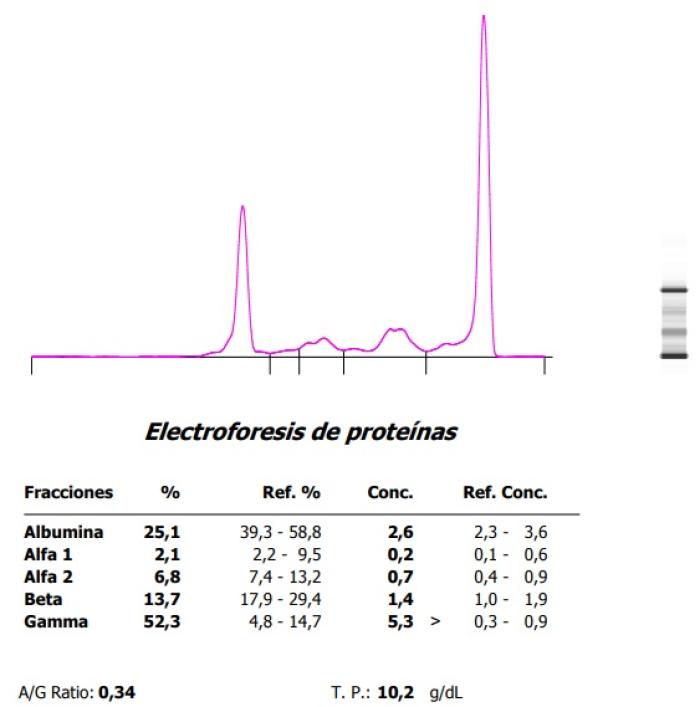
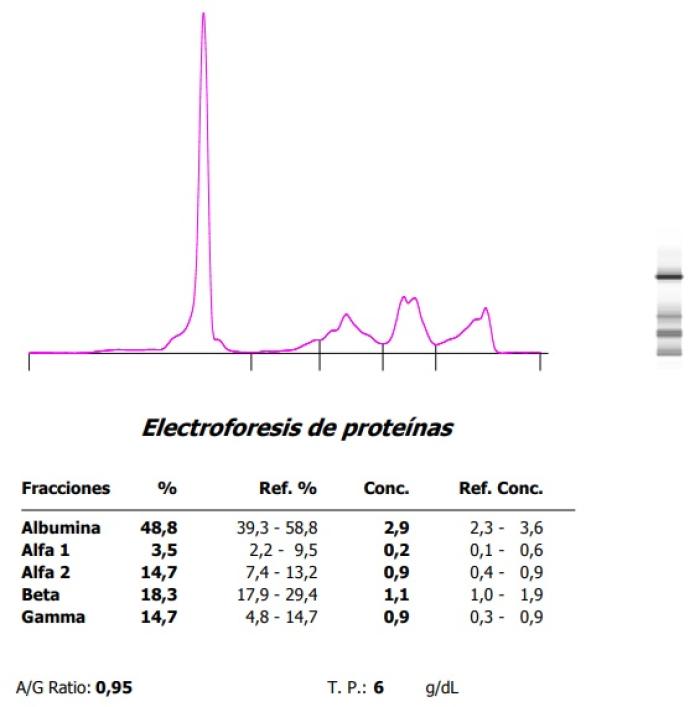
Figura 6. Hipergammaglobulinemia monoclonal en un hurón con (A) plasmocitoma esplénico y (B) evolución posesplenectomía.
Aves
Existe abundante bibliografía sobre valores de referencia de electroforesis de proteínas mediante distintos métodos y en múltiples especies aviares incluyendo psitácidas, rapaces, ibis, cigüeñas, flamencos, perdices, gallinas, etc. Se han descrito diferencias interespecíficas en las distancias de migración y los valores de las fracciones en animales sanos, así como entre distintos métodos8,29,42–50. Disponemos también de un considerable número de publicaciones sobre el uso diagnóstico del proteinograma en condiciones patológicas de origen natural o inducido. Adicionalmente podemos encontrar descripciones de variaciones en el proteinograma no asociadas a procesos patológicos; así, por ejemplo, en guacamayos se ha descrito una tendencia en animales menores de 8 meses de edad a mostrar hipoalbuminemia e hipogammaglobulinemia, en gallinas en puesta se ha descrito un aumento de ovotransferrina y en fase de muda un aumento de prealbúmina24,51,52.
Las Figuras 7 y 8 muestran marcadas alteraciones iniciales en el proteinograma y notable mejoría de estas con el tratamiento en una paloma y un loro amazónico.
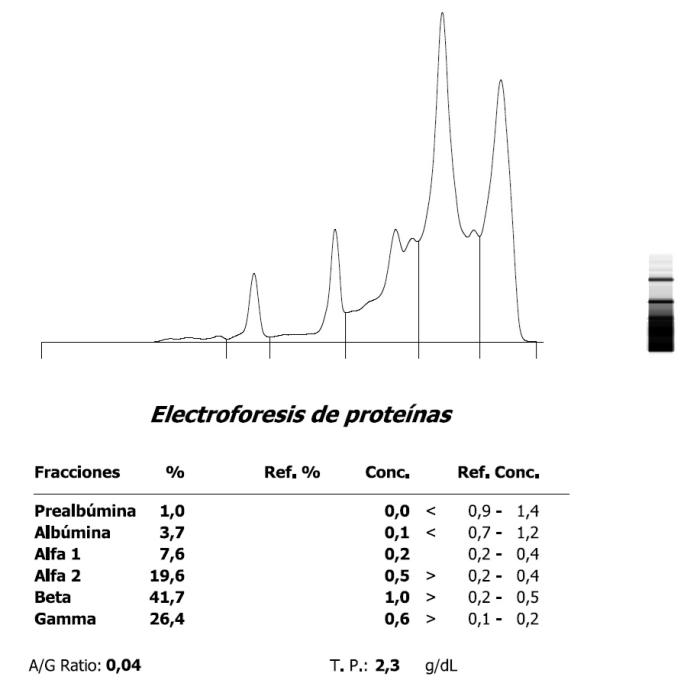
Figura 7. Marcada hipoalbuminemia, aumento de proteínas de fase aguda e hipergammaglobulinemia en una paloma (Columba livia) (A) en el momento de ingreso y (B) evolución postratamiento.
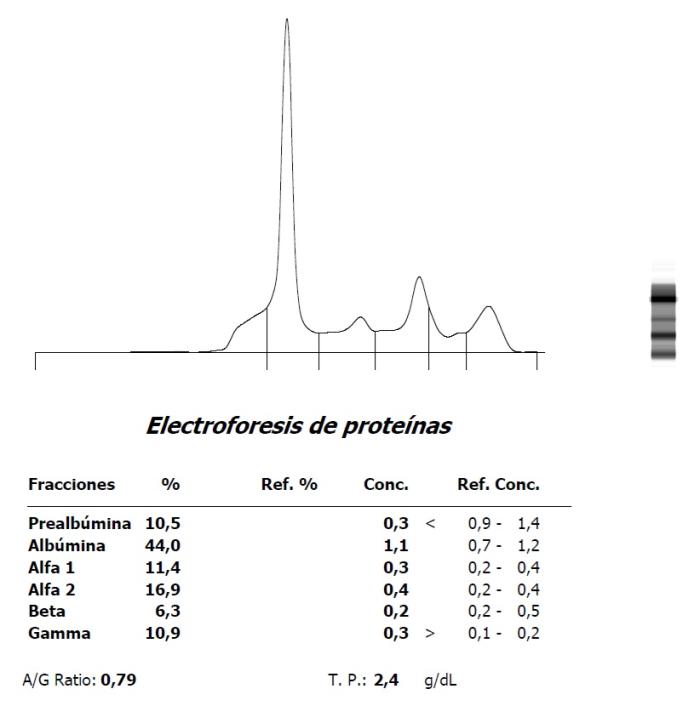
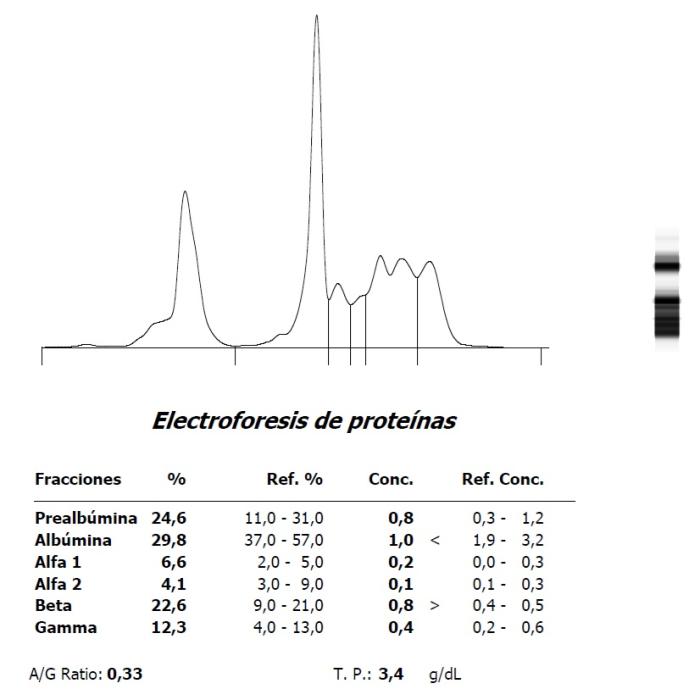
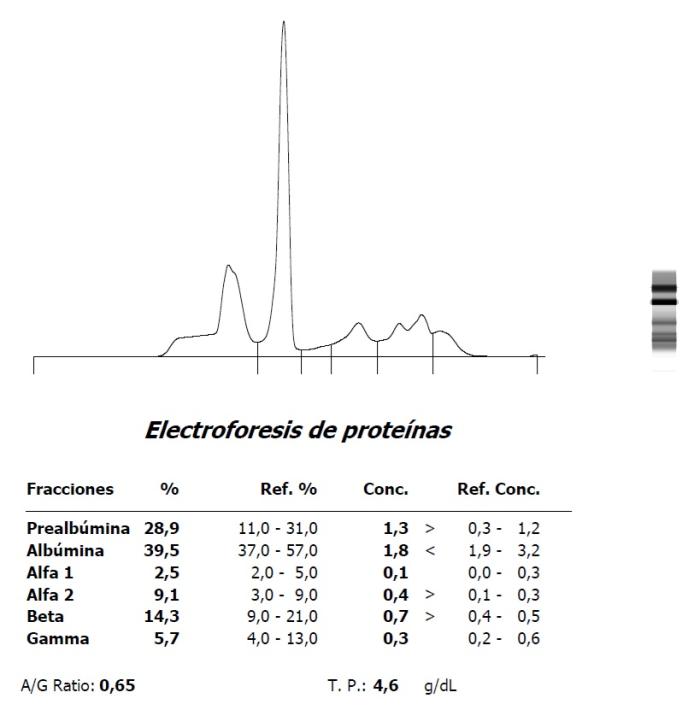
Figura 8. (A) Hipoalbuminemia e hiperbetaglobulinemia en un Amazona leucocephala con PCR en heces positiva a Mycobacterium simiae complex y (B) evolución tras tratamiento.
La ratio A/G suele calcularse como la suma de prealbúmina y albúmina dividida por la suma de la fracción de globulinas por convención, aunque hay autores que sugieren no incluir la prealbúmina42.
Un relevante artículo sobre psitácidas discute los resultados de proteinogramas en plasma de individuos clínicamente normales de Psittacus erithacus, Amazona sp, Melopsittacus undulatus, Nymphicus hollandicus, Cacatua sp, Aratinga sp, Nandayus nenday, Eclectus sp, Poicephalus gulielmi, Lorius spp, Agapornis sp, Ara sp, Pionus maximiliani, Myiopsitta monachus y Poicephalus senegalus, así como en suero de Gallus domesticus. La prealbúmina se halla de manera habitual en muchas especies de psitácidas, aunque en un porcentaje altamente variable entre especies; en este estudio, por ejemplo, las ninfas mostraron altas fracciones de prealbúmina, mientras que en yacos los niveles fueron muy bajos o incluso ausentes, y en periquitos y cotorras argentinas el porcentaje de prealbúmina en ocasiones excedió el de albúmina, aunque en general la albúmina fue la proteína presente en la mayor concentración en las muestras. Las β-globulinas fueron la fracción de globulinas predominante42. Muchas especies de psitácidas presentan subfracciones en β tanto en individuos sanos como enfermos53.
Las inmunoglobulinas no solo migran en la fracción γ: en un estudio en suero de gallinas se detectaron IgM e IgA en la fracción β, e IgG en la fracción γ42.
La bibliografía sobre el uso de electroforesis de proteínas en rapaces también es extensa, especialmente para el diagnóstico de aspergilosis. Un estudio en 139 animales incluyendo Haliaeetus leucocephalus, Buteo jamaicensis, Tyto alba, Bubo virginianus, Cathartes aura, Parabuteo unicinctus, Haliaeetus pelagicus, Strix varia, Otus asio y Coragyps atratus proporciona información sobre valores de referencia en aves sanas y cambios en algunos casos clínicos. Los autores hallaron fracciones de prealbúmina mínimas en la mayoría de las especies, así como en general fracciones de α2-globulinas mayores que en psitácidas y β y γ-globulinas similares. En más de la mitad de las especies se halló con frecuencia un pico de α1-globulinas adhesionado tras la albúmina (shouldering).50
Una reciente revisión de Walton y Siegel discute las proteínas de fase aguda como biomarcadores de inflamación en aves24. En general se han observado incrementos en α2, β y/o γ-globulinas, y con frecuencia hipoalbuminemia, en distintos tipos de aves con aspergilosis, sarcocystiosis, chlamydofilosis, micobacteriosis, abscesos, osteomielitis, etc. En yacos infectados experimentalmente con bornavirus se observó un aumento de γ con normalización a las 23-34 semanas. La inyección de agentes proinflamatorios en gallinas se ha relacionado con elevaciones en α2 y β. Un artículo describe hiperbetaglobulinemia en una ninfa con linfosarcoma, e hipergammaglobulinemia en un guacamayo con linfosarcoma, crecimiento de Pseudomonas aeruginosa y Enterococcus sp en buche y anticuerpos frente a Chlamydophila; en 2 casos de linfoma en amazonas se observó aumento de α2 en Amazona aestiva y de α1 en Amazona amazonica. En general, la fracción α1 no suele mostrar incrementos evidentes en procesos inflamatorios, aunque con los métodos más antiguos solía detectarse solo bajo ciertas condiciones patológicas, generalmente en relación con inflamación sistémica. En aves parasitadas se han observado incrementos selectivos de α1 por aumento de α1-antitripsina42,50,52–62.
La contaminación intencionada para inducir hemólisis y lipemia en psitácidas generó un aumento en β y γ, respectivamente, de manera similar a otra publicación sobre hemólisis en Anser indicus y Milvus migrans en la que se observaron incrementos en γ y en β y γ, respectivamente42,63.
Reptiles
La electroforesis de proteínas se ha utilizado también frecuentemente en medicina de reptiles, por lo que disponemos de un notable número de publicaciones científicas en múltiples especies como Pogona vitticeps, Furcifer pardalis, Iguana iguana, Cyclura lewisi, Cocodrilus niloticus, Testudo hermanni, Terrapene carolina, Geochelone radiata, Chelonia mydas, Caretta caretta, Lepidochelys kempii, Dermochelys coriacea, Trachemys scripta elegans, Graptemys spp, Boa constrictor, Drymarchon couperi, etc. En general, las fracciones son las mismas que en mamíferos y aves; en función de la especie y la técnica utilizada se describen (o no) presencia de prealbúmina y subdivisión de las fracciones α y β. Varios trabajos investigan las variaciones en función de edad, sexo, fase reproductiva, estacionalidad, localización, mantenimiento, así como bajo diversas condiciones patológicas y comparando distintas técnicas. Los animales en libertad pueden tener una mayor exposición a antígenos (p. ej.: carga parasitaria) que generen cambios en los valores de referencia respecto a individuos mantenidos en cautividad16,25–28,64–74.
Igual que sucede en aves, la fase reproductiva de las hembras puede generar cambios en el proteinograma en reptiles de manera fisiológica por incremento de lipoproteínas (que en general migran en la fracción α1), como se ha descrito en diversas especies como G. radiata y puede observarse en la Figura 975.
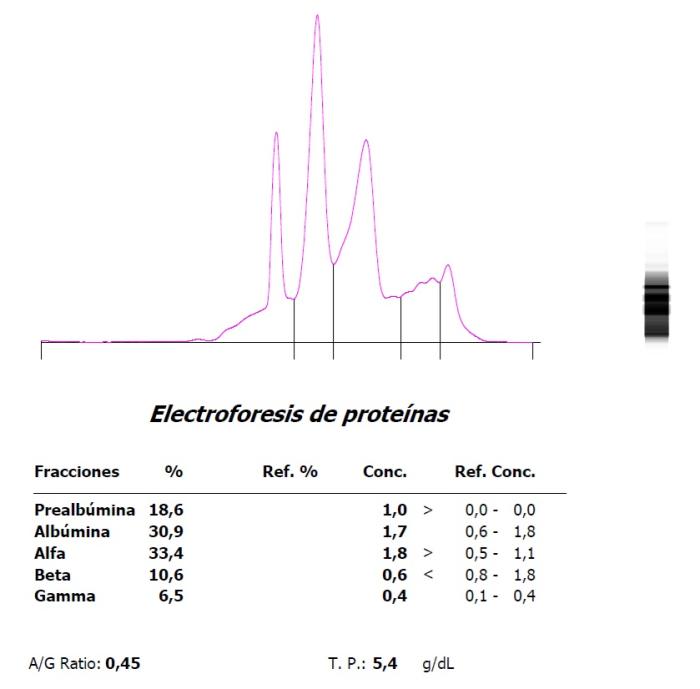
Figura 9. Aumento marcado de α globulinas en una Trachemys scripta hembra en fase reproductiva.
Un trabajo en Iguana iguana detectó 2 picos de albúmina en 4/21 animales sanos, este hallazgo se mantuvo de manera consistente en el muestreo múltiple a lo largo de 10 meses65. Otro estudio en I. iguana mostró también un doble pico compatible con bisalbuminemia en 23/40 animales (sanos y enfermos). Este mismo artículo describe que la hemólisis afectó a la fracción β en iguanas y a α1 y β-globulinas en Trachemys scripta, mientras que en otra publicación en Dermochelys coriacea incrementaba principalmente α2. La fracciónβ fue la globulina más abundante del proteinograma en estas 3 especies y en Terrapene carolina carolina, a diferencia de Furcifer pardalis en que la fracción de globulinas más abundante fue la α, y en Chelonia mydas y Caretta caretta en que fue la γ28,66,67,69,76. Un estudio adicional en iguanas evaluó los cambios en el proteinograma en pacientes con enfermedad inflamatoria cutánea, diversos tipos de hepatopatías e insuficiencia renal crónica/nefritis intersticial crónica: se observaron principalmente hipoalbuminemia e incrementos en β-globulinas (11/14 animales) y, en menor número de casos, en γ-globulinas; las α-globulinas solo se vieron aumentadas en un paciente con dermatitis77.
Una publicación sobre reptarenavirus en Boa constrictor mostró aumento de γ-globulinas y disminución de α-globulinas en individuos RT-PCR positivos clínicamente sanos, y adicionalmente hipoalbuminemia en los enfermos27. La infección experimental por ranavirus en T. scripta produjo hipoalbuminemia, hipoalfaglobulinemia e hiperbetaglobulinemia78.
La exposición a brevetoxinas por floración de marea roja causó hiperalfa2-globulinemia en Lepidochelys kempii, hiperalbuminemia e hipergammaglobulinemia en Chelonia mydas, β-γ bridging en ejemplares de ambas especies presumiblemente debido a la reacción inflamatoria, e hipergammaglobulinemia en Caretta caretta. Es posible que la exposición a estas toxinas predisponga a la reactivación de agentes oportunistas latentes, causando de manera indirecta alteraciones en el proteinograma. En cuanto a la hiperalbuminemia, se ha hipotetizado que las brevetoxinas se ligan a albúmina formando compuestos que incrementan dicha fracción79,80.
La disminución de proteinemia total, α1, α2 y γ en Chelonia mydas con fibropapilomatosis y tumores en alto grado de gravedad se asoció a estados de inmunosupresión tras la comparación con animales no infectados o con menor gravedad de tumores81.
La hipoalbuminemia se correlacionó negativamente con la tasa de supervivencia en Caretta caretta con debilidad crónica82. La hipergammaglobulinemia en hembras ponedoras de Dermochelys coriacea se relacionó con menores tasas de éxito reproductivo, los autores sugirieron que podía deberse a la transmisión de agentes infecciosos de las madres a la descendencia83.
Conclusiones
El proteinograma es una prueba relativamente poco costosa y fácilmente disponible para el clínico que, aunque no proporciona un diagnóstico definitivo, puede contribuir a identificar indicios de procesos inflamatorios, infecciosos y neoplásicos, siendo de utilidad en el diagnóstico y monitorización de los pacientes enfermos y en los exámenes rutinarios de salud.
Los conceptos básicos de interpretación del proteinograma en humanos y especies domésticas convencionales son aplicables a animales exóticos en líneas generales. El uso de valores de referencia específicos para la especie y el método utilizado es clave para aumentar la fiabilidad de la interpretación de los resultados; en caso de no disponer de estos datos podemos comparar con especies similares, pero teniendo en cuenta que puede haber variaciones relevantes. Debemos revisar siempre la imagen del electroforetograma del paciente además de los valores numéricos.
La generación de bibliografía especie y método-específica sobre el patrón de migración característico de las distintas globulinas en las diversas fracciones, el estudio de los cambios que sufren bajo trastornos concretos y la estandarización de los puntos de corte contribuirán a incrementar todavía más la utilidad de la electroforesis de proteínas.
Bibliografía
1. Melillo A; Applications of serum protein electrophoresis in exotic pet medicine; Vet Clin North Am Exot An Prac; 2013;16(1):211-225.
2. Tóthová C, Oskar N, Kovac G; Serum proteins and their diagnostic utility in veterinary medicine: A review; Vet Med (Praha); 2016;61(9):475-496.
3. Cray C; Protein electrophoresis of non-traditional species: a review; Vet Clin Pathol; 2021;50:478-494.
4. Depauw S, Delanghe J, Whitehouse-Tedd K, et al; Serum protein capillary electrophoresis and measurement of acute phase proteins in a captive cheetah (Acinonyx jubatus) population; J Zoo Wildl Med; 2014;45(3):497-506.
5. Regeniter A, Siede W; Peaks and tails: Evaluation of irregularities in capillary serum protein electrophoresis; Clin Biochem; 2018;51:48-55.
6. Gili C, Bonsembiante F, Bonanni R, et al; Detection of hereditary bisalbuminemia in bottlenose dolphins (Tursiops truncatus, Montagu 1821): comparison between capillary zone and agarose gel electrophoresis; BMC Vet Res. 2016;12(172):1-7.
7. Eckersall P, Bell R; Acute phase proteins: Biomarkers of infection and inflammation in veterinary medicine; The Veterinary Journal; 2010;185:23-27.
8. Cray C, King E, Rodriguez M, Decker L, Arheart K; Differences in protein fractions of avian plasma among three commercial electrophoresis systems; J Av Med Surg;2011;25(2):102-110.
9. Bossuyt X; Separation of serum proteins by automated capillary zone electrophoresis; Clin Chem Lab Med; 2003;41(6):762-772.
10. Crivellente F, Bonato M, Cristofori P; Analysis of mouse, rat, dog, marmoset, and human serum proteins by capillary electrophoresis: comparison with agarose gel electrophoresis; Vet Clin Pathol; 2008;37(1):73-78.
11. Giordano A, Paltrinieri S; Interpretation of capillary zone electrophoresis compared with cellulose acetate and agarose gel electrophoresis: reference intervals and diagnostic efficiency in dogs and cats; Vet Clin Pathol; 2010;39(4):464-473.
12. Zaias J, Bossart GD, Cray C; Comparison of agarose gel electrophoresis and capillary zone electrophoresis methods using serum from Bottlenose dolphins (Tursiops truncatus); Aquat Mamm; 2021;47(2):146-152.
13. Thorel M, Roman Y, Leclerc A; Plasma protein electrophoresis in the White stork (Ciconia ciconia): agreement between agarose gel versus capillary zone methods and development of reference intervals; J Zoo Wildl Med; 2004;55(2):330-340.
14. Abreu da Fonseca L, Montiani-Ferreira F, Soto J, Jones M, Zagaya N, Cray C; Comparison of agarose gel and capillary zone electrophoresis methods with preliminary reference interval generation using capillary zone electrophoresis in bald eagles (Haliaeetus leucocephalus); Vet Clin Pathol; 2023;52(3):452-460.
15. Villanueva-Saz S, Aranda M, Jiménez M, et al; Serum protein electrophoresis in European mink (Mustela lutreola): reference intervals and comparison of agarose gel electrophoresis and capillary zone electrophoresis; Vet Q; 2024;44(1):1-11.
16. Toonder M, Perrault J, Cray C; Comparison of agarose gel and capillary zone electrophoresis methods using plasma from green turtles (Chelonia mydas); J Zoo Wildl Med; 2020;51:123-130.
17. Marinho Maciel R, dos Anjos Lopes ST, Andrade Mazzanti CM, et a;. A hematologic and electrophoretic study in puppies vaccinated against Canine Distemper Virus and Canine Parvovirus; Acta Sci Vet; 2012;40(1):1011-1016.
18. Cooper E, Wellman M, Carsillo M; Hyperalbuminemia associated with hepatocellular carcinoma in a dog; Vet Clin Pathol; 2009;38(4):516-520.
19. Vavricka S, Burri E, Beglinger C, Degen L, Manz M; Serum protein electrophoresis: an underused but very useful test; Digestion; 2009;79:203-210.
20. Park S, Kim K, Kim OK, Ro WB, Lee CM; Evaluation of plasma prealbumin as a novel inflammatory biomarker in dogs: a pilot study; Front Vet Sci; 2023 May 24:10:1142535.
21. Cray C, Zaias J, Altman N; Acute phase response in animals: a review; Comp Med; 2009;59(6):517-526.
22. Cray C; Biomarkers of inflammation in exotic pets; J Exot Pet Med; 2013;22:245-250.
23. O’Connell T, Horita TJ, Kasravi B; Understanding and interpreting serum protein electrophoresis; Am Fam Physician. 2005;71(1):105-112.
24. Walton RM, Siegel A; Avian inflammatory markers; Vet Clin Exot Anim; 2022;25:679-695.
25. Leineweber C, Stohr A, Ofner S, Marschange R; Reference intervals for plasma capillary zone electrophoresis in Hermann’s tortoise (Testudo hermanni) depending on season and sex; J Zoo Wildl Med; 2019;50:611-618.
26. Leineweber C, Öfner S, Stöhr A, Marschang R, Mathes K; A comparison of thyroid hormone levels and plasma capillary zone electrophoresis in red-eared sliders (Trachemys scripta elegans) and map turtles (Graptemys spp.) depending on seson and sex; Vet Clin Pathol; 2020;49(1):78-90.
27. Leineweber C, Simard J, Kolesnik E, Hellebuyck T, Marschang R; Protein electrophoresis of plasma samples from Boa constrictors with and without Reptarenavirus infection; J Zoo Wildl Med; 2020;51(2):350-356.
28. Laube A, Altherr B, Clauss M, Hatt J; Reference intervals for bile acids and protein electrophoresis in plasma of captive Panther chameleons (Furcifer pardalis): A first approach; J Herpetol Med Surg; 2018;28(3-4):99-106.
29. Leineweber C, Beckmann J, Westerhüs U, Müller E, Fischer D; Clinical chemistry, vitamin, electrophoresis, and hematologic analytes of black-headed ibis (Threskiornis melanocephalus); J Zoo Wildl Med; 2021;51:948-957.
30. Roman Y, Bomsel-Demontoy M, Levrier J, Chaste-Duvernoy D, Saint J; Semiautomated agarose gel system with an automated capillary system. J Av Med Surg; 2013;27:99-108.
31. Dardas T, Mallmann V; Electrophoretic and immunoelectrophoretic studies of sera from normal, tuberculous and non infected tuberculin sensitive guinea pigs; J Bacteriol; 1966;92(1):76-81.
32. Giffen P, Turton J, Andrews C, et al; Markers of experimental acute inflammation in the Wistar Han rat with particular reference to haptoglobin and C-reactive protein; Arch Toxicol; 2003;77(7):392-402.
33. Zaias J, Mineau M, Cray C, Yoon D, Altman NH; Reference values for serum proteins of common laboratory rodent strains; Journal Am Assoc Lab Anim Sc; 2009;48(4):387-390.
34. Cray C, Besselsen DG, Hart JL, et al; Quantitation of acute phase proteins and protein electrophoresis in monitoring the acute inflammatory process in experimentally and naturally infected mice; Comp Med; 2010;60(4):263-271.
35. Melillo A; Rabbit clinical pathology; J Exot Pet Med; 2007;16(3):135-145.
36. Ravich M, Johnson-Delaney C, Kelleher S, Hess L, Arheart K, Cray C; Quantitation of acute phase proteins and protein electrophoresis fractions in ferrets; J Exot Pet Med;2015;24(2):201-208.
37. Miñana-Morant O, Moya-Vázquez A; Interpretación de las alteraciones del proteinograma en trece hurones (Mustela putorius furo); Clin Vet Peq Anim; 2022;42(1):27-36.
38. Aratani H, Segawa T, Itou T, Sakai T; Cloning and quantification of ferret serum amyloid A; Immunology; 2013;75(1):99-102.
39. Boussarie D; L’électrophorèse des protéines sériques en pathologie du furet (Mustela putorius furo); Bull Acad Vét France; 2007;160(4):319-324.
40. Gromadzka-Ostrowska J, Zalewska B; Seasonal fluctuations in plasma protein fraction levels of chinchillas (Chinchilla laniger, M.); Comp Biochem Physiol A Comp Physiol;1985;80(2):215-224.
41. Jakubów K, Gromadzka-Ostrowksa J; Twenty-four hour changes in lysozyme levels, total plasma protein concentration, gamma-globulin concentration, white blood cell count and numbers of lymphocytes and granulocytes in the peripheral blood of chinchillas Chinchilla laniger M. and rabbits Oryctolagus cuniculus L. Comp Biochem Physiol A comp Physiol; 1987;86(1):109-112.
42. Cray C, Rodriguez M, Zaias J; Protein electrophoresis of psittacine plasma; Vet Clin Pathol; 2007;36(1):64-72.
43. Spagnolo V, Crippa V, Marzia A, Alberti I, Sartorelli P; Hematologic, biochemical, and protein electrophoretic values in captive tawny owls (Strix aluco); Vet Clin Pathol. 2008;37:225-228.
44. Spagnolo V, Crippa V, Marzia A, Sartorelli P; Reference intervals for hematologic and biochemical constituents and protein electrophoretic fractions in captive common buzzards (Buteo buteo); Vet Clin Pathol; 2006;35:82-87.
45. Wernick M, Martin-Jurado O, Beaufrère H, Howard J, Samour J; Serum protein electrophoresis reference values in the gyrfalcon (Falco rusticolus); Comp Clin Pathol; 2018;27:493-497.
46. Jones M, Arheart K, Cray C; Reference intervals, longitudinal analyses, and index of individuality of commonly measured laboratory variables in captive bald eagles (Haliaeetus leucocephalus); J Av Med Surg; 2014;28:118-126.
47. Delk K, Wack R, Burgdorf-Moisuk A, Kass P, Cray C; Acute phase protein and electrophoresis protein fraction values for captive American flamingos (Phoenicopterus ruber); J Zoo Wildl Med; 2015;2015:929-933.
48. Back P, Macek M, Tieber A, Weber M. Reference values for hematology, plasma biochemical analysis, plasma protein electrophoresis, and Aspergillus serology in elegant-crested tinamou (Eudromia elegans); J Avian Med Surg; 2013;27:1-6.
49. Flo J, Løseth M, Sonne C, Jaspers V, Brun-Hansen H; Plasma protein fractions in free-living white-tailed eagle (Haliaeetus albicilla) nestlings from Norway; BMC Vet Res; 2019;15:290.
50. Tatum L, Zaias J, Mealey B, Cray C, Bossart G; Protein electrophoresis as a diagnostic and prognostic tool in raptor medicine; J Zoo Wildl Med; 2000;31:497-502.
51. Clubb S, Schubot R, Joyner K, et al; Hematologic and serum biochemical reference intervals in juvenile macaws (Ara sp.); J Assoc Avian Vet; 1991;5:154-162.
52. Xie H, Huff G, Huff W; Identification of ovotransferrin as an acute phase protein in chickens; Poultry Sci; 2002;81:112-120.
53. Cray C, Tatum L; Application of protein electrophoresis in avian diagnostics; J Avian Med Surg; 1998;12:4-10.
54. Cray C, Zielzienzki-Roberts K, Bonda M, et al; Serologic diagnosis of sarcocystosis in psittacine birds: 16 cases; J Av Med Surg; 2005;19(3):208-215.
55. Ivey E; Serological and plasma protein electrophoresis findings in 7 psittacine birds with aspergilosis; J Avian Med Surg; 2000;14:103-106.
56. Cray C, Watson T, Rodriguez M, Arheart K; Application of galactomannan analysis and protein electrophoresis in the diagnosis of aspergillosis in avian species; J Zoo Wildl Med. 2009;40(1):64-70.
57. Desoubeaux G, Rodriguez M, Bronson E, Sirpenski G, Cray C; Application of 3-hydroxybutyrate measurement and plasma protein electrophoresis in the diagnosis of aspergillosis in African penguins (Spheniscus demersus); J Zoo Wildl Med; 2018;49(3):696-703.
58. Fischer D, Waeyenberghe L Van, Cray C, et al; Comparison of diagnostic tools for the detection of aspergillosis in blood samples of experimentally infected falcons; Avian Dis; 2014;58(4):587-598.
59. Mayahi M, Khajeh G, Mosavari N, Parvandar Asadollahi K, Akhavizadegan M; Serum protein profiles in domestic pigeons naturally infected with Mycobacterium avium subsp. Avium; Vet Clin Pathol; 2013;42(2):212-215.
60. Lennox A, Clubb S, Romagnano A, Altman N, Cray C; Monoclonal hyperglobulinemia in lymphosarcoma in a cockatiel (Nymphicus hollandicus) and a blue and gold macaw (Ara ararauna); Avian Dis; 2014;58:326-329.
61. Högemann C, Richter R, Korbel R, Rinder M; Plasma protein, haematologic and blood chemistry changes in African grey parrots (Psittacus erithacus) experimentally infected with bornavirus; Avian Pathol; 2017;46(5):556-570.
62. Cray C; Plasma protein electrophoresis: An update; Proceedings of the Annual Conference of the Association of Avian Veterinarians; 1997:209-212.
63. Roman Y, Bomsel-Demontoy M, Levrier J, Chaste-Duvernoy D, Saint Jalme M; Effect of hemolysis on plasma protein levels and plasma electrophoresis in birds; J Wildl Dis; 2009;45(1):73-80.
64. Jaensch S, Howard J; Establishment of reference intervals for plasma protein electrophoresis and comparison of biochemical and protein electrophoresis evaluation of albumin in central bearded dragons (Pogona vitticeps); Aust Vet J; 2022;100(9):446-450.
65. Musilová A, Knotková Z, Pinterová K, Knotek Z; Variations of plasma protein electrophoresis in healthy captive Green Iguanas (Iguana iguana); Vet Clin Pathol; 2015;44(2):243-248.
66. Giménez M, Saco Y, Pato R, Busquets A, Martorell J, Bassols A; Plasma protein electrophoresis of Trachemys scripta and Iguana iguana; Vet Clin Pathol; 2010;39(2):227-235.
67. Stacy N, Chabot R, Innis C, et al; Plasma chemistry in nesting leatherback sea turtles (Dermochelys coriacea) from Florida: Understanding the importance of sample hemolysis effects on blood analytes; PLoS One. 2019;14(9):1-19.
68. Rainwater K, McClave C, Raphael B, et al; Hematology, plasma biochemistry, and plasma protein electrophoresis reference intervals for Blue iguanas (Cyclura lewisi) from Grand Cayman Island; J Zoo Wildl Med; 2021;51(4):933-947.
69. Flower J, Byrd J, Cray C, Allender M. Plasma electrophoretic profiles and hemoglobin binding protein reference intervals in the Eastern box turtle (Terrapene carolina carolina) and influences of age, sex, season, and location; J Zoo Wildl Med; 2014;45(4):836-842.
70. Perrault J, Arendt M, Schwenter J, et al; Blood analytes of immature Kemp’s ridley sea turtles (Lepidochelys kempii) from Georgia, USA: reference intervals and body size correlations; Conserv Physiol; 2020;8:1-14.
71. Lock B, Castro L, Mitchell M, McCaskill L, Fleming G, Stetter M; Protein electrophoresis values in captive adult male Nile crocodiles (Crocodilus niloticus) over time; J Herpetol Med Surg; 2014;24(1-2):20-27.
72. Knafo S, Norton T, Mitchell M, et al; Health and nutritional assessment of free-ranging Eastern indigo snakes (Drymarchon couperi) in Georgia, United States; J Zoo Wildl Med; 2016;47(4):1000-1012.
73. Bogan Jr J, Cray C, Rick M, Antonio F; Comparison of selected blood parameters of captive eastern indigo snakes (Drymarchon couperi) housed indoors vs. outdoors in Central Florida, USA; J Herp Med Surg; 2020;30:165-172.
74. Zaias J, Cray C; Protein electrohoresis: a tool for the reptilian and amphibian practitioner; J Herp Med Surg; 2002;12:30-32.
75. Zaias J, Norton T, Fickel A, Spratt J, Altman N, Cray C; Biochemical and hematologic values for 18 clinically healthy radiated tortoises (Geochelone radiata) on St Catherines Island, Georgia; Vet Clin Pathol; 2006;35:321-325.
76. Osborne A, Jacobson E, Bresette M, Singewald D, Scarpino R, Bolten A; Reference intervals and relationships between health status, carapace length, body mass, and water temperature and concentrations of plasma total protein and protein electrophoretogram fractions in Atlantic loggerhead sea turtles and green turtles; J Am Vet Med Assoc;2010;237:561-567.
77. Knotkova Z, Musilova A, Pinterova K, Knotek Z; Plasma protein electrophoresis in green iguanas (Iguana iguana) suffering from hepatic, renal and inflammatory skin diseases. Vet Med (Praha); 2019;64(6):271-279.
78. Russell Moore A, Allender M, MacNeill A; Effects of ranavirus infection of red-eared sliders (Trachemys scripta elegans) on plasma proteins; J Zoo Wildl Med; 2014;45(2):298-305.
79. Perrault J, Stacy N, Lehner A, et al; Potential effects of brevetoxins and toxic elements on various health variables in Kemp’s ridley (Lepidochelys kempii) and green (Chelonia mydas) sea turtles after a red tide bloom event. Sci Total Environm; 2017;605-606:967-979.
80. Perrault J, Bauman K, Greenan T, Blum P, Herny M, Walsh C; Maternal transfer and sublethal immune system effects of brevetoxin exposure in nesting loggerhead sea turtles (Caretta caretta) from western Florida; Aquat Toxicol; 2016;180:131-140.
81. Work T, Raymeyer R, Balzs G, Cray C, Chang S; Immune status of free-ranging green turtles with fibropapillomatosis from Hawaii; J Wildl Dis; 2001;37(3):574-581.
82. Stacy N, Lynch J, Arendt M, et al; Chronic debilitation in stranded loggerhead sea turtles (Caretta caretta) in the southeastern United States: Morphometrics and clinicopathological findings; PLoS One; 2018; Jul 10;13(7):e0200355
83. Perrault J, Miller D, Eads E, et al; Maternal health status correlates with nest success of Leatherback sea turtles (Dermochelys coriacea) from Florida; PLoS One; 2012;7(2):e31841.
84. Tóthová C, Mihajlovicová X, Nagy O; The use of serum proteins in the laboratory diagnosis of health disorders in ruminants; Abubakar M, ed; Ruminants-The Husbandry, Economic and Health Aspects. 1st ed. IntechOpen Ltd; 2018:105-146.
 by Multimédica
by Multimédica