Shunt portosistémico: actualización
Resumen breve
Los shunts portosistémicos (SPS) o anomalías vasculares portosistémicas, son vasos anómalos que permiten que el drenaje de sangre portal del estómago, intestino, páncreas y bazo se redirija directamente a la circulación sistémica, sin pasar primero por el hígado1. Se encuentran entre las anomalías vasculares más frecuentes en el perro, no así en el gato2.Índice de contenidos
Introducción
Los shunts portosistémicos (SPS) o anomalías vasculares portosistémicas, son vasos anómalos que permiten que el drenaje de sangre portal del estómago, intestino, páncreas y bazo se redirija directamente a la circulación sistémica, sin pasar primero por el hígado1. Se encuentran entre las anomalías vasculares más frecuentes en el perro, no así en el gato2.
Los SPS se clasifican en congénitos (SPSc) o adquiridos (SPSa). A su vez, los SPSc pueden ser extrahepáticos (SPScEH) o intrahepáticos (SPScIH). Dentro de los SPScIH, la clasificación tradicional se dividía en shunt divisional derecho, izquierdo y central3. En estudios posteriores esta clasificación se ha visto modificada (Tablas 1 y 2)4,5, mejorando la fiabilidad y validez de las descripciones de estas derivaciones en la tomografía computerizada (TC), así como la planificación quirúrgica. La sintomatología de ambos es similar, presentando epidemiología y pronóstico diferentes2,6.
| Tipo de Shunt | Inserción |
|---|---|
| Derecho | |
| Vena hepática lateral derecha Vena hepática caudada | |
| Izquierdo | |
| Vena hepática izquierda Vena frénica izquierda | |
| Central | |
| Vena hepática cuadrada Vena hepática central Vena hepática medial derecha Aspecto ventral de la vena cava caudal | |
| Múltiple | |
| Variable |
Tabla 1. Clasificación del Shunt portosistémico congénito intrahepático en perros (Plested y cols. 2020)4.
| Tipo de shunt | Origen | Inserción | Localización | Clasificación |
|---|---|---|---|---|
| Interlobar | Rama portal izquierda | Vena cava caudal cerca del diafragma | Craneodorsal a la porta hepatis |
|
| Intralobar | Rama portal derecha | Venas hepáticas previo a la unión con vena cava caudal | A la derecha de la fisura longitudinal derecha, en el proceso caudado o en el lóbulo lateral derecho |
Tabla 2. Clasificación del shunt portosistémico congénito intrahepático en perros (Walsh y cols. 2023)5
Los SPScEH suponen casi el 63 % de las derivaciones únicas en perros; también aparecen en gatos. En perros se han descrito diferentes tipos, como, por ejemplo: de vena porta a vena cava caudal; de vena porta a vena ácigos; de vena gástrica izquierda a vena cava caudal; de vena esplénica a vena cava caudal; vena gástrica izquierda, mesentérica craneal, mesentérica caudal o gastroduodenal a vena cava caudal, y combinaciones de las anteriores. Las SPScIH suponen, aproximadamente, el 35 % de las derivaciones simples en perros y el 10 % en gatos2.
Los SPSa surgen debido a una mayor resistencia del flujo sanguíneo portal, que provoca hipertensión portal. Esta hipertensión hace que conexiones microvasculares normales no funcionales, que están presentes al nacer entre la vena porta y las sistémicas, se vuelvan funcionales. Son extrahepáticas, normalmente múltiples, y representan aproximadamente el 20 % del total de SPS en perros. El tratamiento quirúrgico en este tipo de shunt está contraindicado2,6,7.
Fisiopatología
Independientemente del tipo de SPS, la sintomatología clínica está relacionada con la encefalopatía hepática, que se define como una disfunción neurológica producida por enfermedad hepática, cuando se ha perdido al menos 70 % de la función del órgano y/o en casos de shunt portosistémico3. No se conoce la totalidad de la patogenia de la encefalopatía hepática. El hígado tiene un papel detoxificante, neutralizando sustancias que se absorben desde el tracto gastrointestinal, así como subproductos del metabolismo. Estas sustancias, de forma normal, alcanzan el hígado a través de la circulación portal, detoxificándose por los hepatocitos3. Cuando existe un shunt portosistémico, estas sustancias no son metabolizadas en el hígado, acumulándose en la circulación sistémica y afectando al sistema nervioso central. Existen más de 20 compuestos diferentes como el amoniaco, triptófano, glutamina, aminoácidos aromáticos, ácidos grasos de cadena corta, ácido gamma-aminobutírico y benzodiazepinas endógenas. El amoniaco parece ser uno de los principales responsables de la sintomatología neurológica, contribuyendo en la aparición de edema cerebral. A su vez, como el flujo de sangre que atraviesa el hígado es menor, los animales con SPSc suelen tener microhepatía (por liberación inadecuada de factores tróficos para el hígado) y deterioro de la función hepática, manifestándose analíticamente con hipoalbuminemia e hipoglucemia. Ésta última puede ser un hallazgo que exacerbe los signos neurológicos2,3,6. El hígado, además, interviene en la coagulación, produciendo y metabolizando productos de la hemostasia secundaria y fibrinolisis, por lo que estos animales pueden presentar tendencia trombótica y/o al sangrado3,8.
Por otra parte, el ciclo de la urea se ve alterado, con una disminución de esta en sangre y aumento de la excreción de amoniaco por orina, siendo frecuente la aparición de cálculos de biurato amónico9.
Diagnóstico
Predisposición raza/sexo/edad
Los perros de raza pura tienen mayor riesgo de SPScEH. Las razas con mayor predisposición a SPSc son: Yorkshire terrier, Schnauzer miniatura, Cairn terrier, Bichón maltés, Golden y Labrador retriever, Bobtail, Irish wolfhound, Pastor alemán, Caniche, Dachshund, Pug, Shih tzu, Pastor australiano y mestizos. Los SPScEH son más frecuentes en perros de raza pequeña10. Los gatos Común Europeo o de pelo corto, parecen los más afectados, pero también las razas puras como el Himalaya, el Ragdoll, British shorthair y Tonkinés11,12. En los perros parece existir una predisposición de sexo en el diagnóstico de SPScEH (no así en gatos), ya que, hay una sobrerrepresentación en las hembras de razas Bichón frisé, Maltés y Shih-tzu. En cuanto a los SPScIH, se diagnostican con más frecuencia en perros de razas grandes (como Pastor alemán, Golden retriever, Doberman, Labrador retriever, Setter irlandés, Samoyedo, Wolfhound irlandés). Los perros de razas pequeñas más propensos a tener SPScIH son los Caniche toy y miniatura2,6.
En cuanto a la edad, en caninos los shunt portosistémicos únicos suelen ser congénitos y se diagnostican con mayor frecuencia en animales menores de 2 años, aunque existen casos diagnosticados en edad adulta2,6,13.
Signos clínicos
Los hallazgos de esta patología suelen ser inicialmente sutiles y episódicos, pero pueden progresar en intensidad y frecuencia. Los signos clínicos están influenciados por el tipo de SPS, la anatomía, la dieta y otras enfermedades concurrentes. Los síntomas inespecíficos son retraso en crecimiento, pérdida de peso, anorexia intermitente, depresión y/o relacionados con los sistemas que con más frecuencia se afectan (Tabla 3): sistema nervioso, gastrointestinal y urinario2,6,9,13,14.
| Inespecíficos | Nerviosos (secundarios a encefalopatía hepática) |
| Retraso del crecimiento Pérdida de peso Anorexia intermitente Depresión | Letargia Debilidad Ataxia Estupor Pressing Marcha en círculos Amaurosis Convulsiones Coma |
| Urinarios | Gastrointestinales |
| Disfunción urinaria Hematuria Disuria Polaquiuria PU/PD Estranguria Obstrucción uretral asociada a urolitiasis por cálculos de biurato amónico. | Vómitos Ptialismo (70 % de los gatos) |
Tabla 3. Signos clínicos en pacientes con shunt portosistémico.
Los síntomas neurológicos se relacionan con la encefalopatía hepática y suelen estar presentes en el 95% de los perros. Estos signos pueden variar mucho desde moderados como letargia a graves como ataxia, debilidad, estupor, «pressing», marcha en círculos, amaurosis, convulsiones o coma. Estos signos pueden ser constantes o intermitentes. Es habitual el empeoramiento después de comer, sobre todo cuando están alimentados con una dieta alta en proteínas 2,3,6,13.
Un al 30 % de los perros con shunt presentan sintomatología gastrointestinal, siendo menos frecuente en gatos. Pueden presentar vómitos, ptialismo y diarrea3,14.
En cuanto a la sintomatología urinaria podemos encontrar disfunción urinaria, presentando hematuria, disuria, polaquiuria, PU/ PD, estranguria y obstrucción uretral asociada a urolitiasis por cálculos de biurato amónico. La presencia de urolitos en estos pacientes favorece la aparición de bacteriuria subclínica, predisponiendo a la aparición de infecciones urinarias6,9,15.
En perros con SPSc único aparece ascitis de forma ocasional, siendo más probable su aparición en perros con múltiples SPSa, secundaria a hipoproteinemia grave y/o hemorragia gastrointestinal grave (perros de raza grande con IHPSS o hipertensión portal). En general, el fluido sería un trasudado puro2,6,16.
Los signos de SPS en gatos son similares a los de perros, entre los que destacan ptialismo (hasta un 70 % de los gatos), anorexia, debilidad, vómitos, letargia y ceguera como síntoma característico de esta especie, acompañada de coloración dorada o cobriza en el iris2,3,6,12.
Diagnóstico laboratorial
En los pacientes con sospecha de SPS se debe realizar hematología, bioquímica, ácidos biliares, amoniaco, pruebas de coagulación y análisis sistemático de orina (Tabla 4), aunque los hallazgos de estas pruebas pueden ser normales2,3,6.
| Hemograma | Bioquímica (secundarios a encefalopatía hepática) |
| Microcitosis Anemia no regenerativa moderada Talasemia mayor Poliquilocitosis | ↓Hierro ↓ Albúmina ↓ Colesterol ↓ Urea (BUN) ↓ Glucosa ↑ Alanina aminotransferasa ↑ Aspartato aminotransferasa ↑ Fosfatasa alcalina ↑ Amoniaco ↑ Ácidos biliares |
| Orina | Tiempos de coagulación |
| Dilución ↑ Uratos ↑ Amonio Cristales de biurato amónico y/o cálculos Hematuria Piuria Proteinuria | Normales |
Tabla 4. Posibles alteraciones laboratoriales en pacientes con SPS.
Hemograma
Las alteraciones hematológicas pueden incluir anemia no regenerativa microcítica microcitosis con eritrocitos normocrómicos y/o o poiquilocitosis. Se postula que las bajas concentraciones séricas de hierro por defecto en su metabolismo predisponen a la microcitosis3,6.
Bioquímica
Las pruebas bioquímicas suelen evidenciar hipoalbuminemia, hipoproteinemia, hipocolesterolemia y baja concentración de urea en sangre debido a disminución de la síntesis hepática3,17. Algunos perros (y la mayoría de los gatos) con SPS presentan niveles de albúmina normales. Ocasionalmente, puede observarse también un aumento en suero, de moderado a marcado, de alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y fosfatasa alcalina (ALKP)3,17. La concentración de bilirrubina sérica suele ser normal. La hipoglucemia puede producirse por reducción de la gluconeogénesis hepática y las reservas de glucógeno6.
Estas alteraciones bioquímicas no son específicas de SPS, pueden estar presentes en pacientes con otras patologías3,6.
Pruebas de coagulación
Los hallazgos descritos en diversos estudios son un aumento del tiempo de protrombina (PT) y tiempo de tromboplastina parcial activada (aPTT)2,6. Además pueden existir deficiencias en los factores procoagulantes (II, V, VI y IX), así como trombocitopenia, predisponiendo a un estado anticoagulante3,18. No obstante, en otros pacientes se ha descrito disminución de antitrombina y de la actividad de proteína C, así como un aumento de la actividad del factor VIII y de Von Willebrand, sugiriendo un estado procoagulante3,17. A pesar de lo descrito anteriormente, los tiempos de coagulación suelen ser normales2,6 y la presencia de trombosis en la vena porta y/o los sangrados espontáneos son raros.
Concentración de amoniaco en sangre
El amoniaco se genera principalmente por el metabolismo de las proteínas de la dieta en el intestino delgado y se convierte en urea en los hepatocitos en el ciclo de la urea19.
La hiperamonemia es un signo muy específico de la insuficiencia hepática, pero la simple medida del amoniaco en sangre es una prueba poco sensible, incluso en pacientes con encefalopatía hepática. La mayor desventaja de medir el amoniaco en sangre es la obtención de valores erróneos por procesado incorrecto de la muestra de sangre. Lo ideal es su realización en el propio centro veterinario en los primeros 30 minutos tras la extracción de la sangre. Debido a que el amoniaco se forma a partir de grupos amino de proteínas y urea (también en el tubo de recolección), la muestra de sangre (en un tubo de EDTA) debe colocarse directamente en hielo después del muestreo y separar el plasma17,19,20. La contaminación de la muestra con amoniaco en el aire puede conllevar resultados falsos positivos, por lo que las muestras deben tomarse utilizando un sistema cerrado (aguja colocada en una jeringa o sistema de vacío tipo Vacutainer®). La hemólisis puede aumentar artificialmente la concentración de amoniaco, debido a que los eritrocitos contienen de dos a tres veces más amoniaco que el plasma. La medición del amoniaco debe realizarse en un lugar limpio, donde el aire no esté contaminado con amoniaco procedente de orina o humo de cigarrillo17,19,20. La medición de la concentración arterial de amoniaco no proporciona ningún valor adicional2,6.
Pruebas de tolerancia al amoniaco (PTA)
Las pruebas de tolerancia suelen realizarse en perros con sospecha de SPS pero con niveles de amoniaco en sangre dentro del rango de referencia2,6.
La primera y más utilizada es la medición de las concentraciones de amoniaco en sangre a las 6 - 8 horas de la ingesta de alimento con un 25 % del RER con una cantidad de proteína moderada (aproximadamente un 30 % de la materia seca)21. Es una prueba con mayor sensibilidad que la medición del amoniaco sanguíneo en ayuno20,21.
La segunda (apenas utilizada debido a la complejidad de su realización) es la de la prueba de tolerancia al amoniaco propiamente dicho22. Es muy sensible pero su complejidad radica en que muchos animales vomitan o defecan el cloruro de amonio que se les administra. La administración intrarrectal es un procedimiento más seguro y rara vez aparecen signos de EH, aunque no debe realizarse en pacientes con niveles de amoniaco en sangre muy altos (>150 μmol/L). Para realizarla se administra solución de cloruro de amonio (NH4Cl) al 5 % a una dosis de 2 mL/kg (máximo 3 gramos totales), a 15 cm en el recto, utilizando una sonda flexible. Se realizan mediciones de amoniaco venoso previo a la administración de la solución, 20 y 40 minutos después. En presencia de SPS, la concentración de amoniaco aumentará al menos el doble en los tiempos de muestreo de 20 y/o 40 minutos. Un resultado normal de PTA excluye el SPS. El grado de incremento es una medida semicuantitativa del grado de SPS. Cabe señalar que la administración rectal de solución de NH4Cl puede provocar una irritación transitoria de la mucosa del colon durante los primeros 10 minutos2,3,22.
Pruebas de función hepática- ácidos biliares
Los ácidos biliares se sintetizan en el hígado a partir del colesterol. Se almacenan en la vesícula biliar, secretándose, junto con otros componentes de la bilis, al intestino por el conducto biliar común, para realizar la digestión de lípidos de la dieta. Posteriormente se reabsorben en el íleon y llegan de nuevo al hígado a través de la vena porta, reciclándose en los hepatocitos hasta en un 95 %17,19,20.
Habitualmente se ha asociado que un aumento en los ácidos biliares preprandiales (tras 12 horas de ayuno) pueden estar asociados a SPS debido a la interrupción de la circulación enterohepática de los ácidos biliares. En perros y gatos, durante años, la determinación de los ácidos biliares séricos ha sido la prueba estándar de función hepática, pero, actualmente, se le han reconocido algunas limitaciones de importancia17,19,20. En primer lugar, es fundamental medir las concentraciones de ácidos biliares pre- y posprandiales. Aproximadamente un 20 % de los perros presentan una concentración preprandial mayor. En segundo lugar, algunos perros con concentraciones muy elevadas de ácidos biliares en suero (>150 mol/L) no presentan enfermedad hepática clínicamente significativa, mientras que algunos perros con SPSc tienen concentraciones tan sólo moderadamente elevadas. En tercer lugar, contrario a lo que se podría esperar de la mayoría de las determinaciones bioquímicas, pueden existir variaciones sustanciales en las concentraciones séricas de ácidos biliares dependiendo del momento del día. Actualmente, se considera que la medición de los ácidos biliares en orina es tan útil como la de los ácidos biliares en suero, pero tiene la ventaja de que la toma de muestras es más sencilla (es decir, el dueño puede traer la muestra de orina en vez de traer al paciente), especialmente en gatos2,6,17,19,20.
El aumento de ácidos biliares preprandiales (12 horas de ayuno) en medición única es una prueba sensible para SPS pero poco específica. La especificidad puede verse aumentada con la medición simultanea del amoniaco venoso2,6.
Proteína C
La proteína C es una proteína anticoagulante plasmática dependiente de la vitamina K que se sintetiza en el hígado. Puede utilizarse como biomarcador de la función hepática y de la perfusión portal. Los perros con SPSc tendrán niveles de proteína C más bajos23,24. Se ha sugerido también su medición para la detección de shunt residual tras el tratamiento quirúrgico, aunque la utilidad de la proteína C en estos casos debe ser investigada3.
Análisis de orina
La hiperuricemia y la hiperamonemia provocan un aumento de la excreción de uratos y amoniaco, favoreciendo la precipitación de cristales de biurato de amoniaco. Si se forman cálculos de urato puede aparecer hematuria, piuria y proteinuria2,6,9,15.
Diagnóstico por imagen
A los animales con sospecha de SPS por la predisposición, síntomas clínicos y pruebas laboratoriales compatibles, se les debe realizar pruebas de diagnóstico por imagen para obtener el diagnóstico definitivo: radiografía, ecografía abdominal (EA), angiografía por tomografía computarizada (ATC), angiografía por resonancia magnética (ARM) y/o portovenografía mesentérica intraoperatoria (PMIO)2,6 (Esquema 1).
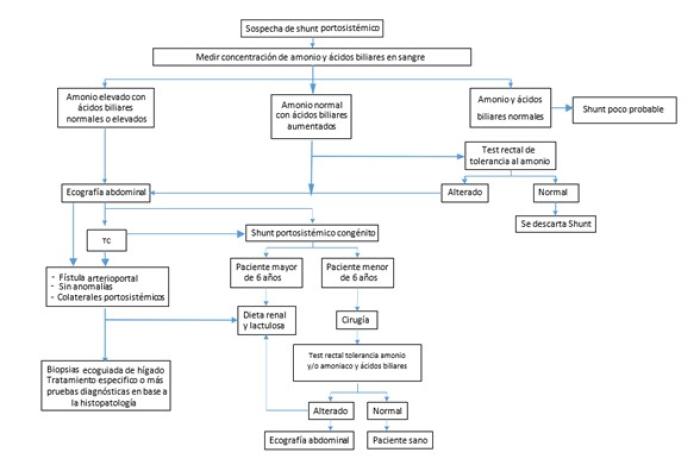
Esquema 1. Algoritmo de diagnóstico y tratamiento del shunt portosistémico.
Radiografía abdominal
Las radiografías abdominales tienen alta sensibilidad para identificar la microhepatía, pero baja especificidad, ya que no todos los pacientes con SPS presentan esta característica. También puede observarse renomegalia bilateral. En las vías urinarias pueden existir cálculos de urato amónico que suelen ser radiolúcidos salvo que presenten depósitos de calcio o de estruvita 2,3,6.
Ecografía abdominal
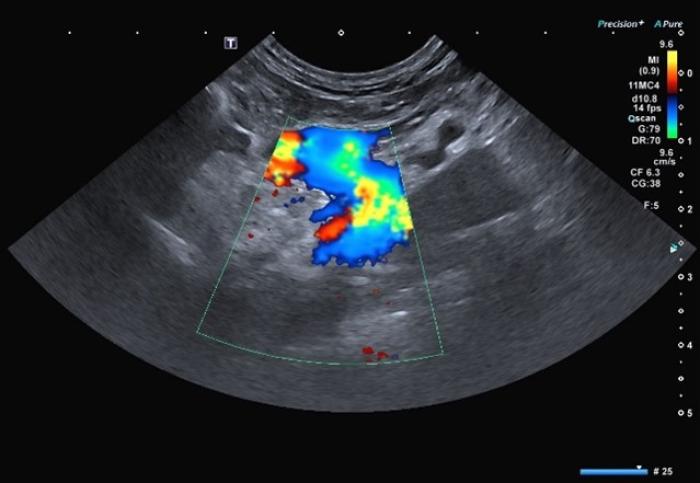
La ecografía abdominal es la prueba más utilizada para la visualización de los SPSc. Los hallazgos más frecuentes son microhepatía, presencia de vasos anómalos (Figura 1 (A, B)), renomegalia y/o urolitos y reducción en la ratio porta/aorta en perros y gatos con SPSEH3,25.
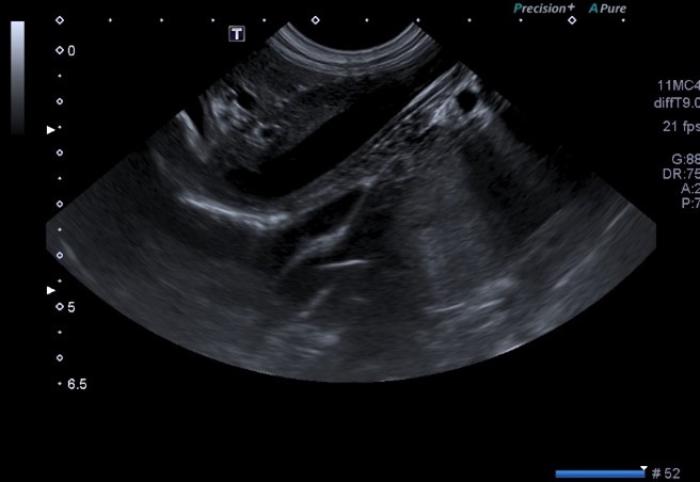
Figura 1. Imágenes (A) sin y (B) con Doppler color mostrando shunt porto-ácigos cruzando el diafragma. Cortesía de Raquel Salgüero Fernández, Lda. Vet. MA DipECVDI MRCVS. EBVS European and RCVS Specialist in Diagnostic Imaging.
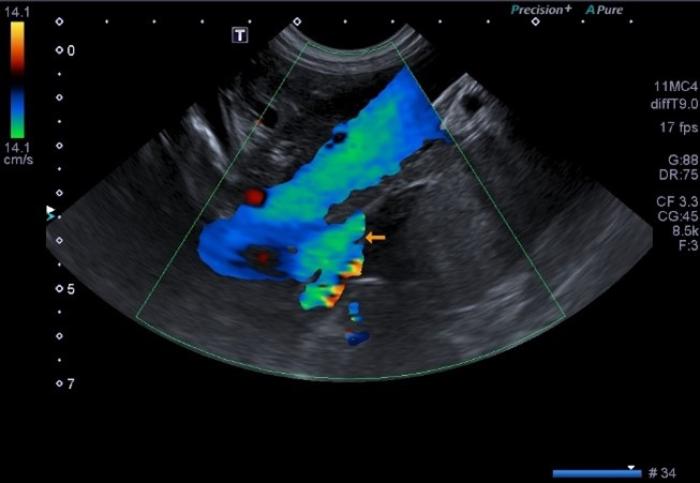
La ecografía Doppler tiene una sensibilidad del 95 % y una especificidad del 98 % (Figura 2 (A,B)). Esta técnica presenta limitaciones en la detección del shunt como el grado de experiencia del ecografista, el equipo utilizado y el tiempo dedicado al paciente2,6,26.
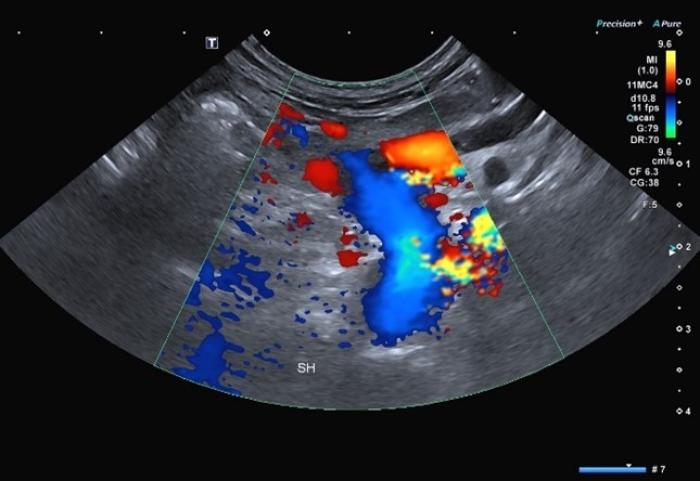
Figura 2 (A, B). Imagen Doppler en color mostrando un vaso anómalo con origen la izquierda de la vena porta y flujo hepatófugo compatible con un shunt portofrénico. Cortesía de Raquel Salgüero Fernández, Lda. Vet. MA DipECVDI MRCVS. EBVS European and RCVS Specialist in Diagnostic Imaging.
Angiografía por tomografía computarizada
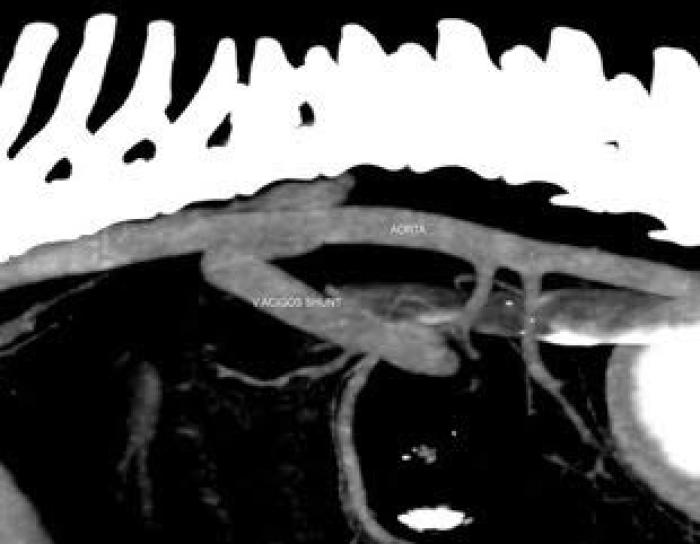
La angiografía por tomografía computarizada (ATC) es la prueba de referencia para el diagnóstico de los trastornos vasculares asociados al hígado. Tiene una sensibilidad del 96 % y una especificidad del 89 %2,6,27. Es una técnica rápida y proporciona imágenes de todos los afluentes portales y ramas a partir de una única inyección venosa periférica de contraste, permitiendo una excelente localización anatómica exacta del origen e inserción del shunt, pudiendo establecer un plan quirúrgico en los casos que se requiera (Figura 3 (A, B))2,6,28.
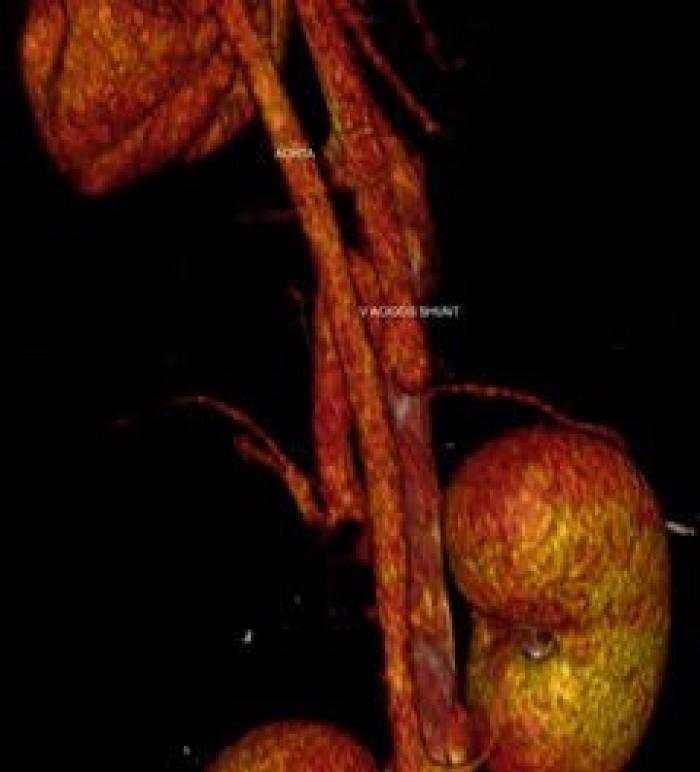
Figura 3 (A, B). Imágenes de TC de un paciente canino con shunt porto-ácigos. Cortesía de Díez-Bru diagnóstico por imagen veterinario.
Escintigrafía
La escintigrafía más empleada es la transcolónica. Es un método útil para detectar el flujo sanguíneo hepático anormal. Se ha utilizado el pertecnetato de Tecnecio (99 mTc) como radioisótopo infundido en el colon, vía rectal. Este contraste se absorbe por las venas colónicas, que drenan a la vena mesentérica caudal y luego a la vena porta, el hígado y el corazón. No proporciona información morfológica sobre el tipo y la localización de la derivación, no puede diferenciar SPScEH de SPScIH y tampoco puede diferenciar entre un solo o múltiples shunts, por lo que es una técnica poco utilizada2,6,29.
Angiografía por resonancia magnética
La angiografía por resonancia magnética (ARM) también proporciona una imagen tridimensional de los SPS y es útil para la valoración quirúrgica, aumentando su sensibilidad mediante administración de contraste intravenoso30,31. Como inconveniente presenta un coste más elevado que la ATC.
Portovenografía mesentérica intraoperatoria
En esta técnica se canula, por lo general, una vena mesentérica, aplicando un contraste radiológico para la realización de radiografías/fluoroscopia32,33. La sensibilidad de la portografía intraoperatoria está entre el 85 % y el 100 %, es una técnica rápida y se obtienen vídeos a tiempo real, pero es invasiva32,33. Los resultados de la ATC son similares o superiores a los de la portografía y se prefiere como diagnóstico preliminar al ser una técnica menos invasiva2,6. No obstante, en la actualidad la portografía se utiliza para la evaluación del tratamiento de los shunts portosistémicos en el periodo quirúrgico mediante equipos de fluoroscopia, permitiendo obtener una imagen a tiempo real sobre el grado de atenuación del shunt34,35.
Tratamiento
En la mayoría de los pacientes con SPS el tratamiento de elección es quirúrgico, puesto que la instauración de un tratamiento médico permitirá que continúe deteriorándose la función hepática ya que la mayor parte del flujo sanguíneo se desvía del hígado2,6,36. La supervivencia en perros con tratamiento médico suele ser menor y presentan mayor recurrencia de signos clínicos2,6,36.
Tratamiento médico
En aquellos pacientes en los que el tratamiento quirúrgico del SPS no esté indicado o no pueda realizarse por diversas causas, se iniciará tratamiento médico, sobre todo en pacientes asintomáticos diagnosticados de manera fortuita o pacientes de más de 6 - 7 años con signos clínicos leves2,6. Se instaura además para la estabilización del paciente antes de la intervención quirúrgica, sobre todo si este presenta signos de encefalopatía hepática o si se aprecian cambios histológicos en el hígado ya que estos pueden originar serias complicaciones postquirúrgicas2,6.
Los objetivos del tratamiento médico se basarán en reducir la absorción de toxinas derivadas de las bacterias intestinales, disminuir la interacción entre estas bacterias y sustancias nitrogenadas, evitar el empleo de fármacos que puedan predisponer a la encefalopatía hepática y reducir el daño oxidativo en los hepatocitos37,38. Es decir, el tratamiento médico va dirigido al control de los signos clínicos, pero no mejora la perfusión portal36–38.
Fluidoterapia intravenosa
En aquellos animales con signos clínicos como vómitos, diarrea y encefalopatía hepática. Puede ser necesario el suplemento con glucosa, sobre todo en pacientes pediátricos. La restauración de la normovolemia reducirá los niveles de amoniaco por dilución, mejorando además la excreción urinaria de amoniaco y urea. Se utilizarán soluciones cristaloides isotónicas como el Ringer Lactato, aunque debido a que este fluido contiene lactato (que requiere metabolismo hepático), algunos autores prefieren la utilización de soluciones isotónicas tamponadas con malato y acetato. En función de los niveles plasmáticos de potasio, puede ser necesaria su suplementación dentro del plan de fluidoterapia38,39. La acidosis metabólica también contribuye a la instauración de una encefalopatía hepática por lo que debe ser corregida2.
Coloides
Valorar transfusiones de sangre entera, concentrado de glóbulos rojos o plasma si existe anemia o prolongación de los tiempos de coagulación2.
Alimentación
Tradicionalmente se ha recomendado una dieta fácilmente digerible con bajo contenido proteico, cuya principal fuente de calorías sean los hidratos de carbono2. La restricción proteica debe ser moderada en perros y gatos con SPSc sin signos clínicos de encefalopatía hepática, especialmente en aquellos con baja condición corporal, debido a que una restricción severa puede aumentar el catabolismo muscular, aumentando la hiperamonemia38–40. El objetivo es administrar dietas con un 18 - 22 % de proteínas en perros y un 30 – 35 % en gatos, eligiéndose a ser posible proteínas de origen vegetal en pacientes con EH (las dietas hepáticas comerciales suelen cumplir estos requisitos). Las dietas renales, con restricción proteica severa, se recomiendan en caso de EH severa a corto plazo38–40.
Lactulosa
Vía oral o en enemas de retención. Se emplea para acidificar el contenido del colon y captar iones amonio del lumen. Además, acelera el tránsito intestinal reduciendo la producción y absorción de amoniaco. Puede originar ciertos efectos colaterales como diarreas, vómitos, anorexia y pérdida de potasio y agua38–40.
Antibióticos
En caso de que no exista una respuesta adecuada a la modificación dietética junto con lactulosa38–40. Se utilizan generalmente para disminuir las bacterias productoras de ureasa y, por lo tanto, disminuir la producción y absorción de amoniaco. Los antibióticos de elección son aquellos con pobre absorción intestinal, como metronidazol o ampicilina38–40. Debido a que el metronidazol tiene metabolismo hepático y posibles efectos secundarios a nivel neurológico, la dosis utilizada será menor en SPSc. Actualmente, la utilización de metronidazol está en controversia, ya que los últimos estudios no han demostrado un mejor control sintomatológico con respecto a los perros que sólo se han tratado con dieta y lactulosa41.
Gastroprotectores
En caso de ulceración gástrica se aconseja la utilización de bloqueantes de los receptores de ácido (inhibidores de la bomba de protones como omeprazol o anti H2 como famotidina), además de sucralfato38–40.
Anticonvulsivantes
Los perros y gatos con EH severa, pueden presentar diversos signos neurológicos, entre ellos convulsiones. La utilización de benzodiacepinas es controvertida, por lo que es preferible el uso de levetiracetam, fenobarbital, propofol o bromuro potásico38–40. Algunos estudios sugieren que la administración de levetiracetam a 20 mg/kg vía oral cada 8 horas durante al menos 24 horas antes de la cirugía, reduce significativamente el riesgo de padecer convulsiones y muerte en perros sometidos a la atenuación con anillo ameroide del SPScEH42. Sin embargo, otros estudios describen que la administración de antiepilépticos profilácticos no es efectiva para reducir la aparición de signos neurológicos en el posoperatorio43.
Nutraceúticos
La S-adenosil-L-metionina (SAME), la silimarina y la vitamina E tienen propiedades antioxidantes y de protección de los hepatocitos por distintos mecanismos. El Zn mejora el ciclo de urea y la funcionalidad hepática38–40.
Diuréticos
En caso de ascitis por hipertensión portal. Emplear espironolactona, si es necesario, asociar a la furosemida, junto con dieta baja en sodio38–40.
Otros tratamientos
Si hay fibrosis en el hígado, se ha descrito tradicionalmente la utilización de fármacos que teóricamente reducen la formación de tejido conectivo como la prednisona y la colchicina38.
Tratamiento quirúrgico
El objetivo de la cirugía es identificar y ocluir o reducir el lumen del vaso anómalo. La atenuación gradual del shunt se relaciona con menor riesgo de complicaciones postquirúrgicas2,6. La atenuación del shunt debe realizarse lo más cerca posible a su inserción para ocluir así todas las posibles ramas que puedan llegar a él. Tras una laparotomía ventral en línea media craneal, existen varias formas de lograr la localización del shunt: visualización, ecografía, portografía mesentérica o mediante la evaluación de cambios en la presión portal2,6. Los SPScIH pueden ser visibles entre los lóbulos hepáticos, sin embargo, la mayoría requieren la disección del parénquima del hígado para su visualización. Suelen ser vasos dilatados y con un flujo turbulento y, en ocasiones, pueden localizarse mediante palpación y cambios de presión2,6. Debido a que muchos pacientes presentan ascitis, se recomienda contar con sistema de succión en el momento de la laparotomía2,6.
Existen varias técnicas quirúrgicas que permiten la oclusión del vaso, las principales son:
Oclusor progresivo aneroide
Se trata de un dispositivo en forma de anillo cuya parte interior está conformada por caseína, un material higroscópico encargado de originar una primera constricción del vaso. Mediante la absorción de fluidos corporales por parte de la caseína, el diámetro interior del anillo disminuirá un 32 %2,44,45. La fibrosis que genera el organismo alrededor del cuerpo extraño dará lugar a la oclusión entre las 2 - 5 semanas desde la colocación2,46,47. Puede no llegar a producirse la oclusión completa del vaso. En algunos perros la oclusión puede producirse como consecuencia a la formación de trombos6.
Bandas de celofán
El celofán produce una respuesta inflamatoria inicial a consecuencia de una reacción tisular, crónica y leve a un cuerpo extraño. La banda de celofán se coloca alrededor del vaso, y se sostiene con 3 - 4 hemoclips colocados en distintas posiciones. Las bandas de celofán pueden colocarse ocluyendo o no el vaso, siendo la segunda técnica más sencilla puesto que no requiere la evaluación de cambios en frecuencia cardiaca, presión arterial, color y motilidad intestinal y color pancreático para emplear un pasador de mayor o menor tamaño a la hora de colocar el celofán2,6,48. La atenuación vascular puede ser más lenta y menos completa que con el anillo ameroide. En gatos se ha descrito flujo persistente con las bandas de celofán, relacionándose con la menor respuesta inflamatoria que genera esta especie2,48–50. En perros, está descrita la colocación de bandas de celofán mediante laparoscopia con mínima morbilidad en el posoperatorio51.
Ligadura con seda
Suele realizarse con menor frecuencia que la colocación del anillo ameroide o la banda de celofán ya que tiene un mayor porcentaje de complicaciones posquirúrgicas que estas. Con esta técnica hay que poner especial cuidado en no provocar hipertensión portal6.
Los perros que no padecen encefalopatía hepática y presentan un tamaño normal de hígado suelen tolerar la ligadura completa del shunt. El grado de atenuación del vaso se basa en la búsqueda de evidencias de hipertensión portal: intestinos pálidos o cianóticos, edema o cianosis en páncreas y aumento de las pulsaciones mesentéricas. Además, pueden medirse presiones venosas centrales o portales. La función hepática vuelve a la normalidad en el 70 % de los perros sometidos a una ligadura parcial. No se aconseja la reintervención salvo en caso de nueva presencia de signos clínicos2,52.
En los pacientes con SPSc, debe realizarse una biopsia hepática. Está se hará antes de la oclusión del vaso si la apariencia del hígado es anormal y después si este es aparentemente normal. Se recomienda, además palpar el sistema urinario en busca de posibles cálculos antes de cerrar la laparotomía6.
Cuidados y evaluación posoperatoria
Debe mantenerse el tratamiento médico hasta que se logre la oclusión completa del vaso y el parénquima hepático se regenere. Además, suele requerirse hospitalización y analgesia con opioides como buprenorfina durante los primeros días2,6. Durante la hospitalización se realizará control de glucemia, ya que un 40 % de los pacientes presentarán niveles de glucosa en sangre por debajo de 60 mg/dl en las 4 horas tras la cirugía de SPScEH2.
Se monitorizará la hipertensión portal, que aparecerá con mayor frecuencia en los casos en los que se haya empleado ligadura con seda, y se haya producido oclusión total (entre el 2 – 14 % de estos pacientes)2,40,53. Los signos clínicos pueden presentarse en forma de dolor abdominal, diarrea hemorrágica, shock endotóxico, distensión abdominal por ascitis y muerte; si el cuadro clínico es muy severo, la recomendación es la reintervención inmediata para retirar o aflojar la ligadura2,6. Los pacientes con fibrosis crónica o cambios hiperplásicos biliares presentan mayor riesgo de hipertensión portal tras la atenuación del shunt.
Otros signos menos comunes pueden ser fiebre (sobre todo en razas toy), ascitis y/o exudado a través de la incisión. La ascitis suele ser autolimitante, desapareciendo en 1 - 3 semanas. En caso de distensión abdominal severa y disnea, valorar el tratamiento con espironolactona y/o furosemida2,6,40. Pueden presentar anemia por hemorragia intra o posoperatoria por la rotura del vaso que se está interviniendo. La hipertensión portal produce hemorragias gastrointestinales así como secuestro esplénico, que contribuirán a la anemia2,6.
Las convulsiones posoperatorias están presentes en el 3 – 18 % de perros y en el 8 – 22 % de gatos. No se asocian a hipoglucemia, hiperamonemia o a la técnica quirúrgica empleada. Antes de las convulsiones pueden aparecer otros signos neurológicos como ataxia, fasciculaciones o letargia. Pueden aparecer alteraciones neurológicas permanentes como ceguera, sobre todo en gatos2,6,42,43,54,55.
Si el shunt continúa siendo permeable, había varios vasos anómalos que no fueron ocluidos durante la intervención o se originan SPSa, puede haber una recurrencia de los signos clínicos, ante lo cual se recomienda la reintervención del paciente2.
Se han descrito una serie de parámetros para evaluar la atenuación completa del shunt en el posoperatorio, siendo la medición de amoniaco la prueba más específica (100 %)56.
Pronóstico
En pacientes con tratamiento médico, se registra una esperanza de vida de 2 meses a 2 años. En SPScIH, los signos neurológicos y urinarios son progresivos y tan solo los signos gastrointestinales son menos severos tras iniciar el tratamiento médico; sin embargo, en SPScEH, los signos neurológicos, gastrointestinales y urinarios ocurren en la misma o menor medida tras instaurar el tratamiento médico6,10,36,57.
En pacientes sometidos a tratamiento quirúrgico, la utilización de ligadura con seda se asocia a mayor número de complicaciones intra y posoperatorias, por lo que se prefiere al anillo aneroide o las bandas de celofán. Se consigue un mayor porcentaje de pacientes con cierre completo del shunt con el anillo ameroide que con las bandas de celofán; sin embargo, no hay diferencias significativas en las complicaciones posoperatorias o en los resultados a largo plazo6,44,47,48,58,59. Los resultados son de buenos a excelentes en el 70 – 89 % de los pacientes intervenidos de SPScEH con ligadura, celofán o ameroide2,48,60,61. En los SPScIH los resultados son de buenos a excelentes en el 70 – 89 % de pacientes intervenidos con ameroide, el 76 – 100 % en los que se empleó ligadura y el 50 % de los intervenidos con celofán2,48,53,58,61,62.
La principal causa de muerte es la persistencia de signos neurológicos, así como aquellos que presentan distensión abdominal en el posoperatorio. Otras causas de mortalidad posoperatoria son: hemorragia, coagulopatía, hipertensión portal, ulceración gastrointestinal, y peritonitis2,53,58,60–62.
Bibliografía
- Evans HE, Howard LA. Miller´s Anatomy of the Dog. Missouri: Elsevier; 2013.
- Berent AC, Tobias K. Hepatic Vascular Anomalies. In: Veterinary Surgery, Small Animal. 2nd ed. Elsevier; 2018. p. 1851–86.
- Konstantinidis AO, Patsikas MN, Papazoglou LG, Adamama-Moraitou KK. Congenital Portosystemic Shunts in Dogs and Cats: Classification, Pathophysiology, Clinical Presentation and Diagnosis. Vol. 10, Veterinary Sciences. MDPI; 2023.
- Plested MJ, Zwingenberger AL, Brockman DJ, Hecht S, Secrest S, Culp WTN, et al. Canine intrahepatic portosystemic shunt insertion into the systemic circulation is commonly through primary hepatic veins as assessed with CT angiography. Veterinary Radiology and Ultrasound. 2020 Sep 1;61(5):519–30.
- Walsh ND, Porter IR, Miller A V., Fischetti AJ, Cheong SH, Scrivani P V. Canine intrahepatic portosystemic shunts: Interlobar and intralobar classifications. Veterinary Radiology and Ultrasound. 2023 Jul 1;
- Radlinsky MA, Fossum TW. Surgery of the Liver. In: Small Animal Surgery. 5th ed. Elsevier; 2019. p. 540–70.
- Anglin E V, Lux CN, Sun X, Folk CA, Fazio C. Clinical characteristics of, prognostic factors for, and long-term outcome of dogs with multiple acquired portosystemic shunts: 72 cases (2000-2018). Vol. 15. 2022.
- Kummeling A, Teske E, Rothuizen J, Sluijs FJ. Coagulation Profiles in Dogs with Congenital Portosystemic Shunts before and after Surgical Attenuation. J Vet Intern Med. 2006 Nov;20(6):1319–26.
- Caporali E, Phillips H, Underwood L, Selmic L. Risk factors for urolithiasis in dogs with congenital extrahepatic portosystemic shunts: 95 cases (1999-2013). JAVMA. 2015;246(5):530–6.
- Tobias KM, Rohrbach BW. Association of breed with the diagnosis of congenital portosystemic shunts in dogs: 2400 cases (1980-2002). JAVMA. 2003;223(11):1636–9.
- Palerme JS, Brown JC, Marks SL, Birkenheuer AJ. Splenosystemic shunts in cats: A retrospective of 33 cases (2004-2011). J Vet Intern Med. 2013 Nov;27(6):1347–53.
- Tivers M, Lipscomb V. Congenital portosystemic shunts in cats. J Feline Med Surg. 2011;13:173–84.
- Windsor RC, Olby NJ. Congenital Portosystemic Shunts in Five Mature Dogs With Neurological Signs. J Am Anim Hosp Assoc. 2007;43:322–31.
- Frymus J, Trębacz P, Galanty M. Gastrointestinal ulceration in dogs with portosystemic shunt. Vol. 79, Medycyna Weterynaryjna. Polskie Towarzystwo Nauk Weterynaryjnych; 2023. p. 275–2778.
- Tinoco-Najera A, Steiner JM, Suchodolski JS, Lidbury JA. Risk factors for urinary bacterial growth in dogs with congenital portosystemic shunts: 66 cases (1997-2019). Journal of Small Animal Practice. 2021 May 1;62(5):359–64.
- Ricciardi M. Unusual haemodynamics in two dogs and two cats with portosystemic shunt - Implications for distinguishing between congenital and acquired conditions. Open Vet J. 2017;7(2):86–94.
- Devriendt N, Serrano G, Paepe D, de Rooster H. Liver function tests in dogs with congenital portosystemic shunts and their potential to determine persistent shunting after surgical attenuation. Vol. 261, Veterinary Journal. Bailliere Tindall Ltd; 2020.
- Kelley D, Lester C, Delaforcade A, Webster CRL. Thromboelastographic evaluation of dogs with congenital portosystemic shunts. J Vet Intern Med. 2013 Sep;27(5):1262–7.
- Chapman SE, Hostutler RA. A Laboratory Diagnostic Approach to Hepatobiliary Disease in Small Animals. Vol. 43, Veterinary Clinics of North America - Small Animal Practice. 2013. p. 1209–25.
- Gerritzen-Bruning MJ, Ingh TSGAM, Rothuizen J. Diagnostic Value of Fasting Plasma Ammonia and Bile Acid Concentrations in the Identification of Portosystemic Shunting in Dogs. J Vet Intern Med. 2006 Jan;20(1):13–9.
- Walker MC, Hill RC, Guilford WG, Scott KC, Jones GL, Buergelt CD. Postprandial venous ammonia concentrations in the diagnosis of hepatobiliary disease in dogs. J Vet Intern Med. 2001;15(5):463–6.
- Rothuizen J. Rectal ammonia tolerance test in the evaluation of portal circulation in dogs with liver disease. Res Vet Sci. 1982;33:22–5.
- Thieman Mankin KM. Current Concepts in Congenital Portosystemic Shunts. Vol. 45, Veterinary Clinics of North America - Small Animal Practice. W.B. Saunders; 2015. p. 477–87.
- Toulza O, Center SA, Brooks MB, Erb HN, Warner KL, Deal W. Evaluation of plasma protein C activity for detection of hepatobiliary disease and portosystemic shunting in dogs. JAVMA. 2006;229(11):1761–71.
- Tivers M, Lipscomb V. Congenital Portosystemic Shunts in Cats. J Feline Med Surg. 2011 Mar 1;13(3):173–84.
- Pablo Rey J. Ultrasonografic diagnosis of portosystemic shunts in small animals: A retrospective of 37 cases (2014-2019). In: Comunicación Corta InVet. 2020. p. 115–24.
- Wilson S, Culp WTN, Wisner ER, Cissell DD, Finn JP, Zwingenberger AL. Ferumoxytol‐enhanced magnetic resonance angiography provides comparable vascular conspicuity to CT angiography in dogs with intrahepatic portosystemic shunts. Veterinary Radiology & Ultrasound. 2021 Jul 26;62(4):463–70.
- Nelson NC, Nelson LL. Anatomy of extrahepatic portosystemic shunts in dogs as determined by computed tomography angiography. Veterinary Radiology & Ultrasound. 2011 Sep;52(5):498–506.
- Landon B, Abraham L, Charles J. Use of transcolonic portal scintigraphy to evaluate efficacy of cellophane banding of congenital extrahepatic portosystemic shunts in 16 dogs. Aust Vet J. 2008 May;86(5):169–79.
- Mai W, Weisse C. Contrast-enhanced portal magnetic resonance angiography in dogs with congenital portal vascular anormalies. Veterinary Radiology & Ultrasound. 2011 May;52(3):284–8.
- Bruehschwein A, Foltin I, Flatz K, Zoellner M, Matis U. Contrast-enhanced magnetic resonance angiography for diagnosis of portosystemic shunts in 10 dogs. Veterinary Radiology & Ultrasound. 2010 Jan;
- Parry AT, White RN. Comparison of computed tomographic angiography and intraoperative mesenteric portovenography for extrahepatic portosystemic shunts. Journal of Small Animal Practice. 2017 Jan;58(1):49–55.
- White RN, Macdonald NJ, Burton CA. Use of intraoperative mesenteric portovenography in congenital portosystemic shunt surgery. Veterinary Radiology
Ultrasound. 2003 Sep;44(5):514–21. - Kayanuma H, Koyama R, Kanai E. Feasibility of complete surgical ligation on 72 dogs with singular extrahepatic congenital portosystemic shunt based on portal pressure and comparison of intraoperative mesenteric portovenography. Journal of Veterinary Medical Science. 2019;81(3):361–4.
- Sura PA, Tobias KM, Morandi F, Daniel GB, Echandi RL. Comparison of 99mTcO4 Trans-Splenic Portal Scintigraphy with Per-Rectal Portal Scintigraphy for Diagnosis of Portosystemic Shunts in Dogs. Veterinary Surgery. 2007 Oct;36(7):654–60.
- Beardall RL, Sumner JP, Menard J V., Parry SA. Outcomes in dogs with congenital extrahepatic portosystemic shunts treated with surgical ligation or medical management. Vet Med Sci. 2023 Jul 1;
- Favier RP, de Graaf E, Corbee RJ, Kummeling A. Outcome of non-surgical dietary treatment with or without lactulose in dogs with congenital portosystemic shunts. Veterinary Quarterly. 2020 Jan 1;40(1):108–14.
- Mehl M. Portosystemic Shunt Management. In: Silverstein D, Hopper K, editors. Small Animal Critical Care Medicine. 3rd ed. Elsevier; 2023. p. 675–9.
- Berent A. Hepatic Failure. In: Silverstein D, Hopper K, editors. Small Animal Critical Care Medicine . e. 2023. p. 660–7.
- Konstantinidis AO, Adamama-Moraitou KK, Patsikas MN, Papazoglou LG. Congenital Portosystemic Shunts in Dogs and Cats: Treatment, Complications and Prognosis. Vol. 10, Veterinary Sciences. MDPI; 2023.
- Serrano G, Devriendt N, de Rooster H, Paepe D. Comparison of diet, lactulose, and metronidazole combinations in the control of pre-surgical clinical signs in dogs with congenital extrahepatic portosystemic shunts. J Vet Intern Med. 2022 Jul 1;36(4):1258–66.
- Fryer KJ, Levine JM, Peycke LE, Thompson JA, Cohen ND. Incidence of Postoperative Seizures with and without Levetiracetam Pretreatment in Dogs Undergoing Portosystemic Shunt Attenuation. Vol. 25, Journal of Veterinary Internal Medicine. 2011. p. 1379–84.
- Mullins RA, Escribano Carrera A, Anderson DM, Billet JP, Brissot H, Broome C, et al. Postattenuation neurologic signs after surgical attenuation of congenital portosystemic shunts in dogs: A review. Vol. 51, Veterinary Surgery. John Wiley and Sons Inc; 2022. p. 23–33.
- Sereda CW, Adin CA. Methods of Gradual Vascular Occlusion and Their Applications in Treatment of Congenital Portosystemic Shunts in Dogs: A Review. Veterinary Surgery. 2005 Jan;34(1):83–91.
- Adin CA, Gregory CR, Kyles AE, Griffey SM, Kendall L. Effect of Petrolatum Coating on the Rate of Occlusion of Ameroid Constrictors in the Peritoneal Cavity. Veterinary Surgery. 2004 Jan;33(1):11–6.
- Inglés AC, Légaré DJ, Lautt WW. Development of portacaval shunts in portal-stenotic cats. Can J Physiol Pharmacol. 1993 Sep 1;71(9):671–4.
- VOGT JC, KRAHWINKEL DJ, BRIGHT RM, DANIEL GB, TOAL RL, ROHRBACH B. Gradual Occlusion of Extrahepatic Portosystemic Shunts in Dogs and Cats Using the Ameroid Constrictor. Veterinary Surgery. 1996 Nov;25(6):495–502.
- Hunt GB, Kummeling A, Tisdall PLC, Marchevsky AM, Liptak JM, Youmans KR, et al. Outcomes of Cellophane Banding for Congenital Portosystemic Shunts in 106 Dogs and 5 Cats. Veterinary Surgery. 2004 Jan;33(1):25–31.
- James F, Knowles G, Mansfield C, Robertson I. Ascites due to pre-sinusoidal portal hypertension in dogs: a retrospective analysis of 17 cases. Aust Vet J. 2008 May;86(5):180–6.
- YOUMANS K, HUNT G. Cellophane banding for the gradual attenuation of single extrahepatic portosystemic shunts in eleven dogs. Aust Vet J. 1998 Aug;76(8):531–7.
- Miller JM, Fowler JD. Laparoscopic Portosystemic Shunt Attenuation in Two Dogs. J Am Anim Hosp Assoc. 2006 Mar 1;42(2):160–4.
- Hunt G, Hughes J. Outcomes after extrahepatic portosystemic shunt ligation in 49 dogs. Aust Vet J. 1999 May;77(5):303–7.
- Wolschrijn CF, Mahapokai W, Rothuizen J, Meyer HP, van Sluijs FJ. Gauged attenuation of congenital portosystemic shunts: Results in 160 dogs and 15 cats. Veterinary Quarterly. 2000 Apr;22(2):94–8.
- Carrera AE, Morrissey AM, Lipscomb VJ, Tivers MS, Chan A, Pisco VLP, et al. Long-term outcome and quality of life of dogs that developed neurologic signs after surgical treatment of a congenital portosystemic shunt: 50 cases (2005-2020). J Am Vet Med Assoc. 2022 Feb 1;260(3):326–34.
- Strickland R, Tivers MS, Adamantos SE, Harcourt-Brown TR, Fowkes RC, Lipscomb VJ. Incidence and risk factors for neurological signs after attenuation of single congenital portosystemic shunts in 253 dogs. Veterinary Surgery. 2018 Aug;47(6):745–55.
- Devriendt N, Paepe D, Serrano G, de Rooster H. Evaluation of different blood tests in dogs with extrahepatic portosystemic shunts to assess shunt closure after surgical treatment. Veterinary Surgery. 2022 Oct 21;51(7):1142–52.
- Wallace ML, Grimes JA, Edwards L, Lux CN, Tam C, Dickerson VM, et al. Dogs ≥ five years of age at the time of congenital extrahepatic portosystemic shunt diagnosis have better long-term outcomes with surgical attenuation than with medical management alone. J Am Vet Med Assoc. 2022 Apr 1;260(7):758–64.
- BRIGHT SR, WILLIAMS JM, NILES JD. Outcomes of Intrahepatic Portosystemic Shunts Occluded with Ameroid Constrictors in Nine Dogs and One Cat. Veterinary Surgery. 2006 Apr;35(3):300–9.
- Serrano G, Charalambous M, Devriendt N, de Rooster H, Mortier F, Paepe D. Treatment of congenital extrahepatic portosystemic shunts in dogs: A systematic review and meta‐analysis. J Vet Intern Med. 2019 Sep 31;33(5):1865–79.
- Kummeling A, Van sluijs FJ, Rothuizen J. Prognostic Implications of the Degree of Shunt Narrowing and of the Portal Vein Diameter in Dogs with Congenital Portosystemic Shunts. Veterinary Surgery. 2004 Jan;33(1):17–24.
- Mehl ML, Kyles AE, Hardie EM, Kass PH, Adin CA, Flynn AK, et al. Evaluation of ameroid ring constrictors for treatment for single extrahepatic portosystemic shunts in dogs: 168 cases (1995–2001). J Am Vet Med Assoc. 2005 Jun 1;226(12):2020–30.
- White RN, Burton CA, McEvoy FJ. Surgical treatment of intrahepatic portosystemic shunts in 45 dogs. Veterinary Record. 1998 Apr;142(14):358–65.
 by Multimédica
by Multimédica