Técnicas e interpretación de muestreo traqueobronquial
Resumen breve
El manejo de las afecciones respiratorias en caninos y felinos constituye un campo en constante progreso que ha experimentado avances significativos gracias a la mayor accesibilidad a técnicas diagnósticas avanzadas en los centros veterinarios, así como el mejor conocimiento de las técnicas anestésicas que permiten realizar procedimientos diagnósticos y terapéuticos con mayor seguridad y eficacia.Índice de contenidos
Resumen
El manejo de las afecciones respiratorias en caninos y felinos constituye un campo en constante progreso que ha experimentado avances significativos gracias a la mayor accesibilidad a técnicas diagnósticas avanzadas en los centros veterinarios, así como el mejor conocimiento de las técnicas anestésicas que permiten realizar procedimientos diagnósticos y terapéuticos con mayor seguridad y eficacia. Entre estas técnicas, la broncoscopia destaca por permitir una visualización directa de las vías respiratorias y la toma de muestras para análisis, lo que facilita, en numerosas ocasiones, la gestión de nuestros casos.
La técnica de recolección de muestras respiratorias es un procedimiento que contribuye al diagnóstico de diversidad de trastornos pulmonares. Mediante técnicas como el lavado traqueobronquial (LTB), el cepillado bronquial (CB) o el lavado broncoalveolar (LBA), es posible obtener muestras representativas de la tráquea y los bronquios mayores. Estas muestras pueden ser de mucha ayuda para el diagnóstico de patologías respiratorias en las cuales sus características clínicas y radiográficas no permiten determinar la etiología subyacente de manera clara. El análisis citológico de estas muestras permite poner en evidencia la presencia de agentes infecciosos, células inflamatorias y otros marcadores de enfermedad, lo cual es esencial para la elección de un tratamiento apropiado.
Métodos de toma de muestras
Las muestras pueden ser tomadas mediante varios métodos, incluyendo lavado traqueobronquial (transtraqueal o endotraqueal) (LTB), cepillado bronquial (CB) o lavado broncoalveolar (LBA) (Tabla 1).
| - | Ventajas | Inconvenientes |
|---|---|---|
| Lavado transtraqueal |
|
|
| Lavado endotraqueal |
|
|
| Cepillado bronquial |
|
|
| Lavado broncoalveolar |
|
|
Tabla 1. Ventajas y desventajas de las diferentes técnicas utilizadas para la obtención de fluidos respiratorios3.
Lavado traqueobronquial
Los lavados transtraqueales y endotraqueales son procedimientos mínimamente invasivos que permiten obtener muestras a ciegas de las vías respiratorias mayores para análisis citológicos y cultivo. Las muestras de LTB recogen células exfoliadas de la superficie de las vías respiratorias más grandes y no reflejan la misma población de células que los LBA. No hay selectividad en la recolección de muestras, ya que el líquido se recupera de manera no específica con esta técnica1–4.
Lavado transtraqueal
El lavado transtraqueal, también conocido como técnica percutánea, se realiza introduciendo, de manera aséptica, una aguja de calibre grueso (18 G o 16 G) a través del ligamento cricotiroideo, justo debajo de la laringe (en perros de gran tamaño se puede penetrar entre dos anillos traqueales). Una vez en la luz traqueal, se introducirá a través de la aguja un catéter urinario estéril (o sonda de alimentación) hasta un nivel justo por encima de la carina para instilar la solución salina fisiológica (1-2 ml por cada 5 kg de peso corporal) (Figura 1), Lo normal es que el paciente comience a toser antes de que todo el suero sea inyectado, momento en el que aspiraremos de nuevo para obtener la muestra3,4.
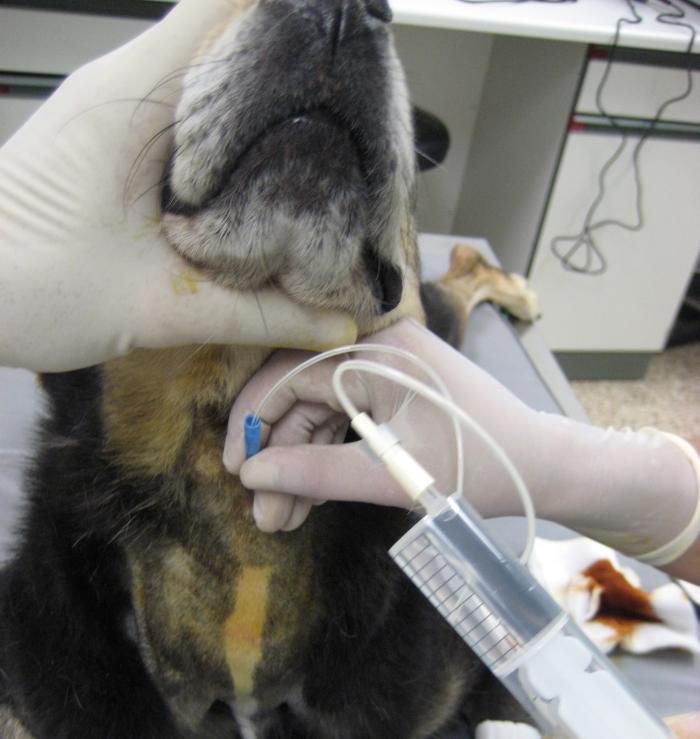
Figura 1. Acceso transtraqueal: inserción de la aguja realizada entre dos anillos traqueales para la introducción de la sonda y ejecución del lavado transtraqueal. En nuestro centro, la utilización de esta técnica se reserva para casos excepcionales, dando prioridad a alternativas que ofrecen un rendimiento diagnóstico más elevado.
Lavado endotraqueal
Se realiza una intubación con un tubo endotraqueal estéril evitando en la medida de los posible el contacto con la mucosa orofaríngea. Con el paciente en decúbito esternal o lateral (con el lado más afectado hacia la mesa) se introduce un catéter estéril a través del tubo endotraqueal, haciéndolo avanzar hasta notar una pequeña resistencia. Se retira entonces unos 3 mm, reintroduciéndolo de nuevo hasta el lugar de resistencia, y se instila la solución salina (2-5 ml/kg) y de inmediato se procede a su aspiración3 (Figura 2).
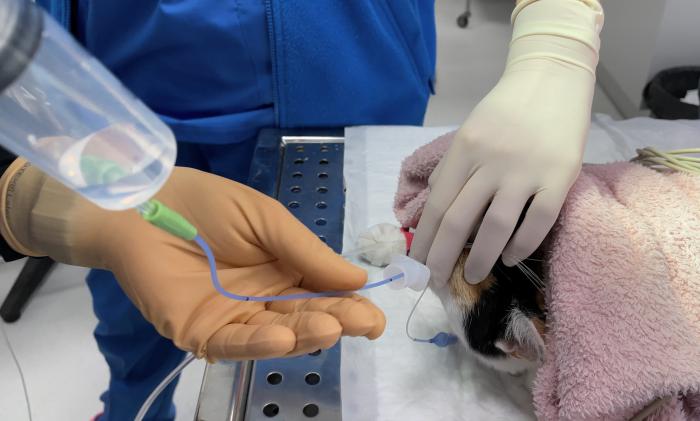
Figura 2. Procedimiento de lavado endotraqueal en un felino: obsérvese la jeringa cargada con solución salina y un volumen adicional de aire que nos asegura el vaciado de la sonda en la vía aérea.
Cepillado bronquial
Los cepillados bronquiales se realizan generalmente a través de un broncoscopio bajo visualización directa (Figura 3), obteniendo células de un área focal y tendiendo a muestrear más profundamente en la mucosa queun simple lavado de la superficie. Su indicación primordial es para la evaluación de lesiones bronquiales focales
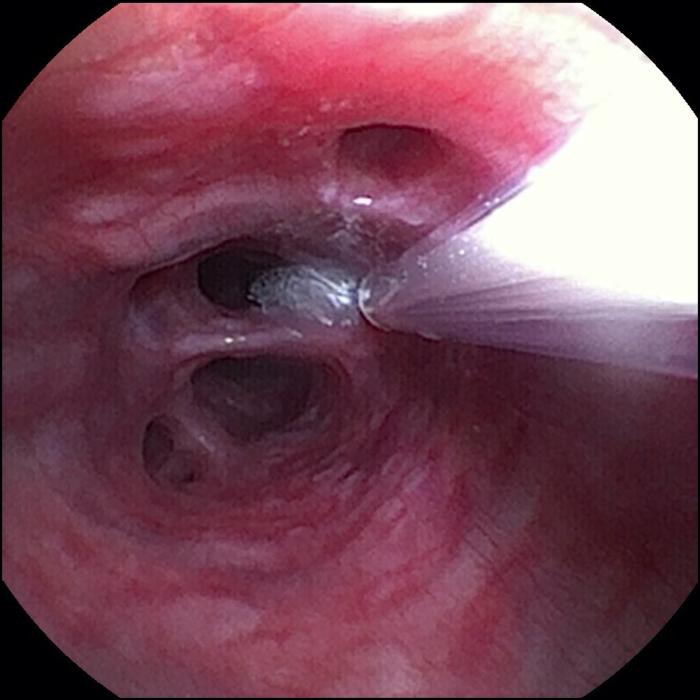
Figura 3. Detalle de toma de muestras con cepillo asistida mediante control visual.
El cepillo está cubierto por una funda de plástico retráctil. Con la punta del broncoscopio en la ubicación deseada, este pequeño cepillo se pasa a través del canal de muestreo. Una vez que se visualiza el catéter, se retrae la funda y el cepillo se frota suavemente contra la mucosa (con movimientos de rotación y avance-retroceso). Luego, el cepillo se retrae de nuevo en vaina protectora y se retira del broncoscopio. El cepillo se puede frotar suavemente en un portaobjetos para el examen citológico y/o introducir en un medio para su cultivo y antibiograma2,3,5,6 (Figura 4).
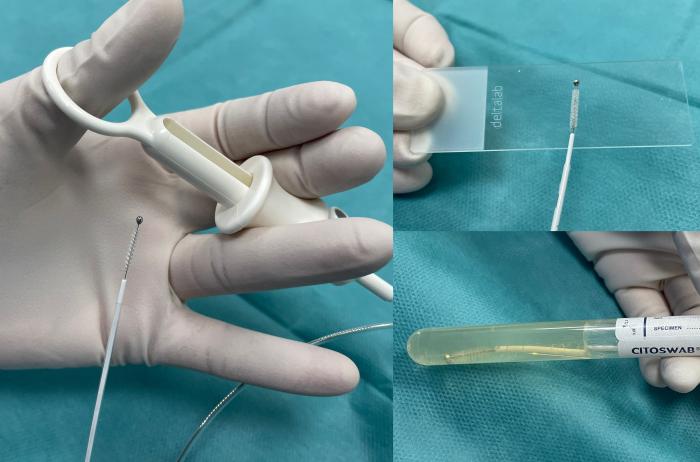
Figura 4. Las muestras obtenidas por cepillado pueden ser utilizadas para citología y/o cultivo. Para ello una vez obtenida la muestra, se limpia la funda con alcohol, y el cepillo se hace rodar sobre un portaobjetos estéril (superior derecha) y posteriormente es introducido en un medio de cultivo cortando el extremo de funda sobrante (inferior derecha).
Este procedimiento es muy seguro y rápido, e identifica células que no exfolian en el líquido de LBA7. También es una excelente manera de evaluar el epitelio bronquial.
Lavado broncoalveolar
El lavado broncoalveolar se efectúa insertando el broncoscopio en una vía respiratoria distal, lo que permite evaluar enfermedades pulmonares que inciden en las pequeñas vías, alvéolos y en el tejido intersticial3,4.
El procedimiento se lleva a cabo a través del tubo endotraqueal con un adaptador en T4,5, pero en pacientes pequeños, el diámetro interno del tubo puede limitar la intervención, haciendo necesaria la inserción directa del broncoscopio (Figura 5). En estos casos, es ventajoso introducir un catéter estéril de pequeño calibre junto al broncoscopio para suministrar oxígeno suplementario2. El LBA se realiza tras la exploración visual y antes de procedimientos más invasivos como biopsias o cepillados, que podrían causar sangrado y alterar los resultados del lavado5,8.
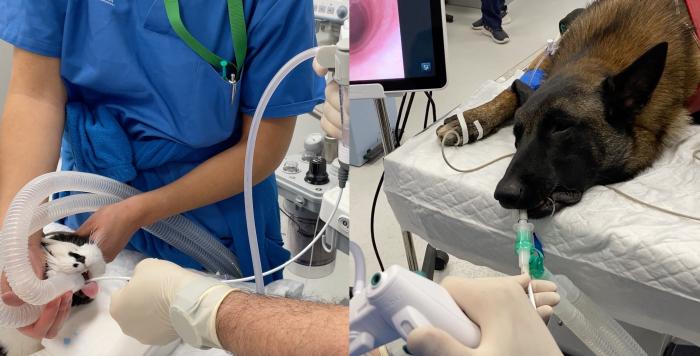
Figura 5. Broncoscopia a través de tubo endotraqueal y directa. En animales de pequeña talla el broncoscopio se introduce directamente sobre la vía aérea, en animales de mayor tamaño hacemos uso de un adaptador en T unido al tubo endotraqueal permite que el gas anestésico y oxígeno se administre mientras el broncoscopio se pasa a través del lumen del tubo endotraqueal.
Una vez que se completa la evaluación visual inicial de las vías respiratorias inferiores5,6,9 (Figura 6) (Tabla 2), se retira el endoscopio del paciente y se limpia el canal del endoscopia, alternando la succión con solución salina estéril y aire inmediatamente antes de realizar el LBA. Este procedimiento, asumiendo una esterilización adecuada del endoscopio antes de su uso, permite la recolección de muestras para citología y cultivo sin contaminación de las vías respiratorias superiores6,10.
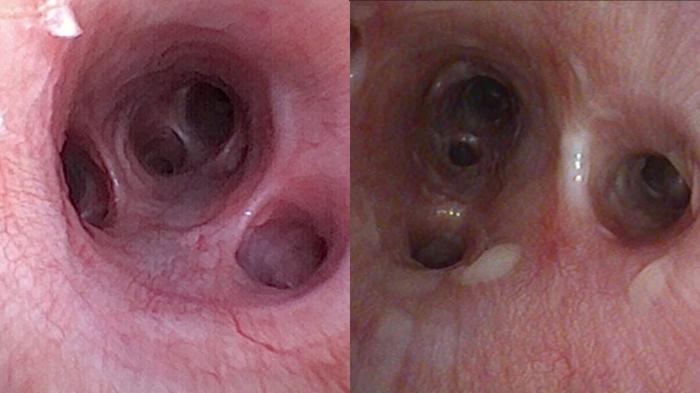
Figura 6. Estudio broncoscópico previo a la realización del lavado. A la derecha de la imagen se muestra el área escogida para la realización del lavado por presencia de secreciones mucosas.
| Superficie de la mucosa bronquial | 0 lisa 1 irregularidad leve 2 marcadamente irregular |
| Color de la mucosa bronquial | 0 pálido 1 eritematoso 2 presencia de áreas blancas como rojas |
| Bronquiectasia | 0 sin agrandamiento de las vías respiratorias 1 bronquio dilatado único 2 más de un bronquio dilatado |
| Prominencia de los vasos | 0 sin vasos visibles 1 vasos visibles, azules 2 vasos azules grandes y distendidos 3 vasos muy grandes, sobresalientes y tortuosos *estas puntuaciones se incrementan 1 punto si se observa pulsación en los vasos |
| Disminución del diámetro bronquial durante la expiración | 0 sin disminución 1 colapso leve 2 colapso moderado 3 colapso grave (broncomalacia) |
Tabla 2. Informe de inspección visual de broncoscopia9.
El broncoscopio se orienta hacia el bronquio seleccionado y se avanza hasta que se ajusta o bloquea la vía respiratoria. Manteniendo el lumen bronquial en el centro de la imagen, se introduce en forma de embolada solución salina estéril al 0.9 % a través del canal de trabajo, seguida por la instilación de una cantidad de aire suficiente que asegure el vaciado de todo el canal de succión. Alternativamente, el procedimiento se puede realizar utilizando un catéter de lavado que se pasa a través del canal de biopsia hacia las vías respiratorias más profundas y pequeñas5. La aspiración del líquido introducido se puede realizar manualmente con la jeringa, o utilizando un aspirador con una presión de succión, evitando una excesiva presión negativa que podría ocasionar el colapso de la vía aérea distal impidiendo la recuperación del líquido del lavado (Figura 7). Se ha visto que el porcentaje de líquido de lavado broncoalveolar recuperado es significativamente mayor cuando se utiliza una bomba de succión, aunque este factor no parece tener efecto sobre la tasa de diagnóstico definitivo alcanzado11.
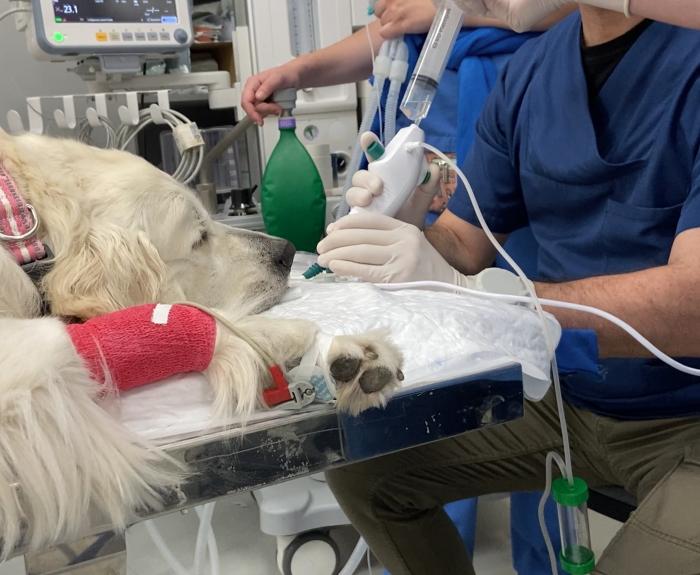
Figura 7. Realización de un lavado broncoalveolar con aplicación de solución salina estéril a través del canal de trabajo y trampa para aspirar secreciones en conector de succión para obtención de la muestra.
El LBA se puede realizar en cualquier territorio pulmonar. En pacientes con patología pulmonar localizada debe efectuarse en el segmento o lóbulo más afectado o de previsible mayor rendimiento (zona identificada en las pruebas de imagen previas). Cuando se trata de una enfermedad difusa cualquier zona podría ser idónea para realizar este estudio, pero de preferencia debería hacerse en dos localizaciones, recomendándose el lóbulo medio derecho y la porción caudal del lóbulo craneal izquierdo6,12,13. Asimismo se recomienda efectuar al menos dos lavados en cada localización, dado que el análisis del segundo lavado suele proporcionar un diagnóstico más preciso de enfermedades pulmonares, tanto inflamatorias como no inflamatorias y la primera alícuota suele mostrar mayor número de células epiteliales ciliadas en comparación con los muestreos subsiguientes6,14.
No existe acuerdo acerca de la cantidad de líquido o del número idóneo de alícuotas necesarias que permitan obtener datos significativos. La dosis de solución salina se determina según el tamaño del paciente, con recomendaciones que oscilan entre 5-30 ml por alícuota o de 2-5 ml/kg2. En un estudio en perros, se utilizó un volumen total de 15 a 75 ml por perro, dividido en dos o más alícuotas7. En un estudio de 68 gatos15, el volumen medio de líquido infundido fue entre 2.62 y 5.05 ml/kg, en alícuotas de 5-10 ml por sitio. Como recomendación general podemos utilizar un volumen por alícuota de 10-20 ml para perros y ~2 ml/kg para gatos6. El LBA puede ser considerado técnicamente aceptable si el líquido recuperado es igual o superior al 40 % del instilado y contiene escasas células epiteliales2.
El procedimiento no está exento de complicaciones, aunque en baja frecuencia. Entre las complicaciones potenciales del lavado broncoalveolar se encuentran la disminución de la saturación de oxígeno, el broncoespasmo y el neumotórax. Se aconseja suministrar oxígeno al 100 % tanto antes como tras la finalización de LBA. El broncoespasmo como complicación de la broncoscopia y el LBA se observa más comúnmente en gatos y la premedicación con un broncodilatador puede reducir esta complicación13,15,16 (Figura 8).
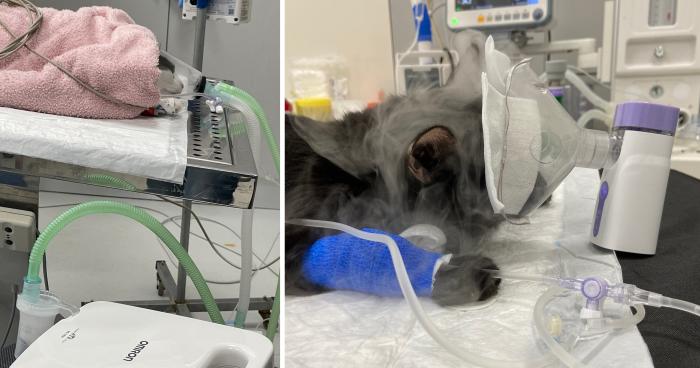
Figura 8. En gatos se recomienda el uso de broncodilatadoras previo al estudio broncoscópico para evitar el broncoespasmo. En la imagen modos de nebulización de broncodilatador (salbutamol).
Manejo de las muestras obtenidas
El líquido obtenido es ligeramente turbio, dependiendo de la cantidad de material celular y no celular en suspensión, y con una capa espumosa en la parte superior, representativa del surfactante5. Un aumento en la turbidez y el cambio de color suelen estar asociados con cantidades incrementadas de mucosidad y/o células (Figura 9). Si la muestra adquiere tintes rojizos, es probable que exista algún grado de hemorragia espontánea o inducida por el procedimiento.

Figura 9. Detalle de las muestras obtenidas a través del lavado broncoalveolar: es visible la presencia de espuma en la superficie del líquido, indicativa del surfactante contenido en la muestra, así como la turbidez del líquido, que denota un significativo retorno celular. La primera muestra se destinará al análisis de cultivo, mientras que la segunda se examinará citológicamente.
El líquido obtenido puede evaluarse citológica y microbiológicamente. Las muestras para cultivo pueden enviarse en un tubo estéril o en hisopo con medio de cultivo, mientras que para su estudio citológico las muestras deben conservarse en EDTA. El análisis de la primera alícuota suele mostrar mayor número de células epiteliales ciliadas en comparación con los muestreos subsiguientes14. Por este motivo, es frecuente destinar esta primera alícuota a cultivos microbiológicos, mientras que todas las restantes, se procesan mezcladas en un solo pool.
La muestra debe procesarse de inmediato, el LBA no debe almacenarse durante más de 8 horas o a altas temperaturas, ya que estos factores se asocian con una reducción significativa de los recuentos de células totales y la calidad de la morfología celular (Figura 10). Se recomienda, sea para revisión en el propio centro o para su envío a laboratorio externo, preparar algunos frotis directos o con técnicas de concentración en los 30 minutos siguientes a la obtención de la muestra4. Para obtener los mejores resultados, se recomienda el uso de una citocentrífuga3, pero otra opción, al alcance de todos, es utilizar el sedimento tras centrifugación a 500-1000 rpm durante 5 minutos o emplear métodos de concentración caseros (Figura 11). En gatos se ha visto que el almacenamiento puede provocar alteración del diagnóstico citológico en un rango del 31 al 57 % de las muestras y la morfología celular experimenta una modificación significativa en todas las muestras almacenadas. Es por esto que en caso de que no sea posible evitar un retraso en el análisis, se prefiere el almacenamiento a 4 °C en lugar de a temperatura ambiente17.
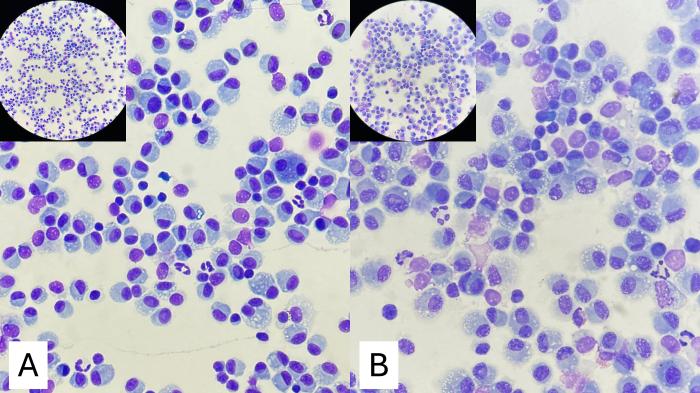
Figura 10. Misma muestra procesada mediante cámara de concentración (A) de forma inmediata y (B) tras 24 horas. Se aprecia hinchamiento celular, pérdida de nitidez de bordes citoplasmáticos y cambios en la compactación de la cromatina nuclear.
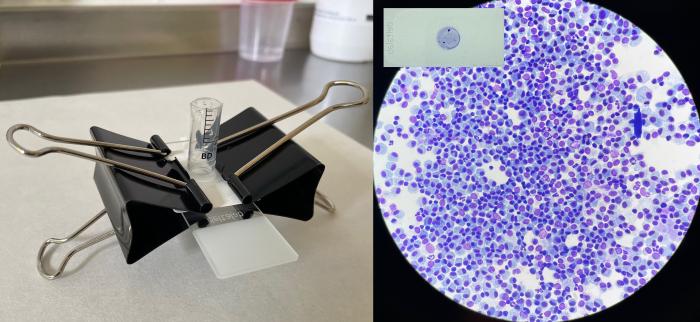
Figura 11. Construcción de una cámara de sedimentación casera: Colocar el cono de una jeringa invertida sobre un portaobjetos, alineado con un papel de filtro que tenga un orificio central. Depositar 0.5 ml de fluido en el cono y permitir la sedimentación durante 25 minutos. La muestra resultante, de forma circular, se dejará secar al aire libre y posteriormente se procederá a teñirla con una tinción de tipo Romanowsky, como por ejemplo, Diff-Quick.
Evaluación laboratorial
Los procedimientos citológicos de aplicación clínica habitual incluyen el recuento diferencial de los diferentes tipos celulares presentes y la visualización de agentes infecciosos.
Recuento total de células nucleadas
El recuento total de células nucleadas no se informa debido a que es probable que sea inexacto, tanto con métodos manuales como automatizados, a causa del moco que provoca la aglutinación de las células (Figura 12), dificultando o imposibilitando su conteo4. Además, otro factor confusor y causante de variabilidad es el hecho de que el recuento celular depende en gran medida de la técnica de muestreo utilizada para recolectar la muestra (cantidad de líquido instilado, el número de alícuotas, método de recuperación, técnica de concentración).
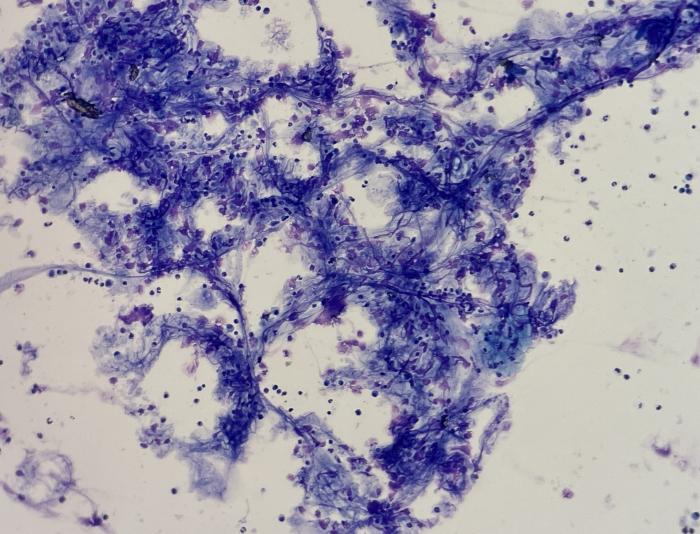
Figura 12. Muestra obtenida mediante lavado broncoalveolar: la presencia de abundante mucosidad conduce a la aglutinación celular, lo que complica tanto el conteo como la evaluación morfológica de las células.
Recuento diferencial de células nucleadas
El recuento diferencial de células nucleadas es más relevante tanto para fines diagnósticos como clínicos y se basa en contar al menos 200 células, aunque idealmente se sugieren 500 células18. Solo se consideran los leucocitos, las células epiteliales se excluyen y se evalúan por separado de manera semicuantitativa (ausentes, pocas, cantidad pequeña/moderada/alta).
Existen factores que pueden afectar el recuento diferencial de células nucleadas. Estos están relacionados con el tipo de muestra y sus técnicas de recolección:
- La alícuota de muestra analizada: la primera alícuota suele contener más neutrófilos.
- Tipo de preparación citológica: las muestras de citocentrifugado contienen menos linfocitos.
- Retraso en la preparación de la muestra: los neutrófilos y eosinófilos parecen disminuir en muestras envejecidas.
- Edad del paciente: los perros más jóvenes tienen significativamente más neutrófilos que los perros de mediana edad y viejos, así como más linfocitos que los perros de mediana edad9.
En la evaluación citológica del tracto respiratorio y el parénquima pulmonar, se identifica una variedad limitada de tipos celulares, entre los que destacan: macrófagos alveolares, neutrófilos, linfocitos, eosinófilos, mastocitos, eritrocitos y epitelio bronquial provisto de cilios. Adicionalmente, es posible hallar células plasmáticas, epitelio escamoso y células caliciformes en determinadas muestras. Asimismo, se puede detectar señales de contaminación oral, como la presencia de Conchiformibius spp y epitelio escamoso colonizado por una diversidad de bacterias, lo cual puede alterar la interpretación de la muestra19 (Figura 13).
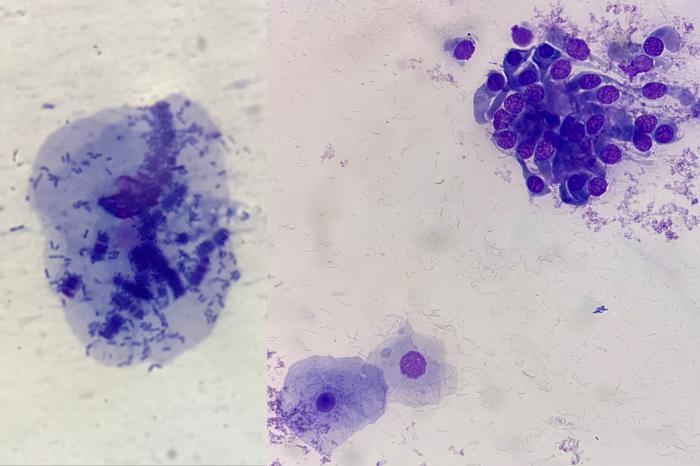
Figura 13. La presencia de Conchiformibius spp (izquierda) y/o células de epitelio escamoso (derecha) sugieren contaminación orofaríngea, y se debe tener precaución al interpretar cualquier resultado del LBA. Conchiformibius spp se caracteriza por su división longitudinal y su disposición en filas paralelas, lo que puede confundirse con una bacteria de mayor tamaño. Obsérvese en la imagen izquierda la presencia de cilios rotos dispersos en el fondo de la preparación.
Cada técnica de muestreo presenta variabilidad en la composición de la muestra y, debido a que las células obtenidas provienen de distintas partes de las vías respiratorias, cada método requiere criterios de evaluación específicos que reflejan las diferencias esperadas entre estos procedimientos1.
- Las muestras obtenidas de las vías aéreas superiores, como el lavado traqueobronquial, reflejan predominantemente la presencia de epitelio columnar ciliado, característico de estas grandes vías (Figura 14). Por lo tanto, es habitual encontrar en el LTB una mayor cantidad de estas células en comparación con las muestras de LBA. Durante la preparación de las muestras, si las células sufren algún tipo de traumatismo, pueden presentar daños y perder sus cilios, los cuales pueden observarse dispersos en el fondo y ser confundidos con bacterias. Además, es común que las muestras de LTB contengan una cantidad significativa de residuos y moco.
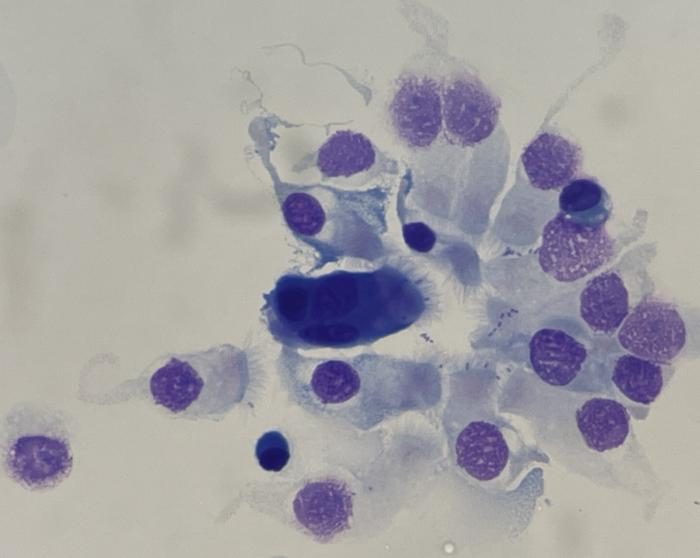
Figura 14. Detalle del epitelio traqueal ciliado, donde se observan estructuras con morfología cocobacilar adheridas a los cilios de las células columnares. El análisis de cultivo confirmó la presencia de Bordetella spp.
- En la citología obtenida mediante cepillado, las células principales son el epitelio columnar ciliado, que se organiza en hileras o agrupaciones de tres a cuatro células. En ocasiones es posible ver células inflamatorias, células caliciformes y algún mastocito. En estas preparaciones, generalmente no se identifican macrófagos alveolares, ya que esta técnica no recupera células de las vías respiratorias inferiores (Figura 15). Una ventaja de este método es que puede permitir la identificación de células inflamatorias que se encuentran únicamente dentro de la mucosa de las vías respiratorias o adheridas al epitelio de las vías respiratorias. En este sentido un estudio mostró que la mayoría de los perros con tos que no tenían inflamación neutrofílica en el LBA tenían inflamación neutrofílica en los cepillados bronquiales. Por lo tanto, parece que la evaluación citológica de los CB pudiera ser un indicador más sensible de inflamación bronquial que la evaluación citológica del líquido de LBA7.
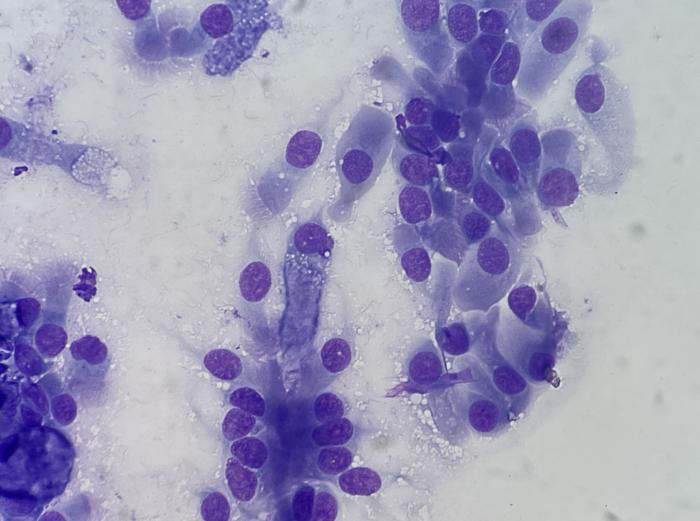
Figura 15. Detalle de citología obtenida mediante cepillado en la que se observa epitelio columnar y cuboidal ciliado.
- Los LBA caninos normales contienen mayoritariamente macrófagos alveolares (Figura 16) con escasos neutrófilos, eosinófilos y mastocitos. En comparación con las muestras caninas, es habitual que las muestras felinas normales presenten una cantidad significativamente mayor de eosinófilos. Los eritrocitos y las células epiteliales deben encontrarse en números muy bajos, especialmente si la broncoscopia fue atraumática. Las células caliciformes y las espirales de Curschmann son raramente observadas, mientras que el moco puede aparecer como material amorfo de coloración variable. También es posible hallar artefactos como gránulos de almidón, generalmente derivados del polvo de los guantes utilizados en el procedimiento. Por su parte un excesivo número de células ciliadas o escamosas epiteliales son indicativos de contaminación por el material bronquial u oral, lo que indica que el espécimen puede no ser representativo de las porciones más profundas.
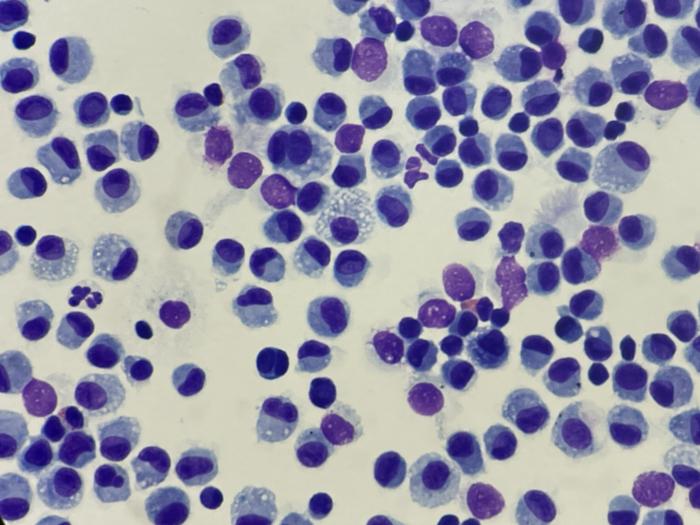
Figura 16. En las muestras de lavado broncoalveolar procedentes de animales clínicamente sanos, los macrófagos alveolares constituyen frecuentemente el tipo celular más abundante. Su presencia confirma que la muestra ha lavado los espacios alveolares de manera efectiva, sirviendo como indicador de calidad. Estos macrófagos presentan un núcleo redondeado o reniforme, ubicado excéntricamente, y un citoplasma granular azul-grisáceo abundante. Al activarse, el citoplasma se torna más prominente y vacuolado (apariencia espumosa) y puede incluir material fagocitado.
Identificación de agentes infecciosos
El cultivo o reacción en cadena de la polimerasa para agentes infecciosos pueden utilizarse para caracterizar mejor una infección observada en la citología o para investigar la posibilidad de una infección bacteriana, viral o fúngica cuando se observa un aumento en el número de células inflamatorias en la citología, pero no se detectan microorganismos19,20.
Hay disponibles otras pruebas complementarias de diagnóstico en función del agente infeccioso. Por ejemplo, el diagnóstico de Angiostrongylus vasorum, en perros, o Aelurostrongylus abstrusus, en gatos, se puede lograr mediante pruebas fecales utilizando la técnica de Baermann (Figura 17).
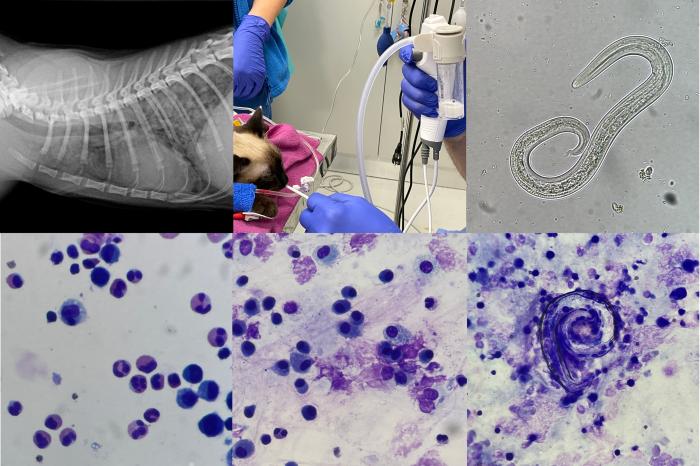
Figura 17. Detalle de un lavado broncoalveolar en un paciente felino con disnea y cambios radiográficos notables. En el fluido de lavado se observan larvas, las cuales fueron e identificadas en la muestra húmeda como Aelurostrongylus abstrusus.
Interpretación
La interpretación de las muestras traqueales y de lavado broncoalveolar se basa en el análisis del tipo, número y proporción de células obtenidas. Estos datos, en conjunto con los resultados clínicos, radiográficos y de otras pruebas de imagen, son fundamentales para contribuir a la formulación de un diagnóstico definitivo.
Los patrones comúnmente identificados1,3,4 son los siguientes:
Muestra no representativa o no diagnóstica
Esta categoría está compuesta por muestras en las que no se obtiene material celular en número adecuado, o el material está distorsionado de manera artefactual por sangre, mala conservación o artefactos de procesamiento de tal manera que no se puede emitir un diagnóstico. Incluidas en esta categoría están las muestras de LBA compuestas exclusivamente de epitelio respiratorio que indican que no se ha alcanzado el espacio alveolar de forma eficiente, y todas aquellas con presencia de células epiteliales escamosas, bacterias y Conchiformibius spp que indican la contaminación orofaríngea de la muestra.
Hallazgos citológicos normales
Los valores de corte de todas las poblaciones celulares no se han estandarizado para muestras de lavado traqueal. El lavado broncoalveolar es la única técnica de muestreo pulmonar para la cual se han establecido y estandarizado recuentos celulares diferenciales normales, y aunque se ha observado cierta variabilidad ésta no es tan amplia.
La citología normal se caracteriza principalmente por macrófagos (80 %). En perros sanos, se acepta un máximo de 7 % de linfocitos, 5 % de neutrófilos, 6 % de eosinófilos, 1 % de mastocitos y 1 % de células epiteliales. En gatos sanos, la composición incluye igualmente macrófagos, con hasta un 5 % de linfocitos, 7 % de neutrófilos y 16 % de eosinófilos21.
Incremento de células inflamatorias
La interpretación de la relevancia clínica del incremento de células inflamatorias (Tablas 3 y 4) es un proceso complejo.
| - | Perro | Gato |
|---|---|---|
| Macrófagos | 70-80 % | 70-80 % |
| Linfocitos | < 11 % (puede llegar a 17 %) | < 5 % |
| Eosinófilos | < 5 % (puede llegar al 11 %) | < 7 % (puede llegar al 23 %) |
| Neutrófilos | < 5 % (raramente hasta 20 %) | < 7 % (raramente hasta 20 %) |
| Mastocitos | < 2 % | < 2 % |
Tabla 3. Porcentajes esperados en el lavado broncoalveolar de los diferentes tipos celulares en perros y gatos sanos3.
| - | Causas | Diferencial |
|---|---|---|
| Neutrofílica |
|
|
| Macrofágica (cambios reactivos) |
|
|
| Linfocítica |
|
|
| Eosinofílica |
|
|
Tabla 4. Patrones inflamatorios y sus posibles relaciones etiológicas3.
Esta complejidad se debe a la capacidad limitada de respuesta de órganos específicos frente a distintos tipos de agresiones, la presencia de procesos inflamatorios secundarios y la considerable variabilidad de los valores citológicos en individuos sanos. Sin embargo, al analizar la respuesta inflamatoria del LBA y cotejarla con otros datos clínicos disponibles, como la evolución de los síntomas y los patrones observados en radiografías, se facilita mucho la priorización de posibles diagnósticos diferenciales y se considera que en el 25 % de los casos, la citología del líquido LBA permite alcanzar un diagnóstico definitivo13.
La inflamación aguda de tipo neutrofílico se caracteriza por una predominancia de neutrófilos (Figura 18), los cuales pueden mostrar cambios degenerativos. Estas células mantienen una morfología similar a la que poseen en la sangre periférica y es infrecuente encontrar formas hipersegmentadas.
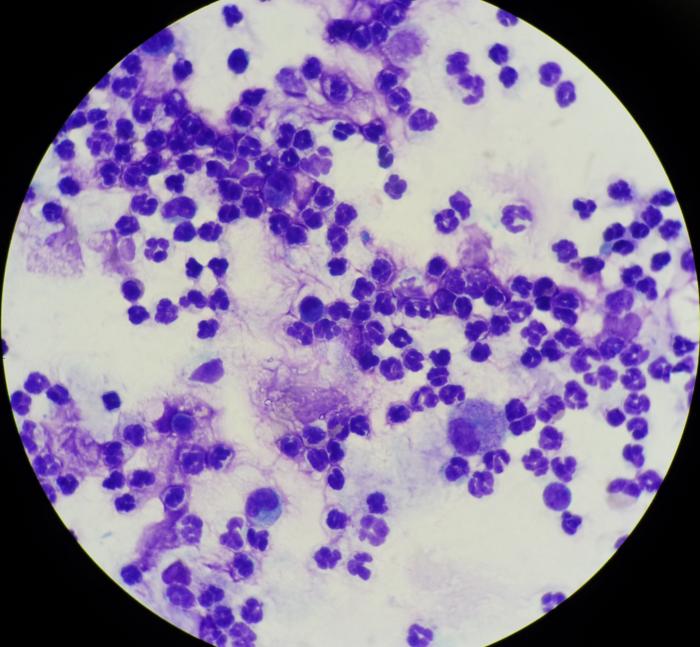
Figura 18. Los neutrófilos en el moco bronquial tienen una apariencia similar a los neutrófilos del sangre periférica, pero pueden mostrar cambios degenerativos o estar rotos por el efecto de la recolección y preparación.
Cuando los neutrófilos están aumentados, es importante examinar con detalle la presencia de bacterias (en particular intracelulares) y agentes infecciosos en general (Figura 19).
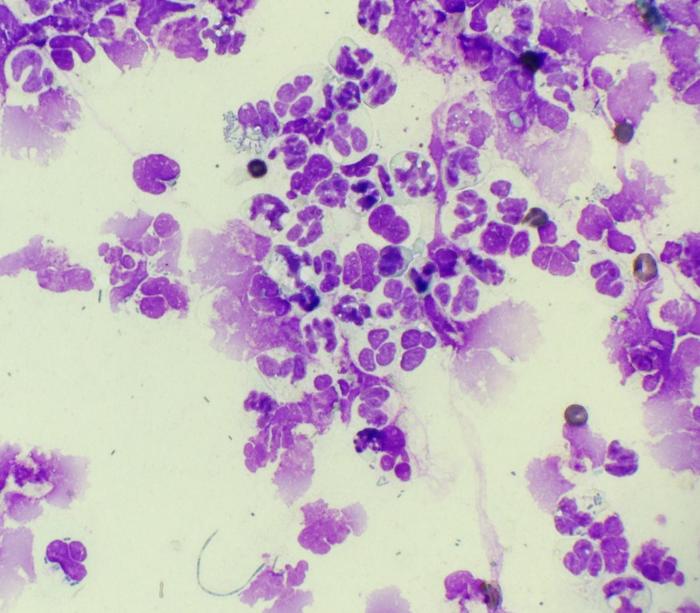
Figura 19. La imagen muestra una marcada respuesta inflamatoria neutrofílica. Se observan microorganismos tanto en el fondo de la preparación como intracitoplasmáticos.
Su presencia indica una infección, pero su ausencia no puede descartarla, ya que la citología no es tan sensible como el cultivo y/o PCR20.
La inflamación neutrofílica aguda se puede clasificar en dos categorías: séptica y no séptica, dependiendo de si se detectan bacterias intracelulares. Entre las causas sépticas se encuentran la neumonía bacteriana, la neumonía por aspiración o una infección bacteriana secundaria. Las posibles causas de una inflamación no séptica incluyen infecciones no bacterianas, tales como fúngicas, rickettsiales y protozoarias, además de la bronquitis crónica y el aumento de neutrófilos por lavados bronquiales repetidos.
La inflamación crónica activa (mixta) se diagnostica en base a un aumento en el número de neutrófilos y macrófagos activados, y puede observarse en condiciones infecciosas, no infecciosas o neoplásicas. El número de neutrófilos está aumentado en casi todas las enfermedades (infecciosas y no infecciosas) que causan inflamación. Los macrófagos activados pueden estar fagocitando restos, organismos o eritrocitos (Figura 20).
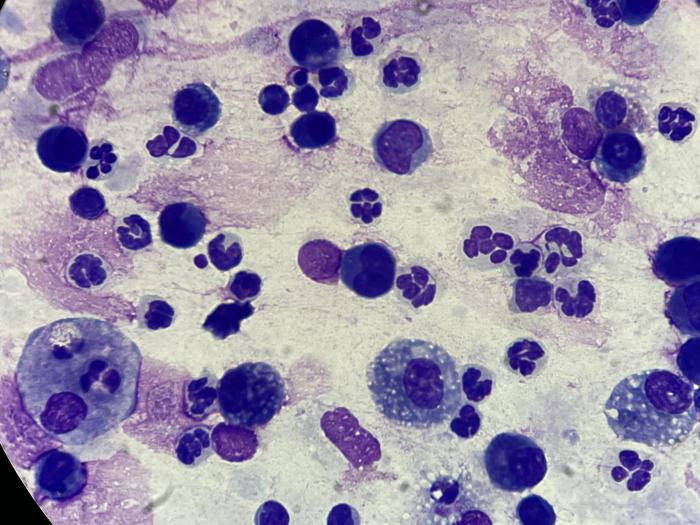
Figura 20. Se observa un aumento en la cantidad de neutrófilos, junto con la presencia de macrófagos. Algunos macrófagos evidencian signos de activación, caracterizados por un citoplasma extenso y espumoso, así como fenómenos de leucofagocitosis.
Las infecciones fúngicas respiratorias (blastomicosis, histoplasmosis o coccidioidomicosis) pueden asociarse con este tipo de inflamación.
La inflamación crónica se evidencia por un incremento en el número de macrófagos activados (citoplasma amplio, de aspecto espumoso y vacuolado), acompañados de una menor cantidad de neutrófilos, linfocitos reactivos y células plasmáticas. Aunque es común encontrar una subpoblación de macrófagos con estas características en las muestras de LBA, un predominio de ellos apunta a una condición más allá de lo habitual21 y puede ser causado por varias patologías, como la bronquitis crónica, neoplasias e infecciones.
La inflamación eosinofílica se diagnostica por un aumento en el número de eosinófilos y puede estar asociada con un incremento en el número de mastocitos. Los eosinófilos tienen gránulos que pueden parecer de color rojo oscuro a marrón (en contraste con el rojo anaranjado brillante en las preparaciones sanguíneas) y núcleos más segmentados que los neutrófilos. Al examinar las muestras, los gránulos de eosinófilos pueden estar presentes en el fondo y es importante no confundirlos con bacterias (Figura 21).
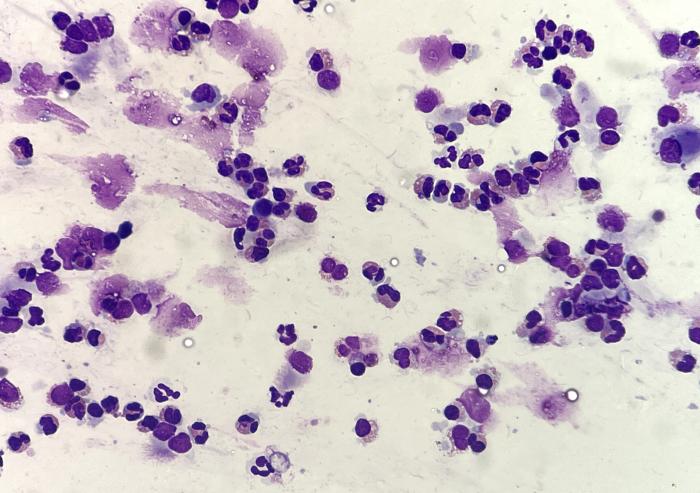
Figura 21. Un aumento en el número de eosinófilos indica una reacción de hipersensibilidad que puede ser alérgica o parasitaria. En algunas muestras de lavado es difícil distinguir los eosinófilos de los neutrófilos, especialmente en áreas donde las células no están bien extendidas y en muestras exudativas en las cuales el citoplasma de los neutrófilos se tiñe de un color eosinofílico difuso e irregular.
Los mastocitos se pueden distinguir fácilmente de los eosinófilos por sus grandes gránulos metacromáticos y núcleos redondos a ovales centralmente ubicados cuando son visibles. Es importante recordar que las vías respiratorias felinas normales tienen un recuento de eosinófilos más alto que el de los perros, y esto no debe confundirse con la enfermedad pulmonar eosinofílica.
La inflamación eosinofílica frecuentemente está causada por etiologías infecciosas como parásitos (Aelurostrongylus, Angiostrongylus, Capillaria spp, Dictyocaulus, Dirofilaria, Filaroides), por ello es importante examinar la muestra a bajo aumento en busca de larvas o huevos (Figuras 22 y 23), teniendo presente que su ausencia no es suficiente para descartar el parasitismo de la lista de diagnósticos diferenciales y se suele requerir de pruebas adicionales22,23. La presencia de eosinófilos también puede ser una parte destacada en la respuesta inflamatoria frente a enfermedades bacterianas y fúngicas. Otras causas reportadas incluyen infiltrado pulmonar eosinofílico, asma/bronquitis felina y neoplasias.
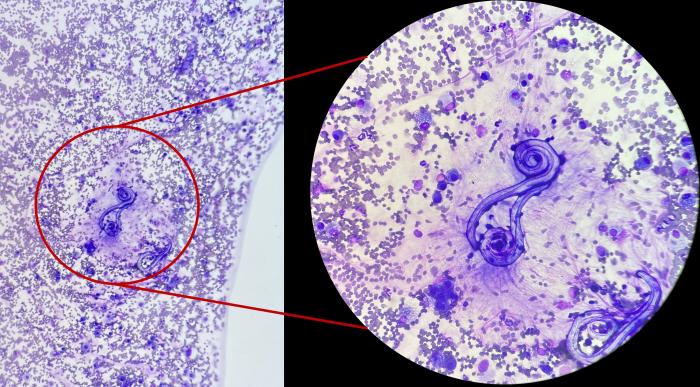
Figura 22. Larvas de parásito pulmonar (Aelurostrongylus spp), abundante componente hemático (presente en las secreciones bronquiales) y células inflamatorias dispersas. La citología no siempre muestra detalle suficiente para especificar la especie, por ello se prefiere la confirmación por test de antígeno o preparaciones húmedas del propio lavado
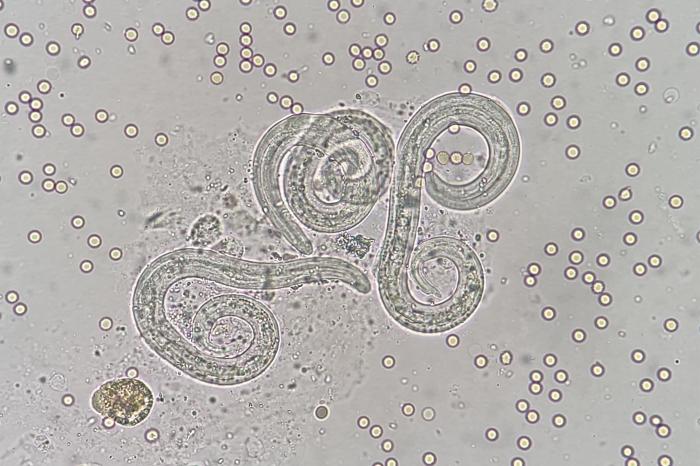
Figura 23. Muestra en fresco del lavado broncoalveolar del caso anterior. La preparación en húmedo permite un mejor detalle de la morfología larvaria. Las larvas de Angiostrongylus vasorum se caracterizan por su curvatura y una espina dorsal en el extremo distal.
Hemorragia
La hemorrágica se puede dividir en aguda y crónica, y se diagnostica cuando hay un aumento de eritrocitos. Un número aumentado de eritrocitos no fagocitados indica una hemorragia aguda que probablemente sea iatrogénica. Los macrófagos que contienen eritrocitos fagocitados, cristales de hematoidina o partículas de hemosiderina (apariencia verde o marrón dorado) proporcionan evidencia de hemorragia crónica. La presencia de hemorragia crónica puede estar asociada con diversas condiciones que causan daño vascular o diapédesis eritrocitaria en el pulmón, incluyendo trauma, presencia de cuerpos extraños, coagulopatías, tromboembolismo, infecciones tanto bacterianas como fúngicas, neumonía por aspiración, hipertensión pulmonar, insuficiencia cardíaca congestiva y neoplasias.
Neoplasia
La neoplasia primaria (linfoma, carcinomas, sarcomas, histiocitosis maligna) o metastásica puede identificarse ocasionalmente mediante LBA. El rendimiento depende en gran medida de la ubicación del tumor (afectación de árbol bronquial frente localización intersticial típica de los procesos metastáticos) y la calidad de la muestra obtenida (Figura 24).
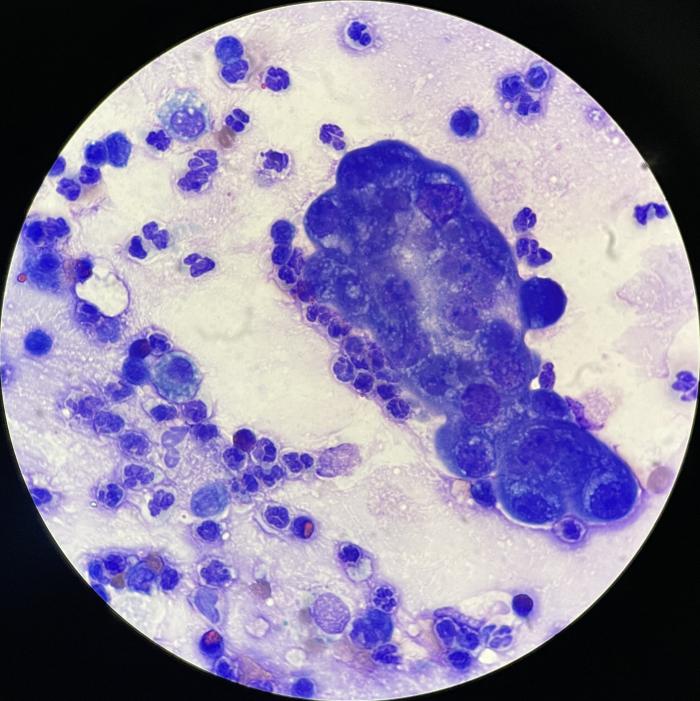
Figura 24. Muestra tomada mediante lavado broncoalveolar en el que observa presencia de grupo celular denso de aspecto epitelial y con atipias altamente sugerentes de neoplasia epitelial maligna
Cuando se observan células neoplásicas suelen ser carcinomas o linfomas. Hay que prestar atención a la evaluación de los criterios nucleares y citoplasmáticos de malignidad, como la anisocitosis, anisocariosis y nucleolos múltiples y prominentes, pues puede resultar complicado en muestras con alta densidad celular, donde además existe el riesgo de confundir el epitelio respiratorio hiperplásico o reactivo con tejido neoplásico.
No disponemos de estudios específicos que evalúen utilidad del LBA en el diagnóstico de neoplasias malignas pulmonares, pero en medicina humana se ha visto que la citología del LBA tiene un alto rendimiento diagnóstico (64.8 %), comparable a la biopsia de aspiración con aguja transbronquial, y puede coincidir con el diagnóstico de tejido en un 36 % de los casos, también se informa que la citología de cepillado pudiera tener mayor sensibilidad y especificidad que la citología de LBA24.
Bibliografía
1. McCullough, S. & Brinson, J. Collection and interpretation of respiratory cytology. Clin Tech Small Anim Pract 14, 220–226 (1999).
2. Tekla M. Lee-Fowler. Transtracheal Wash and Bronchoscopy. in Ettinger’s Textbook of Veterinary Internal Medicine (eds. Stephen J. Ettinger, Edward C. Feldman & Etienne Cote) (Elsevier, 2023).
3. Francesco Cian. Respiratory Tract Fluids. in Differential Diagnosis of Body Fluids in Small Animal Cytology 21–84 (CABI, GB, 2023). doi:10.1079/9781789247787.0002.
4. Di Terlizzi, R., English, K., Cowell, R. L., Tyler, R. D. & Meinkoth, J. H. Transtracheal and Bronchoalveolar Washes. in Cowell and Tyler’s Diagnostic Cytology and Hematology of the Dog and Cat 247–268 (Elsevier, 2020). doi:10.1016/B978-0-323-53314-0.00016-X.
5. Levitan, D. M. & Kimmel, S. Flexible endoscopy: respiratory tract. in BSAVA Manual of Canine and Feline Endoscopy and Endosurgery 97–111 (British Small Animal Veterinary Association, 2020). doi:10.22233/9781910443620.7.
6. McKiernan, B. C. Bronchoscopy. in Veterinary Endoscopy for the Small Animal Practitioner 195–215 (Wiley, 2021). doi:10.1002/9781119155904.ch5.
7. Hawkins, E. C., Rogala, A. R., Large, E. E., Bradley, J. M. & Grindem, C. B. Cellular composition of bronchial brushings obtained from healthy dogs and dogs with chronic cough and cytologic composition of bronchoalveolar lavage fluid obtained from dogs with chronic cough. Am J Vet Res 67, 160–167 (2006).
8. Creevy, K. E. Airway evaluation and flexible endoscopic procedures in dogs and cats: laryngoscopy, transtracheal wash, tracheobronchoscopy, and bronchoalveolar lavage. Vet Clin North Am Small Anim Pract 39, 869–880 (2009).
9. Mercier, E. et al. Influence of age on bronchoscopic findings in healthy beagle dogs. The Veterinary Journal 187, 225–228 (2011).
10. Peeters, D. E., McKiernan, B. C., Weisiger, R. M., Schaeffer, D. J. & Clercx, C. Quantitative bacterial cultures and cytological examination of bronchoalveolar lavage specimens in dogs. Journal of veterinary internal medicine / American College of Veterinary Internal Medicine 14, (2000).
11. Woods, K. S. et al. Comparison of manual and suction pump aspiration techniques for performing bronchoalveolar lavage in 18 dogs with respiratory tract disease. J Vet Intern Med 28, 1398–1404 (2014).
12. Ybarra, W. L., Johnson, L. R., Drazenovich, T. L., Johnson, E. G. & Vernau, W. Interpretation of Multisegment Bronchoalveolar Lavage in Cats (1/2001–1/2011). J Vet Intern Med 26, 1281–1287 (2012).
13. Hawkins, E. C., DeNicola, D. B. & Plier, M. L. Cytological Analysis of Bronchoalveolar Lavage Fluid in the Diagnosis of Spontaneous Respiratory Tract Disease in Dogs: A Retrospective Study. J Vet Intern Med 9, 386–392 (1995).
14. Rennard, S. I. et al. Fractional Processing of Sequential Bronchoalveolar Lavage to Separate Bronchial and Alveolar Samples. American Review of Respiratory Disease 141, 208–217 (1990).
15. Johnson, L. R. & Drazenovich, T. L. Flexible bronchoscopy and bronchoalveolar lavage in 68 cats (2001-2006). J Vet Intern Med 21, 219–25 (2007).
16. Bianco, Z. et al. Risk Factors and Outcomes in Dogs With Respiratory Disease Undergoing Diagnostic Airway Lavage. Front Vet Sci 7, (2020).
17. Nafe, L. A., DeClue, A. E. & Reinero, C. R. Storage alters feline bronchoalveolar lavage fluid cytological analysis. J Feline Med Surg 13, 94–100 (2011).
18. De Lorenzi, D., Masserdotti, C., Bertoncello, D. & Tranquillo, V. Differential cell counts in canine cytocentrifuged bronchoalveolar lavage fluid: a study on reliable enumeration of each cell type. Vet Clin Pathol 38, 532–536 (2009).
19. Foster, S. F., Martin, P., Braddock, J. A. & Malik, R. A retrospective analysis of feline bronchoalveolar lavage cytology and microbiology (1995–2000). J Feline Med Surg 6, 189–198 (2004).
20. Johnson, L. R., Queen, E. V., Vernau, W., Sykes, J. E. & Byrne, B. A. Microbiologic and Cytologic Assessment of Bronchoalveolar Lavage Fluid from Dogs with Lower Respiratory Tract Infection: 105 Cases (2001–2011). J Vet Intern Med 27, 259–267 (2013).
21. Hawkins, E. C., DeNicola, D. B. & Kuehn, N. F. Bronchoalveolar Lavage in the Evaluation of Pulmonary Disease in the Dog and Cat: State of the Art. J Vet Intern Med 4, 267–274 (1990).
22. Crisi, P. E. et al. Evaluation of Bronchoscopy and Bronchoalveolar Lavage Findings in Cats With Aelurostrongylus abstrusus in Comparison to Cats With Feline Bronchial Disease. Front Vet Sci 6, (2019).
23. Barçante, J. M. P. et al. Cytological and parasitological analysis of bronchoalveolar lavage fluid for the diagnosis of Angiostrongylus vasorum infection in dogs. Vet Parasitol 158, 93–102 (2008).
24. Zaidi, A. et al. Role of bronchoalveolar lavage in diagnosing pulmonary infections and malignancies: Experience from a tertiary care center. Diagn Cytopathol 48, 1290–1299 (2020).
 by Multimédica
by Multimédica