Utilidad de la Troponinas tipo I ultrasensible como biomarcador en enfermedades cardiacas y no cardiacas
Resumen breve
La troponina tipo I es un biomarcador utilizado para la valoración del daño miocárdico tanto en enfermedades cardiacas como no cardiacas. Su uso en medicina humana está ampliamente documentado, siendo de gran utilidad en la toma de decisiones en patologías como infartos de miocardio agudo y pacientes críticos en general. En medicina veterinaria se han realizado numerosos estudios para establecer valores de referencias tanto en el perro como en el gato sanos y determinar sus alteraciones en…Índice de contenidos
Resumen
La troponina tipo I es un biomarcador utilizado para la valoración del daño miocárdico tanto en enfermedades cardiacas como no cardiacas. Su uso en medicina humana está ampliamente documentado, siendo de gran utilidad en la toma de decisiones en patologías como infartos de miocardio agudo y pacientes críticos en general. En medicina veterinaria se han realizado numerosos estudios para establecer valores de referencias tanto en el perro como en el gato sanos y determinar sus alteraciones en determinadas enfermedades cardiacas, como la degeneración de la válvula mitral, la cardiomiopatía dilatada, la cardiomiopatía hipertrófica y afecciones cardiacas infecciosas/inflamatorias tales como endocarditis o miocarditis, pero también en otro tipo de patologías como dilatación – torsión gástrica, piometra y varios tipos de tumores. Aunque hoy en día siguen siendo necesario más estudios, se han convertido en un marcador sensible y específico de daño miocárdico de gran utilidad, sobre todo, como factor pronóstico. El objetivo principal de este artículo es realizar una revisión bibliográfica sobre algunos de los estudios más relevantes en cuanto a la utilidad de la determinación de la troponina tipo I en las principales enfermedades cardiacas y en numerosas alteraciones sistémicas que afectan al perro y el gato. Como conclusión, aunque la troponina tipo I parece no tener una clara utilidad diagnóstica y siempre debe ser acompañada de otras pruebas diagnósticas, sí que se presenta como una herramienta útil a la hora de abordar terapias más agresivas y aporta información sobre el pronóstico de nuestros pacientes en un gran número de patologías.
Introducción
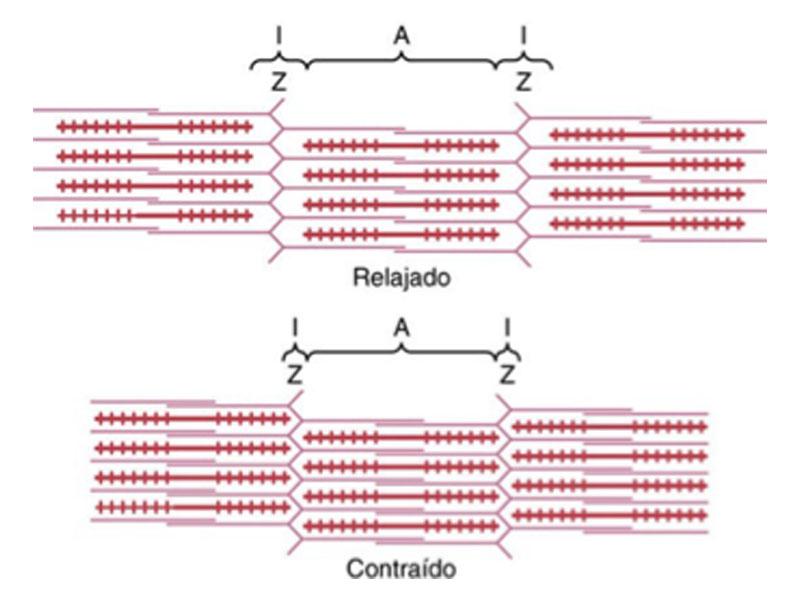
El músculo miocardio está formado por células conocidas como miocitos. Cada miocito está formado por múltiples miofibrillas dispuestas en paralelo. Las miofibrillas consisten en una serie lineal de sarcómeros que tienen función contráctil y unen las células unas con otras. El sarcómero a su vez está formado por dos tipos de proteínas filamentosas. Los filamentos finos de actina, cada uno formado por una doble hélice de monómeros de actina, se disponen desde los discos Z hasta el final de los sarcómeros, mientras que los filamentos gruesos de miosina se disponen desde el centro del sarcómero hasta entrelazarse con los filamentos de actina. Los filamentos de miosina contienen una serie de moléculas de miosina, cada una de ellas formada por una cola helicoidal y dos cabezas globulares. Durante la contracción muscular, las cabezas globulares interactúan con los filamentos de actina traccionando de los filamentos finos a lo largo de los filamentos gruesos y acortando el sarcómero (Figura 1). Durante la relajación muscular, los lugares de interacción actina-miosina están bloqueados por la proteína tropomiosina. La troponina está formada por 3 subunidades que conjuntamente funcionan como activadores e inhibidores de la contracción de los miocitos. La troponina cardiaca T (cTNT) se encargar de desplazar la tropomiosina liberando así el lugar de unión actina - miosina. Las otras dos subunidades son responsables de la inhibición y de la activación de la contracción mediada por el calcio y el ATP. En ausencia de calcio, la troponina tipo I (cTNI), la unidad inhibitoria, inhibe la hidrolisis del ATP necesaria para la interacción entre la actina y la miosina. Por su parte, la troponina C (cTNC) interacciona con el calcio permitiendo la contracción muscular (Figura 2).
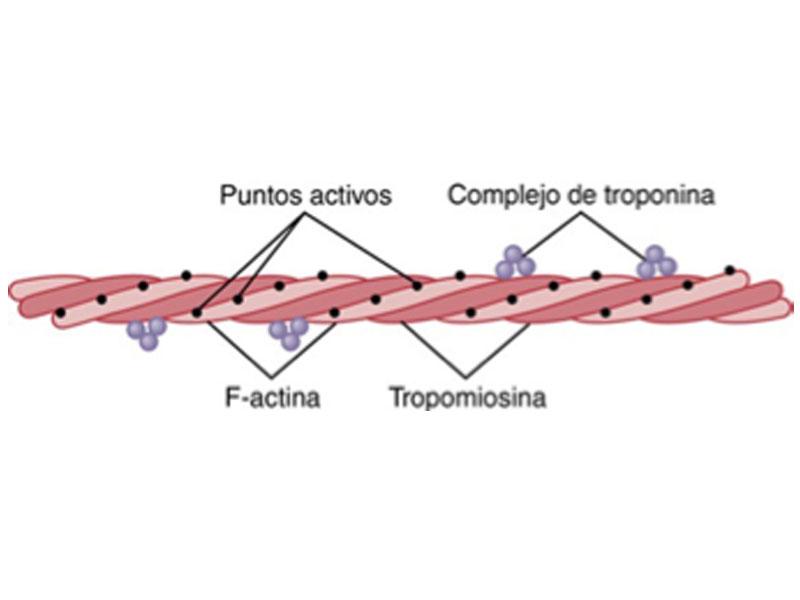
Las subunidades I y T de la troponina tienen isoformas específicas para el músculo cardiaco y esquelético mientras que la subunidad C de la troponina tiene una isoforma homóloga para ambos tejidos lo que la hace menos sensible como biomarcador cardiaco. La isoforma cardiaca de la troponina C comparte más de un 50% de similitud con la isoforma del músculo esquelético mientras que la isoforma cardiaca de la troponina I comparte menos del 50% de similitudes con la isoforma esquelética y además, contiene un péptido N-terminal único, que no se expresa en la isoforma esquelética en estados de enfermedad y que es específicamente cardiaco, lo que la convierte en la subunidad más específica. Por lo tanto, de ahora en adelante, siempre que hablemos de la troponina, nos estaremos refiriendo a la cTNI.
La troponina es una proteína intracelular exclusivamente, su presencia en la circulación muestra la salida de contenido intracelular de los miocitos. La mayoría de la troponina de la célula se encuentra anclada al aparato contráctil mientras que una pequeña parte de ella se encuentra libre en el citosol. Cuando se destruye un cardiomiocito, la porción que se encuentra en el citosol sale rápidamente provocando un temprano aumento de la troponina circulante. Esto va seguido de una lenta salida de la porción que se encuentra anclada al aparato contráctil que provoca un aumento más marcado de la troponina circulantes a los días-semanas de producirse el daño. Por lo tanto, tras un daño cardiaco, se puede detectar un aumento de la troponina a las 2 – 3 horas del inicio del proceso y el pico de máxima elevación se observa entre las 18 y 24 horas tras el suceso.
Se cree que existen seis mecanismos responsables de la liberación de troponina que pueden producirse de forma individual o combinada. Tres de esos mecanismos (muerte celular, apoptosis y recambio celular) están relacionados con la muerte celular que provoca la liberación tanto de la troponina citosólica como estructural. Los otros tres mecanismos (aumento de la permeabilidad, proteólisis intracelular y formación de vesículas) producen la liberación de troponina citosólica sin que se produzca la muerte celular.
La troponina cardiaca circulante tiene muchas características de un biomarcador ideal: especificidad cardiaca, alta sensibilidad para las lesiones, presencia insignificante en la circulación de individuos sanos, alto rango dinámico, persistencia en la circulación varios días después de la lesión y correlación con la gravedad de la lesión. La cTNI son específicas del corazón, pero es importante tener en cuenta que no son específicas de la enfermedad. Por lo tanto, un aumento de su concentración circulante refleja una lesión miocárdica independientemente de su causa. Otro aspecto importante por resaltar es que la troponina no sustituye a un diagnóstico cardiaco avanzado (electrocardiografía y ecocardiografía) en la evaluación del corazón. La enfermedad cardiaca primaria leve no siempre da lugar a una lesión cardiaca, por lo que la exclusión de una enfermedad cardiaca debe seguir solo a un examen cardiaco completo1.
En lo relacionado a la medición de la cTNI, con la sensibilidad de los ensayos actuales, las concentraciones reales de troponina cardiaca en individuos sanos se están haciendo evidentes por lo que se recomienda una interpretación cuantitativa de su concentración, ya que estas tienen una gran correlación tanto con la gravedad de la enfermedad clínica2,3 como con el grado de lesión cardiaca observado histopatológicamente4. La mínima cantidad de troponina circulante en animales sanos probablemente sea debido al recambio normal de los miocitos. Varios factores pueden influir en los resultados del análisis de la troponina cardiaca. Los valores séricos y plasmáticos están significativamente correlacionados, pero se ha documentado una tendencia hacia concentraciones séricas ligeramente inferiores en perros. Sustancias en la sangre como las que se observan en la hemólisis, la lipemia, la fibrina, algunos tipos de anticuerpos o los complejos inmunitarios, pueden aumentar falsamente su concentración5. Los anticuerpos circulantes contra la troponina pueden causar una interferencia negativa6. Se ha observado un aumento moderado de las concentraciones de troponina circulante en individuos de edad avanzada posiblemente asociado a un aumento de la pérdida de miocitos como consecuencia de la remodelación cardiaca5.
A continuación, se realizará un breve repaso sobre las principales afecciones cardiacas que afectan al perro y el gato en los que se ha evaluado la utilidad de la determinación de la cTNI en el diagnóstico, tratamiento y valoración del pronóstico en cada una de ellas. También se abordarán varios estudios realizados en algunas de las principales enfermedades sistémicas que se centran en las variaciones de las concentraciones séricas de troponina circulante.
Enfermedades cardiacas primarias
Degeneración valvular mitral crónica
La degeneración valvular mitral crónica (DVMC) es la enfermedad cardiaca más común en los perros y está descrita como una de las principales patologías responsables de la insuficiencia cardiaca congestiva (ICC)7. Esta enfermedad, también conocida como “insuficiencia crónica de la válvula mitral” o “endocardiosis valvular crónica”, supone entre el 75 – 80% de las enfermedades cardiacas que se producen en el perro, y, por tanto, es la de mayor importancia en estos animales debido a su morbilidad y su mortalidad8. La incidencia y la progresión de la DVMC están muy asociadas a la edad, la raza y el género. La prevalencia en razas pequeñas de más de 13 años llega hasta el 85 %7. También es posible diagnosticarla en animales más jóvenes, aunque con mucha menos frecuencia, y normalmente asociado a determinadas razas como el Cavalier King Charles Spaniel9. Por otro lado, se ha podido ver que la incidencia es mayor en machos que en hembras10. La etiología sigue siendo, actualmente, uno de los mayores desafíos, aunque es evidente que existe un componente genético, por el cual afecta de forma más pronunciada a razas de pequeño tamaño, y un componente hereditario en aquellas razas con mayor incidencia como puede ser el Cavalier King Charles Spaniel9 y Dachshund11. Se caracteriza por el aumento de grosor de la válvula mitral que permite que se produzca un flujo de sangre del ventrículo izquierdo del corazón a la aurícula izquierda durante la sístole cardiaca cuando la válvula se encuentra cerrada, lo que se conoce como regurgitación mitral. La progresión de esta regurgitación, que aumenta el trabajo que debe realizar el corazón, junto a diferentes mecanismos neurohormonales, conducen a la remodelación ventricular (hipertrofia excéntrica tanto del atrio como del ventrículo) y finalmente a la disfunción ventricular llegando en fases finales a producir ICC12.
Son numerosos los estudio que han evaluado la concentración de cTNI en animales con DVMC demostrando un aumento de los niveles de troponina sérica en estos pacientes en comparación con animales sanos y siendo, además, más marcado, en fases más avanzadas13-15. Un estudio realizado en 2020 en el que se incluyeron 316 perros con DVMC en distintas fases de la enfermedad y 40 perros sanos como grupo control mostró que los niveles de troponina sérica en fase B2 y C eran significativamente más altos que en perros sanos, aunque no se observaron diferencias entre pacientes en fase B1 y el grupo control. Estos resultados respecto a los pacientes B1 pueden deberse a que, en fases iniciales de la enfermedad, cuando todavía no existe remodelación cardiaca o es leve, los miocitos del ventrículo izquierdo se encuentran en un estado preapoptótico, pero no están sufriendo apoptosis todavía. Además, puso de manifiesto que valores de troponina más altos estaban relacionados con animales con peor pronóstico16. En este caso, estos resultados son de gran utilidad ya que actualmente los estudios sobre esta patología muestran que se debe instaurar tratamiento a partir de la fase B2 de la enfermedad que es cuando se ha demostrado que presenta beneficios para el paciente y aumenta su esperanza de vida17. Estos hallazgos podrían ayudar a los veterinarios generalistas a estratificar el riesgo en perros con DVMC y optimizar las estrategias de diagnóstico y tratamiento para maximizar el bienestar y la longevidad del paciente18.
Cardiomiopatía dilatada en el perro
La cardiomiopatía más frecuente en perros de razas grandes es la cardiomiopatía dilatada idiopática (CMD), siendo la principal responsable del fallo cardiaco congestivo y muerte súbita en perros de raza mediana y grande. En la mayoría de los casos, se trata de una enfermedad genética que tiene un lento desarrollo y se detecta de forma tardía, diagnosticándose en individuos de edad media y avanzada. Algunas razas como el Bóxer, el Doberman, Lobero irlandés, Perro de agua portugués, Gran danés y Cocker Spaniel parecen estar más predispuestas a padecer esta enfermedad19. El diagnóstico de esta enfermedad de forma temprana supone uno de los mayores retos dentro de la cardiología veterinaria ya que su diagnóstico y tratamiento en fases preclínicas supone un aumento significativo en la esperanza de vida de estos pacientes20. Aunque la prueba de elección para el diagnóstico de la CMD es la ecocardiografía para valorar de forma más precisa la función cardiaca, la fase preclínica puede no mostrar disfunción sistólica y sí otras alteraciones como arritmias o aumento de los biomarcadores cardiacos. Dentro de las distintas pruebas laboratoriales que podemos emplear para poder diagnosticar esta afectación cardiaca se encuentra la determinación de la cTNI. Valores de troponina por encima de 0,22 ng/ml en perros Doberman muestran una sensibilidad del 79,5 % y una especificidad del 84,4 % para el diagnóstico de la CMD. Por lo tanto, la cTNI es una prueba diagnóstica adicional valiosa en el muestreo de pacientes predispuestos y en el diagnóstico en fases preclínicas. Este biomarcador tiene ciertas limitaciones ya que, por ejemplo, en el caso del Bóxer, pacientes que padeciesen la cardiomiopatía arritmogénica del ventrículo derecho también verían aumentados sus valores de cTNI en sangre19.
Cardiomiopatía hipertrófica en el gato
La cardiomiopatía hipertrófica familiar (CMH) es la cardiopatía más frecuente en gatos y se estima una prevalencia del 15 % en la población general. La prevalencia en animales mayores es muchos más alta elevándose hasta un 29 % excluyendo a aquellos gatos que padecen hipertensión sistémica y/o hipertiroidismo. Consiste en el aumento difuso o regional del grosor de las paredes del ventrículo izquierdo sin dilatación de la cámara cardiaca. Este aumento de grosor produce un fallo diastólico que suele conllevar a la dilatación de la aurícula izquierda. Dicha dilatación, aumenta el riesgo de tromboembolismo y del desarrollo de fallo cardiaco conestivo21.
Un estudio de 2002 demostró que valores de cTNI > 0,157 ng/ml poseían una sensibilidad del 85 % y una especificidad del 97 % para el diagnóstico de la CMH independientemente de la gravedad de la enfermedad22. Otro estudio de 2018 mostró que concentraciones plasmáticas de cTNI > 0,234 ng/ml podía ser un punto de corte útil para predecir gatos con CMH grave23, y en otro, concentraciones más elevadas cTNI en sangre (> 0,7 ng/ml) predijeron un mal pronóstico independientemente de que en el momento de la toma de la muestra existiese dilatación auricular o presentasen ICC24. La utilización de la cTNI parece ser útil como prueba complementaría para el diagnóstico y evaluar la gravedad de la CMH sobre todo en aquellos animales que padecieron fallo cardiaco.
Endocarditis/miocarditis
La endocarditis infecciosa (EI) es una enfermedad microbiana rara pero grave causada por una inflamación de la superficie endotelial de por lo menos una válvula cardiaca o de la capa endotelial de una cámara cardiaca. Aunque la prevalencia es realmente baja, < 1 %, las consecuencias de la infección son graves y la tasa de mortalidad es muy alta situándose en torno al 55 % actualmente. Las complicaciones asociadas a este proceso incluyen el fallo cardiaco congestivo, arritmias, tromboembolismo y alteraciones relacionadas por la formación de inmunocomplejos. Otros factores asociados con la mortalidad son el tipo de agente infeccioso y las válvulas afectadas. Un diagnóstico definitivo supone un gran reto de forma ante mortem debido a la ausencia de signos clínicos específicos. Para este diagnóstico ante mortem se suelen utilizar los criterios Duke, un sistema de puntuación adaptado de medicina humana que consiste en una serie de criterios mayores y menores. Un estudio realizado en la que se comparaban concentraciones cTNI en animales con EI, DVMC y anemia hemolítica inmunomediada (AHI) demostró que la determinación de la cTNI es una herramienta útil para distinguir animales afectados por EI de otras patologías. En concreto, un valor de corte > 0,625 ng/ml mostró una especificidad del 100 % en dicho estudio, aunque no hubo asociación entre las concentraciones séricas de cTNI y el tiempo de supervivencia en animales con EI. Dado que el diagnóstico de la EI se basa principalmente en un sistema de puntuación, cualquier prueba adicional que pueda añadir peso al diagnóstico es valiosa25.
Por otro lado, la miocarditis se trata de una enfermedad inflamatoria inespecífica del miocardio. Se desconoce su incidencia real en perros, sin embargo, en un estudio retrospectivo de necropsia mostró un diagnóstico histopatológico de miocarditis en 1,5 % de los perros. Numerosos agentes infecciosos y no infecciosos se han relacionado con el desarrollo de miocarditis. Las enfermedades infecciosas más frecuentemente relacionadas con este tipo de procesos son la tripanosomiasis, leishmaniosis, parvovirosis, toxoplasmosis, neosporosis, borreliosis, ehrlichiosis, leptospirosis y bartonelosis. Como causas no infecciosas encontramos las provocadas por fármacos o toxinas, inmunomediadas, traumatológicas, shock e idiopáticas. El diagnóstico ante mortem de la miocarditis, como en el caso de la endocarditis, es presuntivo. Dentro de las pruebas complementarias para el diagnóstico de este tipo de procesos se encuentran la exploración física, los hallazgos analíticos, la ecocardiografía y los hemocultivos entre otros. La elevación de la cTNI (> 0,2 ng/ml) ha sido documentada en perros con enfermedades infiltrativas del miocardio como miocarditis, neoplasias miocárdicas, al igual que animales con bradiarritmias y enfermedades cardiacas congénitas y adquiridas como hemos visto anteriormente. Por normal general, las enfermedades cardiacas adquiridas provocan simplemente un aumento leve o moderado de cTNI ya que la destrucción de miocitos no es la principal consecuencia de este tipo de patologías. Aunque actualmente no existe un valor de referencia de cTNI para las enfermedades infiltrativas o isquémicas del miocardio, un estudio demostró que el 100 % de pacientes que presentaban miocarditis mostraban cTNI > 0,2 ng/ml y hasta el 96 % tenían valores > 1 ng/ml. Estos resultados hacen pensar que en aquellos animales que presentan miocarditis, las concentraciones cTNI séricas son significativamente más elevadas que en otras patologías cardiacas debido a que el daño en los miocitos es superior. Sin embargo, hay que tener siempre en cuenta que la obtención de valores altos de cTNI en este tipo de procesos dependerá del tiempo transcurrido entre el daño miocárdico y la obtención de la muestra. Viendo estos resultados, es lógico pensar que le determinación de la cTNI obteniendo resultados > 1 ng/ml se considere un criterio mayor a la hora del diagnóstico de las miocarditis del perro y es una de las patologías en la que presenta un mayor interés su determinación26.
Enfermedades no cardiacas
El daño miocárdico ha sido documentado en un gran número de enfermedades no cardiacas, la mayoría de ellas en pacientes críticos y aquellos que presentan enfermedades inflamatorias y shock. La medición de la cTNI es necesaria por lo tanto para conocer el daño miocárdico en pacientes críticos. Se piensa que las citoquinas son las responsables de causar este daño miocárdico en las enfermedades inflamatorias. Se ha visto asociación entre la elevación de la troponina con ciertas citoquinas como el factor de necrosis tumoral (TNF-alfa) y la interleuquina 6 (IL-6) en pacientes críticos27. En pacientes críticos con inflamaciones sistémicas, varias citoquinas, especialmente la IL-10 e IL-15, juegan un papel fundamental en el daño miocárdico28. Se piensa que el mecanismo a través del cual las citoquinas dañan los cardiomiocitos es a través de unos de los mecanismos comentados anteriormente, como es el aumento de la permeabilidad. Con la resolución de la enfermedad sistémica, parecer ser que los daños del corazón son reversibles27. Es interesante destacar, que pacientes críticos con enfermedades no cardiacas suelen presentar normalmente concentraciones de cTNI más elevadas que pacientes con enfermedades cardiacas severas. No se sabe exactamente la razón, pero se especula que posiblemente se deba a que las enfermedades sistémicas graves afectan probablemente a todos los cardiomiocitos mientras que las enfermedades cardiacas primarias van crónicamente sobrecargando el corazón, produciendo a lo largo del tiempo la muerte de las células mientras se produce la remodelación cardiaca1.
Entre las posibles causas del año miocárdico en enfermedades no cardiacas encontramos la hipotensión, hipoxemia, anemia, fiebre, taquicardia, incremento del estrés sobre las paredes cardiacas, tromboembolismo, estrés oxidativo…
Existen numerosos estudios en los que se ha evaluado el aumento de las troponinas en distintas enfermedades no cardiacas tratándose de un tema ampliamente estudiando. Se ha demostrado por ejemplo el aumento de las troponinas en el 70 % de los perros y gatos que presentaban azotemia por fallo renal29. En enfermedades infecciosas, animales infectados por Dirofilarias30 o con leishmaniosis31. También en afecciones neurológicas, en perros que han sufrido convulsiones en los cuales además se observó que su concentración era más alta en función de la edad de los pacientes y del número de episodios convulsivos que presentaron32 o pacientes caninos que han sufrido accidentes cerebrovasculares agudos en los que no se demostró en este caso que tuviesen un valor pronóstico33. También en urgencias quirúrgicas, perras diagnosticadas de piometra en las cuales alrededor del 30 % presentaban elevación de la cTNI previo a la ovarihisterectomía y cerca del 40 % presentaron elevación después de la intervención34 o en perros con dilatación gástrica-vólvulo en los que hasta un 87 % mostraron una elevación de la cTNI sérica y en el cual los pacientes que no sobrevivieron presentaron niveles significativamente más elevados haciendo evidente su utilidad como valor pronóstico en este tipo de pacientes35. Incluso en el ámbito de la oncología, pacientes con derrame pericárdico en los cuales se ha podido ver que cTNI > 0,25 ng/ml tiene una sensibilidad del 81 % y una especificidad del 100 % para detectar la presencia de hemangiosarcomas cardiacos36.
Actualmente, existen dos sistemas de puntuación validados en medicina veterinaria para pacientes críticos, la evaluación fisiológica y laboratorial del paciente agudo (APPLE por sus sigas en inglés) y el índice de predicción de supervivencia (SPI2 por sus siglas en inglés). En un estudio realizado en 2013 donde se estudió las variaciones de concentraciones de cTNI entre otros biomarcadores en pacientes críticos se llegó a la conclusión de que el aumento de la concentración de troponina sérica como marcador de daño miocárdico tenía valor predictivo de mortalidad a los 28 días en pacientes gravemente enfermos por lo que se consideró como un biomarcador de gran utilidad a la hora de establecer un pronóstico en estos pacientes37.
Por todo esto, la medición de la cTNI se presenta como una herramienta de gran utilidad, fácil de determinar y de elevado valor pronóstico en enfermedades no cardiacas y de afectación sistémica.
Bibliografía
- Langhorn, R. and Willesen, J.L. (2015) “Cardiac troponins in dogs and cats,” Journal of Veterinary Internal Medicine;2015; 30(1):36–50.
- Ljungvall I, Hoglund K, Tidholm A, et al. Cardiac troponin I is associated with severity of myxomatous mitral valve disease, age, and C-reactive protein in dogs. J Vet Intern Med;2010; 24:153–159.
- Fonfara S, Loureiro J, Swift S, et al. Cardiac troponin I as a marker for severity and prognosis of cardiac disease in dogs. Vet J;2010; 184:334–339.
- O’Brien PJ, Smith DEC, Knechtel TJ, et al. Cardiac troponin I is a sensitive, specific biomarker of cardiac injury in laboratory animals. Lab Anim;2006; 40:153–171.
- Barison A, Pastormerlo LE, Giannoni A. Troponin in nonischaemic dilated cardiomyopathy. Eur Cardiol;2011; 7:220–224.
- Eriksson S, Halenius H, Pulkki K, et al. Negative interference in cardiac troponin I immunoassays by circulating troponin autoantibodies. Clin Chem;2005; 51:839–847.
- Borgarelli M, Buchanan JW. Historical review, epidemiology and natural history of degenerative mitral valve disease. J Vet Cardiol;2012;14(1):93-101.
- Haggstrom J, Kvart C, Pedersen H D. Acquired valvular disease. En: Ettinger SJ, Feldman EC, editores. Textbook of Veterinary Internal Medicine. 6th ed. St. Louis: Elsevier; 2005;1022-39.
- Swenson L, Häggström J, Kvart C, Juneja RK. Relationship between parental cardiac status in Cavalier King Charles Spaniels and prevalence and severity of chronic valvular disease in offspring. J Am Vet Med Assoc;1996;208(12): 2009-2012.
- Borgarelli M, Savarino P, Crosara S, Santilli RA, Chiavegato D, Poggi M, et al. Survival characteristics and prognostic variables of dogs with mitral regurgitation attributable to myxomatous valve disease. J Vet Intern Med;2008;22(1): 120-128.
- Olsen LH, Fredholm M, Pedersen HD. Epidemiology and inheritance of mitral valve prolapse in Dachshunds. J Vet Intern Med;1999;13(5): 448-456.
- Menciotti G, Borgarelli M. Review of Diagnostic and Therapeutic Approach to Canine Myxomatous Mitral Valve Disease. Vet Sci;2017;4(4); 1-15.
- Winter RL, Saunders AB, Gordon SG, et al. Analytical valida¬tion and clinical evaluation of a commercially available high-sensitivity immunoassay for the measurement of troponin I in humans for use in dogs. J Vet Cardiol;2014; 16:81–89.
- Winter RL, Saunders AB, Gordon SG, et al. Biologic vari¬ability of cardiac troponin I in healthy dogs and dogs with different stages of myxomatous mitral valve disease using standard and high-sensitivity immunoassays. Vet Clin Pathol;2017; 46:299–307.
- Polizopoulou ZS, Koutinas CK, Dasopoulou A, et al. Serial analysis of serum cardiac troponin I changes and correlation with clinical findings in 46 dogs with mitral valve disease. Vet Clin Pathol;2014; 43:218–225.
- Hori Y, Iguchi M, Hirakawa A, et al. Evaluation of atrial natriuretic peptide and cardiac troponin I concentrations for assessment of disease severity in dogs with naturally occurring mitral valve disease. J Am Vet Med Assoc;2020;256(3): 340-348.
- Boswood A, Häggström J, Gordon SG, Wess G, Stepien RL, Oyama MA, et al. Effect of Pimobendan in Dogs with Preclinical Myxomatous Mitral Valve Disease and Cardiomegaly: The EPIC Study—A Randomized Clinical Trial. J Vet Intern Med;2016;30(6): 1765-1779.
- Mattin MJ, Boswood A, Church DB, Brodbelt DC. Prognostic factors in dogs with presumed degenerative mitral valve disease attending primary-care veterinary practices in the United Kingdom. J Vet Intern Med;2019;33(2): 432-444.
- Wess G. Screening for dilated cardiomyopathy in dogs. J Vet Cardiol;2022;40: 51-68.
- Summerfield NJ, Boswood A, O'Grady MR, Gordon SG, et al. Efficacy of pimobendan in the prevention of congestive heart failure or sudden death in Doberman Pinschers with preclinical dilated cardiomyopathy (the PROTECT Study). J Vet Intern Med;2012;26(6): 1337-1349.
- Luis Fuentes V, Abbott J, Chetboul V, Côté E, et al. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med;2020;34(3): 1062-1077.
- Herndon WE, Kittleson MD, Sanderson K, et al. Cardiac troponin I in feline hypertrophic cardiomyopathy. J Vet Intern Med;2002; 16: 558–564.
- Hori Y, Iguchi M, Heishima Y, Yamashita Y, et al. Diagnostic utility of cardiac troponin I in cats with hypertrophic cardiomyopathy. J Vet Intern Med;2018;32(3): 922-929.
- Borgeat K, Sherwood K, Payne JR, Payne JR, Luis Fuentes V, Connolly DJ. Plasma cardiac troponin I concentration and cardiac death in cats with hypertrophic cardiomyopathy. J Vet Intern Med;2014; 28:1731–1737.
- Kilkenny E, Watson C, Dukes-McEwan J, Bode EF, Hezzell MJ, Payne JR, Borgeat K. Evaluation of serum cardiac troponin-I concentrations for diagnosis of infective endocarditis in dogs. J Vet Intern Med;2021;35(5): 2094-2101.
- Lakhdhir S, Viall A, Alloway E, Keene B, Baumgartner K, Ward J. Clinical presentation, cardiovascular findings, etiology, and outcome of myocarditis in dogs: 64 cases with presumptive antemortem diagnosis (26 confirmed postmortem) and 137 cases with postmortem diagnosis only (2004-2017). J Vet Cardiol;2020;30: 44-56.
- Ammann P, Maggiorini M, Bertel O, et al. Troponin as a risk factor for mortality in critically ill patients without acute coronary syndromes. J Am Coll Cardiol;2003; 41:2004–2009.
- Langhorn R, Oyama MA, King LG, et al. Prognostic importance of myocardial injury in critically ill dogs with systemic inflammation. J Vet Intern Med;2013; 27: 895–903.
- Porciello F, Rishniw M, Herndon WE, et al. Cardiac troponin I is elevated in dogs and cats with azotaemia renal failure and in dogs with non-cardiac systemic disease. Aust Vet J;2008;86(10): 390-394.
- Carretón E, Morchón R, Montoya-Alonso JA. Cardiopulmonary and inflammatory biomarkers in heartworm disease. Parasit Vectors;2017;10(Suppl 2):534.
- Silvestrini P, Piviani M, Alberola J, Rodríguez-Cortés A, Planellas M, Roura X, O'Brien PJ, Pastor J. Serum cardiac troponin I concentrations in dogs with leishmaniasis: correlation with age and clinicopathologic abnormalities. Vet Clin Pathol;2012;41(4): 568-574.
- Dutton E, Carmichael N, Michal U, Cripps PJ, Boswood A. Serum cardiac troponin I concentrations in dogs with generalised seizures. J Small Anim Pract;2018;59(3): 167-173.
- Gonçalves R, Sanchez-Masian D, Maddox TW, Dukes-McEwan J. Preliminary investigation of serum cardiac troponin I in dogs with acute ischaemic stroke. J Small Anim Pract;2020;61(2): 93-100.
- Pelander L, Hagman R, Häggström J. Concentrations of cardiac Troponin I before and after ovariohysterectomy in 46 female dogs with pyometra. Acta Vet Scand;2008;11;50(1): 35.
- Schober KE, Cornand C, Kirbach B, Aupperle H, Oechtering G. Serum cardiac troponin I and cardiac troponin T concentrations in dogs with gastric dilatation-volvulus. J Am Vet Med Assoc;2002;221(3): 381-388.
- Chun R, Kellihan HB, Henik RA, Stepien RL. Comparison of plasma cardiac troponin I concentrations among dogs with cardiac hemangiosarcoma, noncardiac hemangiosarcoma, other neoplasms, and pericardial effusion of nonhemangiosarcoma origin. J Am Vet Med Assoc;2010;1;237(7): 806-811.
- Hayes G, Mathews K, Doig G, Kruth S, et al. The acute patient physiologic and laboratory evaluation (APPLE) score: a severity of illness stratification system for hospitalized dogs. J Vet Intern Med;2010;24(5): 1034-1047.
 by Multimédica
by Multimédica