Hemangiosarcoma cardíaco canino: revisión bibliográfica a través de una serie de casos clínicos
Resumen breve
El hemangiosarcoma de aurícula derecha es el tumor cardíaco más frecuente en el perro. Se ha procedido a la revisión de los casos diagnosticados en el Hospital Clínico Veterinario Complutense, Madrid, España, entre 2007 y 2024. Además, se describe un caso clínico, en el cual la respuesta ha sido marcadamente positiva, observándose no solo un beneficio clínico y una reducción del volumen tumoral, sino también una supervivencia muy superior a la esperada.Índice de contenidos

Resumen
El hemangiosarcoma de aurícula derecha es el tumor cardíaco más frecuente en el perro. Se caracteriza por su comportamiento agresivo con repercusión a nivel local (derrame pericárdico y taponamiento cardíaco) y alta capacidad metastásica. Es complicado llegar a un diagnóstico definitivo, pero la presencia de una masa en aurícula derecha y signos compatibles permite establecer un diagnóstico presuntivo suficientemente válido como para comenzar el tratamiento. Existen distintas modalidades terapéuticas (cirugía, quimioterapia, radioterapia), siendo la quimioterapia intravenosa con doxorrubicina la más empleada. A pesar de los tratamientos, el pronóstico en general es pobre, no superando tiempos medios de supervivencia de 3-4 meses, independientemente de la modalidad empleada.
Se ha procedido a la revisión de los casos diagnosticados de hemangiosarcoma cardíaco en el Hospital Clínico Veterinario Complutense entre los años 2007 y 2024, y se ha comparado los datos con lo descrito en la literatura, observando concordancia en reseña, sintomatología y tiempo de supervivencia. Además, se describe un caso clínico, en el cual la respuesta ha sido marcadamente positiva, observándose no solo un beneficio clínico y una reducción del volumen tumoral, sino también una supervivencia muy superior a la esperada.
Introducción
El hemangiosarcoma (HSA) es un tumor mesenquimal maligno derivado de células endoteliales, aunque también se sugiere que puede asociarse a células progenitoras de médula ósea que se trasladan a localizaciones vasculares periféricas. En la especie canina supone un 2 % de los tumores caninos. El bazo es la localización más habitual, seguida del corazón, aunque también puede encontrarse, como tumor primario, en hígado, dermis, tejido subcutáneo, riñón o músculo, entre otros. Suele afectar a perros de edad media-avanzada (media de 10 años) y de razas grandes (destacando el Pastor alemán, Golden retriever y Labrador retriever), sin que haya suficientes evidencias de predisposición por sexo. En todas sus variedades viscerales es un tumor de alto grado de malignidad, destacando su alto potencial metastásico, lo que condiciona que, en general, los tiempos medios de supervivencia (TMS) sean muy limitados.
El HSA es la neoplasia cardíaca más frecuente en perros, representando entre el 40 % y el 69 % de todos los tumores de esta localización. Generalmente se encuentra en el atrio/aurícula derecha (Figura 1), aunque, de forma menos habitual, puede afectar a otras zonas cardíacas.
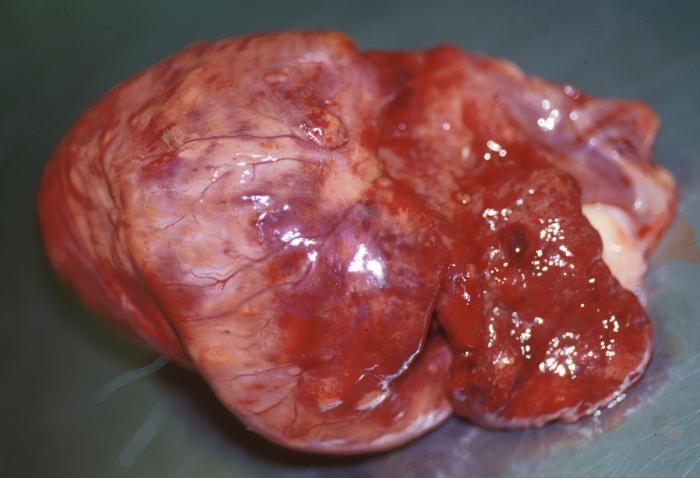
Figura 1. Imagen macroscópica de un hemangiosarcoma cardíaco.
El comportamiento del HSA cardíaco es muy agresivo, caracterizado por una sintomatología clínica aguda, infiltración local y altas tasas de metástasis que suelen aparecer de forma temprana, tanto por vía hematógena como por implantación secundaria. Los signos clínicos pueden ser muy evidentes, graves y aparecer de forma súbita si se produce la rotura del tumor primario, ya que se acompaña de derrame pericárdico hemorrágico y un posible taponamiento cardíaco (sonidos cardíacos atenuados, pulso paradójico, ascitis, colapso, debilidad y letargia). El derrame pericárdico está presente en el 42 % de pacientes con tumores cardíacos y en 82 % de los HSA. Si no hay rotura del tumor primario, los signos son más inespecíficos (debilidad, letargia, tos, etc.).
El diagnóstico presuntivo se realiza en base al diagnóstico por imagen; radiológicamente puede aparecer una silueta cardíaca agrandada y con forma globosa si hay derrame pericárdico (Figura 2); aunque la sensibilidad es bastante baja, puede ser útil para determinar si hay efecto de masa cardíaca; y es una técnica muy adecuada para evidenciar metástasis pulmonares, que suele asociarse a un patrón miliar nodular (Figura 3).
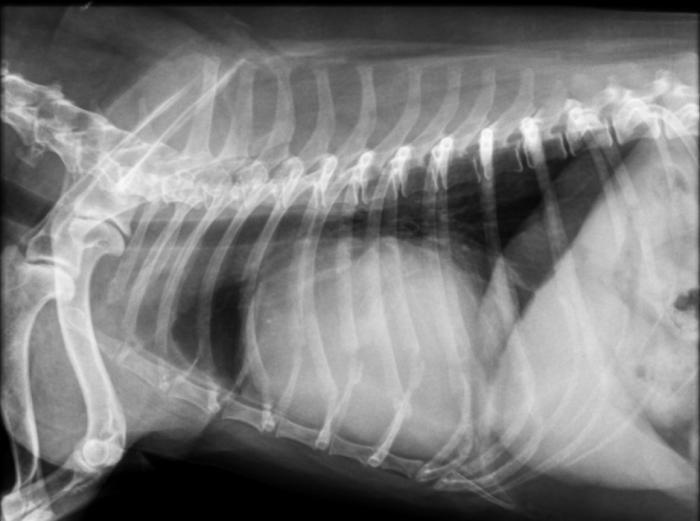
Figura 2. Radiografía laterolateral derecha de un paciente con taponamiento cardíaco, en la que se observa la silueta cardíaca de aspecto globoso (imagen cedida por el Servicio de Diagnóstico por Imagen del HCVC).
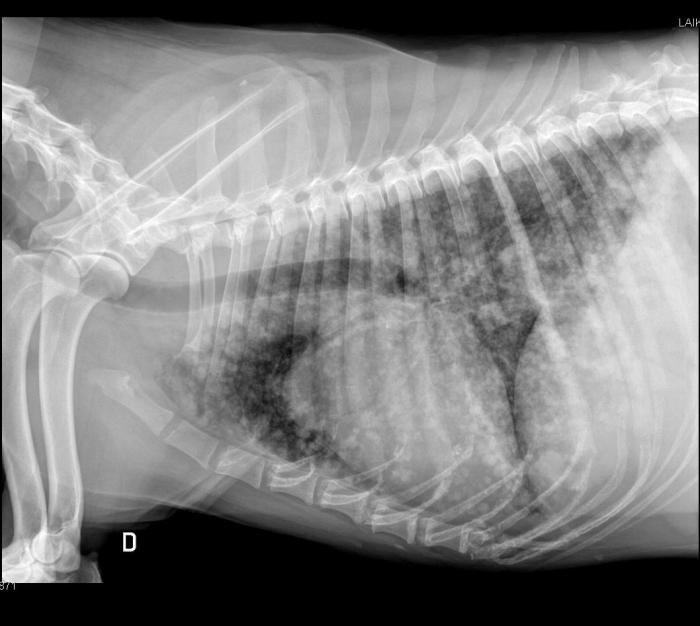
Figura 3. Radiografía laterolateral derecha de un paciente con hemangiosarcoma cardíaco en el que se observa un patrón metastásico miliar (imagen cedida por el Servicio de Diagnóstico por Imagen del HCVC).
La técnica más útil para el diagnóstico de HSA cardíaco es la ecocardiografía, en la cual se evidencia una masa en aurícula derecha, generalmente acompañada de derrame pericárdico. Tiene una elevada sensibilidad y especificidad para diferenciar masas en el atrio derecho de otras posibles causas de derrame pericárdico. En general, si no se detecta la presencia de la masa es por un bajo volumen de derrame. La ecocardiografía también es necesaria para evaluar la funcionalidad cardíaca previa a la administración del tratamiento (por el efecto cardiotóxico de la doxorrubicina).
La analítica sanguínea suele presentar alteraciones en el hemograma, ya que es frecuente que los pacientes presenten neutrofilia, trombocitopenia y anemia con presencia de esquistocitos, acantocitos y glóbulos rojos nucleados, asociadas a daño microangiopático y a la hemorragia; las alteraciones bioquímicas asociadas directamente al tumor son escasas.
La troponina cardíaca I en plasma, un marcador específico y sensible de daño en el miocardio, se encuentra muy elevada en perros con HSA cardíaco, lo que no sucede en pacientes con derrames pericárdicos no producidos por HSA ni en los casos de HSA en otras localizaciones no cardíacas.
Se debe realizar una ecografía abdominal para descartar la presencia del tumor primario o de otras metástasis en órganos abdominales. La afectación simultánea de corazón y bazo está descrita en el 8.7 % de los casos.
La citología, tanto del propio tumor como del derrame pericárdico, es de un valor diagnóstico limitado, por la hemodilución marcada (aunque, en ocasiones, pueden encontrarse escasas células fusiformes de gran tamaño y con criterios de malignidad procedentes del tumor). La citología del derrame es más útil para descartar otros diferenciales como mesotelioma o linfoma.
El alto riesgo de realizar una biopsia no justifica su empleo, por lo que la asociación de derrame pericárdico hemorrágico y masa en aurícula derecha se considera lo suficientemente significativo como para proponer un tratamiento, sobre todo si se asocia a otras alteraciones habituales en el HSA, como la anemia o la trombocitopenia; el diagnóstico definitivo se alcanza, en la mayoría de las ocasiones, post mortem.
El estadio clínico (I, II, III) se define según el tamaño, grado de invasión e integridad del tumor primario y la presencia o no de metástasis regionales (linfonodos) y/o a distancia (Tabla 1).
| Estadio | Tumor primario (T) | Ganglios linfáticos regionales (N) | Metástasis a distancia (M) |
|---|---|---|---|
| I | T1 | N0 | M0 |
| II | T1 | N1 | M0 |
| II | T2 | N0 | M0 |
| III | T1-T3 | N0-N3 | M1 |
Tabla 1. Estadios clínicos del HSA canino (Adaptado de Wendelburg et al., 2015).
(T1) Tumor < 5 cm de diámetro y confinado a tejido primario. (T2) Tumor > 5 cm o roto, que invade tejido subcutáneo. (T3) Tumor que invade estructuras subyacentes, incluido el músculo. (N0) No hay afección de ganglios linfáticos regionales. (N1) Afección de ganglios linfáticos regionales. (N2) Afección de ganglios linfáticos a distancia. (M0) No hay evidencia de metástasis. (M1) Presencia de metástasis a distancia.
En la mayoría de los HSA, el tratamiento de elección es la cirugía, aunque muy pocas veces se realiza en los de origen cardíaco debido a la dificultad del procedimiento y las complicaciones asociadas. La pericardiectomía es un tratamiento paliativo habitual, efectivo para evitar el taponamiento cardíaco, pero no mejora el TMS.
El uso de quimioterapia adyuvante está indicado tanto para el control del tumor primario como por el alto riesgo de metástasis; el fármaco más efectivo es la doxorrubicina, en monoterapia o incluida en protocolos múltiples con otros fármacos como la ciclofosfamida y/o vincristina (Tabla 2).
| Protocolo VAC (repetir cada 3 semanas por un total de 4-6 ciclos) | |
|---|---|
| Día 1 | Doxorrubicina 30 mg/m2 o 1 mg/kg si < 10 kg IV Ciclofosfamida 100-150 mg/m2 IV o 150-200 mg/m2 VO repartidos en 3-4 días |
| Días 8 y 15 | Vincristina 0.75 mg/m2 IV |
| Protocolo AC (repetir cada 3 semanas por un total de 4-6 ciclos) | |
| Día 1 | Doxorrubicina 30 mg/m2 o 1 mg/kg si < 10 kg IV |
| Día 10 | Ciclofosfamida 100-150 mg/m2 IV o 150-200 mg/m2 VO repartidos en 3-4 días |
Tabla 2. Principales protocolos de quimioterapia combinada para tratar el HSA canino. (IV) intravenoso (VO) vía oral.
La radioterapia paliativa reduce la incidencia de taponamiento cardíaco, pero no prolonga el TMS (2.5 m), a no ser que se combine con quimioterapia, en cuyo caso el TMS asciende a 10 meses (326 días). Por la falta de disponibilidad de equipos esta opción no es fácil de plantear en España.
El pronóstico del HSA depende de la localización, estadio clínico y opción terapéutica empleada. En el caso del cardíaco, el pronóstico es reservado. El TMS varía en los distintos estudios, en rangos de entre 16 días a 4 meses, con casos puntuales sobrepasando estos tiempos. Sin tratamiento, el TMS es de 2 semanas, debido a los problemas secundarios de un taponamiento cardíaco. Con cirugía, en el caso de que sea posible, el TMS oscila entre 1-3 meses (42 días), debido a la temprana aparición de metástasis. Un uso conjunto de cirugía y quimioterapia adyuvante permite aumentar el TMS a 6 meses (164 días). Sólo con quimioterapia (con una respuesta objetiva documentada del 41 %) el TMS estimado es de 4 meses (116-140 días).
A continuación, se expone una serie de casos clínicos de HSA cardíaco, diagnosticados en el Hospital Clínico Veterinario Complutense (HCVC) desde el 2007.
Material y métodos, resultados (serie de 16 casos)
Entre 2007 y 2024, en el servicio de oncología HCVC, se diagnosticaron 17 casos de HSA cardíaco. Exceptuando un caso que se abordará de forma extensa más adelante, los datos del grupo de 16 pacientes se describen en conjunto a continuación.
De los 16 pacientes, 8 eran Mestizo (incluyendo mestizos de Pastor alemán), 2 Labrador, 1 Pastor alemán, 1 Bóxer, 1 Dogo argentino, 1 Galgo español, 1 Bulldog francés y 1 Chihuahua. El 62.5 % eran hembras (6/16 castradas); de los 6 machos, 2 estaban castrados. La edad media de los pacientes fue de 10 años, mientras que su peso medio fue de 28.5 kg; solo un 21 % de los pacientes pesaba menos de 20 kg.
De todos los pacientes, 81.2 % (13/16) presentaban signos clínicos en el momento del diagnóstico, en la mayoría de los casos (77 %) derivados de la presencia de derrame pericárdico. Dos de los casos, aunque presentaban derrame pericárdico, fueron diagnosticados antes de que se produjeran signos clínicos asociados. Teniendo en cuenta el conjunto de la población, un 75 % de los casos presentaban derrame pericárdico en el momento del diagnóstico.
Un 44.7 % de los pacientes presentaban alteraciones en otros órganos en el momento del diagnóstico; todos ellos (7/7) presentaban lesiones en pulmón, seguido por el bazo (5/7), el hígado (3/7) y los riñones (1/7). Se consideró enfermedad metastásica en todos ellos.
Solo 9 pacientes fueron tratados: 6 recibieron únicamente quimioterapia (5 con doxorrubicina y 1 con doxorrubicina + vinblastina); 2 se sometieron a pericardiectomía y quimioterapia adyuvante (doxorrubicina) junto con terapia metronómica (uno con ciclofosfamida + AINE y uno con clorambucilo + AINE); y uno fue tratado únicamente con pericardiectomía.
El tiempo medio de supervivencia hasta la eutanasia o la última visita documentada fue de 55 días (rango: 4-122 días) para los pacientes que recibieron sólo quimioterapia, 95 días (rango: 74-116 días) para aquellos que fueron tratados con pericardiectomía, quimioterapia adyuvante y/o terapia metronómica, y 13 días para el paciente tratado solo con pericardiectomía.
El caso 17 se describe a continuación.
Caso clínico
Acude a consulta con el Servicio de Oncología del HCVC una Bóxer de 9 años, hembra entera, por la detección de un efecto masa cardíaca en su centro veterinario habitual tras la presentación de dos episodios de síncope.
En su centro veterinario habitual se habían realizado radiografías de tórax en las que observó imagen de corazón globoso, confirmándose la presencia de derrame pericárdico por ecografía; posteriormente, se realizó una ecocardiografía en la que no se observó masa en atrio derecho, pero sí una imagen dudosa de masa en base cardíaca. Se procedió al drenaje y análisis del líquido pericárdico, que presentaba un hematocrito del 66.5 %; el estudio citológico describe presencia de eritrocitos, incremento número de leucocitos con predominio de linfocitos maduros, histiocitos y polimorfos ocasionales y una población de células mesoteliales reactivas. Se pautó tratamiento con furosemida y ácido tranexámico, pero se necesitó pericardiocentesis semanal durante las tres semanas posteriores al inicio del tratamiento.
Una vez en el HCVC, su exploración física general no reveló alteraciones significativas. Se realizó una nueva ecocardiografía y se observó escaso derrame pericárdico (la última pericardiocentesis se había realizado el día anterior) y una masa en aurícula derecha que se continuaba hacia ventrículo derecho, de 5.8 x 2.16 cm, con imágenes de vascularización en su interior (Figura 4).
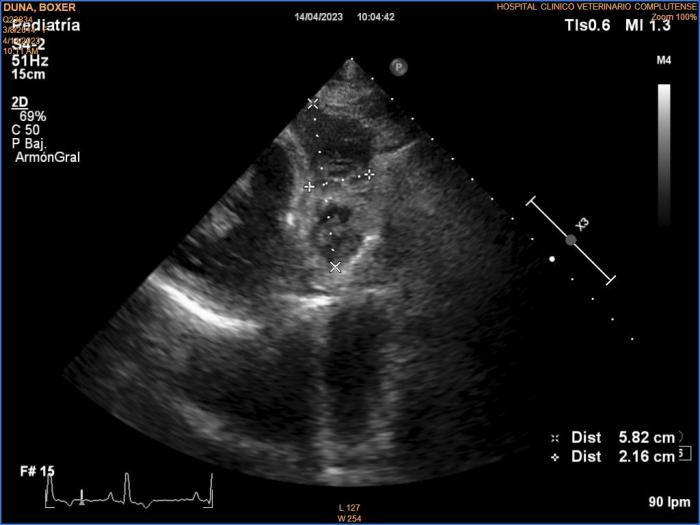
Figura 4. Ecocardiografía del momento del diagnóstico; corte longitudinal izquierdo de tres cámaras optimizado para ver tracto de entrada ventricular derecho. Se observa una masa que abarca pared libre atrial derecha y ventricular derecha, de ecogenicidad mixta con evidentes imágenes hipoecogénicas compatibles con vascularización en su interior, de 5.8 cm x 2.16 cm de dimensiones mínimas. Esta lesión es compatible con hemangiosarcoma.
Además, se realizó una ecografía abdominal en la que se observó esplenomegalia con presencia de tres lesiones focales inespecíficas hipoecoicas, de tamaño aproximado de 1 cm cada una de ellas, con diagnóstico diferencial de nódulos de regeneración o hematoma, pero sin poder descartar neoplasia.
La analítica sanguínea mostró una anemia moderada (hematocrito 24.7 % [valores de referencia 37-55 %]; hemoglobina = 9.2 g/dl [valores de referencia 12-18 g/dl]) con presencia de acantocitos y esquistocitos, ligera trombocitopenia (179 x 103/µl [valores de referencia 200-500 x 103/µl]) y ligera hipoproteinemia (5.3 g/dl [valores de referencia 6-7.5 g/dl]).
Dados los resultados de las pruebas complementarias realizadas, se consideró como diagnóstico más probable un HSA cardíaco, en estadio II. Se informó del pronóstico y opciones de tratamiento a los tutores, que rechazaron la realización de una pericardiectomía paliativa, y se optó por la administración de quimioterapia con doxorrubicina (dosis de 30 mg/m2), retirando el resto de medicaciones.
A las tres semanas se observó un beneficio clínico evidente, pues durante este periodo de tiempo no se manifestó ningún síncope ni fue necesaria una pericardiocentesis. Las alteraciones en el hemograma se habían recuperado (hematocrito 41.1 %, hemoglobina 14.1 mg/dl y plaquetas en valores de 319 x 103/µl). Además, se detectó mejoría en la imagen ecográfica, con una reducción del tamaño del diámetro mayor de la masa del 43 % (3.3 cm) (Figura 5).
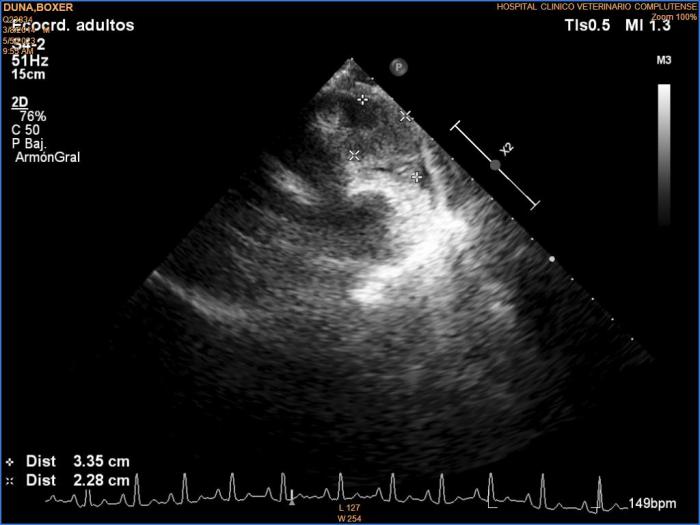
Figura 5. Ecocardiografía a las 3 semanas de la primera dosis de quimioterapia. Corte longitudinal izquierdo de tres cámaras optimizado para ver tracto de entrada ventricular derecho. Se observa una masa que abarca pared libre atrial derecha y ventricular derecha, de ecogenicidad mixta, de 3.35 cm x 2.28 cm de dimensiones mínimas.
A las 6 semanas del inicio del tratamiento, ya no se observaba derrame pericárdico ni presencia macroscópica de masa. La paciente se encontraba alerta y activa, sin signos de intolerancia al ejercicio, con una calidad de vida similar a la previa a su enfermedad.
Dada la buena respuesta y la ausencia de efectos secundarios a la quimioterapia, se continuó con el protocolo quimioterápico. En todas las consultas oncológicas se realizaron hemogramas junto con ecocardiografías para evaluar la evolución. Además, se programaron radiografía de tórax de forma periódica, sin evidencia de imágenes compatibles con metástasis pulmonares en ningún momento.
Durante el protocolo, la paciente no mostró efectos adversos significativos, salvo heces de menor consistencia a las 48-72 horas de la administración de la dosis de quimioterapia, que remitían sin necesidad de tratamiento.
Tras la administración de la 6ª dosis de quimioterapia (a los 5 meses del diagnóstico), se mantenía sin evidencias de tumor; se recomendó continuar el tratamiento, ya que no se observaron signos de disfunción sistólica asociada a la quimioterapia, pero el tutor lo rechazó alegando que la última dosis había tenido más efectos secundarios (diarrea de 3 días de duración).
En la revisión realizada a las dos semanas, se detectó por ecocardiografía una masa de 1.92 cm de ancho en el surco coronario (Figura 6); dado este principio de progresión, el tutor aceptó la administración de la séptima dosis de quimioterapia, con la que se consiguió mantener enfermedad estable. Sin embargo, el tutor declina la administración de una nueva dosis y opta por la realización de revisiones clínicas y ecocardiografías cada 2 semanas.
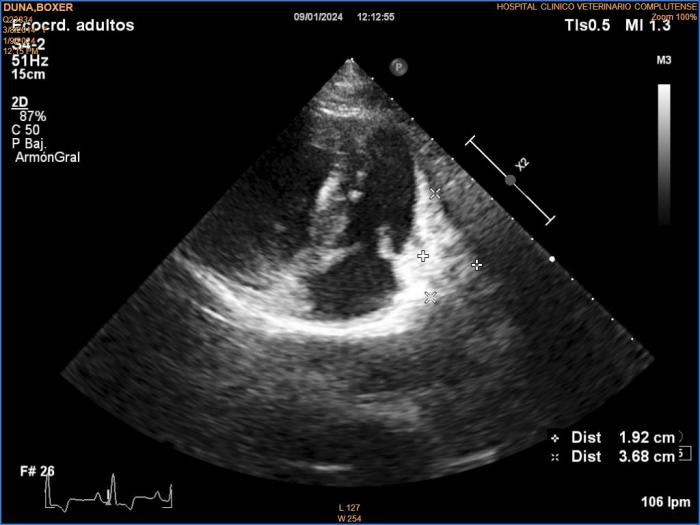
Figura 6. Ecocardiografía de la recidiva. Corte longitudinal izquierdo de tres cámaras optimizado para ver tracto de entrada ventricular derecho. Se observa una masa que abarca pared libre atrial derecha y ventricular derecha, de ecogenicidad mixta, de 1.92 cm de anchura mínima.
A las 7 semanas de la última dosis de quimioterapia administrada, la lesión descrita anteriormente se mantiene del mismo tamaño, pero se observa una zona sospechosa de nueva lesión. Ante esta posible nueva progresión de la enfermedad, el tutor accede a la administración de la octava dosis de quimioterapia. A las 3 semanas de dicha administración, se observa un crecimiento considerable de la masa (3.7 x 2 cm) y se evidencia una nueva masa de 1.2 cm.
El tutor rechaza la administración de más dosis de quimioterapia, por lo que se pauta terapia metronómica con clorambucilo (4 mg/m2/48 h) y firocoxib (5 mg/kg/48 h). A la semana de la última visita con el Servicio de Oncología, el paciente acude al Servicio de Urgencias por presentar derrame pericárdico y hemoabdomen con signos de shock hipovolémico; en la ecografía abdominal se evidencia una masa esplénica de 9 cm y otra de 5 cm. Dada la gravedad, el tutor decide realizar la eutanasia humanitaria.
El TMS de la paciente fue de 293 días desde la aparición de los primeros signos clínicos compatibles.
Discusión
El HSA canino es un tumor frecuente en la especie canina. La afectación cardíaca no es tan común como la esplénica. En el HCVC, constituye la tercera localización (9.7 % de todos los pacientes diagnosticados de HSA no dérmicos), tras el bazo (53.7 %) y la localización subcutánea/muscular (24.4 %). Además de su comportamiento intrínseco agresivo, el HSA cardíaco tiene gran repercusión sistémica por su frecuente asociación a derrame pericárdico con signos secundarios a taponamiento cardíaco.
En el HCVC, la raza más representada son los Mestizo, seguidos de Labrador, Bóxer y Pastor alemán; esta distribución de razas coincide con lo descrito en la bibliografía, aunque sin presentar ningún caso de Golden retriever, descrita como una de las más representadas. La edad y peso medio de población también coincide con la bibliografía, pacientes de edad media-avanzada (10 años de media) y de raza grande (28.5 kg de media). Yamamoto y cols., en su estudio de 51 casos de HSA cardíaco, describen una incidencia superior a la esperada en perros de raza Maltés y Teckel, razas no descritas como de riesgo en ningún otro estudio sobre HSA en general y cardíacos en particular. En nuestra serie de casos solo encontramos un 11.7 % (2/17) pacientes con peso menor de 10 kg, un Chihuahua de 3 kg y un Mestizo de 8 kg.
En nuestros pacientes parece haber una mayor incidencia en hembras (62.5 %), aunque en la bibliografía, los resultados respecto a sexo son discrepantes, con estudios que muestran mayor afectación de machos, mientras que en la mayoría no se observan diferencias.
Coincidiendo con el resto de la bibliografía, la presencia de signos clínicos, específicamente los asociados a derrame pericárdico se detectan en la mayoría de los pacientes (75 % de los casos).
La afectación simultánea cardíaca y esplénica está descrita de forma ocasional (8.7 %, según la bibliografía consultada); sin embargo, en nuestra serie de casos, el porcentaje de pacientes con doble afectación es superior, alcanzando un 29.4 % (siempre junto a metástasis en otras localizaciones). Esta repercusión múltiple justifica la realización de un estadiaje más completo, tanto con ecografía abdominal como con ecocardiografía, para poder evaluar ambos órganos.
Aún faltan muchos avances en cuanto al alcance del diagnóstico definitivo del HSA cardíaco, aunque el veterinario clínico tiene a su alcance bastantes herramientas como para poder emitir un diagnóstico presuntivo con fuertes sospechas, mediante la combinación de signos clínicos, diagnóstico por imagen (sobre todo ecocardiografía) y estudios analíticos (tanto de sangre como del derrame pericárdico). Sin embargo, es necesario seguir profundizando en otras herramientas diagnósticas poco invasivas, sobre todo a nivel de biomarcadores, como la troponina I cardíaca, la timidina quinasa 1 o la evaluación de factores angiogénico, como el factor de crecimiento endotelial vascular, entre otros.
El TMS descrito para el HSA cardíaco en la literatura se corresponde con el TMS observado en esta serie de casos, con la excepción del caso descrito en detalle, en el cual se obtuvo una supervivencia muy superior a la esperada. Generalmente, sin tratamiento, los pacientes no suelen superar las 2 semanas, y en los casos tratados con quimioterapia con protocolos basados en doxorrubicina, el tiempo de supervivencia se encuentra en 3-4 meses (de 74 a 116 días en esta serie de casos; 116 a 140 días en la bibliografía consultada).
En el caso descrito, el TS superó los 9 meses (293 días), más del doble del tiempo descrito previamente para este tipo de casos. El éxito terapéutico de esta paciente demuestra la eficacia de la quimioterapia como tratamiento para este tipo tumoral, tanto para el retraso en la aparición de metástasis, como, en este caso en concreto, para el control y reducción del volumen tumoral primario. Sin embargo, es necesario destacar que en la paciente descrita con detalle no realizaron controles de las lesiones esplénicas detectadas en la ecografía abdominal realizada en el momento del diagnóstico, lo que constituye un error en el seguimiento del caso y una limitación en la valoración de la respuesta. No obstante, la paciente no presentó ningún signo asociado a un posible hemoperitoneo hasta la fecha de la eutanasia. Y en las frecuentes analíticas realizadas durante todo el seguimiento, no se detectó una recaída de las alteraciones hematológicas que hiciera sospechar de una progresión de lesiones en otra localización diferente a la cardíaca.
En este caso, no se realizó pericardiectomía por rechazo del tutor a procedimientos invasivos, pero teniendo en cuenta que su realización es paliativa y no mejora la supervivencia, y teniendo en cuenta el buen control clínico obtenido sólo con terapia médica, no consideramos que su realización hubiera sido beneficiosa para el paciente.
Aunque el pronóstico del HSA cardíaco es malo, a pesar de instaurar tratamiento en sus diferentes modalidades paliativas; probablemente, los avances en cirugía cardíaca o en radioterapia podrán mejorar los resultados en el futuro, pero a nivel clínico todavía están lejos de estar disponibles para la mayoría de los pacientes. Por ello, se debe seguir trabajando con las modalidades disponibles actualmente, entre las que destaca la quimioterapia.
Como conclusión y relevancia clínica, con el caso descrito en detalle, demostramos que existen casos de HSA cardíaco en los cuales, a pesar de no ser factible la resolución quirúrgica o incluso la pericardiectomía paliativa, la doxorrubicina es una opción terapéutica asequible y bien tolerada, que puede mejorar la calidad de vida del paciente, producir una respuesta tumoral objetiva y aumentar significativamente el tiempo de supervivencia esperado, pese a no tener un efecto claro en el TMS de todos los pacientes.
Bibliografía
- Chun R, Kellihan HB, Henik RA, Stepien RL. Comparison of plasma cardiac troponin I concentrations among dogs with cardiac hemangiosarcoma, noncardiac hemangiosarcoma, other neoplasms, and pericardial effusion of nonhemangiosarcoma origin. J Am Vet Med Assoc. 2010 Oct 1;237(7):806-11.
- Clifford CA, Mackin AJ, Henry CJ. Treatment of canine hemangiosarcoma: 2000 and beyond. J Vet Intern Med. 2000 Sep-Oct;14(5):479-85.
- De Nardi AB, de Oliveira Massoco Salles Gomes C, Fonseca-Alves CE, et al. Diagnosis, Prognosis, and Treatment of Canine Hemangiosarcoma: A Review Based on a Consensus Organized by the Brazilian Association of Veterinary Oncology, ABROVET. Cancers (Basel). 2023 Mar 29;15(7):2025.
- MacDonald KA, Cagney O, Magne ML. Echocardiographic and clinicopathologic characterization of pericardial effusion in dogs: 107 cases (1985-2006). J Am Vet Med Assoc. 2009 Dec 15;235(12):1456-61.
- Moirano S, Turek M, Sanchez D, Vail D, Van Asselt N, Lawrence J, Forrest L. Intensity-modulated radiotherapy and chemotherapy for canine right atrial tumors: A retrospective study of seven dogs. Vet Radiol Ultrasound. 2023 Nov;64(6):1099-1102.
- Mullin CM, Arkans MA, Sammarco CD, Vail DM, Britton BM, Vickery KR, Risbon RE, Lachowicz J, Burgess KE, Manley CA, Clifford CA. Doxorubicin chemotherapy for presumptive cardiac hemangiosarcoma in dogs†. Vet Comp Oncol. 2016 Dec;14(4):e171-e183.
- Treggiari E, Pedro B, Dukes-McEwan J, Gelzer AR, Blackwood L. A descriptive review of cardiac tumours in dogs and cats. Vet Comp Oncol. 2017 Jun;15(2):273-288.
- Weisse C, Soares N, Beal MW, Steffey MA, Drobatz KJ, Henry CJ. Survival times in dogs with right atrial hemangiosarcoma treated by means of surgical resection with or without adjuvant chemotherapy: 23 cases (1986-2000). J Am Vet Med Assoc. 2005 Feb 15;226(4):575-9.
- Wendelburg KM, Price LL, Burgess KE, Lyons JA, Lew FH, Berg J. Survival time of dogs with splenic hemangiosarcoma treated by splenectomy with or without adjuvant chemotherapy: 208 cases (2001-2012). J Am Vet Med Assoc. 2015 Aug 15;247(4):393-403.
- Yamamoto S, Hoshi K, Hirakawa A, Chimura S, Kobayashi M, Machida N. Epidemiological, clinical and pathological features of primary cardiac hemangiosarcoma in dogs: a review of 51 cases. J Vet Med Sci. 2013 Nov;75(11):1433-41.
 by Multimédica
by Multimédica