Linfoma alimentario en un gato con protocolo COP-metotrexato
Resumen breve
El linfoma alimentario es la presentación más común de linfoma en la especie felina. Se considera la neoplasia intestinal más frecuente, seguida de adenocarcinomas y mastocitomas. La edad media de presentación oscila entre los 10 y 13 años. En el caso que se describe, el protocolo elegido (COP/M) era el que mejor se adaptaba al paciente, ya que se reducen el número de sedaciones para las semanas que incluían quimioterapia vía intravenosa.Índice de contenidos

Introducción
El linfoma alimentario es la presentación más común de linfoma en la especie felina. Se considera la neoplasia intestinal más frecuente, seguida de adenocarcinomas y mastocitomas. La edad media de presentación oscila entre los 10 y 13 años.
El linfoma alimentario puede afectar a cualquier zona del tracto gastrointestinal (estómago, intestino delgado y/o intestino grueso). La presentación puede ser focal (una masa sólida) o difusa (engrosamiento generalizado de las capas intestinales), con o sin afectación de ganglios linfáticos abdominales u otros órganos.
Este tipo de linfoma se caracteriza por la infiltración de células linfoides tumorales en las capas del tracto gastrointestinal. Dependiendo del grado histológico, el linfoma alimentario felino se clasifica en 3 grupos diferentes:
- Linfoma alimentario de bajo grado (LABG)
- Linfoma alimentario de grado alto-intermedio (LAAG)
- Linfoma alimentario de células granulares (LACGG)
Caso clínico
Un gato Común europeo, macho, castrado, de 13 años, acude a consulta por vómitos esporádicos, diarreas y pérdida de peso. En la exploración física se evidencia caquexia (condición corporal 2/9), con un peso 2.9 kg, deshidratación del 5 %, y un efecto masa compatible en la palpación abdominal con asas intestinales y/o ganglios linfáticos abdominales.
En base a los datos, se realiza hemograma completo, bioquímica completa con SDMA y T4 total, iones, urianálisis y test FeLV/FIV. En los resultados, se identifica una anemia normocítica- normocrómica moderada (HCT 24.7 %, HGB 8.5 g/dl) sin reticulocitosis (RETIC 28.6 K/μl), asociada a una leucocitosis marcada (32.89 K/μl) (Figura 1), con moderados números de neutrófilos inmaduros y tóxicos (26.89 K/μl) en el frotis sanguíneo. En la bioquímica se obtiene leve de la ALT (283 U/l), con el resto de los parámetros y pruebas infecciosas dentro de la normalidad.
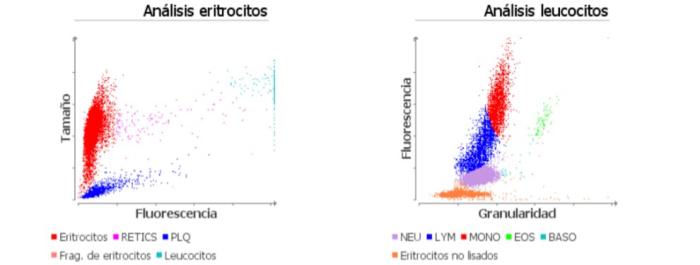
Figura 1. Gráfica de puntos de la serie roja y leucocitaria.
Se lleva a cabo una ecografía de abdomen que revela enteritis severa de todo el intestino delgado, con pérdida de la estratificación del yeyuno y dilatación severa de las asas intestinales. También se observa leve linfadenopatía yeyunal y líquido libre asociado (Figura 2) (Tabla 1).
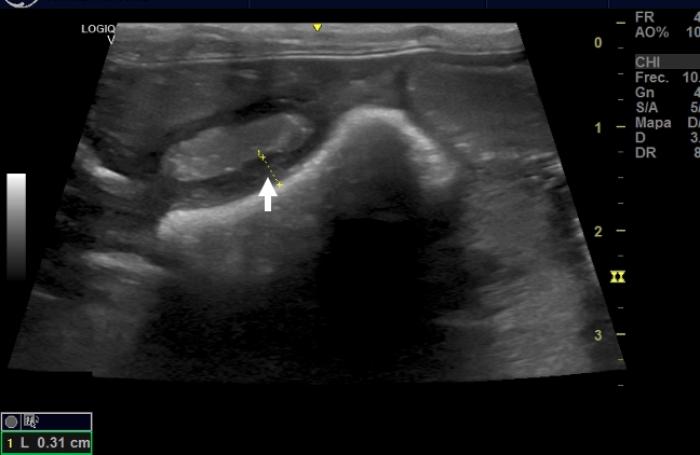
Figura 2. Imagen ecográfica de las paredes intestinales del paciente, observándose un grosor de (A) duodeno y (B) yeyuno por encima de lo normal (flechas blancas).
| Grosor normal de la pared intestinal |
|---|
| < o igual a 2,4 mm en duodeno < o igual a 2,8 mm en yeyuno < o igual a 3,2 mm en íleon < o igual a 1,7 mm en colon |
Tabla 1. Grosor de la pared normal de los diferentes tramos de intestino5.
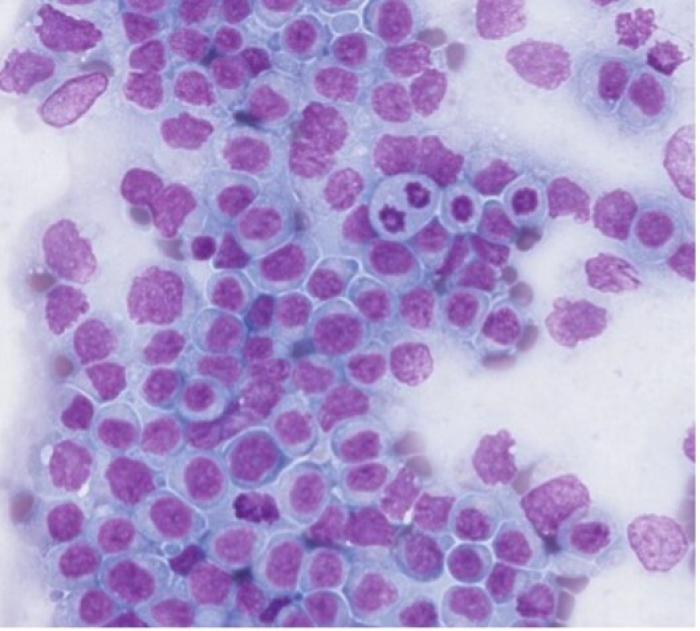
Dada la imagen en ecografía, se realiza una punción guiada por ecografía para su estudio citológico de la lesión intestinal y de ganglio linfático yeyunal, con resultado de un LAAG (Figura 3).
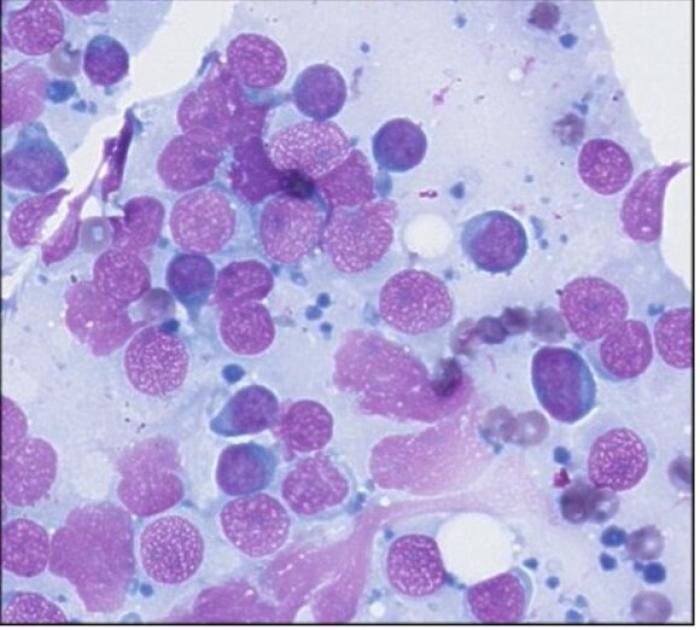
Figura 3. Citología de lesión intestinal y ganglionar donde se observan gran cantidad de linfocitos inmaduros y cuerpos glandulares correspondiente a un linfoma de alto grado.
Una vez obtenido el diagnóstico de LAAG se pauta prednisolona a razón de 1 mg/kg cada 12 h, además de comenzar con un protocolo de quimioterapia para linfoma de alto grado.
Dentro de todos los protocolos descritos para LAAG se encuentran:
- Protocolo CHOP
- Ciclofosfamida: 200 mg/m2 las semanas 2, 7, 13 y 21, PO o IV. Los comprimidos no deben de fraccionarse.
- Vincristina 0.7 mg/m2 IV las semanas 1, 3, 6, 8, 11, 15, 19 y 23.
- Doxorrubicina: 25 mg/m2 2 IV las semanas 4, 9, 17 y 23.
- Prednisolona: 2 mg/kg oral, cada 24 h durante 28 días, luego 1 mg/kg cada 48 h (ajustado y en pauta decreciente según recaída o efectos adversos).
- Protocolo COP
- Ciclofosfamida: 300 mg/m2 cada 21 días, PO o IV. Los comprimidos no deben fraccionarse.
- Vincristina: 0.7 mg/m2 IV cada 7 días durante 4 semanas y luego cada 3 semanas.
- Prednisolona: 2 mg/kg PO, cada 24 h durante 1 semana, luego 1 mg/kg oral a días alternos (ajustado y en pauta decreciente según recaída o efectos adversos).
- Protocolo COP/M (modificación de protocolo COP habitual)
- Día 1: vincristina 0.5 mg/m2 IV
- Día 8: ciclofosfamida 250 mg/m2 PO
- Día 15: vincristina 0.5 mg/m2 2 IV
- Día 21: metotrexato 10-12 mg/m2 PO
- Prednisolona 1-2 mg/kg cada 24 h durante todo el protocolo.
- Se repite el esquema durante 2 meses para luego pasar a cada dos semanas otros 2 meses.
En el caso aquí descrito el protocolo empleado fue COP/M. Este protocolo se ajustaba bastante bien al paciente ya que el manejo era complicado y para la colocación del catéter había que recurrir a la sedación, de manera que solo había que sedarle cada 2 semanas durante los primeros 2 meses. En el caso de la semana 2 y 4, los propietarios, bajo la supervisión veterinaria, le administraron la mediación oral en casa, siempre que el hemograma de revisión estuviera dentro de los rangos fisiológicos.
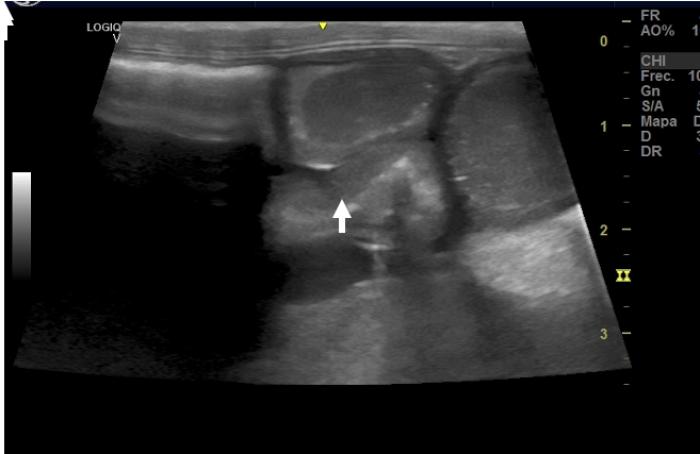
El paciente tolera bien el protocolo, sin presentar ningún efecto secundario asociado y, a partir de la tercera semana, comienza a ganar masa muscular y a dejar de presentar diarreas y vómitos. Al mes de terminar el primer ciclo de quimioterapia, se vuelve a realizar una ecografía de control para valorar la enfermedad mostrando una mejoría evidente, sin presencia de linfadenopatía ni líquido libre y la estratificación se observa conservada. Además, el hemograma se normaliza, la serie roja se encuentra en niveles normales y la leucocitosis marcada desaparece (Figura 4).
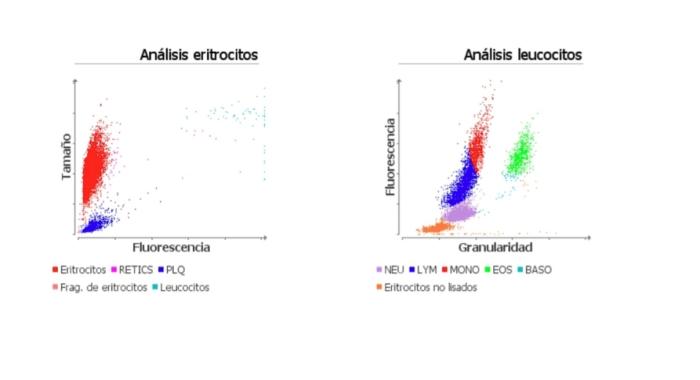
Figura 4. Gráfica de puntos de la serie roja y leucocitaria en la semana 4 de tratamiento.
El paciente recupera peso y masa muscular, hasta alcanzar los 4.1 kg, con buena calidad de vida, animado, apetito y, después de mucho tiempo, con buena consistencia de las heces. A partir del segundo mes, se espacian las dosis y se administran cada dos semanas hasta terminar otro ciclo más, con una pauta de prednisolona de 1 mg/kg cada 24 h, hasta completar un nuevo ciclo.
Al finalizar el protocolo, se realiza un estadio clínico completo con ecografía de abdomen, hemograma y bioquímica completa, mostrando todo dentro de la normalidad y sin lesiones que evidencien neoplasia. En este caso se alcanza una remisión completa del tumor, por lo que se decide dar el alta y se pautan revisiones al mes y medio, y luego cada 2-3 meses.
En la actualidad, el paciente se encuentra en remisión completa 6 meses después de su diagnóstico de LAAG.
Discusión
El LAAG se caracteriza por la infiltración de células linfoides tumorales de gran tamaño del tracto alimentario. Este tipo de linfoma puede ser de células B o T. El pronóstico de este tipo de linfoma suele reservado, con tiempos de supervivencia de 7-10 meses.
Dentro de los signos clínicos asociados destacan:
- Pérdida de peso
- Vómitos (Tabla 2)
- Diarrea
- Anorexia
| Causas de vómitos en gatos |
|---|
| Gastritis IBD Hipertiroidismo Neoplasias intestinales Pancreatitis Enfermedad renal Hepatopatías |
Tabla 2. Diagnósticos diferenciales de vómito en el paciente felino7.
En este caso, el paciente presentaba casi todos los signos clínicos, desde diarreas y vómitos, hasta pérdida de peso. La historia clínica es importante, así como la aparición de los primeros síntomas, ya que puede orientar hacia un tipo de linfoma alimentario (alto grado/bajo grado). Los signos clínicos de un linfoma linfocítico (bajo grado) pueden haber estado presentes durante meses, sin embargo, en el LAAG los signos clínicos suelen ser más agudos y severos. Además, en la mayoría de las ocasiones, en la exploración abdominal se palpan masas abdominales, que pueden ser lesiones en el propio tracto intestinal o linfadenopatía mesentérica.
Dentro del procedimiento diagnóstico, la ecografía es la técnica que orienta hacia el diagnóstico de linfoma alimentario, ya que permite evaluar las capas del tracto intestinal, así como identificar las masas que se hayan detectado en la exploración abdominal. Con la ecografía se evalúa el grosor de la pared intestinal, así como la localización de la lesión, y si el engrosamiento es focal o difuso.
En el caso del LAAG se observa, con alta frecuencia, engrosamiento de la pared intestinal con pérdida de la estructura normal de las diferentes capas intestinales, ecogenicidad reducida, hipomotilidad localizada y linfadenopatía mesentérica o lesiones en otros órganos abdominales.
La toma de muestra del tracto digestivo mediante una punción por aguja fina (PAF) puede ser bastante útil en el diagnóstico del linfoma alimentario, en especial en el diagnóstico de un LAAG, debido a que la población tumoral es de células linfoides inmaduras; exceptuando, en el caso de LACGG se requiere una tinción especial para observar los gránulos del citoplasma.
El pronóstico para el LAAG suele ser pobre, debido a que son muy pocas las veces que se llega a lograr la remisión completa. La mayoría de los pacientes necesitanhospitalización con tratamiento de soporte, además de protocolos de quimioterapia multimodal (COP o CHOP, ± L-asparaginasa y/o metotrexato), que se han mostrado más eficaces que los protocolos en monoterapia.
En el caso que se describe, el protocolo elegido (COP/M) era el que mejor se adaptaba al paciente, ya que se reducen el número de sedaciones para las semanas que incluían quimioterapia vía intravenosa. Por otro lado, en un estudio de 75 gatos con linfoma que fueron tratados con un protocolo de quimioterapia que consistía en vincristina, ciclofosfamida y metotrexato el 52 % de los pacientes alcanzaron la remisión completa.
Así, para los LAAG tratados con protocolos tipo COP/COP-M se describe una ratio de respuesta del 50-75 % con un rango de supervivencia media de 7-9 meses. Siendo el objetivo, en la mayoría de las situaciones, mantener estable al paciente con la mejor calidad de vida posible durante el mayor tiempo de vida.
Bibliografía
- Barrs VR, Beatty JA. Feline alimentary lymphoma: 1. Classification, risk factors, clinical signs and non-invasive diagnostics. J Feline Med Surg. 2012;14(3):182-190. doi:10.1177/1098612X12439265
- Daniaux LA, Laurenson MP, Marks SL, et al. Ultrasonographic thickening of the muscularis propria in feline small intestinal small cell T-cell lymphoma and inflammatory bowel disease. J Feline Med Surg. 2014;16(2):89-98. doi:10.1177/1098612X13498596
- Finotello R, Vasconi ME, Sabattini S, et al. Feline large granular lymphocyte lymphoma: An Italian Society of Veterinary Oncology (SIONCOV) retrospective study. Vet Comp Oncol. 2018;16(1):159-166. doi:10.1111/vco.12325
- Gieger T. Alimentary lymphoma in cats and dogs. Vet Clin North Am Small Anim Pract. 2011;41(2):419-432. doi:10.1016/j.cvsm.2011.02.001
- Goggin JM, Biller DS, Debey BM, Pickar JG, Mason D. Ultrasonographic measurement of gastrointestinal wall thickness and the ultrasonographic appearance of the ileocolic region in healthy cats.J Am Anim Hosp Assoc. 2000;36(3):224-228. doi:10.5326/15473317-36-3-224
- Gouldin ED, Mullin C, Morges M, et al. Feline discrete high-grade gastrointestinal lymphoma treated with surgical resection and adjuvant CHOP- based chemotherapy: retrospective study of 20 cases. Vet Comp Oncol. 2017;15(2):328-335. doi:10.1111/vco.12166
- Hauck SR, Gisselman K, Cordner A, Nicholson AG. Chronic Vomiting in Cats: Etiology and Diagnostic Testing.J Am Anim Hosp Assoc. 2016;52(5):269-276. doi:10.5326/JAAHA-MS-6290
- Hlavaty J, Ertl R, Mekuria TA, et al. Effect of prednisolone pre-treatment on cat lymphoma cell sensitivity towards chemotherapeutic drugs. Res Vet Sci. 2021;138:178-187. doi:10.1016/j.rvsc.2021.06.014
- Jeglum KA, Whereat A, Young K. Chemotherapy of lymphoma in 75 cats.J Am Vet Med Assoc. 1987;190(2):174-178.
- Kleinschmidt S, Harder J, Nolte I, Marsilio S, Hewicker-Trautwein M. Chronic inflammatory and non-inflammatory diseases of the gastrointestinal tract in cats: diagnostic advantages of full-thickness intestinal and extraintestinal biopsies. J Feline Med Surg. 2010;12(2):97-103. doi:10.1016/j.jfms.2009.07.004
- Krick EL, Little L, Patel R, et al. Description of clinical and pathological findings, treatment and outcome of feline large granular lymphocyte lymphoma (1996-2004). Vet Comp Oncol. 2008;6(2):102-110. doi:10.1111/j.1476-5829.2007.00146.x
- Marsilio S. Differentiating Inflammatory Bowel Disease from Alimentary Lymphoma in Cats: Does It Matter. Vet Clin North Am Small Anim Pract. 2021;51(1):93-109. doi:10.1016/j.cvsm.2020.09.009
- Marsilio S, Freiche V, Johnson E, et al. ACVIM consensus statement guidelines on diagnosing and distinguishing low-grade neoplastic from inflammatory lymphocytic chronic enteropathies in cats. J Vet Intern Med. 2023;37(3):794-816. doi:10.1111/jvim.16690
- Moore PF, Rodriguez-Bertos A, Kass PH. Feline gastrointestinal lymphoma: mucosal architecture, immunophenotype, and molecular clonality. Vet Pathol. 2012;49(4):658-668. doi:10.1177/0300985811404712
- Roccabianca P, Vernau W, Caniatti M, Moore PF. Feline large granular lymphocyte (LGL) lymphoma with secondary leukemia: primary intestinal origin with predominance of a CD3/CD8(alpha)(alpha) phenotype. Vet Pathol. 2006;43(1):15-28. doi:10.1354/vp.43-1-15
- Simon D, Eberle N, Laacke-Singer L, Nolte I. Combination chemotherapy in feline lymphoma: treatment outcome, tolerability, and duration in 23 cats. J Vet Intern Med. 2008;22(2):394-400. doi:10.1111/j.1939-1676.2008.0057.x
- Smallwood K, Harper A, Blackwood L. Lomustine, methotrexate and cytarabine chemotherapy as a rescue treatment for feline lymphoma. J Feline Med Surg. 2021;23(8):722-729. doi:10.1177/1098612X20972066.
- Waite AH, Jackson K, Gregor TP, Krick EL. Lymphoma in cats treated with a weekly cyclophosphamide-, vincristine-, and prednisone-based protocol: 114 cases (1998-2008).J Am Vet Med Assoc. 2013;242(8):1104-1109. doi:10.2460/javma.242.8.1104
- Williams LE, Pruitt AF, Thrall DE. Chemotherapy followed by abdominal cavity irradiation for feline lymphoblastic lymphoma. Vet Radiol Ultrasound. 2010;51(6):681-687. doi:10.1111/j.1740-8261.2010.01723.x
 by Multimédica
by Multimédica