Colectas pleurales en el paciente felino
Resumen breve
Se realiza una recopilación bibliográfica sobre los puntos relevantes para la aproximación diagnóstica de los pacientes felinos con colecta pleural, entidad, por su casuística, de importancia clínica en todos los países del mundo. Dado que los felinos tienen particularidades en la forma de presentación y en las causas que originan dichas colectas, se considera fundamental poder interpretar las características del contenido y trabajar en consecuencia.Índice de contenidos
Introducción
Los sacos pleurales están formados por una membrana serosa que asienta en la cara interna de la cavidad torácica (pleura parietal) y a nivel del mediastino se invaginan y cubren la superficie pulmonar, en forma de pleura visceral. Queda así, entre ambas hojas un espacio virtual, la cavidad pleural, que contiene una delgada capa de líquido seroso, lo que permite que las pleuras parietal y visceral se deslicen suavemente una sobre la otra durante los movimientos respiratorios.
Histológicamente cada saco pleural está compuesto de una capa de células escamosas simples (mesotelio), que descansa sobre una lámina de tejido conectivo o lámina propia, formada por colágeno y tejido elástico. El grosor de este tejido conectivo es mayor a nivel pulmonar que parietal, y a nivel mediastínico está fenestrado, comunicado por pequeñas foraminas, y es tan delgado que no es inusual que se rompa cuando existen cambios significativos en la presión entre los sacos, permitiendo la libre comunicación entre ellos.
La pleura parietal recibe el aporte sanguíneo de las arterias intercostales, torácica interna y frénica. La pleura pulmonar, en los felinos, recibe su irrigación a partir de los vasos pulmonares; es debido a esto que la irrigación aumenta en la inspiración y no puede ser eliminada ninguna colecta líquida con volumen medio o abundante de manera efectiva mediante la implementación de diuréticos.
Fibras sensoriales procedentes de los nervios espinales torácicos inervan a la pleura parietal, haciéndola muy sensible a la irritación y al dolor a diferencia de la pulmonar, que al ser inervada por fibras parasimpáticas y simpáticas con función motora es insensible a estímulos nocivos.
En el espacio pleural se forma constantemente el líquido, que baña las superficies de la pleura y es removido hacia la circulación general. Cuando se produce un exceso en su producción o una falla en la extracción se acumula dicho líquido en este espacio.
Toda colecta pleural se define, entonces, como el cúmulo de aire o líquido entre las capas parietal y visceral de la pleura.
Aspectos clínicos
En medicina felina el motivo de consulta suele ser la depresión-anorexia del paciente, por lo que el médico veterinario resulta el encargado, mediante una buena aproximación clínica, de determinar la existencia de aflicción respiratoria indicativa de colecta pleural.
Por lo general los pacientes felinos que presentan colectas de tipo crónico tienen menor evidencia de signos que los que sufren de colectas agudas, por lo que puede sugerirse que el grado de angustia respiratoria no está condicionado al volumen sino a la velocidad de formación.
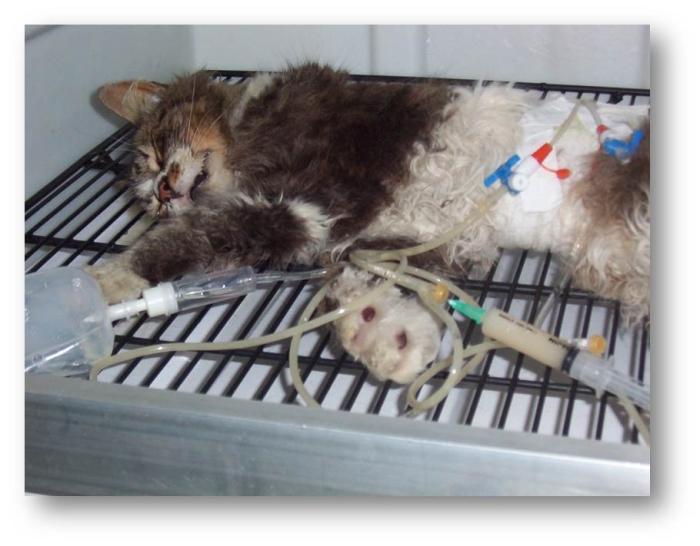
Durante la anamnesis los propietarios relatan intolerancia al ejercicio (manifestada con menor movilidad), posición esternal al descansar y resistencia a la recumbencia lateral. Los gatos dejan de dormir ovillados, tomando posición “de esfinge” (ortopneica). A diferencia de los caninos, no realizan abducción marcada de los codos ni elongación evidente de cuello. En casos severos hay respiración a boca abierta, y raramente se presenta tos (Vídeo 1, Figura 1).
Vídeo 1. Paciente con disnea por colecta torácica

En el examen físico se observan grados variables de deshidratación, aumento de la frecuencia respiratoria con esfuerzo inspiratorio o mixto, y a la auscultación disminución de sonidos pulmonares y cardíacos (tórax “apagado”). Puede realizarse percusión con el paciente de pie, donde los sonidos claros pulmonares están reemplazados, hacia ventral por sonidos sub-mates en el caso de colectas líquidas, o hacia dorsal por sonidos parcialmente timpánicos en el caso de colectas de aire.
Según el estado del paciente, la confirmación de la colecta se realiza mediante radiología torácica, ultrasonografía y toracocentesis, condicionando la prioridad del método a emplear al grado de aflicción respiratoria que se observe. Como primera medida se recomienda realizar oxigenoterapia en jaula, caja de oxígeno o por implementación de collar isabelino cubierto o máscara. En un gran número de casos es imprescindible realizar sedación con tranquilizantes mayores o menores o combinación opioides-benzodiacepinas (Tabla 1).
Tabla 1. Tabla de sedación.
| Butorfanol | Mayor potencia sedativa con estabilidad cardiorrespiratoria |
| Tramadol/midazolan | Permite maniobrar a la mayoría de los pacientes. El midazolan es menos errático y permite la vía IM |
| Acepromacina/nalbufina | Gran combinación neuroléptica. Mala analgesia |
| Medetomidina/dexmedetomidina | Muy seguras con la ventaja de los alfa 2 sin los grandes efectos negativos |
| Morfina (?) | Antiguamente se pensaba que disminuía los requerimientos de O2, pero solo tiene efecto sedante |
| Xilacina (?) | Puede usarse, no es de elección por el efecto emético |
| Propofol | En combinación con benzodiacepinas, dosis a efecto. Muy seguro en dosis correcta |
| Midazolan-Ketamina | Anestesia accesible por vía IM |
Toracocentesis
Es el método primario de elección frente a toda sospecha de colecta pleural, no solo por ser diagnóstico sino también porque, ante la posibilidad de encontrar un acúmulo de aire o líquido en la cavidad pleural, sin importar la causa que lo originara, permite aliviar y salvar la vida del paciente.
Procedimiento:
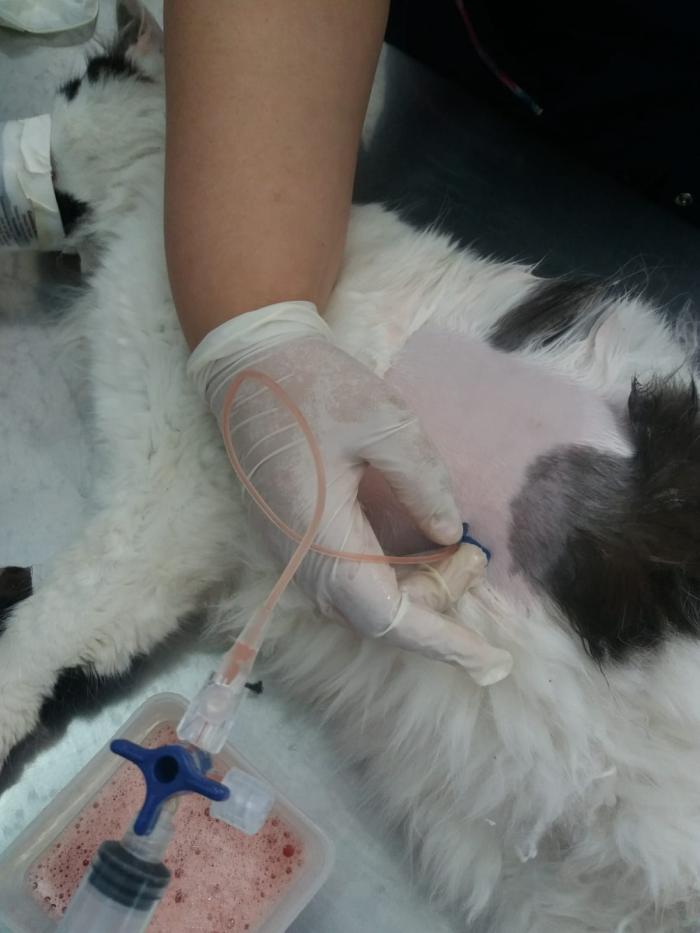
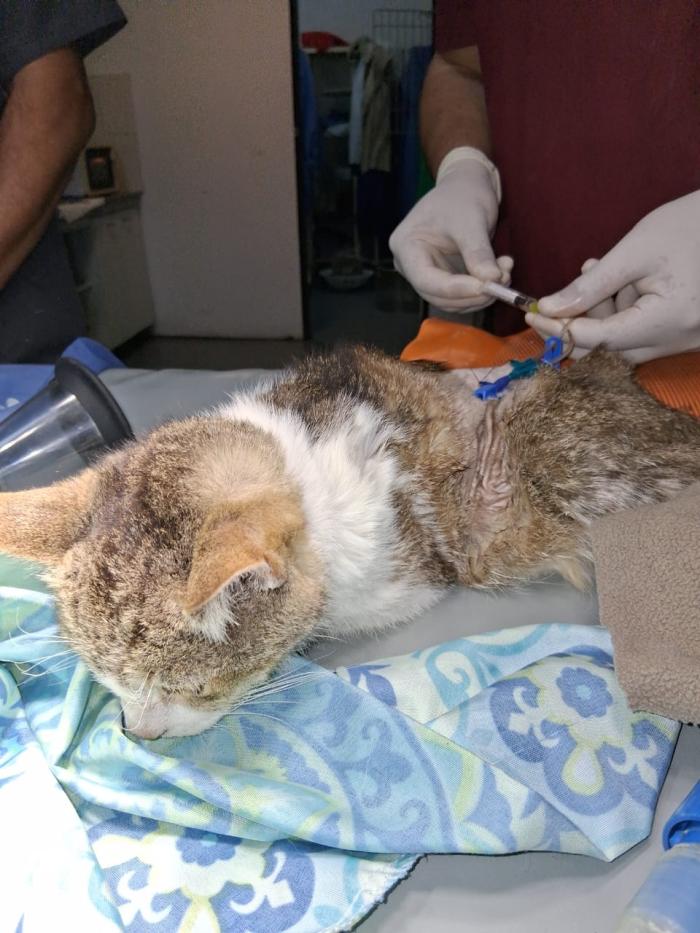
-Rasurar un área amplia de piel, entre el 4o y 8o espacio intercostal. Realizar limpieza con soluciones antisépticas de rutina.
-Con aguja 25/8, Butterfly nº 19 o catéter nº 20 punzar la piel entre el 7o-10o espacio intercostal (EI), pudiendo tunelizar o no hasta el 6o EI. Introducir la aguja con el bisel hacia la pared torácica por craneal al borde costal, para evitar lesionar el paquete vasculonervioso que transita por la cara caudal.
-Realizar succión continua, suavemente, con jeringa no mayor a 10 cc, por el riesgo de producir lesiones en el parénquima pulmonar por succión excesiva.
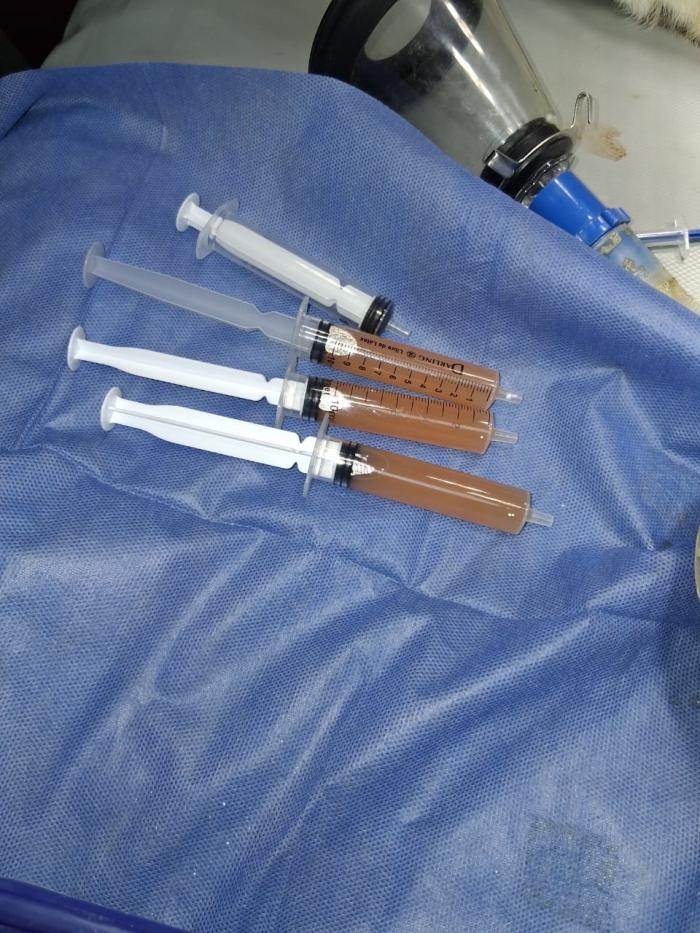
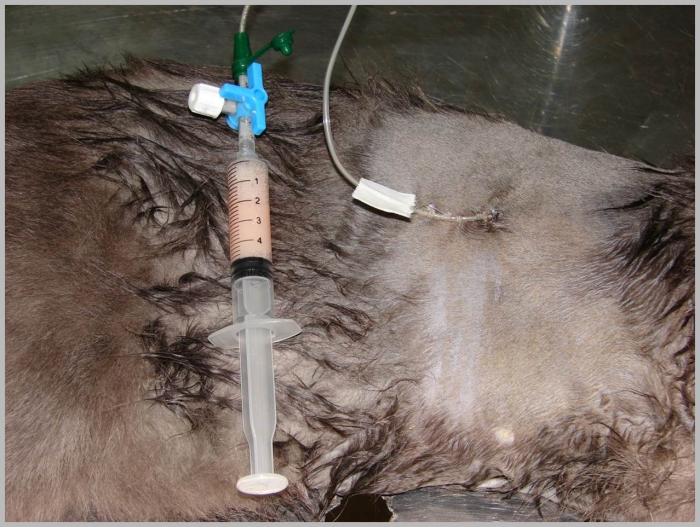
-Mensurar el volumen de líquido o aire extraído de cada hemitórax, separando muestras para su envío a laboratorio (Figura 2A-B).
Diagnóstico por imágenes
Radiología
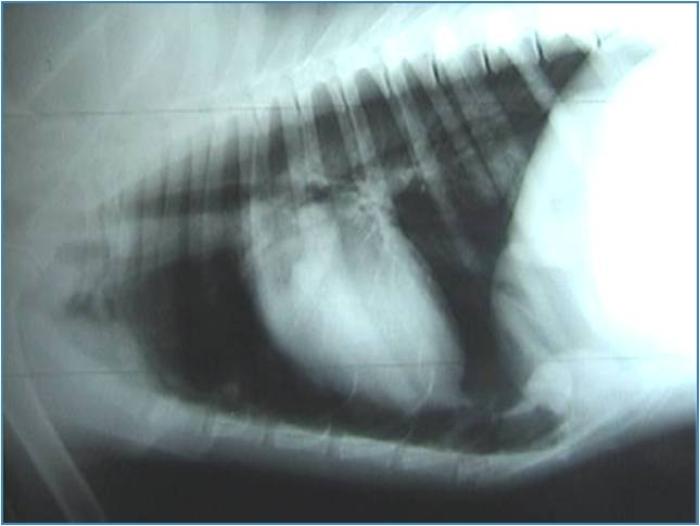
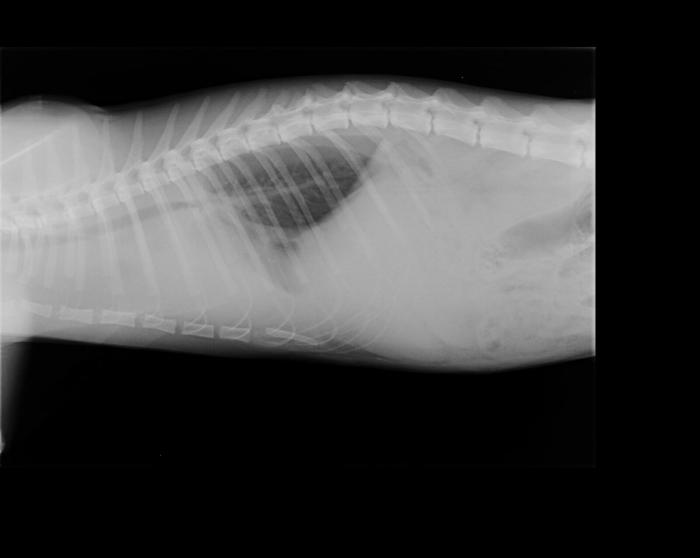
Debe llevarse a cabo con un animal estabilizado y con respiración normal (es decir, jamás con un paciente disneico o cuya oximetría de valores por debajo de lo normal). Es el método más práctico para evaluar tanto continente como contenido de la cavidad torácica, siendo conveniente solicitar al menos dos incidencias (por lo general se realiza laterolateral izquierdo o derecho y dorsoventral o ventrodorsal según el paciente lo permita). Así, se evalúa no solo si existe alguna alteración puntual de la cavidad sino también qué hemitórax se encuentra más afectado, si lo hubiera. Este método permite observar, aparte de la existencia de colectas, fracturas de costilla, rupturas diafragmáticas, presencia de masas, desviaciones viscerales, cuerpos extraños, agrandamiento de la silueta cardíaca o alteración de los patrones vasculares. Los signos radiológicos de colecta de aire son los siguientes: retracción de uno o ambos pulmones con respecto de la pared torácica, mayor densidad del pulmón debido a su colapso, desplazamiento dorsal de la silueta cardíaca.
En el caso de colectas líquidas se hallan: fisuras interlobares ensanchadas, con aumento de densidad de tejidos blandos, retracción del pulmón, quedando un espacio entre este y la pared con radiodensidad similar a los tejidos blandos, redondeamiento de la fisura costofrénica, disminución de visibilidad de la silueta cardíaca y contorno diafragmático poco definido (Figura 3A-B).
Ultrasonografía
Permite evaluar presencia de líquido o gas, masas intratorácicas, contractilidad cardíaca, grandes vasos y ganglios. En el caso de pacientes que no estén estables de manera efectiva, lo ideal es realizar una T-Fast (acrónimo del inglés“Focussed Assessment with Sonography for Trauma”) donde pueda aproximarse a un diagnóstico definitivo sin generar más lesión al paciente por posicionamiento o sometimiento al método. Es importante aclarar que, si bien se ha implementado la T-Fast asociada de manera directa al trauma, puede y debe implementarse en cualquier animal que tenga signos clínicos asociados a afecciones torácicas para diagnosticar diferentes entidades, como edema pulmonar, presencia de masas o focos contusos o atelectásicos, alteraciones pericárdicas y, por supuesto, colectas.
Clasificación de las colectas
Neumotórax
Es la colecta de aire, evidenciable clínica y radiológicamente. Las causas que lo originan son todas aquellas que produzcan disrupción de la pleura o ruptura del parénquima pulmonar. Por esto puede presentarse después de traumatismos, en forma de neumotórax abiertos o cerrados, o ser secundario a rupturas de bronquios y bullas pulmonares (Figura 4).
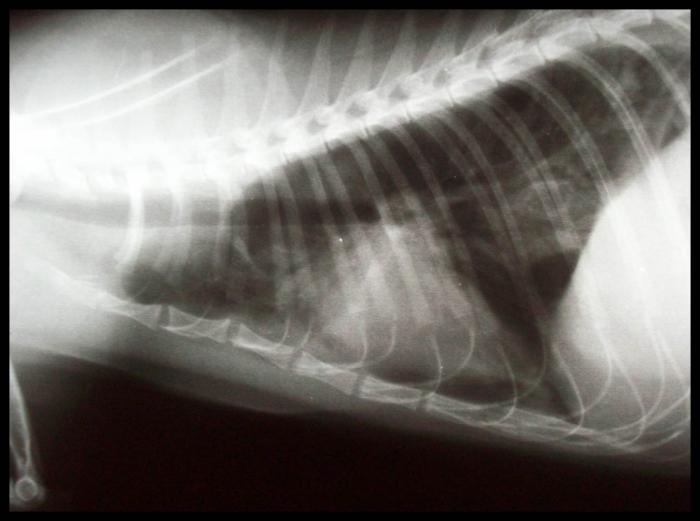
A diferencia de los caninos y los seres humanos, el neumotórax a tensión no es tan frecuente en felinos, aunque puede presentarse.
Otra causa de neumotórax se presenta a partir de la formación de un neumomediastino previo, por lo que debe tenerse en cuenta la posibilidad de encontrarlo en todo caso de desgarro traqueal por mordeduras, traumas de tráquea cervical caudal, obstrucciones de vía aérea y posterior a la colocación de tubos endotraqueales.
Colectas líquidas
Aquí se hallan diferentes tipos. Una vez realizada la toracocentesis deben remitirse a laboratorio muestras en tubos con y sin EDTA para realizar el análisis físico químico del líquido, citología y cultivo-antibiograma. Cierta aproximación diagnóstica puede hacerse, mientras se esperan los resultados del laboratorio, mediante la observación macroscópica de la colecta, la determinación de sólidos totales y densidad (a partir del uso de refractómetro), así como también la celularidad total evaluarse con la centrifugación en tubos de microhematocrito, realizando un frotis con cualquier tinción supravital (Giemsa, T15, etc.).
Una vez obtenidos los resultados se formula el plan terapéutico específico para cada caso.
Trasudados y trasudados modificados
Los trasudados poseen baja concentración de proteínas, llegando sólo a encontrarse hasta el doble de la concentración normal del espacio pleural. Nunca es superior a los 3 mg/dl, y la carga celular está por debajo de 1000 células por microlitro. Estas células son macrófagos, linfocitos y células mesoteliales descamadas.
En el caso de los trasudados modificados la concentración proteica asciende hasta 3.5 mg/dl, y la celularidad aumenta, pudiendo encontrarse neutrófilos. Microscópicamente el líquido es incoloro a ambarino claro, y no tiende a coagular.
Existen tres causas posibles para la formación de trasudados: la reducción de la presión oncótica sistémica (hipoalbuminemia), la obstrucción del drenaje linfático (a partir de neoplasias compresivas o rupturas diafragmáticas) o por aumento de la presión hidrostática (insuficiencia cardiaca derecha, enfermedad pericárdica), causa menos probable en felinos que en otras especies.
Exudados asépticos
La concentración de proteínas totales es mayor a los 3 mg/dl, y aumenta también la celularidad. Se hallan células mesoteliales, macrófagos y linfocitos, que pueden estar reactivos, neutrófilos no tóxicos y eosinófilos.
Dentro de los diagnósticos diferenciales están las efusiones pleurales causadas por pleuroperitonitis infecciosa felina, que origina colectas con alta concentración proteica y líquido ambarino a rosado con flóculos de fibrina característicos en su interior (Figura 5). La ruptura diafragmática crónica, frecuente en consultas posteriores a traumatismos, incluso con años de evolución, las neoplasias, siendo la más frecuente el linfoma mediastínico y en segundo lugar el timoma, aunque pueden hallarse metástasis de diferente origen.

Exceptuando el caso de linfoma, que suele exfoliar células hacia la efusión, en la mayoría de los casos solo se encuentran células mesoteliales hiperplásicas por los cambios inflamatorios, por lo que el diagnóstico debe realizarse por otro método (aspiración o biopsia). Debe resaltarse el hecho de que, en todo paciente que esté cursando con SIRS (Síndrome Inflamatorio de Respuesta Sistémica) por cualquier causa, la posibilidad de este tipo de exudado tiene que ser tenida en cuenta, y es este el motivo por el cual muchas veces los pacientes felinos con pancreatitis llegan con efusión pleural/disnea como motivo de consulta.
Exudados sépticos
El piotórax es una consecuencia frecuente de heridas penetrantes (mordidas, arañazos), neumonías y abscesos pulmonares, secundario a drenajes por otras causas realizados con asepsia deficiente, migraciones bacterianas hematógenas o linfáticas y, en mucha menor medida, perforación esofágica. Los recuentos celulares son altos, superiores en algunos casos a las 100.000 células por microlitro, y en su mayoría son neutrófilos tóxicos. Pueden observarse bacterias intra y extracelulares. El líquido extraído tiene coloración variable, de rosado a marrón verdoso, y no es inusual el olor pútrido. No puede descartarse la presencia de elementos fúngicos hasta el resultado de laboratorio (Figura 6).
Quilotórax
La colecta se produce por el derrame del contenido del conducto torácico, o la imposibilidad de drenaje linfático regional. Puede ser secundario a traumas, neoplasias, ruptura diafragmática, dirofilaria y torsión de lóbulo pulmonar. En algunos casos el origen no puede determinarse, por lo que se lo clasifica como idiopático, una vez descartadas las causas anteriores. Macroscópicamente el exudado es blanquecino-lechoso, pudiendo tener un leve tinte rosado (Figura7).
La concentración de proteínas es menor a la hallada en sangre, y la celularidad la conforma casi exclusivamente linfocitos, pudiendo encontrarse algunos neutrófilos y macrófagos, producto de la irritación pleural. Se diagnostica relacionando la concentración de triglicéridos sanguíneos con los de la colecta, que debe ser mayor en esta última. Una variante de presentación macroscópica similar es el pseudoquilo, en donde los triglicéridos no superan a los encontrados en sangre, y que se presenta como exclusivamente secundario. Hasta hace pocos años se buscaba diferenciar entre quilo y pseudoquilo, pero a los fines prácticos ya no se considera relevante.
Efusión hemorrágica
Puede ser secundaria a traumatismos, neoplasias y torsión de lóbulo pulmonar. Muy rara vez se la encuentra asociada a intoxicaciones con derivados warfarínicos como único signo, y los felinos tienen menor estadística de intoxicación con estos productos que los caninos. Macroscópicamente el líquido es rojo, con composición similar a la sanguínea, pero puede verse eritrofagocitosis y células inflamatorias en el análisis de laboratorio.
Tratamiento de quilotórax, hemotórax, neumotórax y piotórax
Quilotórax
Es una enfermedad compleja con muchas causas posibles. El manejo de esta enfermedad debería dirigirse a identificar la etiología, si es factible, y tratar el disturbio subyacente.
El tratamiento de los gatos con cardiomiopatía y quilotórax se basa principalmente en la paliación, con toracocentesis, y mejoría del volumen minuto y reducción de las presiones venosas con farmacoterapia apropiada. En los casos que tengan dirofilariasis, tratamiento de la misma.
Si se identifica una masa mediastínica anterior se debe realizar aspiración con aguja fina para determinar el tipo de tumor o tejido y luego realizar terapia específica (quimioterapia, radioterapia, cirugía, antifúngicos). En estos animales la efusión quilosa se debe a la compresión de la vena cava craneal por la masa y la reducción de la misma puede redundar en la resolución del líquido pleural.
En los gatos con quilotórax idiopático, inicialmente se recomienda el tratamiento médico paliativo, porque la condición puede resolver en forma espontánea. El tratamiento de estos casos es difícil por que no hay medidas de eficacia significativa.
El tratamiento médico inicial consiste en toracocentesis a demanda para aliviar la disnea o colocación de tubo de toracostomía para evitar punciones frecuentes en los casos que la producción de quilo sea continua. Es necesario cubrir las necesidades nutricionales con una dieta hipograsa (ya no se recomienda suplementar con triglicéridos de cadena reducida o media, porque los gatos tienden a rechazar su sabor y son de eficacia cuestionable). También se debe suplementar con una benzopirona como rutin 50-100 mg/kg/8 h PO, producto que puede adquirirse en dietéticas y comercios de venta de productos naturales.
Cuando el manejo médico es impráctico o insatisfactorio y sobre todo en aquellos animales que no tienen enfermedad subyacente, se puede considerar la intervención quirúrgica. Las opciones quirúrgicas comprenden ligadura del conducto torácico asociado a linfangiografía mesentérica previa, pericardiectomía, comunicación pleuroperitoneal pasiva o activa y pleurodesis (las primeras dos son las más recomendadas). La pleurodesis química o quirúrgica es improbable que tenga éxito en los gatos con quilotórax y si bien en perros hay descripción del uso de sangre entera para realizar la pleurodesis, en gatos existe muy poca bibliografía al respecto, por lo cual aún no puede ser sugerida.
Hemotórax
Los orígenes de la hemorragia pueden ser variados, pero se conoce que las lesiones de los grandes vasos intratorácicos rara vez dan como resultado un animal vivo en la emergencia, a su vez las lesiones pulmonares rara vez dan hemotórax masivo debido a la baja presión de la circulación. Los vasos involucrados con mayor frecuencia son los intercostales, que pueden presentar sangrados profusos y persistentes. Además de las causas traumáticas puede ocurrir por disturbios hemostáticos sistémicos (inmuonomediados, intoxicación con derivados warfarínicos), neoplasias, torsión de lóbulo pulmonar.
El hemotórax tiene 2 consecuencias mayores: la primera es la pérdida de volumen sanguíneo circulante dentro del espacio pleural, conduciendo al shock hipovolémico, y la segunda es el deterioro de la ventilación debido a la compresión pulmonar por la invasión de líquido.
La contusión pulmonar asociada en los casos traumáticos, con mayor frecuencia es causa de la disnea, más que de la efusión.
El diagnóstico se basa en el examen clínico y en la toracocentesis. Esta debe realizarse en forma aséptica debajo de la unión costocondral con el animal de pie o en decúbito esternal. Para evacuar el espacio pleural de forma apropiada es necesario aspirar ambos hemitórax. Una vez estable el paciente debe realizarse estudio radiológico del tórax por posibles patologías concomitantes.
El tratamiento depende del grado de hemotórax, los casos de baja intensidad se tratan en forma conservadora y deberían resolverse en 1 o 2 semanas, el hemotórax extenso debe encaminarse a un pronto reemplazo del volumen de sangre circulante perdido, la expansión de los pulmones colapsados y el control de la hemorragia.
El tratamiento del shock es la primera consideración. Debe evaluarse la posible autotransfusión de la sangre recolectada por toracocentesis.
La hemorragia de la pared torácica en los pacientes con coagulopatías debe resolverse con la terapia apropiada para el desorden subyacente. Aunque no es aconsejable la autotransfusión de la sangre pleural promovida por diátesis warfarínica, en los casos graves esta puede salvar la vida del paciente hasta que se encuentre un donante propicio para obtener plasma o sangre entera.
Neumotórax
El tratamiento del neumotórax depende de las circunstancias de su aparición y la presencia o ausencia de complicaciones. La mayoría de los casos de neumotórax pueden manejarse con éxito mediante métodos no quirúrgicos. Los casos leves responden al descanso en jaula y observación. Los sedantes no narcóticos pueden emplearse en animales excitables, las pequeñas cantidades de aire se absorben en pocos días al sellar las fugas. El tratamiento en la urgencia se basa en la toracocentesis descompresiva para restaurar la presión sub-atmosférica, suministro de oxígeno y terapia de lesiones asociadas. En el caso de heridas abiertas estas deben ser selladas con un apósito impermeable (vaselina estéril o nitrofurazona en pasta) y luego drenar el aire acumulado, de forma tal de transformar un neumotórax abierto en uno cerrado para poder realizar luego la centesis. Estos pacientes, en la evaluación secundaria y si corresponde, son llevados a cirugía para la colocación de un tubo de drenaje pleural, debridamiento, lavado y sutura de las lesiones. En el caso de que ocurriera un neumotórax a tensión, es fundamental la colocación de tubo torácico para poder mantener constante la evacuación del aire y permitir el cierre del defecto (habitualmente pulmonar) con el tiempo.
Piotórax
El drenaje del exudado séptico es esencial en el tratamiento del piotórax. Al igual que cualquier cavidad abscesada, no puede haber resolución sin el drenaje completo del material séptico.
Los pacientes en condición riesgosa se deben estabilizar con terapia antishock, oxígeno y toracocentesis, antes de proceder a la colocación del tubo de toracostomía, para reducir la incidencia de hipotensión y apnea durante el procedimiento. Muy pocos pacientes requieren la colocación bilateral de tubos a causa de un mediastino completo que impida la evacuación de ambos hemitórax con un solo tubo torácico. Los pacientes responden con mayor rapidez mediante la aspiración constante del exudado y los lavajes correspondientes. Aunque la aspiración intermitente es adecuada y muchas veces más práctica, esta se realiza con jeringa idealmente cada 2 horas en los primeros días de tratamiento hasta que se reduce el volumen producido y se puede prolongar el intervalo. El lavado de la cavidad torácica debe realizarse 2 veces al día con la infusión lenta de 10 ml/kg de solución salina estéril tibia instilada dentro del tórax, luego se procede a girar con suavidad al paciente de lado a lado y pasados unos minutos se extrae el líquido. Se deben realizar radiografías cada 24-48 horas para asegurar que el tórax se está drenando completamente.
La decisión de extraer el tubo torácico se fundamenta en el volumen de líquido producido (<2 ml/kg), en las características citológicas del mismo (las bacterias ya no deben estar presentes intra o extracelularmente, los neutrófilos persistirán un tiempo pero no deben ser degenerativos) y que en las radiografías no se vea acumulación de líquidos.
Se retira el tubo y se monitorea el paciente unas 24 horas por el desarrollo de neumotórax o recurrencia de la colecta. Luego debe hacerse un control radiológico semanal hasta terminar la antibioticoterapia. Una vez concluida la misma, es ideal controlar a los 7, 15 y 30 días radiológicamente.
Antibioticoterapia
Los antibióticos se deben administrar, al menos al comienzo de la terapia, por vía endovenosa. Inicialmente debe tomarse muestra para realizar cultivo/antibiograma, pero entre tanto puede orientarse a partir de un Gram o realizar cobertura a 4 cuadrantes. Los antibióticos orales se utilizan cuando se observa evolución favorable, por lo usual a partir de la extracción del tubo torácico, y debe continuarse por 4-6 semanas.
La toracotomía exploratoria se indica cuando se identifican nichos infecciosos, para eliminar tejido fibrótico o cuerpos extraños y en los pacientes que no responden al tratamiento médico, evidenciado por la necesidad continua del tubo torácico durante más de 1 semana después de comenzar el tratamiento apropiado.
En todos los casos de colectas líquidas potencialmente irritantes para la pleura (fundamental considerarlo en hemotórax, piotórax y quilotórax) se sugiere considerar la posibilidad de realizar una toracoscopia evaluatoria, dada la posibilidad de que se generen “nichos” a partir de la presencia de bridas de fibrina que aíslan áreas entre la serosa visceral y parietal, con lo cual se sostiene la afección más allá del tratamiento instaurado.
Bibliografía
- August, J.R : Consultas en Medicina Interna Felina I. Edit.Intermédica, 1993.
- Ettinger, S; Feldman, E : Tratado de Medicina Interna Veterinaria, enfermedades del perro y el gato, Vol I. Edit. Intermédica, 1997.
- Fossum T.W. et al. Cirugía en pequeños animales (3ª ed, 2009). Cap.30, 913-924. Elsevier España.
- King L. Enfermedades Respiratorias en el Perro y en el Gato. Multimédica Ediciones Veterinarias, Barcelona, España, 2006.
- Little, S. E. (2016). El gato: medicina interna. Editora Roca.
- Montoya Alonso A, Garcia Guasch L, Manual de enfermedades respiratorias en animales de compañía. Multimédica Ediciones Veterinarias, Barcelona, España, 2016.
- Mouly J., Emergencias y cuidados críticos en pequeños animales, Multimédica ediciones, Barcelona, España, 2023.
- Nelson, R; Couto, G. En Medicina interna de pequeños animales 4ta ed.(pp. 1342- 1344). Barcelona: Elsevier
- Ruiz M.D, Vessières F, Ragetly G.R, y Hernandez J.L. (2018). Characterization of and factors associated with causes of pleural effusion in cats. J Am Vet Med Assoc. 15;253(2):181-187.
- Sisson and Grossman's The Anatomy of the Domestic Animals, 5ta Ed, 2005, Masson SA, Barcelona.
- Slatter : Tratado de Cirugía en Pequeños Animales, Vol II, Edit. Intermédica, 2006.
- Thrall : Tratado de Diagnóstico Radiológico Veterinario, Edit Intermédica, 2009.
- Torrente, Bosch - Medicina De Urgencia En Pequeños Animales - Tomo1
 by Multimédica
by Multimédica