POCUS en patología venosa portal: revisión bibliográfica y criterios diagnósticos para la detección de shunt congénitos extrahepáticos en pequeños animales mediante ecografía en modo B (PARTE II/II)
Resumen breve
Los shunts congénitos extrahepáticos representan una de las malformaciones venosas del abdomen más frecuentes en medicina veterinaria. En este trabajo se realiza una revisión de las clasificaciones actuales de shunts y se propone una sistematización del estudio ecográfico acorde para su diagnóstico.Índice de contenidos
Sistematización de la búsqueda de shunts extrahepáticos
Clásicamente la búsqueda de shunt por ecografía consistía en identificar un vaso anómalo o signos indirectos de su existencia: microhepatia, nefromegalia, sedimento o cálculos vesicales, dilataciones focales en la vena cava caudal y/o cambios de diámetro en la vena porta. Sin embargo, con la evolución de la ecografía vascular, y por lo inconstante de los signos indirectos, la búsqueda de shunt debe partir desde la evaluación vascular del abdomen. Se inspecciona el tronco principal de la vena porta y sus afluentes, así como también la vena cava caudal, arteria aorta abdominal y vena ácigos derecha. Para evaluar los vasos mencionados se utiliza un abordaje coronal derecho, sobre la línea del hombro y la línea axilar, a la altura de la región paracostal e intercostal 10-12° (Vídeo 1). La línea del hombro es una línea imaginaria que se extiende desde el acromion de la escápula hacia caudal, paralela a la columna lumbar, mientras que la línea axilar es aquella que se extiende desde el pliegue axilar hacia caudal30.
Vídeo 1. Abordaje desde la línea axilar sobre el plano coronal derecho para la visualización de la porción extrahepática de la vena porta.
Los objetivos de realizar estos abordajes ecográficos son:
- Evaluar la anatomía ecográfica vascular de la porción extrahepática de la vena porta, arteria aorta abdominal, vena ácigos derecha y vena cava caudal.
- Identificar la presencia de vasos anómalos.
- Calcular índices relativos comparando los diámetros de la vena porta, arteria aorta abdominal y vena cava caudal.
En un abordaje coronal derecho, sobre la línea del hombro, a la altura del 10-12° espacio intercostal, se observará únicamente la arteria aorta abdominal y la vena cava caudal. La porción abdominal de la vena ácigos derecha en condiciones normales no es identificable por su bajo flujo de sangre circulante. En un corte longitudinal se podrá observar la emergencia del tronco celíaco y arteria mesentérica craneal desde la arteria aorta abdominal como dos vasos redondeados muy próximos entre sí. En esta región, donde se proyecta el foramen epiploico, la vena cava caudal no recibe afluentes, siendo su cara izquierda lisa. Tanto la arteria aorta abdominal como la vena cava caudal deben tener un diámetro similar entre sí. La presencia de una dilatación focal de la vena cava caudal en este abordaje se considera un signo indirecto de shunt LGC o gastrocaval izquierdo (Figura 1).
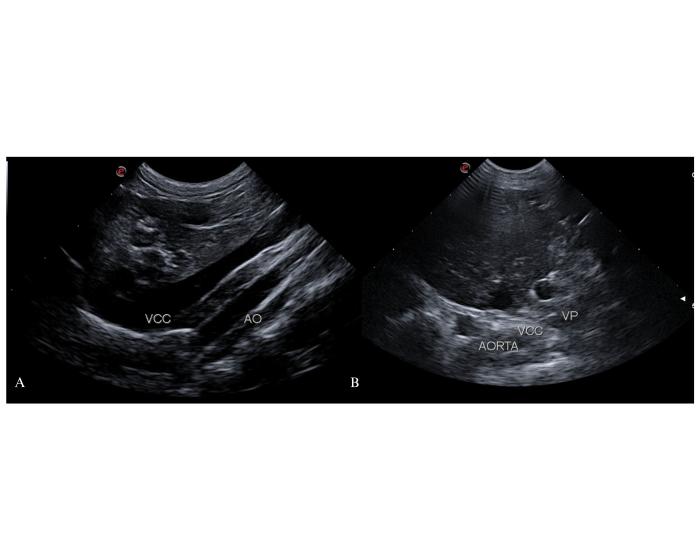
Figura 1. Abordaje coronal derecho del abdomen craneal a la altura del 10-12° espacio intercostal. (A) Corte longitudinal. Se observa la vena cava caudal (VCC) y la arteria aorta abdominal (AO). En condiciones normales la vena ácigos derecha no es identificable. (B) Corte transversal de la VCC, AO y vena porta (VP) para estimar el índice VP/AO.
En este abordaje también se realizan cortes transversales de los grandes vasos. A partir de la comparación del diámetro transverso de la vena porta (VP) y de la arteria aorta abdominal (AO) se estima el índice VP/AO (Vídeo 2)11.
Video 2. Abordaje transversal de los vasos a la altura del 10-12° espacio intercostal derecho sobre la línea del hombro para evaluar la relación anatómica entre vena cava caudal, arteria aorta abdominal y vena porta.
Su valor normal es de 0.75. Un índice menor sugiere una reducción del diámetro de la vena porta por la presencia de un shunt congénito extrahepático. Sin embargo, no todos los tipos de shunts congénitos cursan con una reducción del diámetro de la vena porta22,23,26 y por este motivo un índice normal no excluye su presencia. Se sugiere no recurrir exclusivamente a este cálculo como método único de screening de pacientes. Como veremos más adelante, el abordaje transversal de los vasos a la altura del 10-12° espacio intercostal derecho permite identificar la llegada de shunt a la vena cava caudal y a la vena ácigos derecha, así como también el origen de los shunts en la vena gástrica izquierda y derecha (ver Figura 1).
Anatomía ecográfica de los shunts más frecuentes en felinos y caninos
Para identificar los shunts por ecografía es necesario hacer un estudio planificado del abdomen con orientación en ecografía vascular. Se harán abordajes sucesivos para reconocer:
- Sitios de origen del shunt. Siguiendo las estadísticas del Dr. White y del Dr. Weisse, la autora sugiere comenzar el estudio ecográfico en el tronco gastroesplénico, luego evaluar la proyección de la vena gástrica derecha y, finalmente, evaluar la posibilidad de que el shunt se origine de la vena cólica izquierda, afluente de la vena mesentérica caudal. Así el estudio comienza en el abdomen craneal, en búsqueda de los dos sitios más frecuentes de inicio de shunt, y de no encontrar anormalidades, se explora el abdomen medio caudal en búsqueda del vaso anómalo.
- Sitios de inserción en la circulación sistémica. Sobre coronal derecho, a la altura de la 10-12° espacio intercostal, se evalúa la anatomía ecográfica de la vena cava caudal para identificar la llegada de shunt en el área de proyección del foramen epiploico o en su porción poshepática. También se evalúa la porción de la arteria aorta abdominal próxima a su hiato en el diafragma para identificar a la vena ácigos derecha dilatada. El examen luego debe continuarse hacia caudal del abdomen para explorar la porción de la vena cava caudal que recibe la vena renal izquierda, la vena gonadal izquierda, y la porción inicial de la vena cava caudal junto a las venas iliacas comunes derecha e izquierda.
- Recorrido del vaso anómalo. El vaso anómalo realiza un trayecto corto cuando su origen es en la vena gástrica izquierda y su inserción en la vena cava caudal a la altura del foramen epiploico. Sin embargo, cuando se dirige a la porción poshepática de la vena cava caudal o a la vena ácigos derecha, realiza un largo trayecto entre el hígado, esófago y unión gastroesofágica. El shunt originario en la vena cólica izquierda se observa como un vaso alargado en dorsal del abdomen, con aspecto similar al de un uréter izquierdo dilatado, que se dirige hacia la región del hilio renal izquierdo o hacia la entrada de la pelvis17, 22.
Cuando el shunt se origina en la vena gástrica izquierda, el tronco gastroesplénico se dilata de forma considerable y, desde el abordaje coronal derecho, la vena porta adquiere un aspecto anormal semejante a la letra T. En la mayoría de los pacientes, luego de la emergencia del shunt, la vena porta continúa hacia el hígado con un diámetro disminuido. Sin embargo, en aquellos pacientes con buena perfusión hepática la vena porta puede tener un diámetro similar al normal y conservar el índice VP/AO26. La dilatación del tronco gastroesplénico también se puede observar en el corte transversal donde se realiza el índice VP/AO: la vena porta pierde su aspecto redondeado por la emergencia de un vaso recto que se aleja del transductor hacia la región sublumbar (Figura 2).
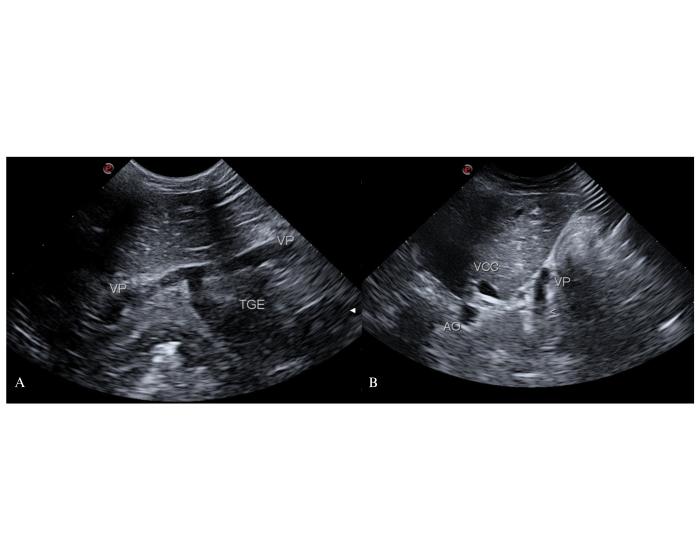
Figura 2. Observación del origen del shunt en la vena gástrica izquierda desde un abordaje coronal derecho. (A) Corte longitudinal de la vena porta (VP) con dilatación del tronco gastroesplénico (TGE). Signo de la T para la autora. (B) Corte transversal de los vasos a la altura de los espacios intercostales derechos 10-12°. La vena porta pierde su forma redondeada por la dilatación del TGE. AO: arteria aorta abdominal. VCC: vena cava caudal. “<” origen del shunt en el TGE.
Al shunt que involucra a la vena gástrica derecha se lo reconoce fácilmente como un vaso voluminoso en relación con la curvatura mayor del estómago. El vaso anómalo se origina a la altura del hilio hepático de la vena gástrica derecha y luego vira, cerca de la flexura craneal del duodeno, hacia caudal, donde se relaciona con el estómago para volver a girar hacia su inserción en la región dorsal del abdomen. En el corte transversal de los tres grandes vasos se observará a la vena porta con forma anormal por la emergencia de un vaso que primero se acerca al transductor y que, luego de un corto recorrido, gira sobre el hilio hepático, próximo al duodeno descendente, hacia la región sublumbar. En estos casos el tronco gastroesplénico presentará un diámetro normal o, si la vena gástrica izquierda es aberrante, podrá no identificarse (Figura 3).
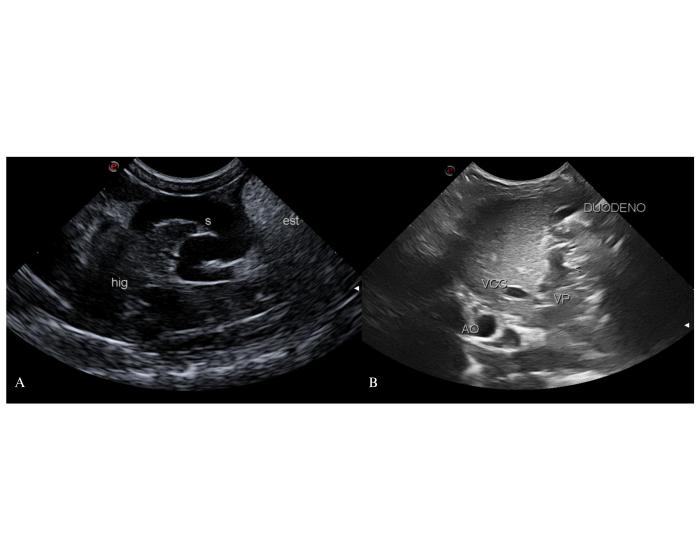
Figura 3. Observación del origen del shunt en la vena gástrica derecha desde un abordaje coronal derecho. (A) Corte longitudinal del vaso anómalo (S) en relación con el estómago (est). Hig: hígado. (B) Corte transversal de los vasos a la altura de los espacios intercostales derechos 10-12°. La vena porta pierde su forma redondeada por la dilatación de la vena gástrica derecha que se dirige hacia el duodeno en relación con la cara visceral del hígado. AO: arteria aorta abdominal. VCC: vena cava caudal. “<” origen del shunt.
Cuando el shunt se origina de la vena cólica izquierda realiza un trayecto opuesto a lo previamente descripto: el vaso anómalo se aleja del hilio hepático hacia el abdomen caudal. Su origen puede identificarse en la vena mesentérica caudal por un aumento del diámetro de esta. El vaso anómalo realiza un recorrido hacia la entrada de la pelvis por la porción dorsal del abdomen, similar al de un uréter izquierdo dilatado (Figura 4).
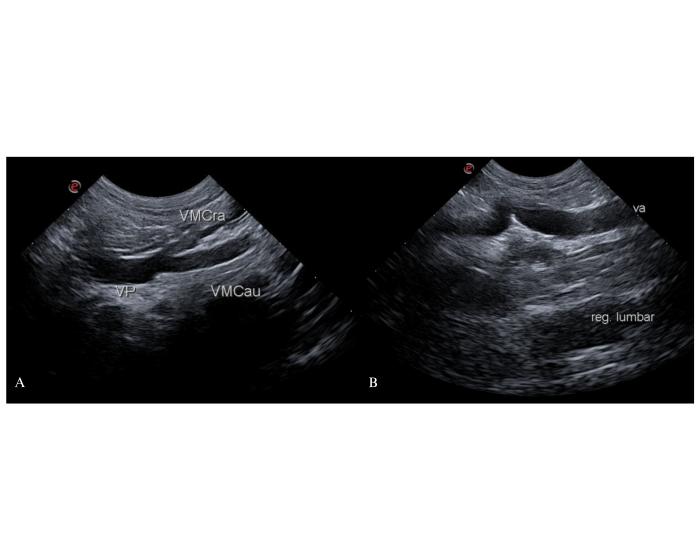
Figura 4. Observación del origen del shunt en la vena cólica izquierda desde un abordaje coronal derecho. (A) En un paciente con shunt colonocaval se observa el comienzo del shunt como una dilatación de la vena mesentérica caudal (VMCau). VP: vena porta. VMCra: vena mesentérica craneal. (B) La VMCau se continua como un vaso anómalo (va) que se dirige hacia la entrada de la pelvis en búsqueda de su sitio de inserción.
Este shunt puede desembocar tanto en la vena gonadal izquierda como en la vena renal izquierda, vena cava caudal próximo a la llegada de la vena renal izquierda, en una vena iliaca común o en la porción de la vena cava caudal adyacente a estas. Cuando se inserta en una vena ilíaca común, o en la vena cava caudal adyacente, sobrepasa el área renal y se dirige hacia la entrada de la pelvis, donde luego de realizar una curva pequeña hacia craneal, su visualización muchas veces se interrumpe por el contenido colónico.
Una vez detectado el origen del shunt es menester identificar su sitio de inserción. Para el cirujano esta es una información fundamental ya que los shunts se atenúan en proximidad al vaso sistémico al que abocan.
La observación de los vasos a la altura de los últimos espacios intercostales derechos permite identificar la llegada de los shunt en tres sitios:
- Vena cava caudal prehepática.
- Vena cava caudal poshepática.
- Vena ácigos derecha.
Por ecografía se define al foramen epiploico como el espacio entre el lóbulo caudado del hígado, duodeno descendente, polo craneal del riñón derecho y arteria aorta abdominal a la altura de la emergencia del tronco celíaco y la arteria hepática común11. Cuando el shunt llega a la porción prehepática de la vena cava caudal, a la altura del foramen epiploico, su aspecto redondeado al corte transversal se perderá para formar un ovalo asimétrico en forma de lágrima o coma (Figura 5).
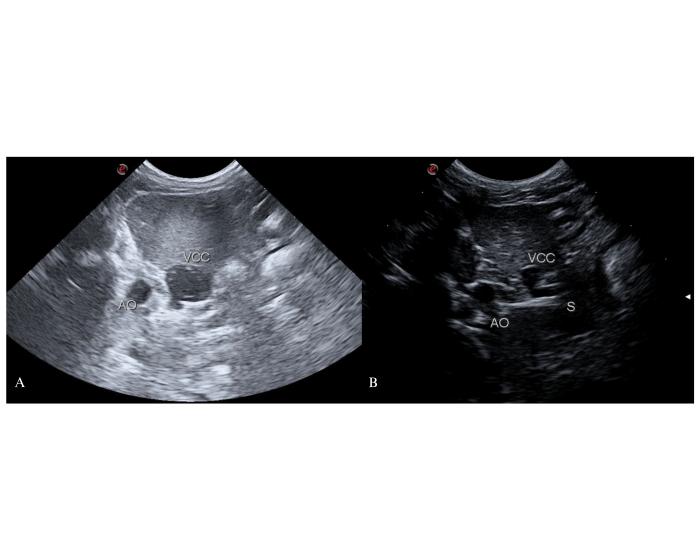
Figura 5. Llegada del shunt a la altura del foramen epiploico desde un abordaje coronal derecho. Corte transversal de los vasos a la altura del 10-12° espacio intercostal derecho. (A) La vena cava caudal (VCC) se observa dilatada y con su cara dorsal irregular por la llegada de un shunt. (B) La vena cava caudal presenta una conformación ojival atípica por la llegada del vaso anómalo.
En un corte longitudinal del mismo abordaje se visualizará la llegada del shunt como un afluente atípico de la vena cava caudal que cruza desde dorsal, por craneal al tronco celíaco, hacia la cara izquierda de esta. Este vaso puede hacer un recorrido de craneal a caudal y viceversa. No siempre es visible en el modo B de la ecografía, pudiendo utilizarse el Doppler Color para su visualización con un PRF (frecuencia de repetición de pulsos) de 40 cm/s y un límite de Nyquist de distribución equitativa. Se observará así un vaso craneal al tronco celíaco con un código de color similar a este y al de la arteria mesentérica craneal. Con este valor de PRF la llegada del shunt en la vena cava caudal se observa como un área de mosaico color. Este representa el flujo turbulento generado por el jet de sangre desde el shunt hacia la luz de la vena cava caudal, muchas veces identificable en el modo B de la ecografía como un sitio de flujo espontáneo y dilatación focal de la misma. Para el Dr. White este es el sitio de llegada de los shunts gastrocaval izquierdo o derecho.Para el Dr. Weisse es la llegada de los shunt LGC-pre en felinos y LGC, aLGC + RGV y aLGC +RGV + SGV en caninos (Figura 6).
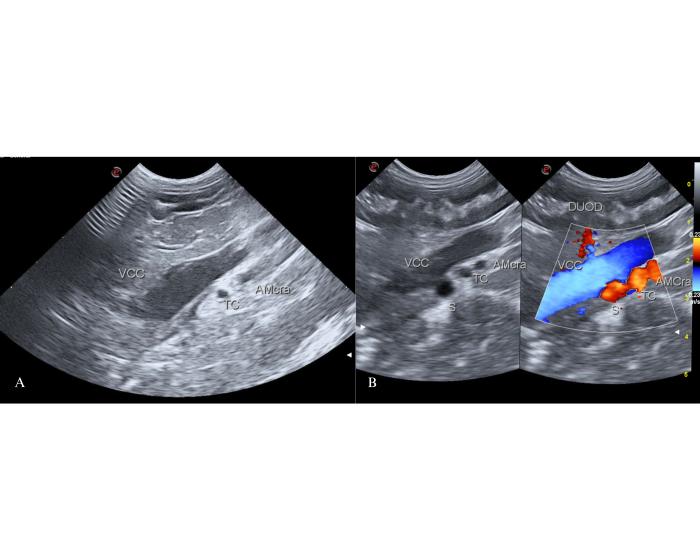
Figura 6. Llegada del shunt a la altura del foramen epiploico en un corte longitudinal desde un abordaje coronal derecho. (A) La dilatación de la vena cava caudal (VCC) en craneal al tronco celíaco (TC) es un signo indirecto de inserción de shunt. (B) Visualización directa del shunt (S) y su inserción en la cara izquierda de la VCC. El shunt se observa como un vaso anómalo en craneal del TC con un código de color Doppler similar a este.
Cuando el shunt llegue a la porción poshepática de la vena cava caudal, ya sea de forma directa o a través de la vena frénica izquierda, es fundamental evaluar su trayecto adyacente al diafragma, el esófago abdominal y la unión gastroesofágica (Figura 7).
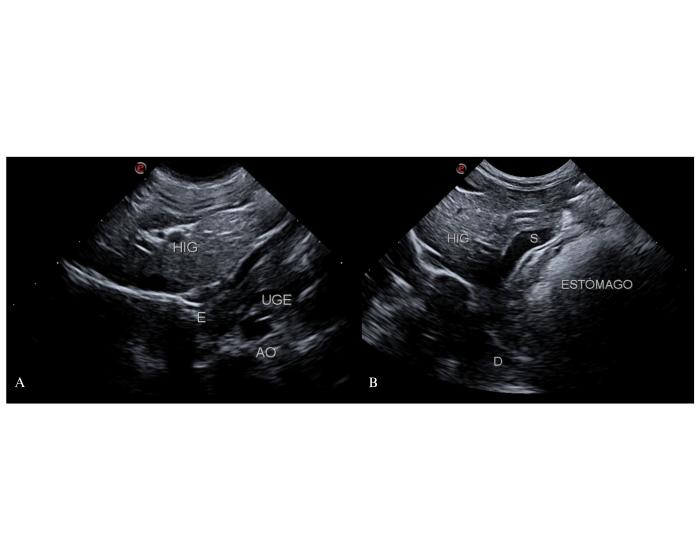
Figura 7. (A) Relación entre el esófago (E), unión gastroesofágica (UGE) e hígado (HIG) desde un abordaje coronal derecho. El esófago se proyecta en ventral de la porción inicial de la arteria aorta abdominal (AO). (B) Presencia de un shunt (S) que se dirige hacia la porción poshepática de la vena cava caudal en relación con el hígado y la cara ventral de la UGE. El vaso anómalo se evidencia aún con cierto grado de repleción gástrica.
En ambas opciones el vaso anómalo se origina principalmente en la vena gástrica izquierda y presenta un diámetro similar al tronco principal de la vena porta. Desde su origen se dirige hacia el foramen de la vena cava caudal en el diafragma atravesando el espacio entre el esófago, la cara ventral de la unión gastroesofágica, y el hígado20. Su llegada a la vena cava caudal adyacente al diafragma se visualiza, casi exclusivamente, al detectar mosaico con el Doppler Color. Esta morfología de shunt es la predominante en felinos, por lo cual, en esta especie, es estratégico indagar con especial atención y detenimiento su área de proyección ecográfica. Para el Dr. White este es el sitio de llegada de los shunts gastrofrénico izquierdo o derecho, para el Dr. Weisse es la llegada de los shunt LGP y LGC- post en felinos y LGP en caninos (Figura 8).
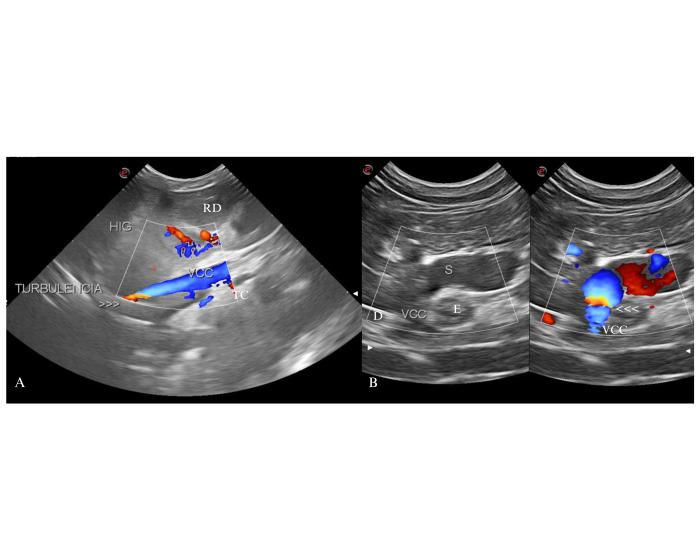
Figura 8. Abordaje coronal derecho del abdomen craneal a la altura del 10-12° espacio intercostal. (A) Demostración de la llegada del shunt gastrofrénico a la porción poshepática de la vena cava caudal (VCC) por la presencia de mosaico color (>>>) en su porción adyacente al diafragma. La inserción del shunt se encuentra alejada del área de proyección del foramen epiploico. RD: riñón derecho, TC: tronco celíaco, HIG: hígado. (B) Presencia de mosaico color (<<<) en la desembocadura de un shunt gastrofrénico de un felino. S: shunt, E: esófago, D: proyección diafragma.
Al recibir la sangre proveniente de un shunt, la vena ácigos derecha se dilata y es visualizable por ecografía. El vaso anómalo realiza un recorrido inicial similar al descrito para los shunts que se insertan en la porción poshepática de la vena cava caudal: se dirige desde su origen hacia el hiato aórtico en relación con el hígado y la cara ventral del cardias o el aspecto dorsal de la unión gastroesofágica20. Cuando el shunt aboca en la vena ácigos, incluso si lo hace dentro de su porción torácica, en el corte transversal del hilio hepático se observa un cuarto vaso próximo a la arteria aorta abdominal (Figura 9).
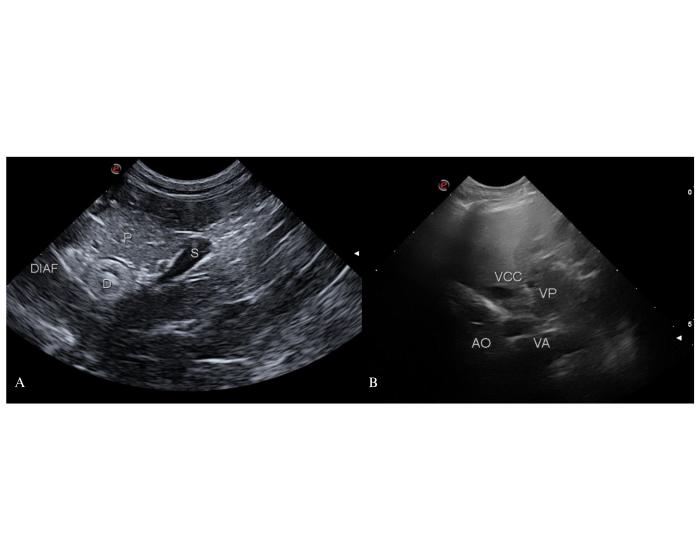
Figura 9. (A) Observación del recorrido del vaso anómalo (S) hacia la vena ácigos derecha en dorsal del duodeno ascendente (D) desde un abordaje coronal derecho. P: páncreas, DIAF: proyección diafragmática. (B) Dilatación de la vena ácigos derecha (VA) en el corte transversal de los vasos a la altura del 10-12° espacios intercostales derechos. Si la comunicación con la VA se produce dentro del tórax este cuarto vaso puede representar al shunt en su recorrido paralelo a la arteria aorta abdominal. La vena porta (VP) presenta una notoria reducción de su diámetro. VCC: vena cava caudal, AO: arteria aorta abdominal.
En un corte longitudinal la vena ácigos dilatada se identifica como un corto vaso paralelo a la arteria aorta abdominal, en forma de cuña o triángulo escaleno, que se origina a la altura de la 2ª o 3ª vértebras lumbares. Con Doppler Color presenta un código de color idéntico al de la vena cava caudal y opuesto al de la arteria aorta abdominal. Para el Dr. White este es el sitio de llegada de los shunts gastroácigos derecho o izquierdo, para el Dr. Weisse es la llegada de los shunt LGA (Figura 10).
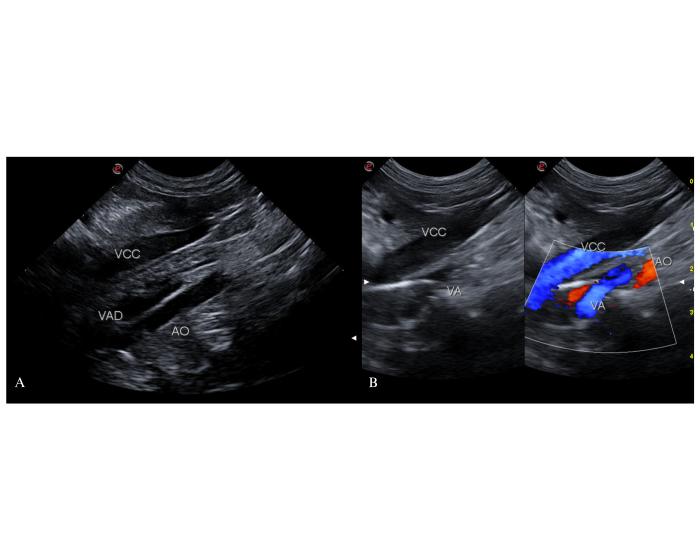
Figura 10. Corte longitudinal en un abordaje coronal derecho del abdomen a la altura del 10-12° espacio intercostal derecho. (A) Se observa la vena ácigos derecha (VAD) dilatada junto a la arteria aorta abdominal (AO). (B) Mediante el uso de Doppler color la vena ácigos (VA) presenta un código de color idéntico al de la vena cava caudal (VCC) e inverso al de la AO.
Los shunts que se originan en la vena cólica izquierda recorren el abdomen medio de craneal a caudal hacia la entrada de la pelvis, donde hacen un giro de 180° para abocar en el origen de la vena cava caudalo en su porción adyacente al hilio renal izquierdo. La inserción en una vena iliaca común, o en la porción adyacente de la vena cava caudal, es casi inmediata a su giro en la entrada de la pelvis y muchas veces no es identificable por el contenido del colon descendente. Si el shunt desemboca en la vena renal izquierda, vena gonadal izquierda o en la porción renal de la vena cava caudal, realiza un recorrido hacia craneal desde la entrada de la pelvis, por la región sublumbar, similar al de un uréter izquierdo dilatado. Para el Dr. White este tipo de shunt recibe el nombre de shuntcolonocaval, para el Dr. Weisse LCG en felinos (Figura 11).
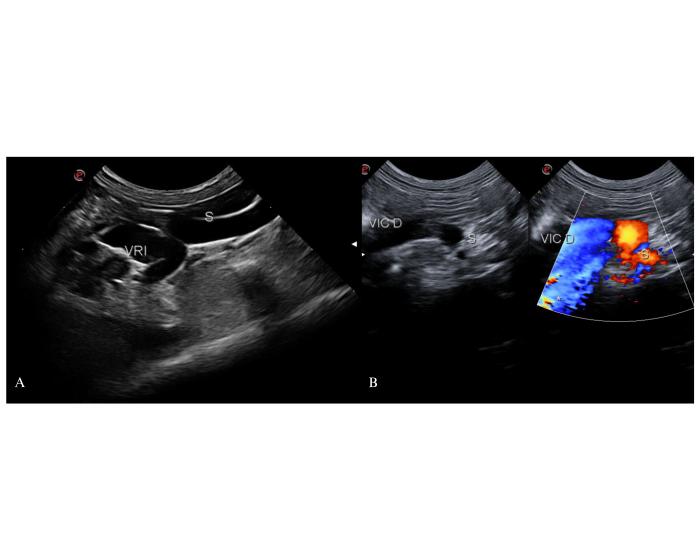
Figura 11. Inserción del shunt colonocaval en la porción prehepática de la vena cava caudal. (A) Inserción en la vena cava caudal a la altura del hilio renal izquierdo desde un abordaje coronal derecho. Se observa la llegada del shunt (S) adyacente a la vena renal izquierda (VRI) sobre la cara izquierda de la vena cava caudal. (B) Inserción del shunt en la vena ilíaca común derecha (VIC D). En proximidad a la entrada de la pelvis se observa la llegada del shunt a la cara izquierda de la vena ilíaca común como un afluente atípico de esta. Con Doppler Color se registran artefactos (*) por el meteorismo predominante de la región.
Los shunts congénitos son anomalías vasculares que, si bien los algoritmos diagnósticos funcionan en la mayoría de los casos, existen configuraciones atípicas e infrecuentes de difícil diagnóstico ecográfico:
- Shunts dobles: pacientes que tienen un shunt predominante, como un shunt gastroácigos izquierdo, y un shunt de menor tamaño que se origina inmediatamente craneal al tronco gastroesplénico y se aboca, por ejemplo, a la vena renal izquierda30.
- Shunts bífidos: si bien no existen comunicaciones sobre este tipo de shunt, distintos colegas, como el Dr. David García Rubio de España, han corregido por cirugía o laparoscopía shunt que se originan de un vaso y se dividen en dos previo a su inserción (Figura 12).
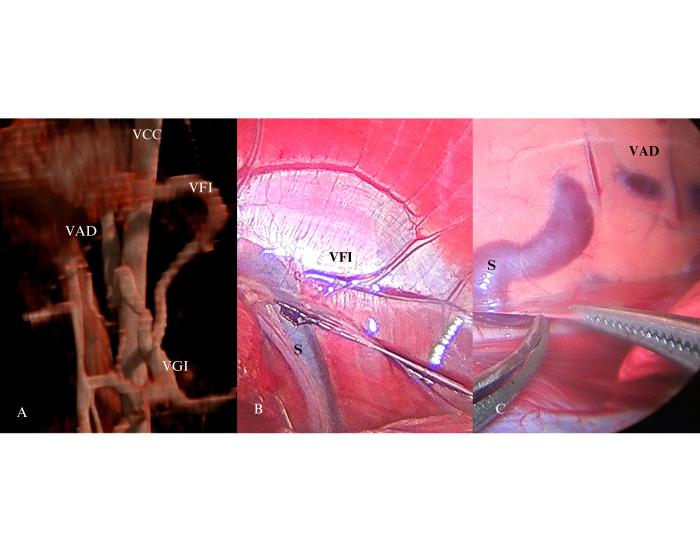
Figura 12. Corrección quirúrgica de un shunt de origen único y doble inserción. (A) En la reconstrucción tomográfica 3D se observa un vaso anómalo de origen único en la vena gástrica izquierda (VGI) que se subdivide en dos para su inserción en la vena ácigos derecha (VAD) y en la vena cava caudal poshepática (VCC) a través de la vena frénica izquierda (VFI). (B) Imagen laparoscópica de la inserción de la rama gastrofrénica del shunt en la VFI. (C) Imagen por toracoscopia derecha de la inserción de la rama gastroácigos en la VAD (imágenes gentileza del Dr. García Rubio).
- Shunts que comunican de forma directa la porción extrahepática de la vena porta con la vena cava caudal. Para el Dr. White este tipo de shunt recibe el nombre de shunt portocava, mientras que para el Dr. Weisse recibe el nombre de PC. A este tipo de shunt se lo denomina también por su nombre en inglés side-to-side shunt (traducción inglesa de lado a lado) y está asociado a una aplasia o hipoplasia severa de la vena porta craneal al shunt. Por el desvío de gran parte de la sangre portal a la circulación sistémica, y la hipoplasia severa de las ramas intraparenquimatosas, los pacientes suelen presentar signos de disfunción hepática a muy temprana edad, siendo los signos neurológicos los de mayor prevalencia. Según un estudio realizado por la Dra. Swieton y colaboradores32 estos pacientes pueden tener otras malformaciones asociadas como aplasia segmentaria de la vena cava caudal con continuación a través de la vena ácigos derecha, duplicación total o parcial de la vena cava caudal, persistencia de la vena ácigos izquierda, entre otras.
En estos casos la ecografía no siempre es un buen método de diagnóstico para identificar el recorrido completo del shunt, y por esto la tomografía nunca debe excluirse de la planificación quirúrgica del shunt.
Conclusión
Antaño la ecografía ha tenido un rol muy importante en el diagnóstico de los shunts, sin embargo, con el advenimiento de la tomografía, su uso fue relegado. Históricamente y desde un enfoque de la medicina general, durante la ecografía se indagaba la presencia de un vaso anómalo y también signos indirectos, muchas veces inconstantes, de su presencia. La tomografía permitió evaluar con precisión la anatomía vascular del abdomen y abordar las malformaciones venosas desde un punto de vista vascular. Hoy en día la ecografía vascular en veterinaria se encuentra en auge, lo que permite estandarizar la identificación y clasificación de los shunts congénitos extrahepáticos más comunes. El modo B de la ecografía es también la antesala para el estudio Doppler de la circulación hepatoportal, clave en la evaluación hemodinámica de pacientes con shunts. En las publicaciones del Dr. Weisse queda expresa la necesidad de desarrollar un método para indagar de forma precisa la perfusión del hígado, siendo el Doppler el único método de diagnóstico capaz de realizar un estudio hemodinámico al reflejar en su registro espectral los cambios de velocidad, presión, dirección de flujo, etc.
La ecografía en manos de un operador formado y entrenado constituye una excelente herramienta diagnóstica. Conociendo la anatomía vascular del abdomen y sus relaciones anatómicas, todo usuario de un ecógrafo puede identificar los principales vasos involucrados en los shunts más comunes de caninos y felinos. La ecografía no solo permite el diagnóstico de la patología sino su clasificación de acuerdo con los criterios tomográficos. Un estudio ordenado y sistematizado, orientado a identificar origen, sitio de inserción y recorrido de los vasos en el modo B, proporciona la información suficiente para hacer el diagnóstico de pacientes con shunts. Con esta información el clínico, intensivista o cirujano podrá comenzar la planificación de la conducta quirúrgica y el tratamiento médico. El diagnóstico ecográfico de shunts no es una novedad: es una herramienta diagnóstica que ha sido estudiada en profundidad por autores referentes en la medicina veterinaria.
A criterio de la autora, y en coincidencia con publicaciones recientes, la ecografía debería realizarse en la atención primaria de los pacientes con sospecha de shunt. La mayor objeción al uso de la ecografía es el tiempo que requiere el estudio y la curva de aprendizaje para realizar diagnósticos. El uso de la tomografía no está en discusión, sin embargo, desde una mirada ética, la ecografía debería utilizarse prioritariamente por ser un método más seguro para el paciente pediatricojuvenil. También, la mayor accesibilidad global a la ecografía como método de diagnóstico, permitirá un incremento en la detección de pacientes asintomáticos o con síntomas leves, que no necesariamente acudirán a una tomografía. Existen además muchos países donde la distribución de la tomografía es todavía escasa y su uso costoso, por lo que una mayor cantidad de operadores formados en ecografía vascular beneficiaría a la comunidad veterinaria. Fomentar el uso de la ecografía vascular en ambientes como las clínicas de emergencia y urgencia permitirá también diagnosticar más precozmente la presencia de shunts congénitos; se podrán así tomar decisiones clínicas más rápidas para la estabilización y manejo médico de estos pacientes, mejorando la calidad de vida y la prognosis de este.
Agradecimientos
Este trabajo no solo constituye una revisión de la nomenclatura actual de los shunts, sino que también resume el trabajo en equipo junto al Dr. Javier Mouly y el Dr. Martín Marcos, ambos veterinarios de la Universidad Nacional de La Plata, con quienes compartimos un grupo de trabajo desde hace más de 10 años. Sin la confianza de ellos y el excelente trabajo de su equipo médico quirúrgico este texto no podría haber sido posible.
Bibliografía
- Konstantinidis, A.O.; Patsikas, M.N.; Papazoglou, L.G.; Adamama-Moraitou, K.K. Congenital Portosystemic Shunts in Dogs and Cats: Classification, Pathophysiology, Clinical Presentation and Diagnosis.Vet. Sci.2023,10, 160. https://doi.org/10.3390/vetsci10020160
- O'Kell AL, Gallagher AE, Cooke KL. Gastroduodenal ulceration in dogs with liver disease. J Vet Intern Med. 2022 May;36(3):986-992. doi: 10.1111/jvim.16413. Epub 2022 Mar 21. PMID: 35312117; PMCID: PMC9151467
- Couture Y, Keys D, Summers S. Comparison of hematologic variables between dogs with congenital intrahepatic and extrahepatic portosystemic shunts. J Vet Intern Med. 2024 May-Jun;38(3):1458-1464. doi: 10.1111/jvim.17081. Epub 2024 May 3. PMID: 38699882; PMCID: PMC11099786).
- Kim S.E., Giglio R.F., Reese D.J., Reese S.L., Bacon N.J., Ellison G.W. Comparison of Computed Tomographic Angiography and Ultrasonography for the Detection and Characterization of Portosystemic Shunts in Dogs. Vet. Radiol. Ultrasound. 2013;54:569–574. doi: 10.1111/vru.12059.
- Umek N, Plut D, Krofič Žel M, Domanjko Petrič A. Radiologic Evaluation of Portosystemic Shunts in Humans and Small Animals: Review of the Literature with Clinical Case Reports. Diagnostics (Basel). 2023 Jan 28;13(3):482. doi: 10.3390/diagnostics13030482. PMID: 36766586; PMCID: PMC9914644
- D'Anjou MA. The sonographic search for portosystemic shunts. Clin Tech Small Anim Pract. 2007 Aug;22(3):104-14. doi: 10.1053/j.ctsap.2007.05.004. PMID: 17844816.
- Szatmari, Viktor & Rothuizen, Jan & Voorhout, George. (2004). Standard planes for ultrasonographic examination of the portal system in dogs. Journal of the American Veterinary Medical Association. 224. 713-6, 698. 10.2460/javma.2004.224.713
- Lamb, C R. Ultrasonographic diagnosis of congenital portosystemic shunts in dogs: results of a prospective study. 1996. Veterinary Radiology and Ultrasound 37, 281-288
- Lamb, C R., White, R N. Morphology of congenital intrahepatic portocaval shunts in dogs and cats. 1998. Veterinary Record 142, 55-60
- Baiges, A., Turon, F., Hernández-Gea, V., Garcia-Pagan, J.C. Congenital Extrahepatic Portosystemic Shunts: Abernethy Malformation. In: Valla, D., Garcia-Pagan, J.C., De Gottardi, A., Rautou, PE. (eds) Vascular Disorders of the Liver. 2022. Springer, Cham. https://doi.org/10.1007/978-3-030-82988-9_5.
- d'Anjou MA, Penninck D, Cornejo L, Pibarot P. Ultrasonographic diagnosis of portosystemic shunting in dogs and cats. Vet Radiol Ultrasound. 2004 Sep-Oct;45(5):424-37. doi: 10.1111/j.1740-8261.2004.04076.x. PMID: 15487568
- Szatmári, V., Rothuizen, J. Ultrasonographic identification and characterization of congenital portosystemic shunts and portal hypertensive disorders in dogs and cats. In: WSAVA Standards for Clinical and Histological Diagnosis of Canine and Feline Liver Disease. 2006. Saunders Elsevier, Edinburgh. pp 15-39.
- Szatmári V, Rothuizen J, van den Ingh TS, van Sluijs F, Voorhout G. Ultrasonographic findings in dogs with hyperammonemia: 90 cases (2000-2002). J Am Vet Med Assoc. 2004 Mar 1;224(5):717-27. doi: 10.2460/javma.2004.224.717. PMID: 15008122.
- Nelson NC, Nelson LL. Anatomy of extrahepatic portosystemic shunts in dogs as determined by computed tomography angiography. Vet Radiol Ultrasound 2011;52:498–506.) White RN, Parry AT. Morphology of congenital portosystemic shunts emanating from the left gastric vein in dogs and cats. J Small Anim Pract 2013;54:459–467.
- White RN, Parry AT. Morphology of congenital portosystemic shunts involving the right gastric vein in dogs. J Small Anim Pract 2015;56:430–440.
- White RN, Parry AT. Morphology of splenocaval congenital portosystemic shunts in dogs and cats. J Small Anim Pract 2016;57:28–32.
- White RN, Parry AT. Morphology of congenital portosystemic shunts involving the left colic vein in dogs and cats. J Small Anim Pract 2016;57:247–254 White RN, Warren-Smith C, Shales C, Parry AT. Classification of portosystemic shunts entering the caudal vena cava at the omental foramen in dogs. J Small Anim Pract. 2020 Nov;61(11):659-668. doi: 10.1111/jsap.13209. Epub 2020 Oct 9. PMID: 33035379.
- White RN, Shales C, Parry AT. New perspectives on the development of extrahepatic portosystemic shunts. J Small Anim Pract. 2017 Dec;58(12):669-677. doi: 10.1111/jsap.12728. Epub 2017 Sep 5. PMID: 28872684.
- White RN, Parry AT. Morphology of splenocaval congenital portosystemic shunts in dogs and cats. J Small Anim Pract. 2016 Jan;57(1):28-32. doi: 10.1111/jsap.12414. Epub 2015 Nov 13. PMID: 26563977.
- White RN, Parry AT, Shales C. Implications of shunt morphology for the surgical management of extrahepatic portosystemic shunts. Aust Vet J. 2018 Nov;96(11):433-441. doi: 10.1111/avj.12756. PMID: 30370593.
- White RN, Warren-Smith C, Shales C, Parry AT. Classification of portosystemic shunts entering the caudal vena cava at the omental foramen in dogs. J Small Anim Pract. 2020 Nov;61(11):659-668. doi: 10.1111/jsap.13209. Epub 2020 Oct 9. PMID: 33035379.
- Weisse C, Asano K, Ishigaki K, et al. Anatomical classification of feline congenital extrahepatic portosystemic shunts based on CT angiography: A SVSTS and VIRIES multi-institutional study in 231 cats. Vet Radiol Ultrasound. 2024;1-10. https://doi.org/10.1111/vru.13363
- Weisse C, Fox-Alvarez WA, Grosso FRV, et al. Anatomical classification of canine congenital extrahepatic portosystemic shunts based on CT angiography:A SVSTS and VIRIES multi-institutional study in 1082 dogs. Vet Radiol Ultrasound. 2024;1-11. https://doi.org/10.1111/vru.13415
- White RN, Parry AT. Morphology of congenital portosystemic shunts emanating from the left gastric vein in dogs and cats. J Small Anim Pract. 2013;54:459–467.
- Van den Bossche L, van Steenbeek FG, Favier RP, et al. Distribution of extrahepatic congenital portosystemic shunt morphology in predisposed dog breeds. BMC Veterinary Research 2012;112.
- Fukushima K, Kanemoto H, Ohno K, Takahashi M, Fujiwara R, Nishimura R, Tsujimoto H. Computed tomographic morphology and clinical features of extrahepatic portosystemic shunts in 172 dogs in Japan. Vet J. 2014 Mar;199(3):376-81. doi: 10.1016/j.tvjl.2013.11.013. Epub 2013 Nov 23. PMID: 24512983.
- Kraun, M. B., Nelson, L. L., Hauptman, J. G. & Nelson, N. C. (2014) Analysis of the relationship of extrahepatic portosystemic shunt morphology with clinical variables in dogs: 53 cases (2009-2012). Journal of the American Veterinary Medical Association 245, 540-549
- Nelson, N. C. & Nelson, L. L. Imaging and clinical outcomes in 20 dogs treated with thin film banding for extrahepatic portosystemic shunts. 2016. Veterinary Surgery 45, 736-745
- Parry, A.T. and White, R.N. Portal vein anatomy in the dog: comparison between computed tomographic angiography (CTA) and intraoperative mesenteric portovenography (IOMP). 2015. J Small Anim Pract, 56: 657-661. https://doi.org/10.1111/jsap.12392
- Ranea G, Molina EM, Souto NN. Abordajes ecográficos de los vasos abdominales para su estudio Doppler: la base para evaluar la circulación esplácnica. Clinurgevet. 2021; 20: 9 – 19.
- Leeman JJ, Kim SE, Reese DJ, Risselada M, Ellison GW. Multiple congenital PSS in a dog: case report and literature review. J Am Anim Hosp Assoc. 2013 Jul-Aug;49(4):281-5. doi: 10.5326/JAAHA-MS-5877. Epub 2013 May 20. PMID: 23690491
- Swieton N, Weisse C, Zwingenberger AL, et al. Outcome of 21 dogs treated for the portocaval subtype of extrahepatic portosystemic shunts. Veterinary Surgery. 2024; 1‐14. doi:10.1111/vsu.14183
 by Multimédica
by Multimédica
