Monitor de tono parasimpático (PTA) una eficaz y precisa alternativa para la predicción, manejo y monitoreo del dolor en perros y gatos
Resumen breve
En las últimas décadas la sociedad ha aumentado su preocupación por el bienestar de los animales, el control del dolor y sufrimiento son debates de interés actual. Debido a esta presión ejercida al bienestar y a la ausencia de dolor de los animales, los gobiernos se han visto obligados a crear leyes destinadas a la protección y resguardo de los animales. Se sabe que el dolor cumple un importante papel biológico, que provoca respuestas fisiológicas que ayudan a mantener el equilibrio homeostático.…Índice de contenidos
Introducción
En las últimas décadas la sociedad ha aumentado su preocupación por el bienestar de los animales, el control del dolor y sufrimiento son debates de interés actual. Debido a esta presión ejercida al bienestar y a la ausencia de dolor de los animales, los gobiernos se han visto obligados a crear leyes destinadas a la protección y resguardo de los animales1.
Se sabe que el dolor cumple un importante papel biológico, que provoca respuestas fisiológicas que ayudan a mantener el equilibrio homeostático. Sin embargo, si no se realiza un tratamiento efectivo para tratar el dolor, los pacientes pueden sufrir efectos no deseados, como pérdida de apetito, auto traumatismos en sitios de intervenciones quirúrgicas y comportamientos anómalos como la agresividad, aumentando el tiempo de recuperación2,3.
La evaluación del dolor en pacientes sometidos a anestesia general sigue siendo una problemática en medicina veterinaria a nivel mundial, incluso en la medicina humana. Se sabe que los reflejos autónomos al dolor afectan a diferentes sistemas del organismo, como son el cardiovascular, gastrointestinal, inmune, endocrino y metabólico4.
La respuesta cardiovascular que produce provoca una serie de efectos no deseados durante el periodo intra y postoperatorio4-6, que incrementaran la morbilidad cardiaca, asociada a la anestesia y la mortalidad quirúrgica7.
El equilibrio entre analgesia y nocicepción es guiado por la experiencia clínica, mediante la lectura de las respuestas somáticas y autonómicas (movimiento, frecuencia cardiaca y aumento de la presión sanguínea)8-12. Sin embargo estos factores no son específicos del proceso nociceptivo, debido a que pueden estar influenciados por fármacos, la condición clínica del animal o de la propia cirugía13.
¿Que es el dolor?
El dolor se define como una experiencia emocional y sensorial desagradable asociada a un daño tisular actual o potencial descrito en términos de dicho daño según la Asociación Internacional para el Estudio del Dolor (IASP)14-16.
Fisiológicamente el dolor cumple un rol protector, el cual se manifiesta a través de la elaboración de una respuesta motora que tiende a evitar el daño frente a diferentes estímulos nocivos. Es de vital importancia cuantificar el nivel de dolor en animales, con el objetivo de implementar una terapia adecuada. Sin embargo por la incapacidad de los animales de manifestar en forma objetiva su percepción de dolor, la determinación de la magnitud de este paso se hace muy difícil en la práctica veterinaria5,17.
La respuesta a la percepción del dolor precisa de la participación del sistema nervioso central (SNC) y del sistema nervioso periférico (SNP), es similar en todos los mamíferos. La nocicepción es la respuesta nerviosa frente a estímulos nocivos o nociceptivos18.
Los mensajes nociceptivos son transmitidos, modulados e integrados en diferentes niveles del sistema nervioso; viajando desde la periferia hacia la médula espinal y desde ésta a los centros superiores como el tálamo y corteza cerebral. Los nociceptores son las estructuras especializadas que asumen la función de captar los estímulos de umbral alto de su entorno y transformarlos en señales nerviosas que se transportan al SNC5,14.
La activación de los nociceptores da lugar a la generación de un potencial de acción, que induce la liberación de una amplia gama de neurotransmisores en el asta dorsal de la médula espinal. Los principales neurotransmisores excitatorios son: el glutamato, que da lugar a potenciales sinápticos rápidos en las neuronas del asta dorsal, mediados por receptores ácido α-amino-3-hidroxi-5-metil4-isoxazolepropionico (AMPA) y sustancia P, en las neuronas que poseen fibras tipo C5,19. La transducción de la señal es mediada por receptores de membrana, que se activan por estímulos nocivos mecánicos, térmicos y químicos20.
Clasificación del dolor
Existen numerosos criterios para clasificar al dolor. De acuerdo a su curso temporal puede ser agudo o crónico, de acuerdo a su ubicación anatómica puede ser visceral, somático o neuropático y finalmente fisiológico o patológico en base a si su presencia cumple o no un rol en el organismo18.
El dolor somático afecta a la piel, músculos, articulaciones, ligamentos y huesos. Éste puede ser de ubicación superficial o profunda. El dolor visceral surge de la activación de mecanoreceptores en la pared vísceral, es sensible a los cambios en la forma y la tensión, además, es urente, difuso y mal localizado.
El dolor neuropático, también llamado anormal o patológico, es aquel en que la etiología predominante es siempre el resultado de una enfermedad o lesión del sistema nervioso, ya sea de los nervios periféricos o del propio SNC, dando lugar a un funcionamiento anormal de las vías nociceptivas las cuales determinan tales percepciones dolorosas5,14.
El dolor agudo va a desencadenar una respuesta de estrés neuroendocrina proporcional a la intensidad del dolor. La activación simpática que se desencadena va a aumentar el tono simpático visceral y la liberación de catecolaminas por parte de la médula adrenal dando lugar a una serie de efectos sistémicos21.
Para evitar todos estos efectos perjudiciales, el uso de analgésicos de acción prolongada es esencial junto a la evaluación de sus efectos en el paciente, que pueden variar particularmente durante las primeras 24 horas3.
Cada animal tiene necesidades analgésicas diferentes a pesar de sufrir un mismo procedimiento y puede mostrar diferentes respuestas endocrinas y comportamentales que pueden estar relacionadas con la edad o el género22, factores estresantes o experiencias previas pueden modular el comportamiento frente al dolor. Existen evidencias que sugieren que agravios dolorosos previos modulan el eje del estrés y las vías del dolor23,24.
¿Cómo trato al dolor?
La analgesia es la supresión de la sensación dolorosa, puede ser, parcial o total. Existen diferentes protocolos para la administración de analgésicos, uno de ellos consiste en la administración de un régimen analgésico antes de que se inicie el estímulo nociceptivo (p. ej., previo a una intervención quirúrgica), razón por la cual se ha denominado analgesia preventiva, teniendo como objetivo prevenir la sensibilización periférica y central, limitando la experiencia dolorosa5,8.
Puede utilizarse la analgesia multimodal, que consiste en la administración de dos o más fármacos combinados que poseen diferentes mecanismos de acción analgésica con el fin de potenciarla y disminuir los efectos colaterales25.
Dolor en el quirófano
En la anestesia general se combina el uso de analgésicos, drogas hipnóticas y relajantes musculares para dejar inconscientes a los pacientes, desconectándolos de su entorno y no respondiendo a la estimulación durante la cirugía26.
Es por ello que la administración adecuada de analgésicos es uno de los objetivos primordiales de la anestesiología, actualmente los anestesiólogos cuentan con parámetros fisiológicos que permiten evaluar el equilibrio entre el nivel de analgesia y la importancia del estímulo nocivo27. Sin embargo el manejo efectivo del dolor en el periodo perioperatorio sigue siendo un reto.
La dificultad en el diagnóstico, la valoración del dolor, la falta de familiarización con los analgésicos disponibles y las técnicas contribuyen a que el dolor perioperatorio en medicina veterinaria en ocasiones no sea abordado adecuadamente28.
Estas variaciones interindividuales están bien documentadas y se han convertido en reto para los evaluadores a la hora de desarrollar métodos de valoración del dolor válido y fiable, empujando a crear herramientas más certeras que la experiencia clínica. Las herramientas de valoración deben adaptarse a estas variaciones y posibilitar que los regímenes analgésicos se ajusten al individuo29.
Durante la última década, se han realizado grandes esfuerzos desplegados con el fin de encontrar adecuadas formas de medir cómo afectan las drogas anestésicas la respuesta de nocicepción en un paciente inducido quirúrgicamente. Hoy en día, la adquisición de parámetros en tiempo real y el análisis de la fisiología de un paciente proporcionan una manera eficiente para evaluar continuamente la respuesta a la administración de medicamentos para suprimir la nocicepción, lo que hace posible a los médicos personalizar la administración de medicamentos y la profundidad anestésica del componente hipnótico26.
Actualmente se cuenta con diversos tipos de monitoreo de analgesia, que se han desarrollado bajo principios fisiológicos, dentro de los cuales se encuentran los reflejos vasomotores de la piel, la plestimografía, el tiempo del tránsito del pulso, pupilometría, electroencefalografía y la variabilidad del ritmo cardiaco, todos tienen ciertas limitantes durante su uso intraoperatorio30,31.
Su uso en la clínica diaria, mejoraría el bienestar animal, fortaleciendo el vínculo entre propietarios y sus animales, la relación entre clientes y veterinarios, así como su reputación32-37.
Ahora hay monitores disponibles comercialmente y se utilizan de forma rutinaria: registran y procesan señales electroencefalográficas (EEG) simplificando y mostrando el resultado en tiempo real, lo que permite a anestesiólogos y enfermeras anestesistas ajustar la administración del agente hipnótico para reducir probabilidad de conciencia intraoperatoria o malestar, así como sobredosis hipnótica que es probable que esté involucrada en el delirio postoperatorio o disfunción cognitiva26.
En la clínica humana una nueva herramienta es el llamado ANI (Índice de Nocicepción Analgesia) para el adulto y NIPE para el neonato. ANI y NIPE están basada en la actividad parasimpática, que informa sobre el estado de bienestar o malestar del organismo, es decir, sobre la aparición de dolor o estrés sea de origen celular o de origen quirúrgico.
La respuesta del ANI ocurre en tiempo real, con un retraso de 45 segundos38. Utiliza el cálculo de analgesia Nociception Index, que se basa en la adquisición de la serie de intervalos RR, que permite medir la influencia de la respiración en el ritmo cardíaco: esta influencia está relacionada con la breve disminución del tono parasimpático con cada ciclo respiratorio, que se traduce en una disminución de los intervalos RR durante la inspiración, lo que se expresa mediante la arritmia sinusal respiratoria.
El interés clínico del análisis de la variabilidad sinusal respiratoria apareció en 1965, cuando Hon y Lee notaron que, previamente al sufrimiento fetal, tenía lugar una modificación de los intervalos RR antes de la alteración del ritmo cardíaco mismo. Hacia 1970, la metodología de Ewing desarrollaron pruebas simples empleando variaciones de los intervalos RR en periodos breves, para detectar la disautonomía en los pacientes diabéticos39.
En 1977, Wolf et al. demostraron que la disminución de variabilidad sinusal respiratoria tras un infarto de miocardio estaba asociada a una disminución de la supervivencia de estos pacientes40. En 1981, Akselrod et al, emplearon los primeros análisis espectrales de la serie RR para cuantificar el control cardiovascular41.
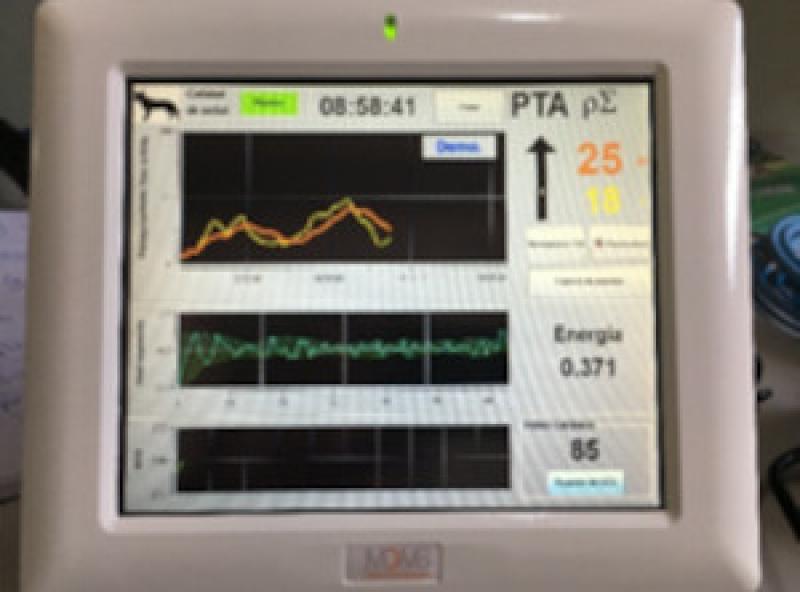
Recientemente se ha probado un monitor que evalúa el índice de nocicepción intraoperatorio en animales, este muestra un índice llamado PTA a través de la medición de la actividad de tono parasimpático basado en el análisis de la variabilidad de la frecuencia cardiaca.
El índice nocicepción-analgesia (ANI) ha mostrado un buen rendimiento para predecir la reactividad hemodinámica (HR) en humanos. Un índice similar que va de 0 a 100, basado en el componente parasimpático de la variabilidad de la frecuencia cardíaca y referido actividad tono parasimpático (PTA) fue desarrollado para uso en animales13.
La tecnología PTA (Actividad del Tono Parasimpático), desarrollada en Francia por la compañía Mdoloris Medical Systems (www.mdoloris.com), permite una gestión óptima de la analgesia en particular durante la cirugía, permitiendo un mejor despertar y facilitando la recuperación de animales.
La base del mecanismo de acción del monitor de tono parasimpático (PTA) es el uso de las tres derivaciones electrocardiográficas, para medir el tono parasimpático, dentro de una escala de 0-100, arrojando resultados de una evaluación continua. Este dispositivo proporciona índices PTA específicos para tres especies de animales: una aplicación para los gatos, una para perros y otro para caballos.
Dentro de la escala si el tono parasimpático muestra una lectura arriba de 50 indica que el paciente se encuentra en una analgesia adecuada, pero si muestra resultados por debajo de 30 nos indica que existe una reactividad autonómica a estímulos nociceptivos26,30,31.
El cálculo de índice nocicepción-analgesia (ANI) se basa en la influencia integradora del ciclo respiratorio en el intervalo RR, derivado del ECG. Permite un desarrollo cualitativo y medición cuantitativa de la VFC, principalmente mediada por el parasimpático y salida simpática del sistema nervioso central al nódulo sinoauricular. Las fluctuaciones de alta frecuencia (HF) en HRV (0.15-0.5 Hz) son mediadas predominantemente por cambios del flujo de salida en el parasimpático, mientras que los cambios de baja frecuencia (LF) están mediados por ambas actividades parasimpáticas y simpáticas.
En caso del tono parasimpático prominente, cada inspiración causa un breve aumento en la frecuencia cardíaca (FC) y disminución en el período RRHF (correspondiente a la arritmia sinusal respiratoria), con el análisis de RR filtrado dando una gran variabilidad. Por el contrario, si el tono parasimpático disminuye, HR aumenta y el efecto de la respiración en el período RR intervalo se puede utilizar para evaluar el tono simpático, y por lo tanto el equilibrio analgesia-nocicepción26.
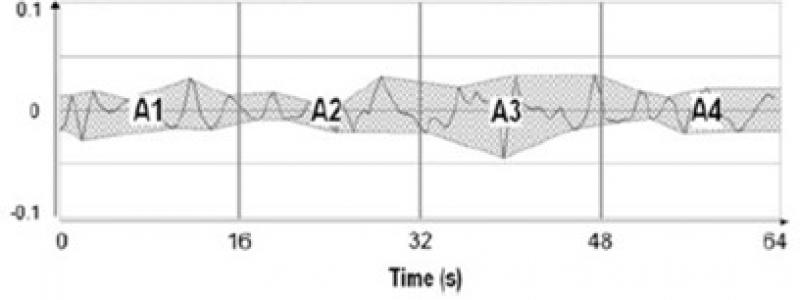
El monitor PTA usa un análisis matemático que permite la diferenciación del efecto simpático y parasimpático. Se miden cuatro areas (A1, A2, A3, A4) de la serie RR donde: AUCminnu= min (A1, A2, A3, A4) y AUCtotnu= S (A1, A2, A3, A4).
Las series locales mínimas y máximas en la normalización de RRHF se detectan automáticamente y las áreas A1, A2, A3 y A4 se miden entre las áreas inferiores y superiores en cada subventana de 16s. El AUCmin se define como la suma del mínimo de las cuatro subáreas: AUCmin¼min (A1, A2, A3 y A4) (Figura 1).
El ANI luego se calcula para expresar una fracción de la superficie total de la ventana, lo que lleva a una medida entre 0 y 100: ANI=100*[(a×AUCmin+b)/12.8]
PTA = 100 * [(5.1 x AUCminnu + 1.2) / 12.8]
Los valores a (5.1) y b (1.2) han sido determinados para mantener la coherencia entre el efecto visual de la influencia respiratoria en series RR y la medida cuantitativa de ANI, PTA es una medida de la arritmia sinusal respiratoria. La medición continua de ANI se puede realizar moviendo la ventana 64s después de cada cálculo. En la práctica, un período de movimiento de 4s da una curva de tendencia aceptable de los valores de los parámetros42,43.
El uso del monitor de tono parasimpático en comparación con la frecuencia cardiaca y la presión arterial sistólica en el transcurso de diversos estímulos nocivos en pacientes anestesiados parece ser más sensible para regular los estímulos nociceptivos, a pesar de que se reportó que en la inducción anestésica disminuyo la frecuencia cardiaca y la presión arterial sistólica, mientras que los valores altos en el monitor de tono parasimpático, reportaron que mostro predominio parasimpático44.
Monitor de PTA
No existe un estándar de oro para la evaluación del equilibrio, anti-nocicepción/nocicepción (NAN), sin embargo varios estudios clínicos han sido realizados para comparar las diferentes tecnologías en varios escenarios clínicos estudiando al ANI10,45 (Tabla 1).
| Tabla 1. Estudios basados en el índice nocicepción-analgesia (ANI) derivado del ECG. |
| Bibliografía | Estudio | Resultados | Conclusiones |
| Le Guen et al., 2012 | ANI y NRS durante el parto y entre las contracciones uterinas | Relación lineal negativa entre ANI y NRS (p= -0.18). | Buena correlación entre ANI y NRS durante el parto |
| Boseli et al., 2013 | ANI y NRS después de la anestesia general, rendimiento de ANI para la detección del dolor (NRS>3) en PACU. | Relación lineal negativa entre ANI y NRS (r2= 0.41). Buen rendimiento de detección de dolor en PACU ANI ≤ 57 | Buena correlación entre ANI y NRS durante el dolr inmediato postoperatorio. |
| Gruenewald et al., 2013 | ANI (índice de Analgesia/nocicepción), SPI (Índice de pletismo quirúrgico), BIS (Índice biespectral), FC y respuesta de PA a la estimulación dolorosa bajo varios niveles de anti-nocicepción. | BIS, FC y PA no cambió después de la estimulación nociva mientras que SPI y ANI variaron después de cada estimulación, las tasas opioide y los valores de PA resultaron mayor en ANI y menor FC y los mientras que SPI y BIS no fueron influenciados. | ANI y SPI pueden detectar posibles equilibrios inadecuados del NAN. |
| Sabourdin et al., 2013 | ANI en la respuesta de conductividad de la piel a la estimulación nociva bajo diferentes tasa de flujo de opioides en una población pediátrica. | El ANI disminuyó significativamente después de cada estímulo nocivo y por tanto las tasas de flujo de opiáceos, mientras que la conductividad de la piel, HR y BP no fueron modificados | ANI podría ser una herramienta más sensible para evaluar el NAN equilibrio que HR, BP o constancia de la piel. |
| Boseli et al., 2014 | ANI puede usarse para predecir el dolor postoperatorio durante la unidad de atención posterior a la anestesia (PACU). | Con un umbral de ANI de 50 que fue identificado como predictivo de dolor agudo posoperatorio (NRS> 3) con buena sensibilidad (86%) y especialidad (86%). | ANI medido inmediatamente antes de la extubación es predictivo de dolor postoperatorio. El ANI constituye un método no invasivo para el monitoreo continuo de equilibrio NAN. |
| Jeanne et al., 2012 | Variacions de ANI, FC y PA durabte la anestesia general en cirugía abdominal laparoscópica. | Después del comienzo de la cirugía, ANI disminuyó a 60 y disminuyó aún más a 50 después del estímulo de estrés mientras que no hubo cambios signif. En la FC o PA. Después de la finalización de la cirugía, ANI volvió a 90. | ANI parece más sensible que la FC y la pA para moderar la estimulación nociva en pacientes anestesiados. |
| Sabourdin et al., 2013 | Las variacions ANI en niños de 8-12 años después de la estimulación quirúrgica del oído medio con desflurano con un índice biespectral a 50 y remifentanil(0.04-0.2 µg/kg/min) pediátrico (8 ± 5 años). | Disminución importante de ANI después de la estimulación tetánica, con la concentración más baja de remifentanil. | Después de la estimulación, el ANI disminuyó significativamente en comparación con los valores de preestimulación para todas las tasas de infusión de remifentanilo durante cirugía pediátrica y parece más sensible que la conductancia de piel. |
| Sabourdin et al., 2013 | Variacions de ANI, FC y PA durante la anestesia general en cirugía abdominal laparoscópica. | Variacions de ANI, FC y PA durante la anestesia general en cirugía abdominal laparoscópica. | Variacions de ANI, FC y PA durante la anestesia general en cirugía abdominal laparoscópica. |
| Gruenewald et al., 2013 | Anestesia intravenosa con propofol y remifentanilo, las variaciones ANI después de la estimulación tetánica (50 mA, 60 Hz, 30 s) en diferentes objetivos de remifentanil (0.2 y 4 ng/ml). | Disminución de ANI después de la estimulación tetánica | ANI es eficiente para el detección de la respuesta al dolor durante la cirugía bajo anestesia general. |
| Jeanne et al., 2014 | Anestesia intravenosa con propofol y sufentanil en bolo en cirugía de reemplazo de rodilla se utilizó ANI para la detección de reactividad hemodinámica priperatoria (aumento> 20% de FC y/o PA en 5 min). | Buen desempeño para la reactividad hemodinámica (AUC ROC = 0.92). ANI ≤ 63 Se = 80% y SP = 88% | Una gota de valores ANI predice una respuesta hemodinámica liderada por dolor. |
| Migeon et al., 2013 | En pacientes pediátricos (2 – 16 años) se utilizo el ANI con el uso de anestesia locorregional y solo sevoflurano. | El rendimiento de ANI para la detección de falla anestesia locorregional (aumento la FC ≥ 10% 2 min después de la incisión) 58 rendimiento ANI para la detección de falla en anestesia locorregional: AUC ROC = 0.75 (0.61 – 0.88) ANI ≤ 51, Se = 79 % y Sp = 62 % | ANI, concluyendo que tiene la capacidad de identificar fallas en anestesia locorregional en pacientes sometidos a anestesia general. |
| Bollag et al., 2014 | Anestesia general com sevoflurano y fentanilo en procedimientos de histerectomía abdominal y el efcto de la administración de ketamina 0.5 mg/kg sobre el ANI. | Sin modificaciones de ANI 5 min después de la administración de ketamina | La administración de ketamina no interfiere con la respuesta del ANI durante cirugía. |
| Pedrosa et al., 2015 | 15 perros sanos fueron sometidos a cirugía de castración. La anestesia se realizó con dexmedetomidina y metadona, propofol e isoflurano. Pacientes recibió anestesia loco-regional, epidural en hembras e intratesticular en machos. PTA se evaluó ante y post intubación, colocación de abrazaderas Backhaus, incisión en la piel, ligadura del pedido ovárico o testículos, ligadura del cuella uterino, cierre de la pared abdominal y extubación. | Los valores de PTA fueron más altos en machos que en hembras querecibieron anestesia regional y fueron inversamente asociados a las presiones arteriales. | El monitor de PTA ser útil para evaluar el grado de nocicepción intraaperatoria. |
Ventajas del uso del monitor PTA en medicina veterinaria
El monitor de actividad de tono parasimpático (PTA) evalúa indirectamente el nivel de determinación de la nocicepción y la variabilidad del ritmo cardíaco. El monitor puede usarse con dos tipos de pacientes: inconscientes y conscientes. En el primer caso (paciente inconsciente bajo anestesia general en el quirófano), el ámbito del ANI (50-70) corresponde a la zona de analgesia adecuada, es decir, que la cobertura anestésica es suficiente, y corresponde a un tono parasimpático relativo que predomina sobre el tono simpático.
Cuando el valor medio de ANI desciende bajo 50, es muy probable que tenga lugar un episodio de reacción hemodinámica dentro de los 10 minutos (un 80 % de probabilidad cuando la curva es inferior a 40 y un 100 % de probabilidad cuando esta es inferior a 30). En ese momento, es conveniente que el anestesista vuelva a inyectar un poco de analgésico para evitar la futura reacción hemodinámica.
En los casos en que el valor del ANI se sitúe por encima de 70, es probable que tenga lugar una dosis excesiva de opiáceos. Entonces, los médicos pueden evitar una inyección adicional y disminuir los efectos secundarios relacionados con las sobredosis de opiáceos como42,46,47:
- Tiempo de recuperación más largo
- Náuseas,
- Vómitos en sala de recuperación
- Bradicardias
- Depresiones respiratorias
- Alucinaciones - Hiperalgesia posoperatoria
- Mareos
- Estreñimiento
- Delirio
- Hipotensión
- Inmunodepresiones que favorecen el avance de un cáncer
La ventaja más importante es poder realizar el monitoreo del índice de nocicepción intraoperatoria de los pacientes, lo cual permite la valoración de la analgesia en el animal disminuyendo así la incidencia de sobredosificación y subdosaje, además de prevenir la inestabilidad hemodinámica intraoperatoria, generarando una evaluación de la analgesia y consecuentemente reduciendo el cambio hemodinámico por estímulos nocivos10,13,30.
Es una herramienta que brinda información confiable sobre el equilibrio nociceptivo y monitoreo de una posible reactividad hemodinámica fácil de medir y usar:
- Monitorizacion clínica estándar continua
- No invasivo
- Procesamiento confiable aun en casos de:
- Hipovolemia
- Shock (hipovolemico, séptico, cardiogénico).
- Hipotermia
- Inconsciencia13.
Es predictivo del dolor post operatorio26. Y la presencia de dolor se puede evaluar con la escala analógica visual (VAS) que maneja un rango de 0 -100 donde el valor más alto es un dolor extremo30. Es un método que le brinda al paciente ausencia de dolor severo y además no es invasivo43.
En conclusión se describe como un aparato de gran ayuda para el clínico30 en la exploración física para detectar donde se encuentra el dolor en el paciente. La evaluación del dolor en animales no es fácil y aunque sería más fácil administrar a todos los animales una dosis estándar de analgésicos, este es un tratamiento inadecuado del dolor que debe y puede ser evitado ahora que existe esta tecnología y que ya está disponible.
Uso del monitor PTA
El monitor de PTA trae consigo 3 electrodos de caimán marcados con un color específico para evitar confusión y un mal colocamiento de estos, la manera en que se utiliza es como si se estuviera realizando un electrocardiograma (ECG) colocando los electrodos en el paciente en el siguiente orden (Tabla 2, Figuras 2-4).
| Tabla 2. Colocación de electrodos. |
| Electrodo | Color | Posición anatómica |
| 1 | Rojo | Miembro torácico derecho |
| 2 | Amarillo | Miembro torácico izquierdo. |
| 3 | Gris | Miembro pelviano derecho. |
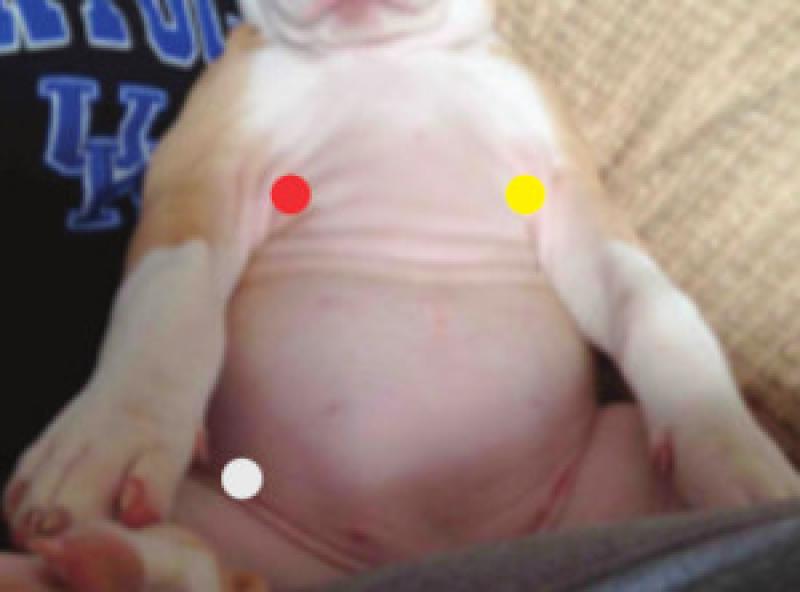
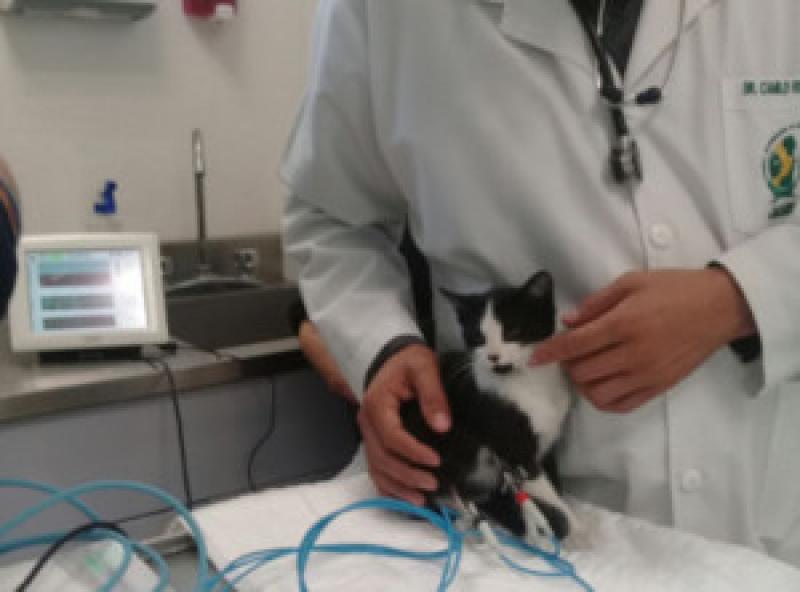
Desventajas del uso del monitor de tono parasimpático
El uso de la analgesia intraoperatoria manipulada en base a los resultados del monitor de tono parasimpático no garantiza la reducción de dolor postoperatorio, factores como arritmias, apnea o baja frecuencia respiratoria intervienen en el uso eficiente del monitor26.
En uso de protocolos realizados con propofol las medidas del tono parasimpático durante la anestesia son coherentes con la evolución del balance analgesia/nocicepción, aunque su rendimiento disminuye en los pacientes despiertos30,48.
Bibliografía
- Rollin, B. 2002. The use and abuse of aesculapian authority in veterinary medicine. Rev. JAVMA; 220, 1144–1149.
- Mathews, K. 2000. Pain assessment and general approach to management. Rev. Vet Clin North Am Small Anim Pract 30, 729-755, v.
- 3 Pascoe, P. 2000. Perioperative pain management. Rev. Vet Clin North Am Small Anim Pract; 30, 917-932.
- Turk, D., Okifuji, A. 2001. Pain terms and taxonomy of pain. In: Bonica´s management of pain. Bonica J, Loeser J, Chapman C, et al. (eds). Lippincott Williams & Wilkins, Hagerstown.
- Romera, E., Perena, M., Perena, M., y Rodrigo, M. 2000. Neurophysiology of pain. Rev. Soc Esp Dolor; 7: Supl. II, 11-17.
- Thienhaus, O., Cole, B. 2002. Classification of pain. In: Weiner´s pain management: a practical guide for clinicians. Raton B (ed).
- Pasero, C., Paice, J., McCaffery, M. 1999. Basic mechanism underlying the causes and effects of pain. In: Pain: clinical manual. (Second Edition edn). M M & C P (eds), St. Louis, Mosby. pp. 15-34.
- Daza M., Álvarez, I. 2001. Reconocimiento del dolor: manifestaciones y valoración clínica en: Canis et Felis: Terapéutica del dolor (I) 52, 31 - 48.
- Gruenewald, M., Ilies, C., 2013. Monitoring the nociception-anti-nociception balance. Rev. Mejor Pract Res Clin Anaesthesiol; 27 (2): 235 – 247.
- Gruenewald, M., Ilies, C., Herz, J., Schoenherr, T., Fudickar, A., Höcker, J., Bein, B. 2013. Influence of nociceptive stimulation on analgesia nociception index (ANI) during propofol–remifentanil anaesthesia. Rev. Br J Anaesth; 110 (6): 1024-1030.
- Gruenewald, M., Ilies, C., Herz, J., Schoenherr, T., Fudickar, A., Hocker, J. 2013. Influence of nociceptive stimulation on analgesia nociception index (ANI) during propofol remifentanil anaesthesia. Rev. Br J Anaesth;110:1024-30.
- Gruenewald, M., Ilies, C., Herz, J., Schoenherr, T., Fudickar, A., Hocker, J., Bein, B. 2013. Influence of nociceptive stimulation on analgesia nociception index (ANI) during propofol– remifentanil anaesthesia. Rev. British Journal of Anaesthesia; 4-7 pp.
- Mansour, C., Merlin, T., Bonnet, G. J. M., Chaaya, R., Mocci, R., Ruiz, C.C., Allaouchiche, B., Boselli, E., Junot, S. 2017. Evaluation of the parasympathetic tone activity (PTA) index to assess the analgesia /nociception balance in anaesthetized dogs. Rev. Res Vet Sci; 10(115): 271-277.
- Rivera L. 2001. Fisiología del dolor. En Canis et Felis: Terapéutica del dolor (I) 52, 6 - 30.
- IASP. 2011. Pain terminology. Part III. Pain Terms. A Current List of Definitions and Notes on Usage. IASP Taxonomy Working Group. pp. IASP http://www.iasppain.org/files/Content/ContentFolders/Publication2/ClasificationofChronicPain/Part_III-PainTerms.pdf
- Fajardo, M., Lesmes, M., Cardona, L. 2012. Evaluación del efecto analgésico postoperatorio de infusiones intraoperatorias de tramadol y tramadol/lidocaína/ketamina en comparación con morfina/lidocaína/ketamina en hembras caninas sometidas a ovariohisterectomía, Archivo médico veterinario. Vol.44. No.2.
- Ortega, A., Roca, J., Mico, A. 2002. Modelos animales de dolor. Una visión crítica. Rev. Soc Esp Dolor; 9, 447 – 453.
- Lemke, K. 2004a. Understanding the pathophysiology of perioperative pain. Rev. Can Vet J; 45, 405 - 413.
- Moreno, C., Prada, D. 2004. Fisiopatología del dolor clínico. Asociación Colombiana Neurología 2, 9 - 21.
- Kidd B., Urban, L. 2001. Mechanisms of inflammatory pain. Rev. J Anaesth; 87, 3-11.
- Salazar, N., Rioja, E., Martínez, F. 2014. Analgesia. In: Manual de anestesia y analgesia de pequeños animales. SERVET (ed). pp. 58-84
- Clark, C., Mendl, M., Jamieson, J. 2011. Do psychological and physiological stressors alter the acute pain response to castration and tail docking in lambs?. Rev. Vet Anaesth Analg; 38, 134-145.
- Sternberg, W., Ridgway, C. 2003. Effects of gestational stress and neonatal handling on pain, analgesia, and stress behavior of adult mice. Rev. Physiology & Behavior; 78, 375-383.
- Guesgen, M., Beausoleil, N., Stewart, M. 2013. Effects of early human handling on the pain sensitivity of young lambs. Rev. Vet Anaesth Analg; 40, 55-62.
- González de Mejía, N. 2005. Analgesia multimodal postoperatoria. Rev. Soc Esp Dolor; 12, 112 - 118.
- De jonckheere, J., Bonhomme, V., Jeanne, M., Boselli, E., Gruenewald, M., Logier, R., Richebé, P. 2015. Physiological Signal Processing for Individualized Anti-nociception Management During General Anesthesia: a Review. Rev. IMIA and SchattauerGmbH; 30: 8-14.
- De jonckheere, J., Delecroix, M., Jeanne, M., Keribedj, A., Couturier, N., Logier, R. 2013."Automated analgesic drugs delivery guided by vagal tone evaluation: Interest of the Analgesia Nociception Index (ANI)", Engineering in Medicine and Biology Society (EMBC) 35th Annual International Conference of the IEEE, pp. 1952-1955.
- Berry, S. 2015. Analgesia in the perioperative period. Rev. Vet Clin North Am Small Anim Pract; 45, 1013-1027.
- Price, J., Catriona, S., Welsh, E. 2003. Preliminary evaluation of a behaviourbased system for assessment of post-operative pain in horses following arthroscopic surgery. Vet Anaesth Analg 30, 124-137.
- Szental, J. A., Webb, A., Weeraratne, C., Campbell, A., Sivakumar, H., Leong, S. 2015. Postoperative pain after laparoscopic cholecystectomy is not reduced by intraoperative analgesia guided by analgesia nociception index (ANI®) monitoring: a randomized clinical trial. Rev. Br J Anaesth; 114 (4): 640-645.
- Szental, J., Webb, A., Weeraratne, C., Campbell, A., Sivakumar, H., Leong, S. 2015. Postoperative pain after laparoscopic cholecystectomy is not reduced by intraoperative analgesia guided by analgesia nociception index (ANI®) monitoring: a randomized clinical trial. Rev. Br J Anaesth; 114 (4): 640-645.
- Roughan, J., Flecknell, P. 2001. Behavioural effects of laparotomy and analgesic effects of ketoprofen and carprofen in rats. Rev. Pain; 90, 65-74.
- Festing, M. 2003. Principles: the need for better experimental design. Rev. Trends Pharmacol Sci; 24, 341-345.
- Richardson, C., Flecknell, P. 2005. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Rev. Altern Lab Anim; 33, 119-127.
- Coulter, C., Flecknell, P., Richardson, C. 2009. Reported analgesic administration to rabbits, pigs, sheep, dogs and non-human primates undergoing experimental surgical procedures. Rev. Lab Anim; 43, 232- 238.
- Eddie, C., R., Clarke, K. W., y Pascoe, P. J. 2011. Animal welfare in biomedical publishing. Rev. Veterinary Anaesthesia and Analgesia, 38(1), 1-2.
- Cobos, E., Portillo, E. 2013. "Bedside-to-Bench" Behavioral Outcomes in Animal Models of Pain: Beyond the Evaluation of Reflexes. Rev. Curr Neuropharmacol; 11, 560-591.
- Hernández, C., E. 2016. Analgesia personalizada ANI y NIPE. Rev. Anest. Méx; 28 (2).
- Gutiérrez A., Montes, M., Jiménez, J. 2012. Prevalencia de neuropatía autonómica cardiovascular en pacientes con diabetes mellitus tipo 2 y estandarización en población mexicana por medio de la variabilidad de la frecuencia cardiaca. Rev. Mex Med Fis Rehab;24(2):45-55.
- Bernal, O., Moro, C. 2006. Arritmias cardiacas en la mujer. Rev. Esp Cardiol; 59 (06).
- Akselrod, S., Gordon, D., Ubel, F., Shannon, D., Barger, A., Cohen, R. 1981. Power spectrum analysis of heart rate fluctuations: a quantitative probe of beat-to-beat cardiovascular control. Rev. Science; 213, 220-222 pp.
- Boselli, E., Bouvet, L., Bégou, G., Dabouz, R., Davidson, J., Deloste, J. 2014. Prediction of immediate postoperative pain using the analgesia/nociception index: a prospective observational study. Rev. Br J Anaesth;112:715-21.
- Boselli, E., Ionescu, D., Bégou, L., Bouvet, Dabouz, C. Magnin,C., Allaouchiche, B. 2013. Prospective observational study of the non-invasive assessment of immediate postoperative pain using the analgesia/nociception index (ANI). Rev. British Journal of Anaesthesia; 111(3), 453–459.
- Jeanne, M., Clément, C., De Jonckheere, J., Logier, R., Tavernier, B. 2012. Variations of the analgesia nociception index during general anaesthesia for laparoscopic abdominal surgery. Rev. J Clin Monit Comput; 26(4) :289-294.
- Sabourdin, N., Arnaout, M., Louvet, N., Guye, M., Piana, F., Constant, I. 2013. Pain monitoring in anesthetized children: first assessment of skin conductance and analgesia nociception index at different infusion rates of remifentanil. Rev. Paediatr Anaesth;23:149-55.
- Krenk, L., Rasmussen, L., Hansen, T., Bogø, S., Søballe, K., Kehlet, H. 2012. Delirium after fast-track hip and knee arthroplasty. Rev. Br J Anaesth.;108 (4):607-11.
- Nguyen, A., Yosinski, J., Clune, J. 2014. Deep neural networks are easily fooled: high confidence predictions for unrecognizable images in computer vision and pattern recognition (CVPR ’15), IEEE.
- Jeanne, M., Delecroix, M., De Jonckheere, J., Keribedj, A., Logier, R., Tavernier, B. 2014. Variations of the Analgesia Nociception Index during propofol anesthesia for total knee replacement. Rev. Clin J Pain;30(12):1084-8.
 by Multimédica
by Multimédica