Laboratorio básico para ATV´S
Resumen breve
Este artículo tiene como objetivo exponer el proceso que sigue una muestra biológica desde que se obtiene del paciente hasta que se procesa en el laboratorio; ya sea para establecer o complementar un diagnóstico, para controlar la evolución de las enfermedades en curso o para corroborar la desaparición de las mismas. Cada vez es más frecuente que los centros veterinarios cuenten con un laboratorio propio, y una de las funciones del ATV es conocer como procesar las muestras biológicas más…Índice de contenidos
Resumen
Este artículo tiene como objetivo exponer el proceso que sigue una muestra biológica desde que se obtiene del paciente hasta que se procesa en el laboratorio; ya sea para establecer o complementar un diagnóstico, para controlar la evolución de las enfermedades en curso o para corroborar la desaparición de las mismas. Cada vez es más frecuente que los centros veterinarios cuenten con un laboratorio propio, y una de las funciones del ATV es conocer como procesar las muestras biológicas más habituales (sangre, orina, heces, etc.), y también es importante conocer la técnica para la extracción de las diferentes muestras.
Introducción
El análisis de sangre es el estudio de los componentes de muestras biológicas de tejidos o fluidos orgánicos para la obtención de datos con un fin diagnóstico.
Las muestras fisiológicas son aquellas que se obtienen de tejidos o fluidos existentes en el cuerpo, como la sangre, heces y orina, mientras que las muestras patológicas se obtienen de tejidos o fluidos formados o alterados por procesos patológicos, como el pus, los exudados, etc.
Tanto en hospitales como en las clínicas veterinarias, los análisis más habituales son:
- Sangre: hemograma, frotis sanguíneos, bioquímica y test rápidos.
- Orina: tira bioquímica, densidad y sedimento urinario.
- Heces: coprología directa y técnicas de flotación.
- Otras muestras: citologías, biopsia y cultivos.
Fases del proceso analítico:
- Preanalítica.
- Analítica (procesamiento de las muestras).
- Postanalítica
- Mantenimiento del laboratorio
Preanalítica
Extracción y/o recepción de las muestras
La sangre en perros y gatos suele extraerse principalmente de dos vías: en el cuello, de la vena yugular; y en las extremidades, de las venas cefálica y safena, aunque es recomendable reservar estas en caso de que el paciente requiera hospitalización.
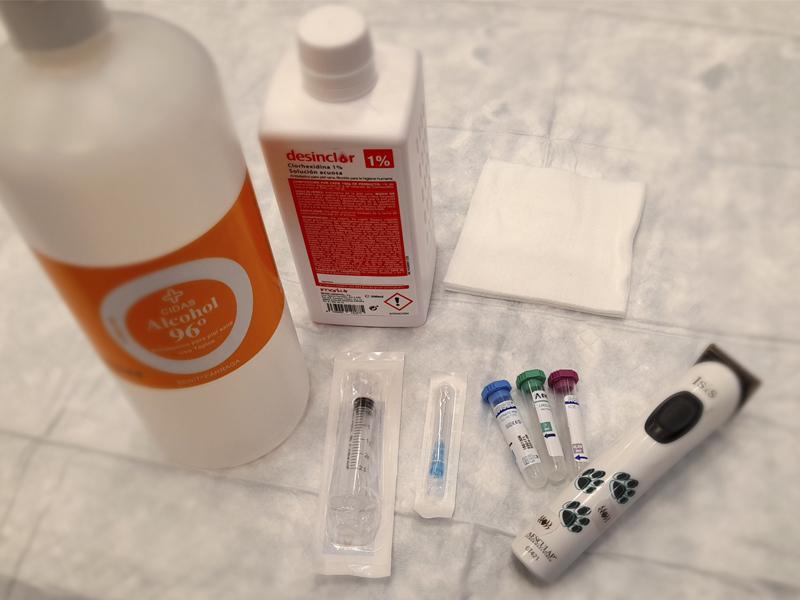
El material necesario es:
- Rasuradora.
- Alcohol/ clorhexidina (para desinfectar la zona rasurada).
- Jeringuilla y aguja (calibre acorde con el tamaño del animal).
- Tubos para introducir la sangre recogida (Figura 1).
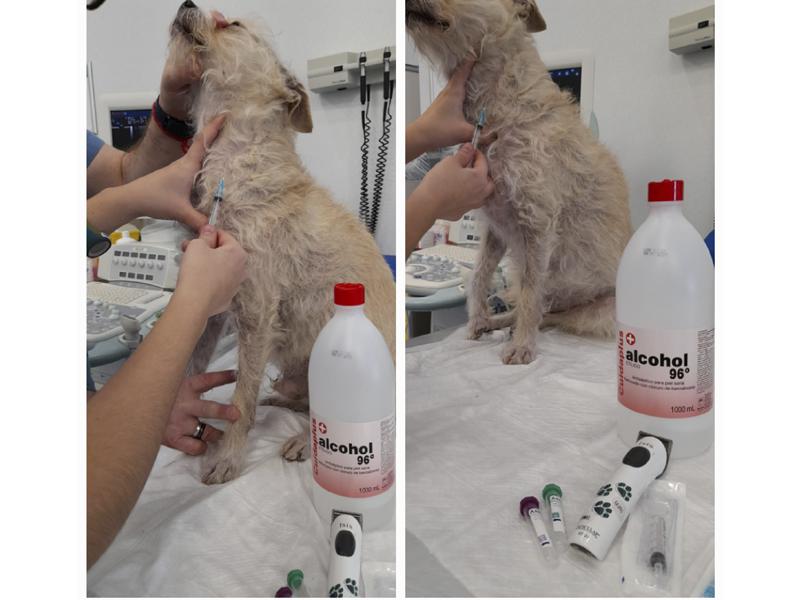
Para la extracción, los pasos son los siguientes:
- Rasurar y desinfectar bien la zona.
- Ejercer algo de presión en la zona proximal del cuello (en caso de yugular) o compresión de la vena con los dedos o con ayuda de una goma compresora en caso de venas en extremidades.
- Introducción de la aguja en la vena.
- Extracción de la sangre tirando del émbolo de la jeringuilla suavemente (Figura 2).
Extracción de orina
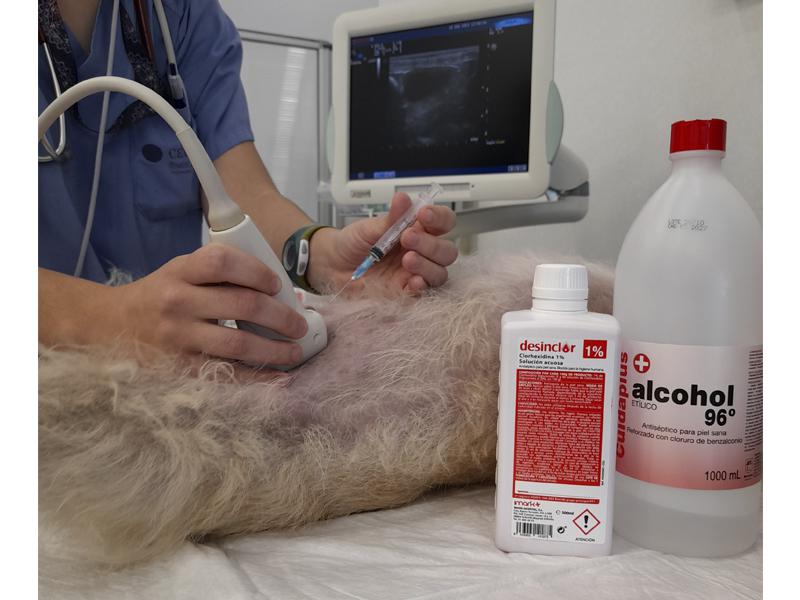
La muestra de orina ha de recogerse en un recipiente limpio y estéril, desechando las primeras gotas. No debe recogerse nunca del suelo.
En algunos casos será necesario obtener la muestra por sondaje o incluso por punción directa de la vejiga (cistocentesis). Normalmente será ésta la técnica de elección para conseguir resultados sin interferencias. Esta técnica suele realizarse por los veterinarios con ayuda del ecógrafo (Figura 3).
Las muestras de orina nunca deben congelarse. Se conservan unos 30 minutos a temperatura ambiente y unas 12 horas a 4ºC.
Lo más recomendable es efectuar los análisis lo antes posible para que no se alteren los resultados (Tabla 1).
| Tabla 1. Tipos de obtención de muestras de orina |
| Tipo | Proceso de recogida |
| Micción espontánea | Recolección de la muestra mientras el animal orina. Esta muestra no será válida para evaluar posibles infecciones (puesto que está contaminada con las bacterias del tracto urinario inferior) |
| Sondaje | Introducción de una sonda urinaria por la uretra, con la ayuda de lubricante. |
| Cistocentesis | Punción abdominal, atravesando la pared muscular hasta llegar a la vejiga de la orina. Hay que rasurar y desinfectar bien la zona y utilizar material estéril. |
Obtención de heces
De forma habitual, son los propietarios los que se encargan de la recogida de heces. La muestra tiene que introducirse en un bote estéril o lo más limpio posible (Figura 4). Las heces deben tener, como máximo, el tamaño de una nuez.
Para análisis coproparasitológicos, las heces deben ser de tres días consecutivos, conservadas en frío y la última muestra no debe tener más de 24h.
Se debe recoger la parte de las heces que tenga un aspecto más desagradable; zonas con sangre, moco o de consistencia diferente.
En caso de necesitar muestras durante una hospitalización, se puede recoger o extraer directamente del recto mediante un hisopo.

Extracción de fluidos orgánicos
Estos fluidos pueden ser varios, como, por ejemplo:
Liquido sinovial, líquido cefalorraquídeo, contenido de abscesos, exudados pleurales, abdominales o pericárdicos, etc.
Suelen ser extraídos por veterinarios mediante diferentes procesos con diferentes tubos (Tabla2).
| Tabla 2. Tubos utilizados para la extracción de muestras orgánicas. |
| Los tubos utilizados serán: |
| Tubos con EDTA | Para estudios citológicos o recuentos celulares |
| Tubos con (heparina) o sin anticoagulante | Para parámetros bioquímicos |
| Tubos estériles | Para cultivos microbiológicos |
Preparación y envío de muestras a laboratorio externo
Cuando la muestra va a ser enviada a un laboratorio externo, hay que seguir las pautas de recogida, etiquetado, conservación y transporte de dicho laboratorio. Ya que cada uno tiene sus normas.
En general, el envío de muestras biológicas suele ser en recipientes con rosca, para evitar que se derrame la muestra, además de envolver el envase con un material absorbente.
Este pack se suele introducir en una bolsa sellada, y ésta a su vez en un sobre plastificado.
Analítica (procesamiento de las muestras)
SANGRE
La muestra de sangre se introducirá en el tubo correspondiente quitando la aguja de la jeringuilla. Si no se hace así, puede provocarse la hemólisis y la muestra no será aceptable para el análisis, ya que la hemoglobina liberada al romperse los eritrocitos teñirá el suero de rojo.
Los tubos siempre van marcados con una señal (a veces es una flecha, otras un recuadro) (Figura 5) que nos indica la cantidad de sangre que se debe introducir dentro. La muestra no es válida tanto si se pone más o menos cantidad de lo estipulado.
Inmediatamente después de introducir la muestra en los tubos, debe ser identificada, con una etiqueta adhesiva (con el código de barras) en caso de enviar la muestra a un laboratorio externo, o rotulando con letra clara y en mayúsculas.
Los datos básicos necesario son: nombre del paciente, número de identificación, así como los apellidos del propietario (Figura 5).
Antes de realizar la analítica, hay que valorar si la muestra es válida o no. Se rechazarán las muestras coaguladas o que estén en recipientes inadecuados ya que no se puede realizar un hemograma con un tubo sin el anticoagulante correspondiente. Si esto sucede es necesario que se obtenga una muestra nueva (Tabla 3).
Una vez se tenga la muestra, el ATV debe prepararla para el para el análisis. Dependiendo del estudio que se vaya a realizar, se puede necesitar sangre entera, plasma o suero (que se obtendrán tras la centrifugación de los tubos).
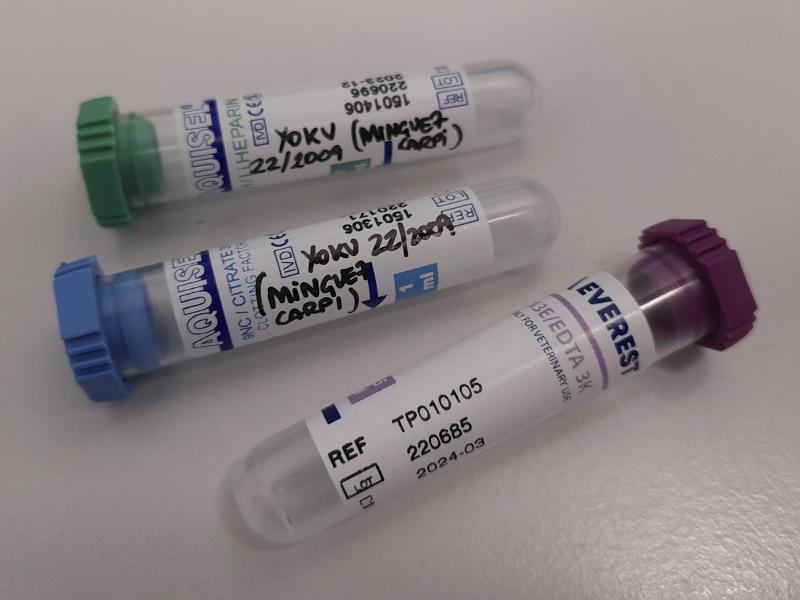
| Tabla 3. Procesamiento de una muestra sanguínea. |
| Color del tubo | Tipo de anticoagulante | Muestra obtenida | Tipo de análisis |
| Tapón verde / naranja | Heparina de litio | Plasma | Bioquímica / iones |
| Tapón lila | EDTA | Sangre entera | Hematología /parásitos hemáticos/citologías |
| Tapón azul | Citrato de sodio | Sangre entera | Estudios de coagulación |
| Tapón Blanco | No lleva anticoagulante, pero si un gel separador | Suero | Bioquímica especial/ Análisis serológicos (inmunología) |
| Tapón rojo | No lleva anticoagulante, contiene un activador de la coagulación | Suero | Bioquímica especial |
HEMOGRAMA
El hemograma es la determinación de la cantidad y de las características morfológicas y distributivas de los componentes sanguíneos: serie roja, serie blanca y plaquetas (Tabla 4).
La sangre entera se conservará en un tubo de EDTA ya que es el anticoagulante que mejor conserva la morfología celular.
La heparina permite realizar adecuadamente los contajes, pero altera la morfología celular y conduce a errores en el frotis sanguíneo.
| Tabla 4. Valores del hemograma en perros y gatos. |
| Parámetro | Perro | Gato |
| Glóbulos rojos | 5.5 - 7.8x106 /μl (millones/microlitro) | 5 - 10x106 /μl (millones/microlitro) |
| Hematocrito | 36 - 54 % | 24 – 45 % |
| Hemoglobina | 12 - 19 g/dl | 8 - 15 g/dl |
| Glóbulos blancos | 6000 - 17000/ μl | 5500 - 19500/ μl |
| Plaquetas | 200000 - 500000/ μl | 400000 - 600000/ μl |
Serie roja
Se analiza la morfología y el número de glóbulos rojos, la cantidad total de hemoglobina en sangre y el hematocrito (Tabla 5).
El hematocrito es uno de los parámetros más importantes. Es el volumen ocupado por los glóbulos rojos en la sangre y se calcula mediante centrifugado. Se expresa en porcentaje (%) y nos sirve para conocer la masa de glóbulos rojos existentes en la sangre.
| Tabla 5. Hemograma, serie roja. |
| Parámetro | Significado | Definición |
| HTO | Hematocrito | Cantidad de eritrocitos en relación al volumen de sangre total (%) |
| RBC | Recuento de eritrocitos | Número de eritrocitos por μl |
| HGB | Hemoglobina | Cantidad total de hemoglobina |
| MCV | Volumen corpuscular medio | Tamaño medio de los eritrocitos |
| MCH | Hemoglobina corpuscular media | Peso de la hemoglobina por eritrocito |
| MCHCH | Concentración de Hemoglobina corpuscular media | Relación entre tamaño de los eritrocitos y el peso de la hemoglobina |
| RDW | Amplitud de distribución eritrocitaria | Coeficiente de variación en la distribución del tamaño de los eritrocitos |
| RET | Recuento de reticulocitos | Número de eritrocitos jóvenes por μl |
| % RET | Porcentaje de reticulocitos | Porcentaje de eritrocitos jóvenes |
| RET-HE | Hemoglobina en reticulocitos | Cantidad total de hemoglobina en eritrocitos jóvenes |
MICROHEMATOCCRITO
Material necesario (Figura 6):
- Capilares sin heparina.
- Plastilina.
- Centrífuga de microhematocritos.
- Regla o tabla para lectura de microhematocritos.
- Sangre entera en EDTA (tapón lila).

Pasos de la técnica del microhematocrito:
- Introducir el capilar en la muestra sanguínea, inclinando un poco el tubo para que la sangre sea absorbida por capilaridad, llenando un 75 % del capilar (aproximadamente ¼ del capilar).
- Sellar con plastilina uno de los extremos del capilar.
- Colocar el capilar en la centrífuga, poniendo atención en que la parte sellada con plastilina quede hacia la parte exterior de la centrífuga y siempre haya un contrapeso enfrente con el mismo volumen de sangre.
- Centrifugar durante 5 minutos (11.000-15.000rpm).
- Medición del capilar.
Métodos más habituales de medición del microhematocrito:
- Con una regla: poniendo la regla debajo del hematocrito (despreciando la porción ocupada de la plastilina) y midiendo hasta los elementos que forman la serie roja (p.ej., si 2.1 cm en nuestro hematocrito es la serie roja y el volumen total sumando la serie roja y el plasma es 4.7 cm).
Se procede al cálculo mediante una regla de tres:
Si 4.7cm — 100 %
En 2.1cm —– ¿X?
X = (2.1x100) / 4.7 = 44.68 % de microhematocrito.
- Tablas para lectura de microhematocritos: posicionando el capilar con la parte de la plastilina fuera de la línea en el 0 % y la parte final del plasma en el final de la última línea en el 100 % sesiguen las líneas y da el porcentaje directamente (Figura 7).

FROTIS SANGUÍNEO
El estudio citológico sanguíneo, es una técnica fácil y barata que no requiere aparataje (únicamente un microscopio) y permite identificar anomalías morfológicas en las células sanguíneas. El objetivo de la extensión es obtener una amplia zona donde las células se disponen independientes en un solo plano, lo que permite la correcta evaluación del frotis.
Material necesario:
- Portas.
- Pipeta pasteur o jeringa.
Pasos de la técnica para preparación del frotis sanguíneo (Figura 8):
- Depositar una gota de sangre entera sobre un porta limpio.
- Acercar otro porta de forma retrógrada a la gota de sangre, dejar que se extienda la sangre por capilaridad por el filo corto del porta.
- Realizar un movimiento rápido y decidido hacia adelante, sin separar ambos portas.
- El frotis será adecuado si la capa es uniforme en toda su extensión, sin vacíos ni zonas con mayor acumulación de sangre.
- Tinción de la extensión sanguínea (diff-quick, descrita más adelante), lo que permite diferenciar correctamente los eritrocitos (anucleados), los leucocitos (núcleo púrpura y citoplasma azulado) y las plaquetas (de menor tamaño) (Figura 9).

Serie blanca
El estudio de la serie blanca se lleva a cabo con un recuento de los glóbulos blancos totales y de cada uno de sus tipos (neutrófilos, eosinófilos, basófilos, monocitos y linfocitos) (Tabla 6).
| Tabla 6. Serie blanca. |
| Parámetro | Significado | Definición |
| WBC | Recuento de leucocitos | Número de leucocitos por μl |
| %NEU | Porcentaje de neutrófilos | Fórmula leucocitaria |
| %LYM | Porcentaje de linfocitos | Fórmula leucocitaria |
| %MON | Porcentaje de monocitos | Fórmula leucocitaria |
| %EOS | Porcentaje de eosinófilos | Fórmula leucocitaria |
| %BAS | Porcentaje de basófilos | Fórmula leucocitaria |
| NEU | Recuento de neutrófilos | Número de neutrófilos por μl |
| LYM | Recuento de linfocitos | Número de linfocitos por μl |
| MON | Recuento de monocitos | Número de monocitos por μl |
| EOS | Recuento de eosinófilos | Número de eosinófilos por μl |
| BAS | Recuento de basófilos | Número de basófilos por μl |
Esto se denomina recuento diferencial o fórmula leucocítica. Este recuento suele hacerse mediante la máquina de hemograma, pero también con el microscopio.
Si el procedimiento se realiza mediante microscopio, se procede haciendo un frotis sanguíneo, el cual se dejará secar para su posterior tinción.
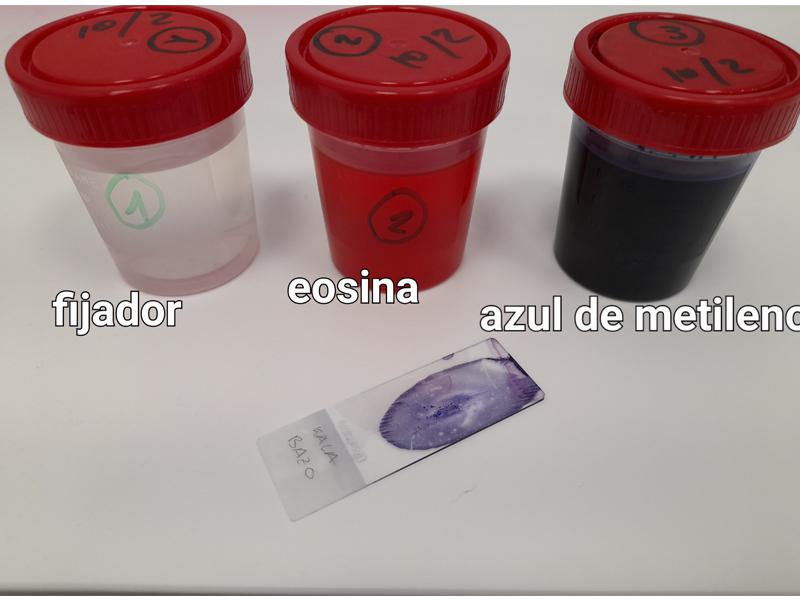
El método de tinción más frecuente es el diff-quick panóptica rápida (ver Figura 9). Consta de tres reactivos; un fijador, un colorante ácido (eosina) y un colorante básico (azul de metileno). Se debe introducir el portaobjetos en cada solución unos 15-25 segundos.
El portaobjetos se introduce primero en la cubeta con el fijador, segundo en la cubeta de eosina y tercero en la cubeta del azul de metileno para finalmente aclarar con agua fría y dejar secar al aire.
El tiempo que hay que dejar las muestras en cada solución lo indica el fabricante, pero también la persona que vaya a mirar las tinciones, ya que dependiendo de cómo esté acostumbrada a examinar las muestras, las querrá más o menos teñidas.
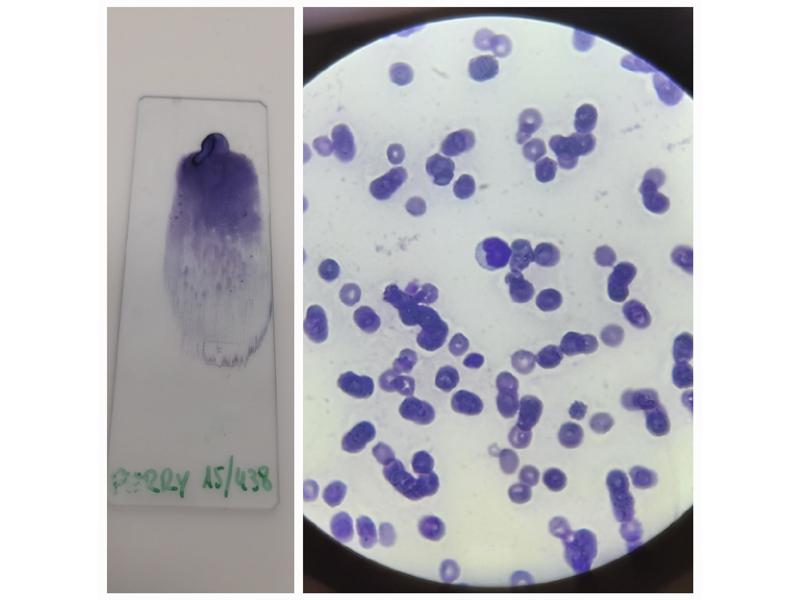
Después se procederá a observar bajo el microscopio (con objetivo 100x y con aceite de inmersión) y a hacer un recuento de células en el campo. Se recomienda analizar el frotis al momento, ya que las células pierden sus características pasadas unas horas (Figura 10).
Estudio plaquetario
Se realiza un recuento de las plaquetas y se evalúa su morfología. Las plaquetas carecen de núcleo y son más pequeñas que los glóbulos rojos (Tabla 7).
| Tabla 7. Estudio plaquetario. |
| Parámetro | Significado | Definición |
| PLT | Recuento de plaquetas | Número de plaquetas por μl |
| MPV | Volumen plaquetario medio | Tamaño medio de las plaquetas |
| PDW | Amplitud de distribución plaquetaria | Coeficiente de variación de la distribución del tamaño de las plaquetas |
| PCT | Plaquetocrito | Cantidad de plaquetas en relación al volumen de sangre total (%) |
BIOQUÍMICA
La bioquímica sanguínea es el conjunto de determinaciones de sustancias presentes en la fracción líquida de la sangre (plasma o suero).
Por ejemplo, la urea o la creatinina son parámetros importantes para conocer la función renal y las enzimas como la GPT, la GGT o la fosfatasa alcalina nos indican que puede haber un problema hepático.
Para el análisis bioquímico de la sangre es necesario suero o plasma:
- Para obtener suero se pondrá la sangre en un tubo sin anticoagulante (tapón blanco o rojo) y se dejará en posición vertical a temperatura ambiente durante 20-30 minutos para que se forme el coágulo. Después se centrifugará el tubo a 2500-3000 rpm durante 5 minutos.
- El plasma, se obtendrá centrifugando la sangre en un tubo con anticoagulante (tapón verde o naranja) a 2500-3000 rpm durante 5 minutos.
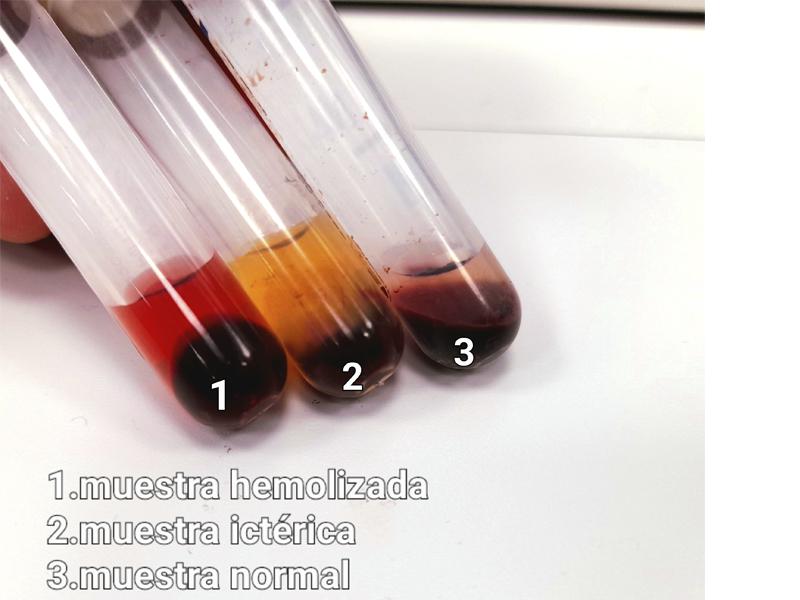
Si el animal no está en ayunas este suero o plasma puede contener una excesiva cantidad de grasa (plasma o suero lipémico, de aspecto blanquecino). También podemos encontrar problemas de hemólisis (suero o plasma rojizo, por la rotura de los eritrocitos) o ictericia (suero o plasma de color amarillo) y esto en ocasiones altera el resultado de la analítica (Figura 11).
IONES (Tabla 8)
| Tabla 8. Valores normales de los parámetros bioquímicos. |
| Parámetros bioquímicos | Intervalos fisiológicos * | |
| Perros | Gatos | |
| Urea (mg/dl) | 8.4-29.4 | 5.7-13 |
| Creatinina (mg/dl) | 0.6-1.9 | 1.0-2.0 |
| Glucosa (mg/dl) | 60-120 | 60-180 |
| ALT (UI/l) | 20-100 | 30-100 |
| GGT (UI/l) | 1-10 | 0-12 |
| AST (UI/l) | 19-70 | 10-80 |
| Fosfatasa alcalina (UI/l) | 20-155 | 15-96 |
| Proteínas totales (g/dl) | 5.1-7.2 | 6.8-7.8 |
| Albúmina (g/dl) | 2.3-3.8 | 2.3-3.8 |
| Globulinas totales (g/dl) | 2.1-4.4 | 2.5-4.5 |
| Potasio (mEq/l) | 3.8-5.8 | 3.7-5.5 |
| Sodio (mEq/l) | 144-166 | 150-160 |
| Cloro (mEq/l) | 106-126 | 118-128 |
| Calcio (mEq/l) | 8.9-12 | 8.9-11.2 |
| Fósforo (mEq/l) | 3.6-6.0 | 4.0-5.8 |
| Colesterol (mg/dl) | 125-310 | 60-115 |
| *Los intervalos de referencia son orientativos, pueden variar de un laboratorio a otro según la técnica utilizada. |
Los iones que se analizan con mayor frecuencia son:
• Calcio (Ca): ión que interviene en el latido cardíaco, la conducción nerviosa, la contracción muscular, además de la coagulación de la sangre.
• Cloro (Cl): se asocia con la falta o el exceso de bicarbonato (acidosis/alcalosis metabólica)
• Fósforo (P): el fósforo es un componente celular vital importante en el almacenamiento, liberación y transferencia de energía y en el metabolismo ácido-base. Forma parte de la estructura de huesos y dientes. La homeostasis del fósforo se regula principalmente por la hormona paratiroidea, que promueve la excreción renal.
• Potasio (K): sus desequilibrios pueden provocar efectos en nervios y músculos (sobre todo en el músculo cardiaco).
• Sodio (Na): es el principal responsable de la presión osmótica sanguínea y celular.
SNAP´SO TEST RÁPIDO
Dentro de los procesos analíticos también se llevan a cabo serologías y test rápidos (que utilizan una variante de la técnica ELISA de unión antígeno-anticuerpo).
Existen varios tipos y dependiendo del laboratorio hay que seguir diferentes pautas, pero en general suelen ser bastante parecidos todos los del mercado.
Al hacer este tipo de pruebas, los componentes deben estar a temperatura ambiente (15 - 25ºC).
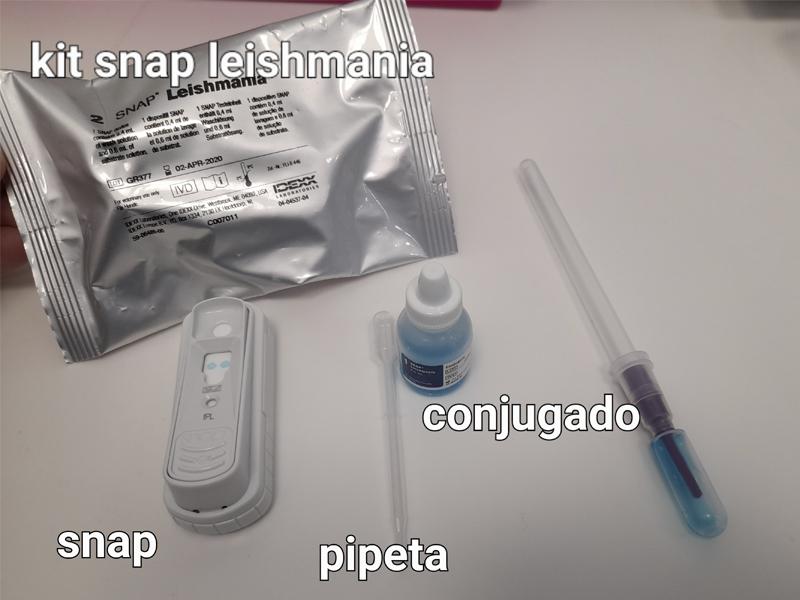
- Con la pipeta (generalmente viene en el kit), verter en un tubo de ensayo nuevo las gotas de muestra que nos indique el fabricante.
- Añadir las gotas de conjugado (para cada tipo de test es una cantidad diferente) al tubo de ensayo.
- Tapar el tubo y mezclarlo a fondo invirtiéndolo entre 3 y 5 veces.
- Colocar el Snap sobre una superficie horizontal. Añadir todo el contenido del tubo en el pocillo de muestras (con cuidado de no verter el contenido fuera del pocillo).
- La muestra fluirá por la ventana de resultados, alcanzando el círculo de activación en aproximadamente 30-60 segundos.
- En cuanto aparece la muestra por el círculo de activación, presionar el activador.
Se deben leer los resultados cuando haya pasado el tiempo indicado en las instrucciones.
Dependiendo del Snap que se vaya a realizar, será una cantidad de muestra, conjugado y tiempo diferente. Por eso es recomendable siempre consultar las instrucciones en cada caso (Figura 12).
ORINA
En el caso de la orina, una vez se vaya a preparar para el análisis, se dividirá en dos partes, una de ellas se centrifugará para examinar el sedimento y la otra se reserva para el análisis físico de la misma (Tabla 9).
Para el análisis químico, hay la ayuda de las tiras reactivas multiparamétricas. Estas tiras están formadas por unos pequeños cuadros con indicador de color que cambian en contacto con la orina, indicando si hay alguna anomalía en la muestra (Figura 13).
| Tabla 9. Características físicas normales de la orina. |
| Parámetro | Características normales |
| Color | Amarillo / ámbar |
| Olor | Suave |
| Turbidez | Transparente |
| Densidad (por refratómetro) | Perros: 1015-1045 Gatos: 1035-1060 |
| Cantidad | Perros adultos: 20-40 ml/Kg/día Gatos adultos: 15-30 ml/Kg/día Oliguria : < 1ml/kg/h |
| Sedimento | No hay que detectar |

CARACTERÍSTICAS DE LA ORINA (Tabla 10)
| Tabla 10. Características del análisis químico de la orina. |
| Indicadores de las tiras de orina | Valores normales |
| pH | • Entre 5.5 y 7 |
| Glucosa | • Negativo (si es positivo puede ser indicativo de diabetes) |
| Proteínas | • < 30mg/dl La proteinuria (cuando el valor es mayor) es indicativo de una afección renal. |
| Cuerpos cetónicos | • Negativo (siempre) La cetonuria puede aparecer en animales con diabetes, tumores, inanición, etc. |
| Sangre | • Negativo Las trazas de sangre pueden deberse a hemorragias, inflamación, neoplasias, etc., aunque también debe tenerse en cuenta la técnica utilizada para la extracción de la muestra. < 1ml/kg/h |
| Bilirrubina | • Negativo Si es positivo, es indicativo de enfermedades hepáticas. |
| Urobilinógeno | • Negativo Aparece aumentado en procesos que afectan al hígado, inflamaciones, infecciones, intoxicaciones,etc. |
Densidad: la densidad urinaria se medirá con la ayuda del refractómetro, de la siguiente manera (Figura 14):
- Con una pipeta pasteur colocar una gota de orina (50 μL) en la superficie del prisma principal (extremo del refractómetro).
- Cerrar la lámina para que la muestra pueda extenderse sobre la superficie del prisma.
- Dirigir el instrumento hacia una fuente de luz, y mirar las escalas a través del lente, en el límite entre el campo claro (blanco) y el campo oscuro (azul)
- Limpiar la muestra del prisma con agua y secar bien con papel.

Sedimento: para poder examinar el sedimento, se centrifugará a unas 1000-1500 rpm durante 10 minutos. En el fondo del tubo se observará que se forma un poso. Con la ayuda de una pipeta pasteur se extrae la orina sobrenadante, dejando muy poca cantidad, para poder pipetear el sedimento formado.
En un portaobjetos, se depositará una gota del sedimento, la cual será cubierta con un cubreobjetos y se llevará al microscopio para realizar una observación directa, para la detección de cristales. Esta misma muestra se puede dejar secar al aire y teñirla para evaluar la presencia de células atípicas, bacterias, etc.
En el sedimento de la orina de perros y gatos se puede observar diversas sustancias, diferenciándolo en, sedimento activo si hay presencia de células, ya sean epiteliales (que no tienen por qué ser indicativo de ningún problema patológico) (Tabla 11), leucocitos, eritrocitos, bacterias o levaduras o sedimento inactivo si hay proteínas, glucosa o cristales.
| Tabla 11. Células epiteliales que se observan de forma normal. |
| Tipo celular | Origen |
| Células escamosas | Procedentes de la porción distal de la uretra y de la parte externa de los genitales. |
| Células transicionales | Presentes en el tracto urinario, desde la pelvis renal hasta la uretra. |
| Células cilíndricas del epitelio renal | Se originan en los túbulos renales. |
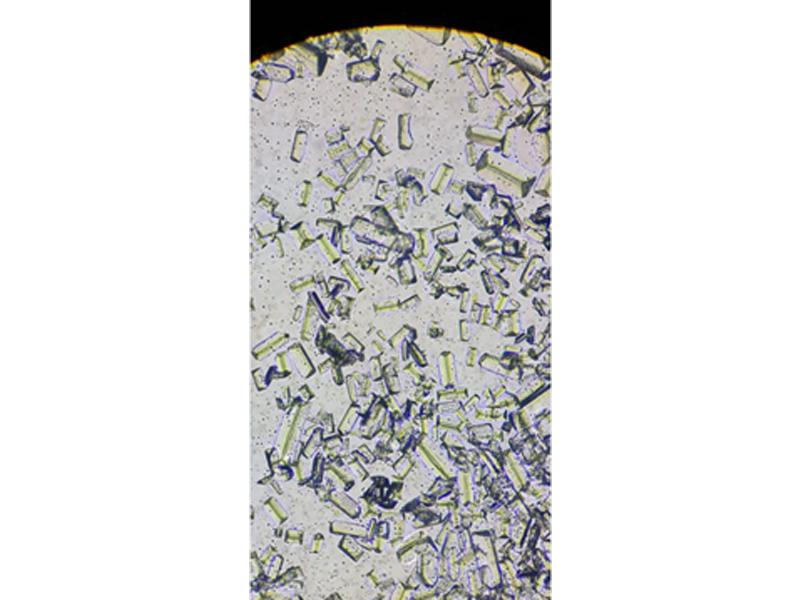
Los cristales dependen del pH. Los más comunes en orinas ácidas son los cristales de oxalato cálcico y en orinas básicas son los conocidos comúnmente como cristales de estruvita (fosfato amónico magnésico) (Figura 15).
HECES
El análisis coprológico ayuda a diagnosticar patologías gastrointestinales, sobre todo de origen parasitario. La muestra debe introducirse en un bote estéril o en su defecto lo más limpio posible.
Tipos de analíticas coprológicas:
La coprología directa; consiste en observar al microscopio una extensión de heces. Permite determinar la presencia de huevos o larvas de helmintos, así como formas vegetativas con movilidad.
Es el examen más sencillo y rápido, el material necesario es:
- Portaobjetos.
- Cubreobjetos.
- Hisopos.
- Suero salino.
Los pasos son los siguientes:
- Con el hisopo, se coge parte de la muestra (siempre de la parte de la muestra que haya sangre, mucosidad, o que sea más líquida) y se extiende por el portaobjetos.
- Se disuelven las heces añadiendo 2-3 gotas de suero salino.
- Se coloca el cubreobjetos y se lleva al microscopio (Figura 16).

Para la extracción, flotación utilizan soluciones de alta densidad (p.ej., sulfato de zinc, soluciones de sacarosa, etc.) para separar y concentrar huevos y formas larvarias.
En los análisis coproparasitológicos, las heces destinadas a estos análisis deben ser de tres días consecutivos y deben almacenarse en frío.
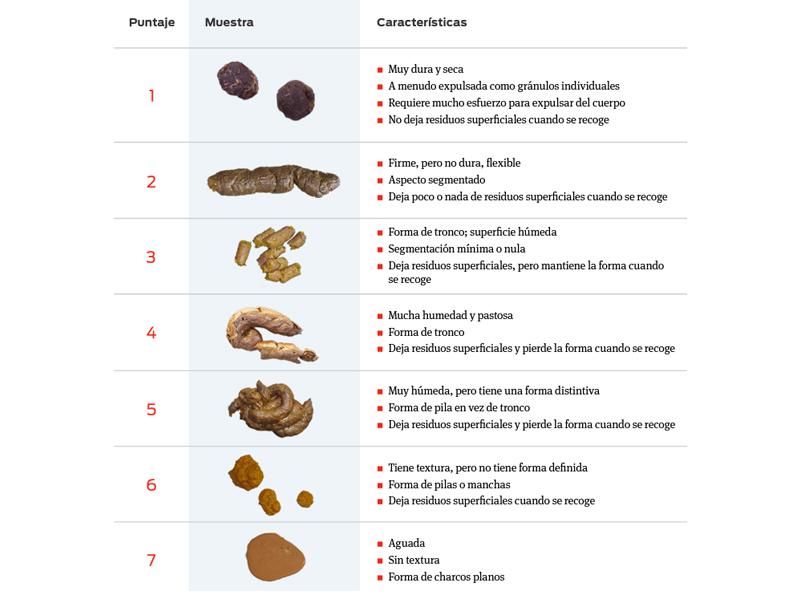
Además del estudio microscópico, es importante prestar atención al color y la consistencia de las heces, para poder clasificar esto. Existe la Fecal Score (FS) o escala de Bristol, que clasifica en 7 grupos el tipo de heces según su consistencia, y es muy importante en el control de pacientes hospitalizados (Figura 17).
FLUIDOS ORGÁNICOS
Estos fluidos suelen ser: líquido cefalorraquídeo, exudados pleurales, pericárdicos o abdominales, bilis, líquido sinovial, contenido de abscesos, etc. (Tabla 12).
| Tabla 12. Los tubos utilizados para su procesado o envío a laboratorio externo de fluidos orgánicos. |
| Tubo EDTA | Citología o recuentos celulares |
| Tubo heparina | Para parámetros bioquímicos |
| Tubo estéril | Para cultivos microbiológicos |
Los exámenes más habituales suelen ser la observación en fresco, las citologías y los cultivos microbiológicos, aunque en algunos casos, como el líquido peritoneal, también se realizan análisis bioquímicos, recuentos celulares u otras pruebas diagnósticas como el test de Rivalta.
CITOLOGÍAS
El análisis citológico es la observación de las células presentes en una muestra. Se efectúan citologías de todo tipo de fluidos, tejidos orgánicos, contenido del oído, conjuntivales o vaginales.
Otras muestras comunes son las muestras de pelo, piel y oídos. Estas muestras dermatológicas, se utilizan principalmente, para observar si hay presencia de ectoparásitos y dermatofitos.
Las técnicas de diagnóstico en estas muestras son:
- Punción: con una aguja fina se pincha varias veces el tejido que se quiere analizar, en varias direcciones, para asegurar que se obtiene muestra suficiente. Como la muestra queda dentro de la aguja, se extrae con la ayuda de una jeringa llena de aire, y al apretar el émbolo con la aguja puesta en la jeringa, se depositará la muestra en un portaobjetos (Figura 18).
- Punción-aspiración: muy parecida a la técnica anterior, pero en este caso al puncionar hay que aspirar con una jeringa unas 3 o 4 veces. La muestra se deposita en un portaobjetos al vaciar el contenido de la jeringa.
- Impronta: se presiona el portaobjetos contra la superficie que se quiere analizar, de tal forma que se imprime sobre él. Esta técnica se reserva para biopsias o citologías intraquirúrgicas.
- Raspado: se realiza un raspado con una hoja de bisturí y un poco de aceite de inmersión, que se extiende en el portaobjetos. Se utiliza en lesiones superficiales y en presencia de ectoparásitos.
- Tricograma: con unas pinzas se arrancan unos cuantos pelos que se depositan en un portaobjetos. Hay que coger el pelo por la zona más cercana a la piel y tirar lentamente para sacar la raíz sin romperla.
- Cinta adhesiva: impronta que se realiza con celofán adhesivo. La cinta se pega a la piel del paciente, se rasca un poco para que se adhiera la máxima muestra posible y se tira de ella. Se pega en un portaobjetos y se analiza directamente o se tiñe.
- Hisopos: en las zonas más sensibles en las que no es aconsejable realizar un raspado, la muestra se obtiene utilizando un hisopo o torunda, que se presiona en el portaobjetos y se hace rodar (Figura 19).
- PAAF: la punción y aspiración con aguja fina es la técnica más utilizada y con mayor valor diagnóstico especialmente en neoplasias.
- BAL o Lavado broncoalveolar: para tomar muestras del aparato respiratorio, se realizan lavados broncoalveolares, siempre con el animal bajo sedación. Este es un proceso muy delicado, debido a que es una técnica estéril en la que se introduce de 5 a 10 ml de solución salina estéril al 0.9 % por el tubo endotraqueal que inmediatamente se aspira para obtener la muestra.

CULTIVOS
El cultivo es el proceso en el que tras la toma de muestras se le facilita un medio para observar crecimiento en la misma. Se pueden realizar cultivos a partir de diversos tejidos, exudados, etc., con el objetivo de identificar agentes patológicos bacterianos o fúngicos. Se utilizan medios de cultivo que permiten el crecimiento y la identificación de dichos agentes.
Los patógenos posteriormente se suelen someter a un antibiograma para evaluar la sensibilidad o resistencia a diversos tipos de antibióticos o antifúngicos, determinando así el tratamiento.
En clínica habitualmente se realizan los cultivos DTM (dermatophyte test medium) que contienen un indicador de pH que permite, de una forma visual, determinar a grandes rasgos si los hongos que están creciendo son patológicos o no, ya que son selectivos y solo permiten el crecimiento de hongos patógenos (dermatofitos) causantes de las micosis o tiñas.
Se debe depositar el material (pelo, piel, etc.) que sea sospechoso de dermatofitosis en el medio de cultivo. En la mayoría de los casos, el hongo crecerá en un periodo de 3 a 7 días, y una vez haya crecido el dermatofito deberá observarse al microscopio para su identificación. En caso de ser negativo, no se debe desechar hasta las 3-4 semanas (Figura 20).

BIOPSIAS
Es la extracción de un pequeño fragmento de un órgano o tejido, potencialmente enfermo, de un organismo vivo.
El tejido se analiza para intentar identificar la naturaleza de la enfermedad.
Esta técnica se suele llevar a cabo por patólogos expertos en laboratorios externos.
Dependiendo del tejido del que se vaya a extraer la muestra y del número de biopsias, el procedimiento se podrá efectuar solo con sedación y anestesia local o habrá que someter al paciente a una anestesia general.
Para la toma de biopsia puede utilizarse una hoja de bisturí y unas pinzas para hacer una cuña del tejido o también puede utilizarse un sacabocados o punch (Figura 21).
Las biopsias deben tener el tamaño suficiente y englobar en la medida de lo posible tejido afectado y tejido sano. Si la zona lo permite, como mínimo deben ser de 1x1 cm.
Para el envío, se introducen en recipientes preparados con formol al 10 % (1 parte de formaldehído al 40 % y 3 partes de agua o SSF al 9 %)
Postanalítica
- Una vez realizada la analítica, hay que validar los resultados y saber identificar los que son erróneos, ya sea por problemas con la muestra o con el equipo. En este punto se valorará si se repite la toma de la muestra o si se realiza otra vez la prueba.
- Si la muestra se ha enviado a laboratorio externo hay que hacer un seguimiento de su estado, para cuando llegue el resultado avisar al veterinario para que paute el tratamiento correspondiente.
Mantenimiento del laboratorio
- Manejo de equipos y reactivos, calibración, controles y mantenimiento.
La mayoría de los errores que se cometen en la realización de analíticas suceden por el mal estado de los equipos y de los reactivos, por lo que es esencial realizar calibraciones y controles periódicos a las máquinas. Por lo que se deben seguir los protocolos del fabricante y mantener limpia y ordenada la zona de laboratorio.
- El refractómetro debe ser calibrado antes de ser utilizado. Los pasos son los siguientes:
- Colocar de 2 a 3 gotas de agua destilada en la superficie del prisma.
- Cerrar el cubreobjetos y girar el tornillo de ajuste de manera que el límite claro/oscuro se alinee con la línea de cero.
- Después del ajuste a cero, hay que limpiar el prisma con papel.
- El microscopio se debe limpiar después de cada uso, sobre todo cuando se utiliza con aceite de inmersión. Con una gasa y un poco de alcohol limpiaremos el objetivo, y lo mantendremos tapado con su funda.
- Los líquidos de tinción o diff-quick se suelen reemplazar dependiendo de su uso mínimo cada 3-4 semanas. Es recomendable tener un kit para muestras limpias, (sangre, citologías de neoplasias, etc.) y otro kit para muestras sucias (heces, etc.).
- Las centrífugas se deben de mantener limpias y sin restos de sangre, ya que hay veces que los tubos se abren o los capilares de mhto se rompen.
- Después de cada jornada, es recomendable deshacerse de las muestras que ya hayamos gestionado, los tubos de sangre que las analíticas ya se hayan realizado, o los portaojetos que el veterinario haya revisado.
- El mantenimiento del orden e higiene, así como el control del stock de los materiales necesarios en el laboratorio y la gestión adecuada de los residuos es una labor fundamental del ATV.
Bibliografía
- Gemma Mercadé i Grau; Manual práctico del Auxiliar veterinario; Servet Editorial veterinaria; 2018; Zaragoza.
- Engel Machado J., Garcia Guasch L; Manual del ATV; Multimédica Ediciones Veterinarias; 2008 Barcelona.
 by Multimédica
by Multimédica