Manejo anestésico en el paciente con cardiomiopatía hipertrófica felina
Resumen breve
El manejo anestésico del paciente con CMHF es multimodal y debe comenzar desde la reducción del estrés previa a acudir al centro veterinario hasta la recuperación del paciente. Incluso en pacientes asintomáticos o con mínimos signos clínicos, un adecuado protocolo diagnóstico nos permitirá detectar de forma precoz un cuadro de CMHF, lo que permitirá elegir el protocolo anestésico adecuado al paciente y su estadio de enfermedad.Índice de contenidos
Resumen
La cardiomiopatía hipertrófica (CMH) es la cardiopatía felina más frecuente. Se caracteriza por el desarrollo de una hipertrofia concéntrica de la pared del ventrículo izquierdo (VI), que produce un fallo en el llenado ventricular (fallo diastólico) y, en estadios avanzados, también dilatación de la aurícula izquierda (AI) y obstrucción dinámica del tracto de salida ventricular. El diagnóstico de esta patología se realiza mediante pruebas de imagen, fundamentalmente ecocardiografía y radiografía torácica.
Por su frecuencia de presentación, es habitual tener que realizar una sedación o anestesia general en gatos con CMH en diferentes estadios. Por ello, el objetivo de este trabajo es aportar pautas para el manejo anestésico óptimo de gatos con CMH.
El manejo anestésico de estos pacientes debe ser multimodal y comenzará desde antes de acudir al centro veterinario, reduciendo el estrés del paciente mediante la administración de sedantes si es necesario. En las diferentes etapas de la anestesia se deben tener en cuenta las alteraciones hemodinámicas características de estos pacientes y elegir los fármacos y técnicas anestésicas sin efecto o al menos, con efecto mínimo, sobre la estabilidad cardiovascular de los mismos.
Introducción
La cardiomiopatía hipertrófica (CMH) se define como la hipertrofia concéntrica de la pared del ventrículo izquierdo (VI) de origen primario1,2. No debe confundirse con la hipertrofia del VI secundaria a otras patologías3.
La CMH se considera la cardiopatía felina más frecuente, mientras que su aparición en el paciente canino es mucho más infrecuente. Por ese motivo, en este trabajo se centra en el paciente felino con CMH4.
Las principales razas de gatos afectadas por esta enfermedad son Ragdoll, Maine coon, Sphynx y Siamés3,5, en las cuales la edad de presentación es también más temprana. Otras razas de gatos pueden desarrollar CMH, aunque con menor frecuencia. La edad media de presentación varía desde el primer año hasta la etapa geriátrica5, aunque está descrita su aparición incluso en gatos de menos de un año de edad6.
El objetivo de este trabajo es realizar una revisión de la CMH felina (CMHF) para posteriormente dar pautas sobre el manejo anestésico de gatos con dicha patología.
Fisiopatología y signos clínicos de la CMHF
El engrosamiento de la pared del VI compromete el suministro de sangre a los miocitos, lo que lleva a un daño continuo de los mismos y su posterior muerte7.
Una anomalía funcional común observada en la CMHF es la disfunción diastólica ya que debido a la hipertrofia del VI, este tiene dificultad para llenarse con presiones normales durante la diástole4 y como consecuencia se produce una reducción del gasto cardíaco (GC)3,8. La hipertrofia ventricular puede llegar a generar también una obstrucción dinámica del tracto de salida ventricular4.
En estadios avanzados de la enfermedad, el aumento de presión en el VI termina por generar dilatación de la aurícula izquierda (AI), lo que llevará a un aumento de presión en las venas pulmonares y dilatación de las mismas, pudiendo desarrollarse como consecuencia edema pulmonar8. Dado que las venas que drenan la pleura se encuentran en la superficie de los pulmones, el aumento en la presión venosa pulmonar (PVP) puede también desencadenar derrame pleural6,7; todo ello se traducirá en insuficiencia cardíaca congestiva (ICC)3,5.
Dado que el aumento de tamaño del ventrículo no se ve acompañado de un aumento de la perfusión coronaria, puede generarse hipoxia miocárdica con la consecuente aparición de arritmias8. Finalmente, la estasis sanguínea a nivel de la AI hace que los pacientes con CMHF tengan una elevada predisposición al desarrollo de tromboembolismo arterial (TEA), especialmente a nivel de las arterias ilíacas10.
El American College of Veterinary Internal Medicine (ACVIM) ha realizado una clasificación de los diferentes estadios de la CMHF, desde el paciente predispuesto (estadio A) al paciente refractario a tratamiento (D)4 (Figura 1).
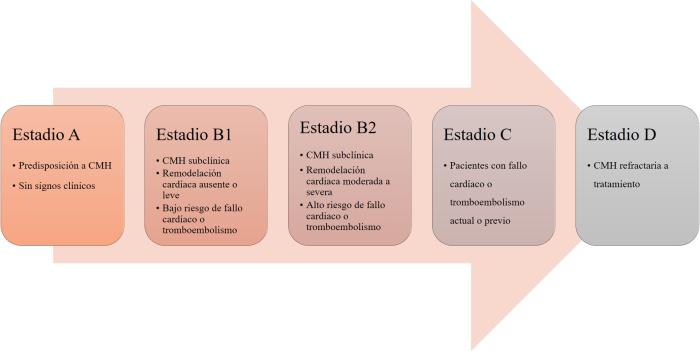
Figura 1. Estadiaje de la CMHF según el consenso del ACVIM.
En estadios iniciales de la CMHF ya se pueden encontrar con algunos indicios o signos clínicos en la anamnesis y/o la exploración física general tales como pérdida de apetito, disminución de la actividad y el interés por jugar. En estadios más avanzados de la enfermedad podremos encontrar hallazgos como ritmo de galope a la auscultación cardíaca, dificultad respiratoria consecuencia del desarrollo de edema de pulmón o derrame pleural, ausencia de pulso femoral o pulso femoral asimétrico consecuencia del desarrollo de TEA y síncopes4,12.
Diagnóstico de la CMHF
El diagnóstico definitivo de la CMHF se basa en ecocardiografía. La mayoría de los gatos con CMHF presentarán hipertrofia simétrica, es decir, tanto del septo ventricular como la pared libre estarán afectados en el mismo grado. Es relativamente habitual observar también músculos papilares grandes y prominentes12. Como ya se ha mencionado, la hipertrofia puede producir obstrucción dinámica del tracto de salida del VI (Figura 2A-B).
![Figura 2. Imágenes ecocardiográficas de un gato con CMHF. Se observa (A) hipertrofia concéntrica del ventrículo izquierdo y (B) dilatación grave de la aurícula izquierda [imágenes cortesía de Dolores Porteiro y Patricia Gómez (Hospital Veterinario Puchol, Servicio de Cardiología)].](https://revistas-veterinaria.multimedica.es/fotografies/petites/35252figura-2a-ecocardiografia-hipertrofia-del-vi.jpg)
Figura 2. Imágenes ecocardiográficas de un gato con CMHF. Se observa (A) hipertrofia concéntrica del ventrículo izquierdo y (B) dilatación grave de la aurícula izquierda [imágenes cortesía de Dolores Porteiro y Patricia Gómez (Hospital Veterinario Puchol, Servicio de Cardiología)].
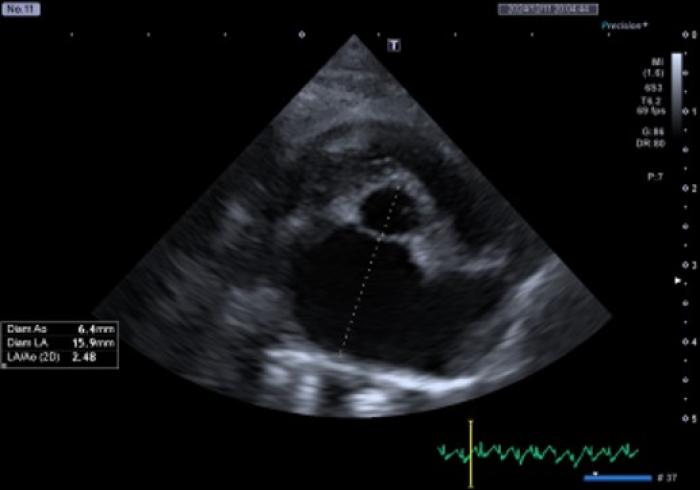
Debido al fallo diastólico, a menudo se observará aumento de la presión de llenado del VI, que puede ir asociada a dilatación de la AI, siendo esta última un indicador de peor pronóstico13. La dilatación de la AI suele ser secundaria a la disfunción diastólica, pero también puede ser secundaria a fallo sistólico o función anormal de la válvula mitral4,12.
En el caso de no poderse realizar ecocardiografía, las radiografías torácicas pueden ayudar a enfocar el diagnóstico de la CMHF. Si se ha producido dilatación de la AI, en las radiografías en proyección ventrodorsal podrá observarse cardiomegalia con ensanchamiento de la base cardíaca, dando lugar a la imagen característica de corazón de San Valentín4,13 (Figura 3).
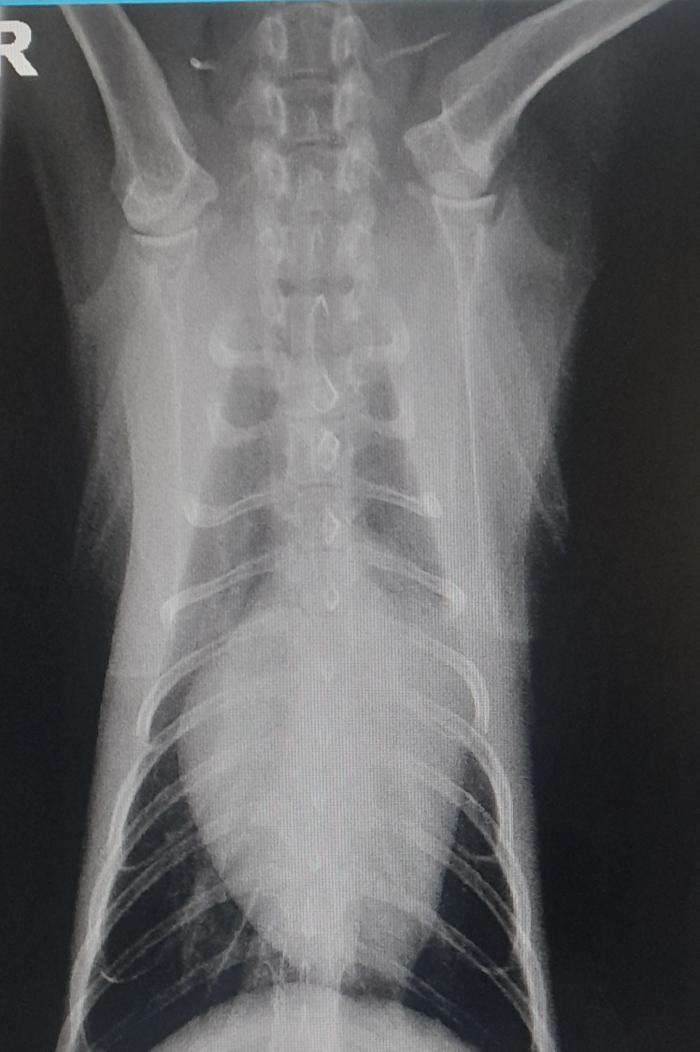
Figura 3. Radiografía ventrodorsal de un gato con CMHF. Se observa ensanchamiento de la base cardíaca con imagen característica de corazón de San Valentín (imagen cortesía del Servicio de Diagnóstico por Imagen del Hospital Veterinario Puchol).
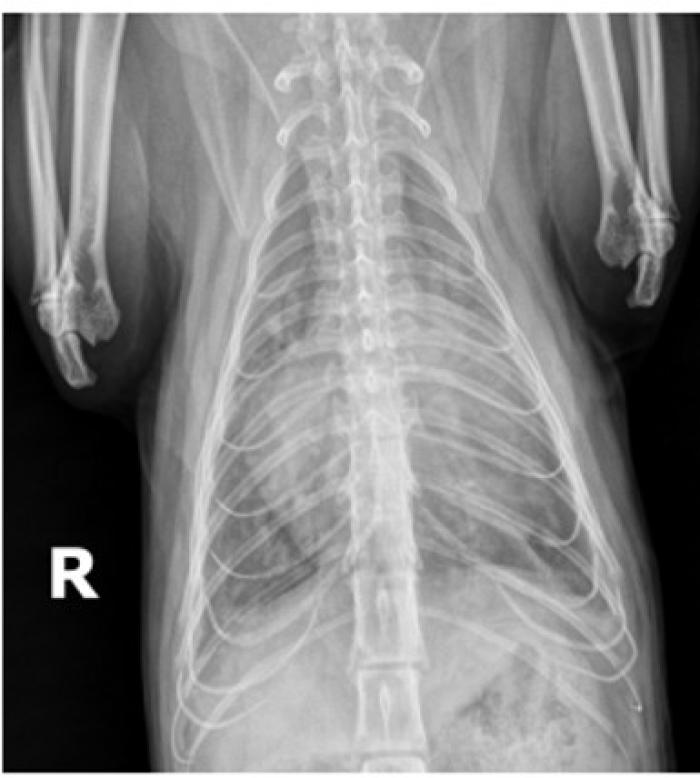
Las radiografías torácicas también son útiles para valorar el pulmón, pudiendo observarse patrones vasculares prominentes (que pueden indicar hipertensión pulmonar secundaria y/o presión diastólica VI elevada) o patrones intersticiales/alveolar (que son compatibles con edema pulmonar) así como la presencia de derrame pleural, siendo estos dos últimos frecuentes en casos de ICC 4 (Figura 4).
![Figura 4. Radiografías torácicas (A) lateral y (B) ventrodorsal de un gato con CMHF, se observa aumento de la silueta cardíaca izquierda y dilatación de las venas pulmonares [imágenes cortesía de Dolores Porteiro y Patricia Gómez (Hospital Veterinario Puchol, Servicio de Cardiología)].](https://revistas-veterinaria.multimedica.es/fotografies/petites/49662figura-4a-radiografia-proyeccion-lateral.jpg)
Figura 4. Radiografías torácicas (A) lateral y (B) ventrodorsal de un gato con CMHF, se observa aumento de la silueta cardíaca izquierda y dilatación de las venas pulmonares [imágenes cortesía de Dolores Porteiro y Patricia Gómez (Hospital Veterinario Puchol, Servicio de Cardiología)].
La determinación de biomarcadores como el NT-pro BNP y la troponina I (c-TnI) es una ayuda para el diagnóstico de la CMHF4,15. El NT-pro BNP específico felino es un marcador de estiramiento de músculo cardíaco y sobrecarga de volumen y un indicador de la función miocárdica; su principal utilidad es ayudar a determinar si el distress respiratorio de un paciente es de origen cardíaco o no. La cTnI es un marcador de lesión miocárdica isquémica que puede ayudar a determinar el pronóstico de los pacientes cardíacos, ya que su concentración sérica está muy correlacionada con el riesgo de muerte14. Ninguno de estos dos marcadores sustituye, no obstante, a las pruebas de diagnóstico por imagen mencionadas.
Finalmente, es importante recordar que ante un paciente con sintomatología compatible con CMHF se deben descartar otras causas de hipertrofia del miocardio tales como el la hipertensión sistémica y el hipertiroidismo felino3,4.
Tratamiento de la CMHF
El tratamiento requerido dependerá del estadio de la enfermedad y los signos clínicos del paciente.
El uso de betabloqueantes, tales como el atenolol, se recomienda incluso en pacientes en estadio B1 (subclínico) con el fin de reducir la frecuencia cardíaca (FC) basal del paciente, facilitando así el llenado ventricular, y minimizar el riesgo de obstrucción del tracto de salida ventricular. En estadios más avanzados se emplean también como antiarrítmicos4,15.
A partir del estadio B2, se recomienda el tratamiento con antiagregantes plaquetarios ante el riesgo de desarrollo de TEA, siendo el más recomendado el clopidogrel, el cual puede combinarse con otros antitrombóticos como la aspirina o el inhibidor de factor Xa4.
En pacientes con estadio C se recomienda también el empleo de diuréticos para tratar y/o prevenir el edema de pulmón4. En pacientes con bajo gasto cardíaco se puede considerar también el uso de pimobendán16.
El uso de inhibidores de la enzima convertidora de angiotensina (IECA) es controvertido en pacientes con CMHF ya que los estudios sobre su eficacia son variables y su administración puede suponer un estrés añadido para el paciente al existir sólo formulaciones orales4.
En estadio D se recomienda la adición de otros diuréticos como torasemida o espironolactona y de otras terapias de soporte como suplementos de taurina oral y dietas restringidas en sodio4. Dado que en este estadio es relativamente frecuente la caquexia cardíaca, es importante asegurar la adecuada nutrición del paciente4.
La Tabla 1 recoge los diferentes tratamientos para l CMHF y recomendaciones específicas sobre su retirada o no antes de la anestesia general.
| Grupo de fármacos | Ejemplos | ¿Retirar antes de anestesia/cirugía? |
|---|---|---|
| Beta-bloqueantes |
| No se recomienda |
| Antiagregantes plaquetarios |
| Depende del riesgo de tromboembolismo:
|
| Inhibidores de la fosfodiesterasa III |
| No se recomienda |
| Inhibidores de la enzima convertidora de angiotensina (IECA) |
| Falta de consenso al respecto |
| Diuréticos |
| No se recomienda |
Tabla 1. Principales fármacos empleados en el tratamiento de la CMHF, con las dosis y recomendaciones sobre su mantenimiento o no previamente a la anestesia según la literatura.
Manejo anestésico del paciente con CMHF
Evaluación y estabilización previa a la anestesia
Como ya se ha mencionado, los pacientes con CMHF pueden ser asintomáticos o presentar signos clínicos difíciles de detectar. La auscultación de soplo cardíaco o ritmos de galope debe hacernos sospechar de una posible CMHF, en especial en pacientes adultos-geriátricos y de razas predispuestas4. Ante estos hallazgos, se debería recomendar un examen ecocardiográfico o al menos la realización de radiografías torácicas antes de la anestesia.
La detección de pulso femoral asimétrico, la ausencia del mismo, la palpación de extremidades frías o la existencia de pulso yugular marcado pueden considerarse signos clínicos indicativos de estadio avanzado de CMHF, entre otros6. Ante un paciente con dificultad respiratoria y/o taquipnea, se deberá realizar un manejo cuidadoso, minimizando el estrés, y descartar la existencia de derrame pleural o edema de pulmón.
La determinación de la presión arterial sistémica en el paciente consciente es aconsejable en pacientes con CMHF como parte de la evaluación preanestésica, siempre que esta sea posible y no genere un estrés adicional4.
En pacientes con CMHF ya diagnosticada y en tratamiento, se recomienda mantener la mayoría de los fármacos antes de la anestesia. Los antiagregantes plaquetarios deberían retirarse entre 3 y 5 días antes de un procedimiento que implique riesgo de sangrado, salvo en pacientes con riesgo de TEA elevado3,17. Respecto a los IECA, en pacientes caninos existe controversia sobre si deberían retirarse 12-24 horas antes de una anestesia general debido a su efecto vasodilatador a nivel renal, que puede dar lugar a hipotensión difícil de controlar3; sin embargo, en conocimiento de los autores, no existen recomendaciones específicas en gatos a este respecto.
Siempre que sea posible, se debe retrasar la anestesia general hasta la estabilización de los signos clínicos del paciente.
Pruebas diagnósticas previas a la anestesia
En general, se recomienda disponer de una analítica sanguínea completa (hemograma y bioquímica), siendo especialmente relevantes los niveles séricos de creatinina, y electrolitos en pacientes en tratamiento crónico con diuréticos3,17.
Siempre es recomendable que el paciente con CMHF ya diagnosticada haya tenido una revisión ecocardiográfica al menos 6 meses antes de una anestesia general, o más recientes si han presentado un empeoramiento del estadio clínico posterior a la última revisión3,4. La realización de radiografías torácicas previas es recomendable en todos los pacientes, especialmente en caso de sospecharse de derrame pleural o edema de pulmón.
El electrocardiograma (ECG) puede mostrar anomalías tales como bloqueos de rama o fasciculares, complejos prematuros ventriculares y/o taquicardia ventricular (Figura 5, Vídeo 1).No obstante, estos signos son inespecíficos14,18.
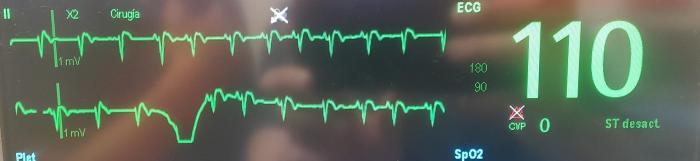
Figura 5.
Vídeo 1. En el vídeo se observa electrocardiograma compatible con bloqueo de rama derecha en un gato bajo anestesia general.
Puntos clave del manejo anestésico en pacientes con CHMF
- Minimizar el estrés del paciente.
- Minimizar la activación simpática, ya que esta producirá un aumento de la FC y por ello un aumento de la demanda miocárdica de oxígeno.
- Evitar aumentos de la contractilidad miocárdica y disminuciones de la poscarga cardíaca y el volumen ventricular, puesto que todos estos factores empeorarán la obstrucción del tracto de salida ventricular.
- Evitar la hipovolemia y asegurar un volumen intravascular adecuado.
Premedicación anestésica
Con el fin de minimizar el estrés y facilitar el manejo, especialmente en gatos agresivos, puede ser de ayuda la administración de gabapentina a dosis de 50-100 mg/gato 60-90 minutos antes de la visita al centro veterinario. La gabapentina a la dosis indicada ha demostrado producir una buena sedación en gatos agresivos con mínimos efectos cardiovasculares, por lo que el propio consenso del ACVIM aconseja su uso en pacientes con CMHF4,19. En caso de ser necesario, la gabapentina puede combinarse con trazodona a dosis de 50-100 mg/gato aproximadamente 90 minutos antes de acudir al centro veterinario, pudiendo en este caso reducirse las dosis de ambos fármacos20,21.
Si el paciente es de fácil manejo, puede considerarse la cateterización de acceso venoso periférico y administración de la premedicación anestésica por vía intravenosa (IV). En pacientes de manejo más difícil, se recomienda la premedicación por vía intramuscular (IM) para minimizar el estrés del paciente.
El uso de agonistas adrenérgicos α-2 como la dexmedetomidina es especialmente útil en pacientes con CMHF ya que producen sedación y relajación muscular dosis-dependiente, proporcionan analgesia, reducen en más de un 50 % las dosis de inductores y anestésicos inhalatorios además de producir un descenso de la FC que facilita el llenado ventricular; además, se pueden antagonizar con el uso de atipamezol3,8,16. Algunos estudios han mostrado incluso una resolución de la obstrucción del tracto de salida del VI como consecuencia de la administración de estos fármacos22.Por otro lado, dado que producen una marcada reducción del GC, deberían emplearse a dosis bajas (1-3 µg/kg de dexmedetomidina IV o 5-7 µg/kg IM) o evitarse en pacientes con estadios avanzados8.
La acepromacina proporciona una sedación menos potente y de duración más prolongada que los agonistas adrenérgicos α-2 y, además, carece de antagonista3,17. Su uso produce reducción de la poscarga y la resistencia vascular sistémica (RSV) por antagonismo sobre receptores α-13,17. Además, la dosis necesaria para producir sedación en gatos es considerablemente más elevadas que en perros. Por todo ello, se desaconseja su uso en pacientes con CMHF8.
Las benzodiacepinas son fármacos sedantes con mínimos efectos cardiovasculares, por lo que su uso es aceptable en pacientes con cualquier cardiopatía3,23. No obstante, producen una sedación escasa y a menudo reacciones de excitabilidad, especialmente en pacientes ya estresados3,17. Se recomienda emplearlos como coadyuvantes de otros sedantes o inductores, o como sedante único solo en pacientes muy debilitados3.
La alfaxalona puede considerarse en combinación con otros sedantes con el fin de reducir las dosis de los mismos, ya que, en general, permite mantener una buena estabilidad cardiovascular23. Como desventaja, las dosis requeridas por vía intramuscular son elevadas, lo que supone volúmenes de inyección muy grandes3,17. Hay que considerar, además, que la alfaxalona solo está autorizada para su uso por vía IV3,23.
El uso de ketamina se desaconseja como sedante o inductor anestésico por sus efectos simpaticomiméticos, que producen aumento de la contractilidad miocárdica y por ello de la demanda de oxígeno del paciente3,8,24.
Los opioides son de gran utilidad analgesia y potenciar la sedación de otros fármacos como los agonistas adrenérgicos α-23,8,17. La elección del opioide dependerá del grado del procedimiento al que vaya a ser sometido el paciente y el grado de dolor esperado, pero, en todo caso, se desaconseja el uso de petidina ya que suele producir aumento de la FC y potencialmente, liberación de histamina (sobre todo por vía IV)3,25.
El uso de antinflamatorios no esteroideos (AINE) puede ser controvertido en gatos con CMHF. Estos fármacos disminuyen la producción de prostaglandinas mediante una inhibición de las diferentes isoformas de la ciclooxigenasa (COX)3,17. Concretamente, la ciclooxigenasa 1 (COX-1) está implicada en la agregación plaquetaria y su inhibición se asocia a trastornos de la coagulación sanguínea, lo que puede ser especialmente perjudicial en pacientes en tratamiento con antiagregantes plaquetarios17. Por ello, los AINE deberían evitarse en pacientes en tratamiento con antiagregantes, aunque podría valorarse el uso de inhibidores selectivos de COX-2 si fuera necesario7. Por otro lado, la aspirina es un AINE inhibidor selectivo de COX-1, por lo que en pacientes en tratamiento con este fármaco debe evitarse el empleo de otros AINE y dejar periodos de una semana de lavado antes de cambiarla por otro antinflamatorio17.
Inducción anestésica
Como en cualquier paciente, se recomienda la preoxigenación durante aproximadamente 5 minutos para evitar el desarrollo de hipoxemia consecuencia de hipoventilación o de apnea durante la inducción anestésica26. En pacientes con CMHF, especialmente en estadios avanzados, el tiempo de preoxigenación recomendado es incluso mayor por la menor tolerancia de los mismos a la apnea8. Antes de la intubación endotraqueal se debe iniciar una monitorización lo más completa posible que incluya ECG, saturación de oxígeno (SpO2) y PA8,26.
En general, el uso de propofol y alfaxalona es igualmente válido en estos pacientes ya que ambos producen inducciones anestésicas rápidas y seguras3,8,17. Ambos fármacos producen vasodilatación transitoria con posible hipotensión asociada, siendo la diferencia que la alfaxalona suele conllevar un aumento compensador de la FC3.
El etomidato es el inductor anestésico con mayor estabilidad cardiovascular, pero produce inducciones anestésicas de mala calidad, a menudo asociadas a mioclonias3,17, por lo que se aconseja su combinación con benzodiacepinas y reservar su uso solo para pacientes muy inestables27.
Independientemente del inductor elegido, el uso de coinductores como las benzodiacepinas y opioides de acción rápida como el fentanilo es recomendable con el fin de reducir las dosis de inductores y con ello sus efectos adversos17,27, mientras que se desaconseja el uso de ketamina como coinductor por las razones ya explicada. Se debe realizar la inducción de forma lenta para minimizar la aparición de apnea, ya que, como se ha explicado, esta será peor tolerada en estos pacientes3,8.
La intubación endotraqueal puede causar respuestas cardiovasculares como taquicardia e hipertensión, con el consecuente aumento de la demanda miocárdica de oxígeno3,17. Por ello, antes de la intubación, se debe asegurar una profundidad anestésica adecuada26. Al tratarse de pacientes felinos, deben administrarse unas gotas de lidocaína tópica al 2 % en la laringe antes de la intubación para reducir el riesgo de laringoespasmo26,28.
La Tabla 2 recoge un resumen de las ventajas e inconvenientes de cada uno de los fármacos mencionados.
| Fármaco | Ventajas | Inconvenientes | ¿Uso recomendado en gatos con CMH? |
|---|---|---|---|
| Agonistas adrenérgicos alfa-2 |
|
| Sí, a dosis bajas |
| Acepromacina | Sedación moderada: reducción del estrés |
| No |
| Ketamina |
|
| No |
| Opioides |
|
| Sí, salvo la petidina |
| Benzodiacepinas |
|
| Sí, junto con otros sedantes y/o como coinductores |
| Propofol |
| Vasodilatación transitoria: hipotensión | Sí |
| Alfaxalona | Inducción anestésica rápida y suave |
| Sí |
| Etomidato | Mínimos efectos sobre el GC | Inducción anestésica de mala calidad | Solo en pacientes muy debilitados o con estadios avanzados de CMH |
Tabla 2. Ventajas e inconvenientes del uso de diferentes sedantes e inductores en gatos con CMHF.
Mantenimiento anestésico
Los anestésicos inhalatorios son los fármacos más comúnmente utilizados para el mantenimiento de la anestesia, pero hay que tener en cuenta que producen vasodilatación y disminución de la contractilidad cardíaca dosis-dependiente3,17, lo que lleva a una disminución de la presión arterial (PA). Para minimizar estos efectos secundarios se recomienda aplicar estrategias de reducción de la concentración alveolar mínima (CAM) mediante infusiones intravenosas continuas (IIC) de sedantes y/o opioides, y mediante técnicas de anestesia locorregional3,8,26.
La utilización de anestesia total intravenosa (TIVA) puede considerarse como alternativa al mantenimiento inhalatorio en pacientes con cardiopatías, ya que ha demostrado una mayor estabilidad cardiovascular comparada con la anestesia inhalatoria29,30. El uso de TIVA de propofol (0.1-0.4 mg/kg/min) se desaconseja en gatos para anestesias de más de 60 minutos de duración o en anestesias en días consecutivos por su metabolismo hepático más ineficiente en comparación con perros y por el potencial desarrollo de anemias con cuerpos de Heinz31,32. La TIVA de alfaxalona (0.05-0.1 mg/kg/min) es una mejor alternativa en gatos, aunque se asocia a recuperaciones más prolongadas30,33. Se desaconseja el uso de TIVA de etomidato por la supresión adrenal de larga duración que puede ocasionar3,17.
Es recomendable combinar las TIVAs de propofol o alfaxalona con infusiones continuas de opioides, benzodiacepinas o agonistas adrenérgicos α-2 para reducir las dosis requeridas y/o proporcionar analgesia3,31,33.
Fluidoterapia durante la anestesia
La fluidoterapia ayuda a mantener el volumen intravascular, el GC y el aporte de oxígeno durante la anestesia3,27,34.La velocidad de infusión debe ser suficiente para reemplazar las pérdidas urinarias, de evaporación por las vías respiratorias y sangrado, por lo que un ritmo de 3 ml/kg/h en gatos se considera suficiente cuando no existen pérdidas o el sangrado es mínimo27,34. Esta velocidad puede mantenerse en pacientes con CMHF subclínica, pero en pacientes con riesgo de sobrecarga de fluidos, debería reducirse la misma a 1-2 ml/kg/h y administrar bolos de cristaloides a necesidad en casos de hipovolemia o sangrado27,34.
Los fluidos de elección durante la anestesia son los cristaloides isotónicos de reemplazo como el Ringer lactato (RL) o el Isofundin©, por su composición electrolítica similar a la del plasma, y su efecto alcalinizante que ayuda a compensar la acidosis que típicamente acompaña a la anestesia3,27,34.
Otras consideraciones durante la anestesia
En general la ventilación espontánea es adecuada en pacientes con CMHF siempre que se mantengan niveles de CO2 espirado no superiores a 55-60 mmHg, ya que la hipercapnia produce un aumento de las concentraciones de catecolaminas que incrementan la demanda miocárdica de oxígeno3,17. En caso de necesitar la aplicación de ventilación mecánica, es importante recordar que esta producirá potencialmente un descenso del retorno venoso y por ello de la precarga ventricular, que puede ser mal tolerado por un paciente con CMHF3,35. Por ello, es importante valorar muy bien el riesgo-beneficio de la aplicación de ventilación mecánica en estos pacientes e intentar emplear volúmenes corrientes y presiones inspiratorias bajas para minimizar los efectos adversos mencionados36.
La determinación de la PA por métodos invasivos en estos pacientes resulta recomendable por ser el gold standard de dicha monitorización3,17. En caso de hipotensión, al igual que en cualquier paciente se debe empezar reduciendo el nivel de anestésicos inhalatorios27. Si no hay respuesta a esta maniobra, puede considerarse el uso de bolos de cristaloide con mucha precaución ya que, en general, los pacientes con cardiopatías no son respondedores a fluidos, salvo que estén hipovolémicos.
Los anticolinérgicos como la atropina debería usarse con precaución en pacientes con CMHF por la posible taquicardia sinusal secundaria a los mismos38. El fármaco de elección para el tratamiento de la hipotensión en estos pacientes es la fenilefrina (bolo único 0.5-5 µg/kg IV o IIC 1-3 µg/kg/min), ya que aumenta la RVS sin afectar a la contractilidad cardíaca3,8. Como alternativa, podría considerarse el uso de dopamina a dosis elevadas (IIC 10-15 µg/kg/min), que produce efectos similares a la fenilefrina, pero también aumenta el GC3,39.
Dado que los gatos tienen una mayor tendencia a la hipotermia por su mayor superficie corporal en relación con el peso, es esencial la monitorización continua de la temperatura (preferiblemente con sondas esofágicas)3,27 y la administración de métodos de calentamiento tales como suero intravenoso atemperado o sistemas de aire caliente40,41.
Recuperación anestésica
La fase de recuperación anestésica se considera una de las más críticas, ya que un elevado porcentaje de muertes relacionadas con la anestesia ocurren en dicha fase42,43. Durante esta fase se debe continuar con la monitorización del paciente, especialmente de la ventilación y oxigenación3,8. Diferentes estudios han mostrado que el empleo de pulsioximetría durante el posoperatorio temprano en gatos permite reducir la mortalidad relacionada con la anestesia28,44. Si se considera necesario, se debe mantener oxigenoterapia durante el posoperatorio hasta que el paciente mantenga una SpO2 > 95 %3,27.
Si ha habido complicaciones durante la anestesia tales como hipotensión, se recomienda monitoriza la PA de forma continua en las primeras horas posanestesia, manteniendo la administración de vasopresores si es necesario3,27.
El control y tratamiento de la hipotermia es especialmente importante en pacientes con cardiopatía. El temblor asociado a la hipotermia aumenta las demandas de oxígeno, lo que puede ser especialmente mal tolerado en estos pacientes3,27. Por ello, es importante mantener el calentamiento activo del paciente, estimular su vuelta a la consciencia. El temblor posanestesia puede ser tratado mediante la administración de dosis bajas de agonistas α-2 (medetomidina 1 µg/kg o dexmedetomidina 0.5 µg/kg IV) o petidina 0.5-1 mg/kg IM3, estando más indicados los agonistas α-2 por las razones ya explicadas.
Cuidados posoperatorios
Durante la hospitalización, se debe:
- Reanudar la medicación cardiovascular del paciente lo antes posible.
- Administrar la analgesia adecuada, preferiblemente basada en la realización de escalas de valoración del dolor.
- Mantener un ambiente lo más libre de estrés posible.
- Continuar la monitorización cardiovascular y ventilatoria del paciente siempre que se requiera.
- Reanudar la ingesta de agua y sólidos lo antes posible, valorando el uso de fluidoterapia intravenosa y/o sondas de alimentación en caso de que el paciente no quiera comer por sí solo34.
La Tabla 3 recoge un resumen de las principales recomendaciones durante la anestesia de pacientes con CMHF.
|
Tabla 3. Resumen de las principales recomendaciones para el manejo anestésico de gatos con CMHF.
Conclusiones
El manejo anestésico del paciente con CMHF es multimodal y debe comenzar desde la reducción del estrés previa a acudir al centro veterinario hasta la recuperación del paciente. Incluso en pacientes asintomáticos o con mínimos signos clínicos, un diagnóstico adecuado nos permitirá detectar de forma precoz un cuadro de CMHF, lo que permitirá elegir el protocolo anestésico adecuado al paciente y su estadio de enfermedad. Finalmente, conocer tanto la fisiopatología de la CMHF como los efectos clínicos y adversos de los fármacos anestésicos, nos permitirá elegir aquellos que tengan en el mínimo impacto posible en la estabilidad cardiovascular del paciente.
Bibliografía
- Kittleson M, Côte M, The feline cardiomyopathies (Hypertrophic cardiomyopathy). Journal of Feline Medicine and Surgery (2021) 23, 1028–1051
- Liu SK, Peterson ME and Fox PR. Hypertrophic cardio -myopathy and hyperthyroidism in the cat. J Am Vet Med Assoc 1984; 185: 52–57.
- Duke-Novakovsky T, De Vries M, Seymour C. BSAVA Manual of canine and feline anesthesia and analgesia, 3th edition.2016.
- Fuentes L, V. , Abbott, J. , Chetboul V., Côté, E., Fox , P.R., Häggström, J., Kittleson, M.D., Schober, K., Stern, J.A. Consensus statement guidelines for the classification, diagnosis and management of cardiomyopathies in cats; ACVIM 2020
- Kittleson Md, Meurs KM and Harris SP. The genetic basis of hypertrophic cardiomyopathy in cats and humans. J Vet Cardiol 2015; 17 Suppl 1: S53–S73.
- Payne JR, Brodbelt dC and Luis Fuentes V. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J Vet Cardiol 2015; 17 Suppl 1: S244–S257.
- Liu SK, Peterson ME and Fox PR. Hypertrophic cardio -myopathy and hyperthyroidism in the cat. J Am Vet MedAssoc 1984; 185: 52–57.
- Martinez-Albiña A., Plaza-del Castaño, Q., Aguilar-Gallego, N., Fernandez-Rodriguez, P., Viscasillas-Monteaguado, J. Anasthetic management of the patient whit acquired cardiac pathology. Clin Vet Peq Anim, 2020; 42 (3): 169 – 179
- Fox PR, Keene BW, Lamb K, et al. International collaborative study to assess cardiovascular risk and evaluate long-term health in cats with preclinical hypertrophic cardiomyopathy and apparently healthy cats: The REVEAL Study. J Vet Intern Med. 2018; 32: 930–943.
- Patata V, Caivano d, Porciello F, et al. Pulmonary vein to pulmonary artery ratio in healthy and cardiomyopathic cats.
- Hogan dF, Fox PR, Jacob K, et al. Secondary prevention of cardiogenic arterial thromboembolism in the cat: the doubleblind, randomized, positive-controlled feline arterial thromboembolism; clopidogrel vs. aspirin trial (FAT CAT).
- Rush JE, Freeman LM, Fenollosa NK, et al. Population and survival characteristics of cats with hypertrophic cardio - myopathy: 260 cases (1990–1999). J Am Vet Med Assoc. 2002; 220: 202–207.
- Schober K and Todd A. Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy. J Vet Cardiol.2010; 12: 1–16
- Brizard d, Amberger C, Hartnack S, et al. Phenotypes and echocardiographic characteristics of a European population of domestic shorthair cats with idiopathic hypertrophic cardiomyopathy. Schweiz Arch Tierheilkd 2009; 151: 529–538.
- Connolly dJ, Cannata J, Boswood A, et al. Cardiac troponin I in cats with hypertrophic cardiomyopathy. J Feline Med Surg 2003; 5: 209–216.
- Schober KE, Rush JE, Luis Fuentes V, Glaus T, Summerfield NJ, Wright K, Lehmkuhl L, Wess G, Sayer MP, Loureiro J, MacGregor J, Mohren N. Effects of pimobendan in cats with hypertrophic cardiomyopathy and recent congestive heart failure: Results of a prospective, double-blind, randomized, nonpivotal, exploratory field study. J Vet Intern Med. 2021 Mar;35(2):789-800.
- Lamont L, Grimm K, Robertson S, Love L, Schroeder C. Veterinary anaesthesia and analgesia. The sixth edition of Lumb & Jones. 2024. Ed. Willey Blackwell.
- Romito G, Guglielmini C, Mazzarella Mo, et al. Diagnostic and prognostic utility of surface electrocardiography in cats with left ventricular hypertrophy. J Vet Cardiol2018; 20: 364–375.
- Erickson A., Harbin K., MacPherson J., Rundle K., L. Overall K. A review of pre-appointment medications to reduce fear and anxiety in dogs and cats at veterinary visits. Can Vet J 2021;62:952–960
- Orlando JM, Case BC, Thomson AE, Griffith E, Sherman BL. Use of oral trazodone for sedation in cats: a pilot study. Journal of Feline Medicine and Surgery.2016;18(6):476-82.
- Siepmann EC, Agnol Gianezini ED, Ruaro ME, Wolfran L, Faria CA, Fukushima FB. Trazodone-gabapentin association increases sedation scores with mild hemodynamic and echocardiographic impact in healthy cats. Top Companion Anim Med. 2025 Jan-Feb;64:100945.
- Lamont LA, Bulmer BJ, Sisson DD, Grimm KA, Tranquilli WJ. Doppler echocardiographic effects of medetomidine on dynamic left ventricular outflow tract obstruction in cats. J Am Vet Med Assoc. 2002 Nov 1;221(9):1276-81.
- Keating S.; Fries R., Humphries L.; Strahl-Heldreth D. Echocardiographic and hemodynamic effects of alfaxalone or dexmedetomidine based sedation protocols in cats with hypertrophic cardiomyopathy: a pilot study. Vet Anaesth Analg. 2024 Mar-Apr; 21(2):168-172
- Selmi AL, Mendes GM, Lins BT, Figueiredo JP, Barbudo-Selmi GR. Evaluation of the sedative and cardiorespiratory effects of dexmedetomidine, dexmedetomidine-butorphanol, and dexmedetomidine-ketamine in cats. J Am Vet Med Assoc. 2003 Jan 1;222(1):37-41.
- Yang N.; J. C Ko, Wang H, Liu P. A preliminary study comparing the sedative, cardiorespiratory, and histaminic-releasing effects of intramuscular and intravenous administration of pethidine (meperidine) with midazolam in healthy cats; Vet Anim Sci. 2021 Nov 6:14:100218
- Grubb T, Sager J, Gaynor JS, Montgomery E, Parker JA, Shafford H, Tearney C. 2020 AAHAAnesthesiaand MonitoringGuidelinesforDogsandCats. J Am Anim Hosp Assoc. 2020 Mar/Apr;56(2):59-82.
- Gier S.; Keating S.; Strahl-Heldreth D.; Martins F.; Pavlosky G.: Oba P.; Swanson K.; The effect of midazolam co-induction on cardiorespiratory variables, myoclonus and etomidate dose requirements in healthy cats; Vet Anaesth Analg. 2024 Dec ·1:S1467-2987.
- Brodbelt D.C., Pfeiffer D.U., Young L.E., Wood J.L. 2007. Risk factors for anaesthetic-related death in cats: results from the confidential enquiry into perioperative small animal fatalities (CEPSAF). Br J Anaesth. 99(5):617-623.
- Bustamante R, Aguado D, Cediel R, Gómez de Segura IA, Canfrán S. Clinical comparison of the effects of isoflurane or propofol anaesthesia on mean arterial blood pressure and ventilation in dogs undergoing orthopaedic surgery recei - ving epidural anaesthesia. Vet J. 2018. 233:49-54.
- Dehuisser V, Bosmans T, Devreese M, Gehring R, Croubles S, Duchateu L, Polis I. Alfaxalone total intravenous anaesthesia in dogs: pharmaco - kinetics, cardiovascular data and recovery charac - teristics. Vet Anaesth Analg. 2019. 46(5):605-612. roceedings IVECCS. 2019: 25-28.
- Andress JL, Day TK and Day DG. The effects of consecutive day propofol anesthesia on feline red blood cells. Vet Surgery 1995; 24: 277–282. 30.
- Pascoe PJ, Ilkiw JE and Frischmeyer KJ. The effect of the duration of propofol administration on recovery from anesthesia in cats. Vet Anaesth Analg 2006; 33: 2–7.
- Suarez MA, Dzikiti BT, Stegmann FG, Hartman M. Comparison of alfaxalone and propofol administered as total intravenous anaesthesia for ovariohysterectomy in dogs. Vet. Anaesth. Analg. 2012. 39: 236-244.
- Pardo M.; Spencer E.; Odunayo A.; Ramirez M.L.; Rudolf E.; Shafford H.; Weil A.; Wolff E.; 2024 AAHA Fluid Therapy Guidelines for Dogs and Cats 2024
- Fantoni DT, Ida KK, Lopes TF, Otsuki DA, Auler JO Jr, Ambrósio AM. A comparison of the cardiopulmonary effects of pressure controlled ventilation and volume controlled ventilation in healthy anesthetized dogs. J Vet Emerg Crit Care (San Antonio). 2016 Jul;26(4):524-530
- Sánchez A, López M, Asorey I. Manejo ventilatorio en diferentes patologías y situaciones clínicas. Clinanesvet. 2025.
- Halavina K et al; Management of Fluid Overload in Patients With Severe Aortic Stenosis (EASE-TAVR): A Randomized Controlled Trial JACC Cardiovasc Interv. 2024 Sep 9;17(17):2054-2066
- Upadhyay A.; Beuerman R.; Biological Mechanisms of Atropine Control of Myopia; Eye Contact Lens 2020 May;46(3):129-135
- Wiese AJ, Barter LS, Ilkiw JE, Kittleson MD, Pypendop BH. Cardiovascular and respiratory effects of incremental doses of dopamine and phenylephrine in the management of isoflurane-induced hypotension in cats with hypertrophic cardiomyopathy. Am J Vet Res. 2012 Jun;73(6):908-16.
- Machon RG, Raffe MR and Robinson EP (1999) Warming with a forced air warming blanket minimizes anesthetic-induced hypothermia in cats. Veterinary Surgery 28, 301–310
- Brodeur A.; Wright A.; Cortes Y.; Hypothermia and targeted temperature management in cats and dogs; J Vet Emerg Crit Care (San Antonio). 2017 Mar;27(2):151-163
- Redondo-García JI et al. Mortalidad anestésica en gatos en España. Resultados del proyecto COMPLRED. Clin Vet Peq Anim, 2024; 44 (1): 25-37
- Redondo J, Domínguez J, Suárez EM, Santisteban J, Villamandos RG. Mortalidad peri-anestésica en el gato: Estudio prospectivo en 505 casos. Consulta de Difusión Veterinaria 2001; 83(9): 94-98
- Brodbelt D. Feline anesthesic deaths in Veterinary practice. Top Companion Anim Med. 2010 Nov;25(4):189-94.
 by Multimédica
by Multimédica