Reptiles y anfibios: características fisiológicas y manejo clínico I
Resumen breve
Dentro del conjunto de mascotas de carácter exótico, el grupo de los reptiles y anfibios suele generar una gran curiosidad y atractivo tanto para los propietarios como para el personal clínico. Si bien el trabajo con pequeños mamíferos puede guardar más similitudes con la clínica de pequeños animales enfocada a perros y gatos, las especies que hoy aquí ocupan requerirán de unos conocimientos aún más especializados si se quiere garantizar un manejo clínico correcto y una hospitalización…Índice de contenidos
Resumen
Dentro del conjunto de mascotas de carácter exótico, el grupo de los reptiles y anfibios suele generar una gran curiosidad y atractivo tanto para los propietarios como para el personal clínico. Si bien el trabajo con pequeños mamíferos puede guardar más similitudes con la clínica de pequeños animales enfocada a perros y gatos, las especies que hoy aquí ocupan requerirán de unos conocimientos aún más especializados si se quiere garantizar un manejo clínico correcto y una hospitalización adecuada.
Para ello, y siguiendo la metodología del artículo sobre pequeños mamíferos anteriormente publicado, se ofrecerán pautas básicas y datos de consulta rápida que puedan servir como apoyo al ATV. En este sentido, y de forma genérica, se expondrán una serie de características fisiológicas relativamente comunes al conjunto de los reptiles y anfibios, así como nociones sobre hospitalización, contención química, patologías comunes y otros datos de interés. Posteriormente, y ya de forma más específica, se precisará sobre las características y requerimientos asociados a cada especie en particular, así como las enfermedades que más particularmente les afectan.
Introducción
En base a una serie de factores físicos, anatómicos y evolutivos, se pueden clasificar a reptiles y anfibios en distintos grupos. Dicha clasificación permitirá saber con qué otros reptiles o anfibios está emparentado un individuo, lo que resulta especialmente útil cuando se trata con una especie por primera vez.
Clasificación básica de reptiles:
| Tabla 1. Clasificación básica de reptiles |
| Superorden | Descripción |
| Chelonia | Reptiles con caparazón, como el orden de los Testudines (que incluye a la mayoría de las tortugas). Ejemplos: Orden Testudinae (Tortuga Mora y Mediterránea) |
| Lepidosauria | Clásicamente, este superorden contiene el orden Squamata, que incluye los subórdenes Serpentes (serpientes), Lacertilia (lagartos) y Amphisbaenia (lagartos gusano) Más recientemente, el orden Squamata ha sido dividido en:
|
| Crocodylomorpha | Incluye el orden Crocodylia, en el que están incluidas las siguientes familias:
|
Clasificación básica de anfibios:
| Tabla 2. Clasificación básica de anfibios |
| Superorden | Descripción |
| Anura (Salientia) | Ranas y sapos |
| Gymnophiona (Apoda) | Cecilias (anfibios ápodos) |
| Caudata (Urodela) | Salamandras y tritones |
Fisiológicamente, y dado que los reptiles presentan unos valores sumamente variables en función del entorno, no tendría sentido fijar unos datos de referencia en cuanto a parámetros como la frecuencia cardíaca o respiratoria. Dada su condición de ectotérmicos, son incapaces de autoregular su temperatura corporal, estando esta condicionada por elementos externos. Así pues, existen unos valores de temperatura ambiental y humedad relativa óptimas recomendadas para cada especie. He aquí algunos ejemplos:
| Tabla 3. Valores de temperatura ambiental y humedad relativa óptimas por especie |
| Especie | Rango de temperatura (ºC) | Humedad relativa |
| Tortuga Mediterránea | 20 - 28 | 30 - 50% |
| Iguana Verde | 25 - 35 | 75 - 100% |
| Gecko Leopardo | 25 - 34 | 30 - 40% |
| Dragón de Agua | 24 - 30 | 80 - 90% |
| Dragón Barbudo | 25 - 35 | 30 - 40% |
| Serpiente del Maíz | 23 - 30 | 30 - 70% |
| Pitón de Birmania | 25 - 30 | 50 - 80% |
Sin embargo, sí se pueden establecer unos valores referenciales en cuanto a pruebas hematológicas.
Ejemplos del valor hematocrito y proteínas totales:
| Tabla 4. Valores de hematocrito y proteínas totales |
| Especie | Hematocrito | Proteínas totales (g/L) |
| Iguana Verde | 25 -38% | 28 - 69 |
| Tortugas de Género Testudo | 19 - 40% | 32 - 50 |
| Culebra Ratonera | 20 - 30% | 30 - 60 |
| Boa Constrictor | 20 - 32% | 46 - 60 |
Bioquímica, valores de referencia:
| Tabla 5. Bioquímica, valores de referencia |
| Parámetro | Valor |
| Proteínas totales (g/dL) | 4,4 - 6,5 |
| Albúmina (g/dL) | 1,3 - 3 |
| AST (U/L) | 20 - 80 |
| CPK (U/L) | 400 - 600 |
| LDH (U/L) | 200 - 350 |
| Calcio (mg/dL) | 8 - 12 |
| Fósforo (mg/dL) | 3 - 5,5 |
| Glucosa (mg/dL) | 144 - 324 |
| Ácido úrico (mg/dL) | 2,5 - 5,8 |
Se debe tener en cuenta que el potasio contenido en el EDTA produce hemólisis en la sangre de algunos reptiles, por lo que debe optarse por tubos con heparina para la recolección de muestras.
A la hora de manipular y/o inmovilizar a reptiles, estos no se estresan con tanta facilidad como por ejemplo las aves, por lo que la inmovilización de un animal debilitado implica, por lo general, menos riesgos. Aun así, para garantizar la seguridad tanto del paciente como del ATV, es imprescindible tener en cuenta una serie de puntos:
- ¿Precisa el paciente de una exploración física o medicación? ¿Es realmente necesaria la manipulación?
- ¿Presenta distrés respiratorio? ¿Podría ser peligrosa una manipulación excesiva?
- ¿Se trata de una especie frágil? (Por ejemplo, el Gecko de Madagascar es extremadamente delicado y suele mudar la cola cuando se le manipula. Otras especies, como la Iguana Verde, tienden a desarrollar enfermedad metabólica ósea, lo que puede dar lugar a fracturas espontáneas).
- ¿Es una especie agresiva? Algunas, como la Tortuga Mordedora, el Gecko Tokay o la Pitón Africana de Roca lo son por naturaleza.
Datos generales:
- Los reptiles no poseen diafragma.
- Tampoco poseen paladar duro, a excepción de los cocodrilos.
- Son animales celomados, esto es, poseen celoma. El celoma es una cavidad interna que, dada la ausencia de diafragma, contiene todos los órganos internos del animal.
- La cloaca es una cavidad que se encuentra al final del tracto digestivo de todos los reptiles y anfibios (también en las aves y en ciertos peces y mamíferos). En esta cavidad confluyen los aparatos digestivo, reproductor y urinario.
- Algunos reptiles pueden portar en su piel de manera fisiológica la bacteria de la salmonela, por lo que es recomendable mantener una buena higiene tras haberlos manipulado, siendo el uso de guantes altamente aconsejable.
Aunque existen enfermedades que se dan con mayor incidencia en ciertas especies (y que serán comentadas más adelante) los reptiles, como conjunto, comparten una serie de procesos patológicos que suelen aparecer habitualmente.
| Tabla 6. Procesos patológicos más habituales en reptiles |
| Patología | Comentario |
| Disecdisis | Retención de la muda |
| Enfermedad vesicular (blister desease) | Puede darse en condiciones higiénicas deficientes y a niveles de humedad incorrectos |
| Quemaduras térmicas | Debidas a dispositivos de calor |
| Enfermedad ósea metabólica | Resultado de un desequilibrio de calcio / fósforo |
| Distocia | Imposibilidad para la puesta. Pueden ser obstructivas o no obstructivas |
| Retención preovulatoria | Los folículos se desarrollan en el ovario pero no se produce la ovulación, con lo que comprimen los órganos internos |
| Prolapso del pene o hemipene | Suele estar causado por infecciones, separación forzada en la cópula o inflamación debido a sondajes |
| Prolapso del oviducto | Común tras sobreesfuerzos en la puesta |
Hospitalización
Existen ciertas nociones muy importantes a la hora de hospitalizar un reptil y que están orientadas, no solo a mejorar la estancia del paciente y aumentar su comodidad, sino también a garantizar su supervivencia. En algunos casos puede suponer la diferencia entre el éxito y el fracaso en su recuperación.
En primer lugar, se deben tener en cuenta las dimensiones del terrario donde se alojará el reptil. Idealmente, este debe ser de un material de calidad, translúcido, de fácil limpieza y lo suficientemente espacioso como para permitir un gradiente de temperatura (el cristal reforzado o el metacrilato pueden ser buenas opciones). Las especies arbóreas como la Iguana Verde o ciertas serpientes (como la Boa Constrictor o la Pitón de Birmania) agradecerán espacios más verticales, mientras que otras como las tortugas no necesitan de esta verticalidad. En caso de estancias hospitalarias que no superen los 2 o 3 días, los requerimientos de espacio pueden ser poco estrictos. Superado este tiempo, el tamaño del terrario debería acercarse lo máximo posible a las medidas mostradas en la tabla (Tabla 7).
| Tabla 7. Tamaños recomendados de terrario |
| Tipo de reptil | Tamaño mínimo del terrario |
| Lagartos arbóreos | Altura: 2-3 veces la longitud del reptil Dimensiones del suelo: como mínimo, 2 por 3 veces la longitud del reptil |
| Lagartos terrestres | Altura: la suficiente para evitar que escape Dimensiones del suelo: como mínimo, 2 por 3 veces la longitud del reptil |
| Serpientes arbóreas | Altura: como mínimo, la longitud del reptil Dimensiones del suelo: como mínimo, ¾ por ⅓ la longitud del reptil |
| Serpientes terrestres | Altura: como mínimo, ½ la longitud del reptil Dimensiones del suelo: como mínimo, ¾ por ⅓ la longitud del reptil |
| Quelonios terrestres | Dimensiones del suelo: como mínimo, 5 por 5 veces la longitud del reptil |
| Quelonios acuáticos | Altura: la suficiente para evitar que escape Dimensiones del suelo: 5 por 3 la longitud del reptil Profundidad del agua: ½ la longitud del reptil |
La temperatura es otro punto de vital importancia. Como se ha mencionado antes, los reptiles son ectotérmicos, por lo que necesitan fuentes externas de calor con las que regular su temperatura corporal. Para ello, se recomienda el uso de focos o lámparas de calor que calienten al animal desde arriba (existe discusión sobre el uso de dispositivos como paneles radiantes eléctricos, elementos en forma de cerámica que emiten calor focalizado y otros artilugios, si bien no se recomiendan en este artículo, ya que aumentan innecesariamente el riesgo de quemaduras). Hay que asegurarse de que el animal tenga acceso a un punto en el que aumentar su temperatura, siendo capaz de retirarse a zonas más frescas cuando lo precise. Para más datos sobre la temperatura óptima de las distintas especies, se puede consultar la Tabla 3.
La humedad representa otro de los factores que se debe vigilar. El hábitat natural de un reptil puede diferir enormemente del de otro en función de su procedencia, por lo que la cantidad de humedad ambiental que necesite o pueda soportar puede variar entre una especie y otra. En el caso de aquellas especies que requieren de un alto porcentaje, se puede rociar periódicamente el recinto con un spray de agua previamente hervida y enfriada. Mojar ligeramente el sustrato es otra opción, si bien se deben evitar excesos que podrían derivar en infecciones cutáneas como la enfermedad blister. Existen ocasiones en las que un reptil requiere de unos mayores niveles de humedad que en condiciones normales, como durante el ciclo de muda de la piel. En estos casos, es necesario un incremento de los valores habituales para evitar que la piel se seque antes de desprenderse (lo que podría dar lugar a constricciones alrededor de los miembros y posterior necrosis) para lo cual se debe colocar un plato llano con agua y unas bolas de algodón dentro de un escondite donde el paciente dispondrá de mayor humedad que en el resto del terrario. Para más datos sobre los niveles óptimos de humedad de las distintas especies, se puede consultar la Tabla 3.
Como apuntes adicionales sobre la hospitalización de reptiles, las toallitas de papel o el papel de periódico suponen un buen tipo de sustrato, pues es higiénico y facilita la recolección de heces. Se debe evitar el papel de periódico con color, que puede ser irritante. Para facilitar la estancia y reducir el estrés, el reptil debe disponer de algún tipo de escondite en el que ocultarse. Por último, es sumamente importante llevar a cabo una limpieza y desinfección completas del terrario entre paciente y paciente para evitar la propagación de enfermedades.
Los anfibios y especies acuáticas, como los galápagos y las tortugas, requieren de grandes zonas de agua. Otros, como las ranas o los sapos, pueden ser emplazados en espacios pequeños pero muy húmedos. En el caso de las especies de agua dulce, se puede usar agua del grifo previamente declorada (mediante pastillas decloradoras de venta en tiendas de acuariofilia o dejándola reposar en un recipiente abierto durante 24 horas) y a temperatura ambiente. Los galápagos y tortugas de caparazón blando deben disponer de alguna zona cuya profundidad sea suficiente como para que puedan sumergirse completamente, así como un área de descanso donde reposar y secarse. Es importante mantener la limpieza del agua cambiándola frecuentemente, pues la acumulación de restos de comida, orina y heces pueden generar gran cantidad de bacterias, lo que incrementa el riesgo de infecciones en el caparazón y septicemia.
Fluidoterapia
Los reptiles tienen una extraordinaria capacidad para conservar fluidos. Las principales pérdidas vienen dadas por la orina, respiración, movimiento gular (del saco gular, ubicado ventralmente en la zona cervical) y salivación, ya que no poseen (o poseen muy pocas) glándulas sudoríparas. Los anfibios, sin embargo, sufren pérdidas fácilmente a través de las membranas semipermeables de su piel, por lo que necesitan fuentes de agua cercanas para sobrevivir.
La mayoría de los reptiles son uricotélicos, es decir, excretan ácido úrico en lugar de urea como principal proteína de desecho urinario, lo que supone que sus necesidades en cuanto a mantenimiento de fluidos sean menores que los de los mamíferos. Otras especies de reptiles acuáticos o semiacuáticos excretan amoníaco y urea. Los anfibios totalmente acuáticos como las cecilias excretan únicamente amoníaco, mientras que los anfibios más terrestres como los sapos eliminan urea (y ácido úrico en el caso de un par de especies). Si un reptil uricotélico es privado de agua por un tiempo prolongado, el ácido úrico no desechado se acumulará en el organismo hasta producir la formación de cristales de ácido úrico alrededor de órganos vitales como los riñones o el corazón, generando un daño permanente pues no son extirpables. Esta condición es conocida como gota.
El volumen de mantenimiento de fluidos puede variar ampliamente entre una especie y otra en función de las diferencias anatómicas y fisiológicas. Estas variaciones en los requerimientos están también definidas por el hábitat natural, que puede ser desde un bosque tropical hasta un entorno desértico, con lo que, una vez más, hay que hacer hincapié en la importancia de la humedad y la temperatura: un reptil como la Iguana Verde, habituada a condiciones de hasta un 100% de humedad, se deshidrataría rápidamente en condiciones de aridez (especies como la propia Iguana Verde o los camaleones no suelen beber agua de un recipiente, deben tomarla directamente de las gotas que caen en las hojas). En cuanto a la temperatura, si una especie ectotérmica no es capaz de alcanzar su temperatura corporal óptima, se producirá una ralentización de su metabolismo que derivará en una gestión de fluidos deficiente.
El cálculo de fluidos requeridos en caso de deshidratación puede hacerse en base a 20-25 ml/kg/día para reptiles y anfibios. Se puede estimar el nivel de deshidratación de la siguiente forma:
- 3% de deshidratación: polidipsia, levemente letárgico, descenso del ácido úrico.
- 7% de deshidratación: polidipsia, anorexia, apatía, pérdida de tersura en la piel tras pellizcarla, córneas opacas, pérdida de tersura de la membrana lenticular en serpientes.
- 10% de deshidratación: animal apático/comatoso, la piel no recupera su estado normal tras pellizcarla, mucosas secas, globos oculares hundidos, anuria.
Comparar los niveles de hematocrito y proteínas totales también puede ayudar a establecer el nivel de deshidratación (ver Tabla 4). Independientemente del nivel de deshidratación, es importante no exceder un máximo de 25-30 ml/kg/día. Por lo tanto, la rehidratación de un reptil seriamente debilitado puede llevar días o incluso semanas.
En el caso de cirugía, se han de suministrar fluidos postquirúrgicos para compensar pérdidas. Estas son las principales causas:
- Hemorragias intraquirúrgicas.
- La sequedad producida por los gases anestésicos.
- El pequeño tamaño de muchas de estas especies hace que pierdan fluidos a mayor velocidad que las de mayor tamaño.
- Algunos pacientes son incapaces de beber inmediatamente después de la cirugía, lo que puede prolongar el período sin agua ni comida varias horas.
- Algunas intervenciones, como las de cirugía oral, generan inapetencia en el paciente durante un tiempo.
Los fluidos más frecuentemente usados en la práctica con reptiles son:
| Tabla 8. Fluidoterapia |
| Vía de administración | Ventajas | Desventajas |
| Oral | Estrés mínimo si el manejo es adecuado Vía fisiológica para la entrada de fluidos Menor riesgo de daños tisulares Puede ser administrada en casa por el propietario Rápida administración | Altamente estresante si el manejo no es el adecuado No indicada en caso de patología gastrointestinal Posible daño gástrico si la sonda se inserta de forma brusca Ritmo de rehidratación lento Riesgo de neumonía por aspiración Volúmenes bajos en cada sesión |
| Subcutánea | Admite la administración de volúmenes altos en cada sesión Es posible la administración rápida, lo que minimiza el estrés Mejor asimilación que por vía oral en caso de patología gastrointestinal Riesgo de daño de órganos internos mínimo | Puede ser incómodo para el paciente Riesgo de daño de tejido tisular y muscular Ritmo de rehidratación lento en casos de deshidratación severa e insuficiencia circulatoria periférica Solo se deben administrar fluidos hipotónicos e isotónicos Oscurecimiento de la piel en el punto de inyección, particularmente en lagartos como iguanas y camaleones |
| Intracelómica | Admite la administración de altos volúmenes en intervalos menores La asimilación es más rápida que por vía subcutánea No resulta apenas dolorosa | Debido a la ausencia de diafragma, puede producirse presión en los pulmones si se administran volúmenes amplios Ritmo de rehidratación lento en casos de deshidratación severa Sólo se deben administrar fluidos hipotónicos e isotónicos Alto riesgo de daño de órganos internos |
| Intravenosa | Rápida rehidratación, incluso en pacientes con deshidratación severa Apta para la administración de coloides e hipertónicos, así como transfusiones sanguíneas El uso de catéteres intravenosos y de perfusores automáticos incrementa la precisión | El reducido tamaño de algunos reptiles puede dificultar la cateterización del vaso Algunas especies, como las serpientes, pueden precisar de cirugía menor para cateterizar la vía Los vasos de los reptiles son más frágiles que los de los mamíferos Se requiere de gran habilidad y material adecuado |
| Intraósea | Rápida rehidratación, incluso en pacientes con insuficiencia circulatoria periférica Apta para la administración de coloides e hipertónicos, así como transfusiones sanguíneas El uso de catéteres intraóseos y de perfusores automáticos incrementa la precisión | Contraindicada en caso de infección (osteomielitis) o enfermedades metabólicas óseas Requiere de sedación o anestesia local o general para la inserción del catéter Baja tolerancia en algunas especies |
Las vías de administración habituales, así como sus ventajas e inconvenientes son las siguientes:
| Tabla 9. Vías de administración habituales |
| Tipo de fluido | Uso |
| Lactato de Ringer | Altura: 2-3 veces la longitud del reptil Rehidratación y mantenimiento Fluidoterapia postquirúrgica Tratamiento de la acidosis metabólica Patologías gastrointestinales crónicas |
| Glucosalino | Anorexia Hipoglucemia |
| Hipertónico | Hipovolemia |
| Suplementos de proteínas, aminoácidos y vitamina B | Soporte nutricional en casos de malnutrición Pérdida de proteínas debido a enteropatía, parasitación severa, nefropatía, enfermedad hepática o dermatitis con gran cantidad de exudado |
| Coloides (sólo vía intravenosa) | Abundante pérdida de sangre |
| Transfusión sanguínea (sólo vía intravenosa o intraósea) | Indicada cuando el valor hematocrito está por debajo de 5-10% No se han descrito grupos sanguíneos, pero donante y receptor han de ser de la misma especie La extracción debe ser, como máximo, un 2% del peso del donante Usar jeringa preheparinizada o con citrato y fosfato. Inmediatamente tras la extracción transfundir al receptor |
| Orales y electrolitos | Indicado en casos de deshidratación leve Viable para el propietario |
Nutrición
Según su dieta, se pueden clasificar a reptiles y anfibios en cuatro grupos:
- Carnívoros: son, en su mayoría, las serpientes. Se alimentan de presas que engullen enteras. Algunas poseen veneno en sus colmillos, mientras otras, como las boas y las pitones, asfixian a sus presas mediante constricción.
- Herbívoros: este grupo abarca una amplia variedad de especies, en las que se incluyen la mayoría de tortugas y lagartos como la iguana verde.
- Insectívoros: predominan en este grupo los lagartos (Gecko Leopardo, Lagarto de Collar, etc.) y los anfibios (ranas, salamandras, etc.).
- Omnívoros: en este grupo se incluyen aquellos reptiles que desarrollan cambios en sus hábitos alimentarios a lo largo de sus vidas. Por ejemplo, el Dragón Barbudo comienza su vida siendo insectívoro, pasando, con el tiempo, a alimentarse de frutas y verduras principalmente.
Independientemente de a qué grupo pertenezcan, todo reptil o anfibio tiene unas necesidades nutricionales básicas que deben ser cubiertas. Estas suelen ser desconocidas para un amplio número de propietarios, por lo que un gran porcentaje de las visitas a consulta de reptiles (y de cualquier especie exótica en general) están relacionadas con una dieta deficiente. Estos problemas son, principalmente:
- Anorexia posthibernación. Se presenta en Tortugas Mediterráneas, las cuales hibernan durante los meses de invierno. Se caracteriza por un estado de inapetencia tras salir del estado de hibernación y suele cursar con infección sistémica o respiratoria, bajo peso corporal en relación con la longitud del animal (ratio de Jackson), hipoglucemia y niveles altos de urea. En casos graves, puede haber insuficiencia renal con ácido úrico y potasio elevados.
- Gota, comentada en el apartado de fluidoterapia.
- Obesidad. Muy frecuente en reptiles criados en cautividad. El desconocimiento hace que muchos propietarios no ofrezcan el alimento apropiado a sus reptiles o que los intervalos para alimentarlos sean incorrectos. Por ejemplo, si se ofrece alimento para perros a una tortuga o iguana verde, estas, a pesar de ser especies herbívoras, lo aceptarán. Esto se traduciría en casos de gota por exceso de proteínas, excesos de calcio y vitamina D3 (que causan mineralización de los tejidos blandos) y exceso de grasa animal (que puede dar lugar a una lipidosis hepática).
- Problemas relacionados con la temperatura ambiental. Como ya se ha mencionado anteriormente, existe un rango de temperatura para cada reptil en el que el organismo mantiene funcionales todos sus procesos metabólicos. Una temperatura por debajo de este rango, ralentizará el proceso de digestión del alimento hasta el punto de suspenderlo por completo. En casos en los que la temperatura es demasiado alta, el animal entrará en un proceso de deshidratación y estrés por calor que hará que pierda todo estímulo por alimentarse.
Tipos y frecuencia de alimentación recomendados:
| Tabla 10. Tipos y frecuencia de alimentación recomendados |
| Especie | Alimento | Frecuencia |
| Iguana verde |
| La mezcla de pienso, verduras, fruta y aporte cálcico debe ser suministrada diariamente. El suplemento para jóvenes y hembras anidando, 1 o 2 veces por semana |
| Tortugas mediterráneas* |
| La mezcla de pienso, verduras, fruta y suplemento de calcio debe ser suministrada diariamente El suplemento de calcio/vitamina D3, 1 o 2 veces por semana en función de mayor necesidad (joven) o menor necesidad (adulto) |
| Pequeños insectívoros (p.ej., Gecko Leopardo, Lagarto de Collar) |
| 2 o 3 veces a la semana |
| Pequeños carnívoros (p.ej., serpiente jardinera, serpiente del maíz) | Crías de rata y/o pequeños ratones acorde al tamaño del reptil, no sobrepasando la presa el 50% de la anchura del reptil | 2 o 3 veces a la semana |
| Carnívoros medianos (p.ej., serpiente Rey de California, Culebras Ratoneras) | Ratones adultos o ratas pequeñas, acorde al tamaño del reptil, no sobrepasando la presa el 50% de la anchura del reptil | 1 o 2 veces a la semana |
| Carnívoros grandes (p.ej., Boa Constrictor, Pitón de Birmania) | Ratas adultas o conejos pequeños, no sobrepasando la presa el 50% de la anchura del reptil | 1 vez a la semana o de quincenalmente (a mayor tamaño de la serpiente, menor frecuencia de alimentación) |
*En el caso de especies más tropicales, como la Tortuga de Pies Rojos o Amarillos, la cantidad de fruta y flores debe ser el doble.
*En el caso de especies como la tortuga leopardo, la Tortuga de Espolones Africana y la Tortuga Estrellada de la India, se recomienda una buena cantidad de hierba fresca sin cortar o heno de alta calidad.
*En el caso de especies más omnívoras, como las Tortugas de Caja, se debe sustituir el 50% de la fruta y la verdura indicada en la tabla por alimento seco para perros (empapado), gusanos de la harina, grillos, lombrices e incluso crías de ratón.
En cuanto al agua, las necesidades varían enormemente entre las especies, dependiendo de la humedad del entorno al que estén adaptadas y al tipo de dieta: no consumirá la misma cantidad de agua una Iguana Verde, adaptada a un clima con una humedad relativa de entre 60-100% y que se alimenta de frutas y vegetales, que un Gecko Leopardo habituado a regiones semidesérticas, cuya dieta se basa en insectos. Por lo tanto, se debe tener muy en cuenta estos dos factores a la hora de estimar el agua que requiere un reptil.
Anestesia y sedación, conceptos básicos
La contención química en reptiles es un proceso que se lleva a cabo con relativa frecuencia, desde procedimientos menores como la extracción de la cabeza de algunas tortugas hasta habilitar una yugular para una extracción sanguínea o la realización de cirugías (Figura 1).
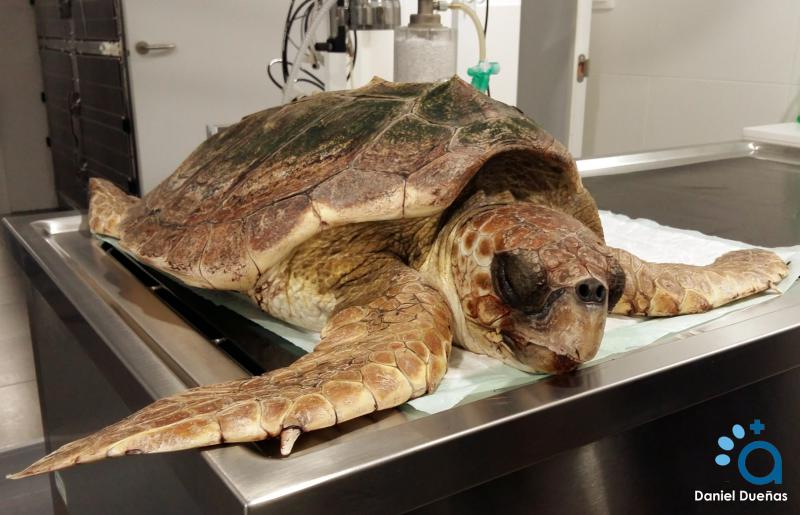
De cara a realizar una anestesia o sedación, es conveniente conocer algunas particularidades del aparato respiratorio de los reptiles con respecto a los mamíferos:
- Glotis: similar a la de las aves, situada en la base de la lengua (más rostral en serpientes y lagartos, y más caudal en tortugas). En reposo, permanece cerrada, abriéndose brevemente durante la inspiración y la expiración.
- Tráquea: en tortugas, está formada por anillos completos cartilaginosos. En algunas especies, se divide en dos bronquios. La tráquea en serpientes y lagartos se caracteriza por poseer unos anillos incompletos en forma de c, y es mucho más larga en el caso de las serpientes.
- Pulmones: simples y elásticos en el caso de las serpientes y lagartos, la mayoría de serpientes no tienen pulmón izquierdo o es vestigial, mientras que el derecho suele acabar en un saco aéreo. Las tortugas poseen un par de pulmones bajo la zona dorsal del caparazón.
- Los reptiles no tienen diafragma. La mayoría hace uso de los músculos intercostales y abdominales para abrir y cerrar la caja torácica, a excepción de las tortugas, que necesitan mover cabeza, cuello y extremidades dentro y fuera del caparazón para hacer circular el aire.
- Ausencia de epiglotis. La glotis está relativamente craneal en la mayoría de las especies, y permanece cerrada en reposo, por lo que es necesario esperar a la inspiración para intubar.
- No tienen reflejo nauseoso.
- Ciertas especies pueden sobrevivir privadas de oxígeno durante largos períodos, lo que puede dificultar seriamente la anestesia inhalatoria.
- Debido a una serie de receptores intrapulmonares, las serpientes pueden anular los efectos de una alta concentración de dióxido de carbono.
Antes de llevar a cabo una anestesia o sedación, se debe considerar lo siguiente:
- ¿Es la anestesia o sedación necesaria para el procedimiento requerido?
- ¿El reptil sufre de insuficiencia respiratoria o septicemia?
- ¿La salud del paciente es susceptible de empeorar debido a la sedación o anestesia?
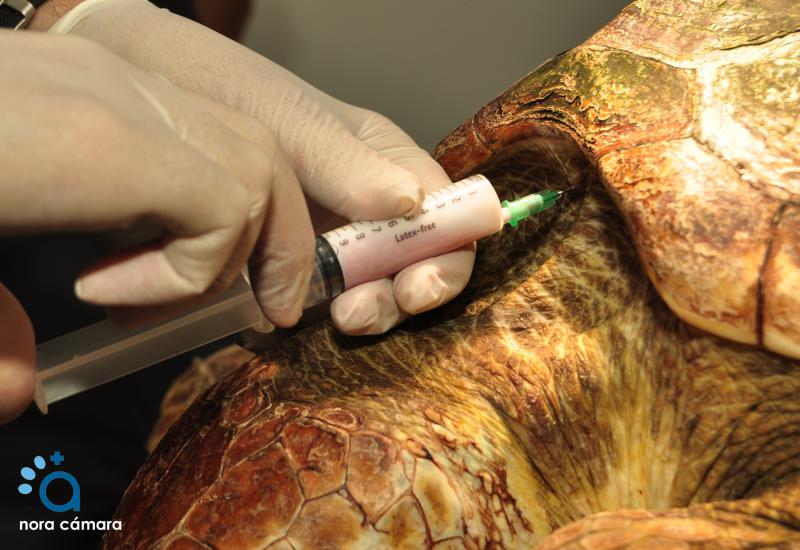
Preparación preanestésica:
- Peso. Importante a la hora de calcular la dosis, sobre todo en las especies de menor tamaño.
- Analítica sanguínea. Aconsejable la realización de pruebas bioquímicas y hematológicas.
- Ayuno. Mientras que la mayoría de reptiles no requiere de ayuno, la regurgitación y la presión cardíaca o pulmonar representan un riesgo para las serpientes, por lo que es importante que no hayan ingerido ninguna presa en los dos días previos a la anestesia. En el caso de los insectívoros, se debe evitar que se alimenten de presas vivas en las 24 horas previas, ya que estas podrían seguir con vida cuando el reptil esté bajo los efectos de la anestesia.
- Medicación preanestésica:
- Antagonistas muscarínicos: atropina, bromuro de glicopirronio.
- Sedantes: acepromacina, diazepam, midazolam.
- Estimulantes adrenoreceptor Alpha-2: xilazina, medetomidina (reversible con atipamezol).
- Opioides: butorfanol (combinable con midazolam).
- Fluidoterapia.
En reptiles, como en mamíferos, el estado de sedación o anestesia puede alcanzarse mediante fármacos administrados por vía inyectable (ketamina, combinable con otros agentes como midazolam, xilazina o medetomidina; propofol, alfaxalona) o inhalatoria (isoflurano, sevoflurano, óxido nitroso). Se optará por unos u otros en función de cada caso y especie, teniendo en cuenta que cada método tiene sus ventajas e inconvenientes.
Ventajas e inconvenientes de anestésicos inyectables:
| Tabla 11. Ventajas e inconvenientes de anestésicos inyectables |
| Ventajas | Inconvenientes |
| Facilidad de administración | La recuperación dependerá del metabolismo |
| Se evita la tendencia a aguantar la respiración que se da en la anestesia inhalatoria | Difícil de revertir rápidamente |
| Más económica | Los tiempos de recuperación suelen ser prolongados |
| Menor riesgo para el anestesista | Posible necrosis muscular en el punto de inyección |
Ventajas e inconvenientes de anestésicos inhalatorios:
| Tabla 12. Ventajas e inconvenientes de anestésicos inhalatorios |
| Ventajas | Inconvenientes |
| Fácil administración con máscara facial | Contención de la respiración (especialmente los quelonios) |
| Indolora | Contaminación ambiental |
| Daño tisular mínimo | Riesgos para la salud del anestesista Riesgo asociado a la manipulación de reptiles peligrosos |
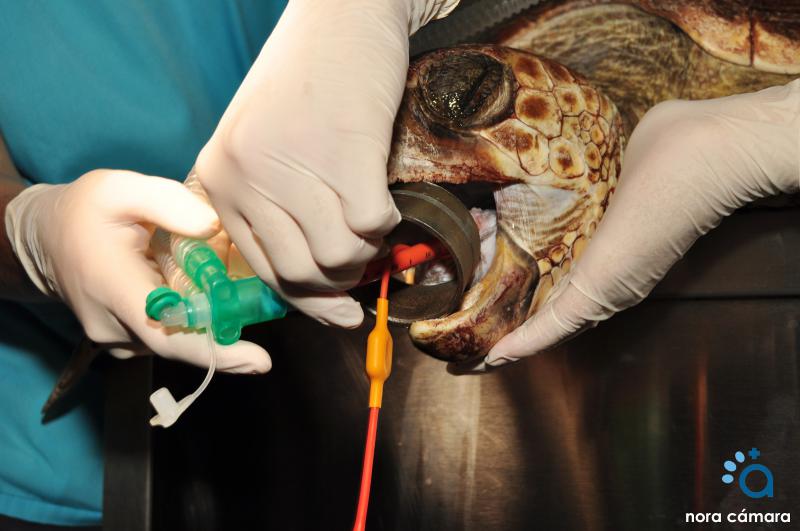

Las fases de la anestesia en reptiles son:
| Tabla 13. Fases de la anestesia en reptiles |
| Fase | Signos clínicos |
| Estadio 1 |
|
| Estadio 2 |
|
| Estadio 3 |
|
| Estadio 4 |
|
En el caso de los anfibios, existen tres vías para la administración de anestésicos: inyectables, gases inhalatorios y compuestos disueltos en el agua.
El principal agente inyectable es la ketamina, mientras que la anestesia inhalatoria suele llevarse a cabo con isoflurano, aprovechando las vías cutánea y bucofaríngea (los anfibios pueden respirar a través de la piel o las membranas orales) si bien las especies más pequeñas y frágiles, como los urodelos más pequeños o los cecílidos, pueden sufrir daños graves por el efecto irritante que produce el gas en su piel.
Los agentes solubles en agua más habituales son el llamado MS-222 (presentado como en forma de polvo, común en la anestesia de peces) y la benzocaína. Estas sustancias deben ser combinadas con bicarbonato sódico para contrarrestar la acidez que producen en la solución. Es recomendable usar la propia agua del anfibio para minimizar los cambios en el entorno del animal, así como llevar a cabo el proceso en una bolsa de plástico o similar, ya que algunos pacientes entran en un estado de excitación que puede llevar a lesiones si se golpean contra superficies rígidas. También es importante asegurarse de que los anuros y otros anfibios sin branquias sean capaces de alcanzar la superficie del agua con las fosas nasales para evitar que se ahoguen.
Bibliografía
Girling, Simon J; “Veterinary Nursing of Exotic Pets”; Part III: Reptiles and Amphibians, Págs. 245 – 354; 2013 (Second Edition); Oxford, United Kingdom.
Douglas R. Mader, MS, DVM, DABVP, “Reptile Medicine and Surgery”, Section II: Biology and Husbandry, Section III: Anatomy, Physiology and Behavior, Section IV: Medicine, Section V: Critical Techniques/Procedures, Section VII: Specific Diseases and Critical Conditions, Section VII: Special Topics, Págs. 25 - 674, 715 - 972; 2006 (Second Edition); St. Louis, Missouri.
 by Multimédica
by Multimédica