Coronavirus en el conejo doméstico
Resumen breve
Las recientes epidemias causadas por virus de la familia Coronaviridae en humanos han puesto de manifiesto el papel que las diferentes especies animales han jugado en ellas y han impulsado la realización de múltiples estudios para encontrar virus de esta familia en los animales.Índice de contenidos
Resumen
Las recientes epidemias causadas por virus de la familia Coronaviridae en humanos han puesto de manifiesto el papel que las diferentes especies animales han jugado en ellas y han impulsado la realización de múltiples estudios para encontrar virus de esta familia en los animales.
En los conejos ya se habían descrito cuadros clínicos asociados a la presencia de virus similares a coronavirus, y más recientemente y a raíz de las epidemias de SARS y MERS se han identificado otros coronavirus en conejos asintomáticos.
Dentro del primer grupo está el coronavirus entérico del conejo (RECoV), que se ha asociado a cuadros de diarrea en gazapos y que no suele causar mortalidades elevadas.
También se encuentra dentro del grupo de coronavirus capaces de causar enfermedad clínica en el conejo el virus de la miocarditis infecciosa o de la efusión pleural, que además ilustra la capacidad de recombinación y adaptación de los coronavirus a nuevos hospedadores.
Dentro de los trabajos de campo que se han llevado a cabo desde la epidemia de SARS de 2002 dirigidos a identificar posibles especies intermediarias para el paso de los coronavirus a la especie humana, se han detectado virus que si bien de momento no causan enfermedad en los conejos, sí que pueden verse como un riesgo potencial de la transmisión de nuevos virus a los humanos.
Introducción
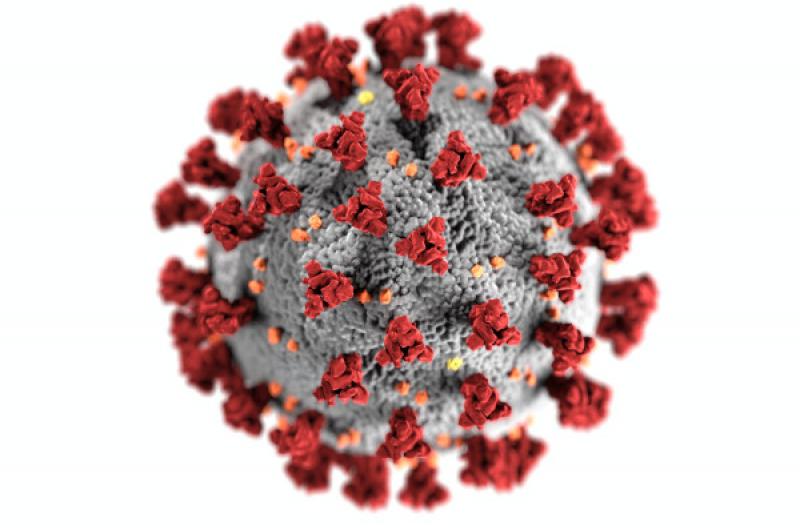
Los coronavirus (Figura 1) son virus esféricos de 100 -160 nm de diámetro, con envuelta de bicapa lipídica y que contienen ARN monocatenario de polaridad positiva. Son los virus ARN con el genoma más largo que se conoce. Pertenecen a la familia Coronaviridae, subfamilia Coronavirinae y se agrupan en cuatro géneros: Alfacoronavirus (αCoV), Betacoronavirus (βCoV), Gammacoronavirus (γCoV) y Deltacoronavirus (δCoV). Los alfa y betacoronavirus afectan a mamíferos, los gammacoronavirus afectan a aves y los deltacoronavirus presentan un tropismo más específico por aves, aunque también pueden infectar a algunas especies de mamíferos1.
Los coronavirus pueden producir un gran número de enfermedades, que afectan principalmente los sistemas digestivo, respiratorio y nervioso, tanto en humanos como en el resto de especies animales.
Estos virus son bien conocidos por su alta capacidad de mutación y recombinación, lo que favorece el salto entre diferentes especies y conforma la base de su potencial zoonótico. La capacidad de mutación también es responsable de los cambios de tropismo y patogenicidad del virus, tal y como sucede en el coronavirus entérico felino (FECV) y la mutación que le permite replicarse en monocitos y macrófagos (virus de la peritonitis infecciosa felina, FIPV) 1.
El salto entre especies es lo que ha permitido el paso de algunos coronavirus de animales salvajes saltar a los humanos y diseminarse, causando epidemias importantes en los últimos 20 años2.
El conejo es una especie cercana a los humanos por ser una fuente de proteína animal consumida a nivel mundial, por su uso como animal de experimentación y, más recientemente, por su papel como animal de compañía. En estos tres aspectos de la relación entre humanos y conejos se ha manifestado la ocurrencia de coronavirus. Este trabajo es el resultado de una revisión bibliográfica de las publicaciones referentes a la infección por coronavirus en conejos. Los coronavirus que se han identificado en el conejo y su relación con los virus humanos más relevantes se resumen en la Tabla 1.

Coronavirus que pueden causar enfermedad clínica en el conejo
El coronavirus entérico del conejo ( RECoV)
El complejo de la enteritis del conejo hace referencia a un cuadro de diarrea y enteritis que se produce en los conejos de 5 a 8 semanas de edad y que cursa con mortalidad elevada en granjas y otros centros de cría3.
Algunos de los animales afectados presentan diarrea, otros mueren de forma aguda, sin sintomatología previa4.
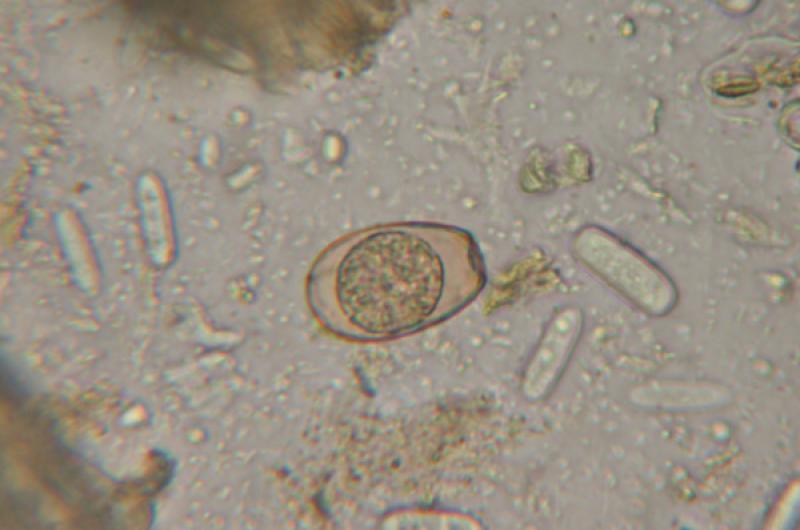
Como causantes de este cuadro se han identificado tanto agentes infecciosos (E. coli, coccidios [Figura 2], rotavirus) como dietéticos (nivel de fibra bruta de la dieta). En varios estudios se encontraron partículas víricas compatibles con coronavirus en los animales afectados2,5,6, por lo que se cree que este virus podría jugar un papel relevante en la aparición de este cuadro.
En una colonia de cría de conejos de laboratorio en Alemania en 1979 se describió un brote de enfermedad en animales recién destetados, de 3 a 8 semanas de edad6. Los conejos afectados presentaban quietismo, pelaje en mal estado y perineo sucio de heces, pero no tenían fiebre. La morbilidad resultó ser de un 40-60 % y la mortalidad cercana al 100 %. En el examen postmortem sólo se identificó una reacción inflamatoria moderada en el epitelio intestinal (acortamiento de las vellosidades intestinales, vacuolización y necrosis de enterocitos, edema de mucosa e infiltración monocuclear y polimorfonuclear).
Se descartó que la etiología estuviera relacionada con endoparásitos y bacterias (incluyendo la toxina de Clostridium perfringens), y en las muestras de heces de animales afectados se hallaron partículas víricas con las proyecciones capsulares características de los coronavirus (espículas) en 15 de 16 muestras, y partículas compatibles con reovirus en 3 de 16 muestras. Estas muestras no produjeron ningún efecto citopático en los cultivos celulares en que se inocularon (más tarde se concluyó que el RECoV es difícil de cultivar in vitro)4.
Como tratamiento se utilizaron coccidiostáticos, antibióticos y modificaciones de la dieta que en ningún caso alteraron la mortalidad. Finalmente se utilizaron vacunas orales bovinas frente a coronavirus y reovirus, que produjeron resultados inconsistentes.
En Canadá, en 1980, el análisis de muestras intestinales de conejos provenientes de colonias con una alta incidencia de enfermedad intestinal demostró la presencia de un virus morfológicamente similar a los coronavirus bajo el microscopio electrónico5. El uso de suero hiperinmune frente al coronavirus humano 229-E inhibía la hemoaglutinación inducida por estas muestras, indicando una cierta relación antigénica entre ambos virus. El coronavirus humano 229E es un alfacoronavirus, uno de los 4 coronavirus que circulan a nivel mundial y se ha relacionado con el resfriado común en adultos sanos7.
Más adelante, mediante técnicas inmunológicas y electroforéticas se confirmó que el virus se comportaba como el resto de coronavirus conocidos, y se describió una técnica, la microscopía inmunoelectrónica, que facilitaba la identificación del virus en las heces y permitía detectar con mayor facilidad a los portadores asintomáticos8.
En general, y con la excepción del brote alemán de 1979, la enteritis asociada a coronavirus en conejos cursa con bajas mortalidades. La prevalencia en explotaciones comerciales de Estados Unidos según un estudio publicado en 1993 fue del 3 al 40 %7.
Un estudio llevado a cabo en Canadá en 1990 concluyó que el coronavirus entérico del conejo es altamente contagioso, ya que la mayoría de conejos libres de virus e inoculados con él resultaron infectados. Puede causar infecciones agudas y subclínicas en los que los animales infectados permanecen como portadores asintomáticos durante largos periodos de tiempo4.
Los hallazgos histopatológicos resultan similares a los de los cerdos afectados por el virus de la gastroenteritis transmisible (TGEV), otro coronavirus de importancia en producción animal. En los conejos afectados se observaron lesiones en el tejido linfático asociado al intestino (GALT); aunque no se estudió la presencia de virus a este nivel, es probable que estas lesiones estén relacionadas con la infección por RECoV. En los cerdos la presencia del TGEV en el tejido linfático intestinal juega un importante papel defensivo, por lo que las lesiones encontradas en conejos enfermos podrían indicar una cierta protección frente a la reinfección4.
El RECoV es el único coronavirus asociado a un cuadro clínico que puede causar una infección natural en conejos1.
El virus de la cardiomiopatía y el virus de la efusión pleural
En el diagnóstico de la sífilis humana se puede utilizar una prueba llamada prueba de inmovilización del treponema (TPI) que consiste en verificar la inmovilización de las espiroquetas causantes de esta enfermedad, Treponema pallidum, mediante el uso de suero de los pacientes afectados. Para mantener las espiroquetas se utilizaban conejos a los que se les inoculaba una emulsión que contenía este agente infeccioso por vía intratesticular. En 1968 se produjo un cuadro febril en un grupo de animales inoculados, y en 1961 empezaron a producirse muertes esporádicas en individuos de ese grupo, que alcanzaron tasas del 50 % (1968) y el 75 % (1970). Las muertes se producían entre una y dos semanas después de la inoculación, tras un cuadro de fiebre (temperatura rectal superior a 40º), edema pulmonar severo y congestión de los ganglios linfáticos superficiales. También se observó congestión de conjuntiva e iris, y en algunos casos quemosis e hifema, coincidiendo con la fiebre9.
Los conejos afectados presentaban degeneración y necrosis del miocardio con poca o ninguna respuesta inflamatoria9.
El cuadro febril se producía incluso tras la inactivación de Treponema pallidum en las muestras previas a la inoculación, por lo que éste se descartó como agente causal del cuadro clínico, y tras diferentes estudios se concluyó que el agente causal más probable era un virus10.
En estudios posteriores se comprobó la presencia de un coronavirus mediante microscopía electrónica, y se observó un resultado positivo a la inmunofluorescencia con suero anti-229E en el miocardio de los animales afectados9.
Por este motivo, y aunque no se ha llegado a secuenciar este virus, se cree que se trata de un alfacoronavirus11.
Los trabajos realizados posteriormente llevaron a definir tres posibles cuadros clínicos tras la infección experimental con este virus:
- Cuadro agudo: Los animales afectados presentan congestión ocular, edema pulmonar, dilatación del ventrículo derecho, derrame pleural (10 a 50 ml) y ganglios linfáticos superficiales de color rojo oscuro. Generalmente se produce la muerte repentina y sin síntomas de los animales afectados12.
- Cuadro subagudo: Cursa con dilatación del ventrículo derecho y aumento y enrojecimiento de ganglios linfáticos periféricos, además de congestión hepática y pulmonar13. Puede aparecer una cantidad moderada de líquido pleural (5 ml) y ascitis (10-20 ml líquido claro o serosanguinolento). La sintomatología en el momento de la presentación se debería a un fallo cardíaco congestivo9,12.
- En los animales que superaban las fases aguda y subaguda no se observaron signos clínicos de insuficiencia cardíaca ni alteraciones en el electrocardiograma hacia el día 30 postinfección. Sin embargo, desarrollaron dilatación e hipertrofia excéntrica de ambos ventrículos sin que se apreciaran lesiones valvulares o vasculares, lo que sugiere el desarrollo de cardiomiopatía dilatada. Este hecho ha llevado a que se haya utilizado el coronavirus del conejo (RbCV) como modelo experimental de miocarditis vírica, insuficiencia cardíaca congestiva y cardiomiopatía dilatada12,13.
La mortalidad total asociada a la infección experimental resultó ser del 64 % , con un 27 % de los animales muertos durante la fase aguda y un 37 % de las muertes durante la fase subaguda)13.
Inicialmente, la enfermedad asociada a la inyección intratesticular de Treponema pallidum se denominó enfermedad de la efusión pleural (PED) o de la miocarditis infecciosa, y en ambos casos se identificaron partículas víricas similares a coronavirus, si bien algunos estudios posteriores ponían en duda este hecho14.
En estos estudios también se observaba un amplio rango de patogenicidad entre las diferentes cepas de virus y una viremia muy prolongada (hasta dos años tras la inoculación) independiente de la patogenicidad de la cepa. En estos casos de viremia prolongada (infección crónica), pese a asociarse a niveles elevados de IgG, no se observó la formación de inmunocomplejos (excepto en un caso) y en ningún caso se produjeron lesiones glomerulares atribuibles a estos inmunocomplejos15.
Dadas las circunstancias en que apareció este virus, es probable que se trate de un virus humano adaptado a los conejos a partir de la contaminación de las muestras de T. pallidum.
También se ha sugerido que la emergencia del virus de la enfermedad de la efusión pleural (PEDV) en conejos es el resultado de la presión selectiva sobre una población de virus de comportamiento benigno, al haber realizado durante años pases de inoculados testiculares entre conejos a intervalos de 1 o 2 semanas para la propagación de T pallidum15.
La historia de este virus ilustra la capacidad de los coronavirus de saltar entre especies y de modificar su patogenicidad, si bien en este caso tanto el paso de una especie a otra como el cambio en la patogenicidad han sido facilitados de forma artificial.
Coronavirus asintomáticos en conejos
Coronavirus de los conejos
Históricamente los coronavirus no se han considerado una amenaza grave para la salud pública hasta que se produjeron los brotes de neumonía atípica en 2002 y 2012. La primera, más tarde llamada SARS (síndrome respiratorio agudo grave) se asoció a mortalidad del 10 % y la segunda, MERS (síndrome respiratorio de Oriente Medio) con mortalidades de hasta el 37 %1.
A raíz de la epidemia de SARS originada en China en 2002 y de la identificación de virus similares al coronavirus causante de la enfermedad en murciélagos y civetas aumentó el interés de la comunidad científica en la búsqueda de coronavirus en animales para identificar especies hospedadoras y virus con un potencial epidémico para los humanos.
En este contexto, un estudio realizado en los mercados de animales vivos de la provincia de Cantón (Hong Kong, China) llevó a la detección y caracterización de un coronavirus en conejos domésticos, el coronavirus del conejo HKU14 (RbCoV HKU14), que se clasificó como betacoronavirus subgrupo A (los coronavirus que causan SARS se clasifican como betacoronavirus subgrupo B)11. Ninguno de los animales en que se aisló el virus presentaban sintomatología en el momento de la toma de muestras.
En otro estudio realizado en Francia con muestras de conejos silvestres recogidas entre 2007 y 2009 se encontraron secuencias muy cercanas al RbCoV HKU14 encontrado en conejos domésticos en China, y a un alfacoronavirus hallado en liebres y conejos en España. La prevalencia de animales infectados fue del 7,56 %, con diferencias importantes según el área geográfica de muestreo. Este estudio demuestra la circulación de beta y alfacoronavirus en conejos silvestres16.
Coronavirus humanos
Las epidemias de SARS y MERS también han impulsado la realización de estudios que permitan entender el paso de estos coronavirus desde su hospedador inicial hasta los humanos y del papel que las diferentes especies de animales silvestres y domésticos pueden jugar en la epidemiología de estos virus.
Los estudios de transmisión del coronavirus que causa el MERS (síndrome respiratorio de Oriente Medio), el MERS-CoV, demuestran que si bien se llega a replicar y excretar en conejos que se han infectado de forma experimental, los conejos que están en contacto directo o indirecto con los animales infectados no desarrollan sintomatología, no excretan el virus ni presentan seroconversión, por tanto se considera que este virus no se puede transmitir entre conejos17.
El primer caso registrado de transmisión de SARS-CoV-2 , el virus causante de la COVID-19, de humanos a animales se produjo en Hong Kong, en un perro de raza Pomerania. También se ha documentado la transmisión a felinos salvajes y domésticos. Aunque los estudios basados en el RBD (receptor-binding domain) del coronavirus y encaminados a identificar especies animales susceptibles a la infección a partir de los humanos descartan a la rata, el ratón y el conejo como especies sensibles a este virus2, trabajos posteriores demuestran que los conejos sí que pueden adquirir la infección.
La infección es asintomática, pero los animales inoculados eliminan virus infeccioso hasta 7 días tras la inoculación, si bien la cantidad de virus que se elimina es insuficiente para causar la infección en otros conejos. Por este motivo es probable que la transmisión entre conejos sea menos eficiente que en otras especies, como el hámster o el hurón18.
Solamente se ha descrito un caso de posible transmisión de SARS-CoV-2 de animales a humanos en una granja de visones en Holanda2.
Estos estudios demuestran que el conejo no es una especie importante desde el punto de vista epidemiológico para la transmisión y mantenimiento de los coronavirus causantes de MERS y SARS en humanos, si bien existen otros coronavirus en las poblaciones de conejos domésticos y silvestres.
Bibliografía
- Zappulli, Valentina, Silvia Ferro, Federico Bonsembiante, Ginevra Brocca, Alessandro Calore, Laura Cavicchioli, Cinzia Centelleghe, et al. 2020. “Pathology of Coronavirus Infections: A Review of Lesions in Animals in the One-Health Perspective.” Animals 10 (12): 1–41. https://doi.org/10.3390/ani10122377.
- Salajegheh Tazerji, Sina, Phelipe Magalhães Duarte, Parastoo Rahimi, Fatemeh Shahabinejad, Santosh Dhakal, Yashpal Singh Malik, Awad A. Shehata, et al. 2020. “Transmission of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) to Animals: An Updated Review.” Journal of Translational Medicine 18 (1): 1–11. https://doi.org/10.1186/s12967-020-02534-2.
- Peeters, J. E., P. Pohl, and G. Charlier. 1984. “Infectious Agents Associated with Diarrhoea in Commercial Rabbits: A Field Study.” Annales de Recherches Veterinaires 15 (3): 335–40.
- Descôteaux, J. P., and G. Lussier. 1990. “Experimental Infection of Young Rabbits with a Rabbit Enteric Coronavirus.” Canadian Journal of Veterinary Research = Revue Canadienne de Recherche Vétérinaire 54 (4): 473–76.
- Lapierre, J., G. Marsolais, P. Pilon, and J. P. Descoteaux. 1980. “Preliminary Report on the Observation of a Coronavirus in the Intestine of the Laboratory Rabbit.” Canadian Journal of Microbiology 26 (10): 1204–8. https://doi.org/10.1139/m80-201.
- Eaton, P. 1984. “Preliminary Observations on Enteritis Associated with a Coronavirus-like Agent in Rabbits.” Laboratory Animals 18 (1): 71–74. https://doi.org/10.1258/002367784780864938.
- Kerr, Peter J., and Thomas M. Donnelly. 2013. “Viral Infections of Rabbits.” Veterinary Clinics of North America - Exotic Animal Practice 16 (2): 437–68. https://doi.org/10.1016/j.cvex.2013.02.002.
- Descôteaux, J. P., G. Lussier, L. Berthiaume, R. Alain, C. Seguin, and M. Trudel. 1985. “An Enteric Coronavirus of the Rabbit: Detection by Immunoelectron Microscopy and Identification of Structural Polypeptides.” Archives of Virology 84 (3–4): 241–50. https://doi.org/10.1007/BF01378976.
- Small, James D, Laure Aurelian, Robert A Squire, John D Strandberg, Edward C Melby, Thomas B Turner, and Burlina Newman. 1979. “Rabbit Cardiomyopathy Associated with a Wirus Antigenically Related to Human Coronavirus Strain 229E.” The American Journal of Pathology 95 (3): 709–29.
- Gudjonsson, H, B Newman, and T B Turner. 1970. “Demonstration of a Virus-like Agent Contaminating Material Containing the Stockholm Substrain of the Nichols Pathogenic Treponema Pallidum.” Brit. 7. Vener. Dis 46: 435. https://doi.org/10.1136/sti.46.6.435.
- Lau, Susanna K P, Patrick C Y Woo, Cyril C Y Yip, Rachel Y Y Fan, Yi Huang, Ming Wang, Rongtong Guo, et al. 2012. “Isolation and Characterization of a Novel Betacoronavirus Subgroup A Coronavirus, Rabbit Coronavirus HKU14, from Domestic Rabbits.” https://doi.org/10.1128/JVI.06927-11.
- Alexander, Lorraine K, Bruce W Keene, Boyd L Yount, Joachim Dieter Geratz, J David Small, Ralph S Baric, and S Baric. 1999. “ECG Changes After Rabbit Coronavirus Infection.” Journal of Electrocardiology. Vol. 32.
- Edwards, Suzanne, J David Small, Joachim Dieter Geratz, Lorraine K Alexander, and Ralph S Baric. 1992. “An Experimental Model for Myocarditis and Congestive Heart Failure after Rabbit Coronavirus Infection.”
- Fennestad, KL, and MR MacNaughton. 1983. “Pleural Effusion Disease in Rabbits. Properties of the Aetiologieal Agent.” Archives of Virology. Vol. 76.
- Fennestad, K L, B Mansa, N Christensen, S Larsen, and Sv-E Svehag. 1986. “Pathogenicity and Persistence of Pleural Effusion Disease Virus Isolates in Rabbits.” J. Gen. Virol. Vol. 67.
- Monchatre-Leroy, Elodie, Franck Boué, Jean Marc Boucher, Camille Renault, François Moutou, Meriadeg Ar Gouilh, and Gérald Umhang. 2017. “Identification of Alpha and Beta Coronavirus in Wildlife Species in France: Bats, Rodents, Rabbits, and Hedgehogs.” Viruses 9 (12). https://doi.org/10.3390/v9120364.
- Widagdo, W., Nisreen M.A. Okba, Mathilde Richard, Dennis De Meulder, Theo M. Bestebroer, Pascal Lexmond, Elmoubasher A.B.A. Farag, et al. 2019. “Lack of Middle East Respiratory Syndrome Coronavirus Transmission in Rabbits.” Viruses 11 (4): 1–13. https://doi.org/10.3390/v11040381.
- Mykytyn, Anna Z., Mart M. Lamers, Nisreen M.A. Okba, Tim I. Breugem, Debby Schipper, Petra B. van den Doel, Peter van Run, et al. 2021. “Susceptibility of Rabbits to SARS-CoV-2.” Emerging Microbes and Infections 10 (1): 1–7. https://doi.org/10.1080/22221751.2020.1868951.
 by Multimédica
by Multimédica