Rinitis linfoplasmocítica felina: reporte de un caso
Resumen breve
Se describe el caso clínico de un gato, doméstico europeo de pelo corto, de 11 años de edad, castrado, nacido en Italia y con residencia en el Perú en los últimos 6 meses. Se presenta con un proceso respiratorio superior, de 3 meses de duración, con fuerte congestión nasal. El diagnóstico final fue rinitis linfoplasmocítica, la cual fue tratada con éxito con meloxicam y doxiciclina, no encontrando respuesta clínica al uso de glucocorticoides.Índice de contenidos
Resumen
Se describe el caso clínico de un gato, doméstico europeo de pelo corto, de 11 años de edad, castrado, nacido en Italia y con residencia en el Perú en los últimos 6 meses. Se presenta con un proceso respiratorio superior, de 3 meses de duración, con fuerte congestión nasal. Fue tratado en otros centros veterinarios, con antibióticos y corticoides cada vez que se presentaba el problema; el cual mejoraba al principio para luego volver a manifestarse al poco tiempo. La secreción nasal era de color blanquecino cremoso, en ambas fosas nasales. Se realizó un perfil general de salud, encontrándose todos los valores dentro de los rangos referenciales para la especie. Bajo anestesia general, tomaron muestras para citología e histopatología. El diagnóstico final fue rinitis linfoplasmocítica, la cual fue tratada con éxito con meloxicam y doxiciclina, no encontrando respuesta clínica al uso de glucocorticoides. El paciente se recuperó y fue mantenido con dosis bajas de meloxicam.
Introducción
La enfermedad del tracto respiratorio superior (ETRS) es común en la clínica veterinaria de felinos. Suele ser una patología con alta morbilidad y baja mortalidad; siendo más prevalente en criaderos, refugios o albergues. Esto se debe a que, en estos ambientes hay alta población con hacinamiento, por lo tanto, alto índice de patógenos respiratorios, asociado a pobre inmunidad y bajo índice de vacunación. La ETRS puede tener causas infecciosas (virales, fúngicas, bacterianas), inflamatorias, traumáticas (accidentes, cuerpos extraños), congénitas (p. ej.: paladar hendido) o neoplásicas (malignas o pólipos benignos). Puede tener un curso agudo o crónico y en ocasiones también afecta las conjuntivas y cavidad oral. Ciertas enfermedades sistémicas como neumonía, hipertensión, reflujo esofágico, vasculitis o coagulopatías pueden producir signos clínicos de ETRS.
Causas infecciosas de ETRS
Causas virales
Se considera que el 80 % de casos de ETRS son causados por 2 virus: el herpesvirus felino-1 (HVF-1) y calicivirus felino (CVF), con la posibilidad de infección bacteriana secundaria. Estos virus tienen una distribución mundial. Ambos virus proveen una inmunidad pasiva vía calostro que puede durar hasta las 10 semanas. A pesar de que la vacunación ayuda a reducir su prevalencia, pueden generar mortalidad en gatitos menores de 10 semanas con pobre sistema inmunológico. Ambos virus se transmiten vía contacto directo entre gatos a través de secreción nasal, oral o conjuntival; siendo la madre la principal forma de contagio a los gatitos durante la lactancia. Durante el estornudo estas secreciones pueden dispersarse hasta un par de metros, por lo que se debe asegurar la separación y distancia entre los pacientes. Se debe tener mucho cuidado con la transmisión de dichas secreciones a través del material médico o ambientes hospitalarios no esterilizados apropiadamente. Al mismo tiempo, el personal debe lavarse bien las manos entre paciente y paciente. Ambos virus son sensibles a los desinfectantes comunes y jabones.
El HVF-1 puede entrar al cuerpo vía oral, nasal o conjuntival y se replica en las células epiteliales causando citólisis. Se produce inflamación con infiltración neutrofílica caracterizada por necrosis epitelial multifocal. Origina destrucción irreversible de los cornetes nasales que conlleva a infección bacteriana secundaria y finalmente una posible rinitis crónica (Figura 1).
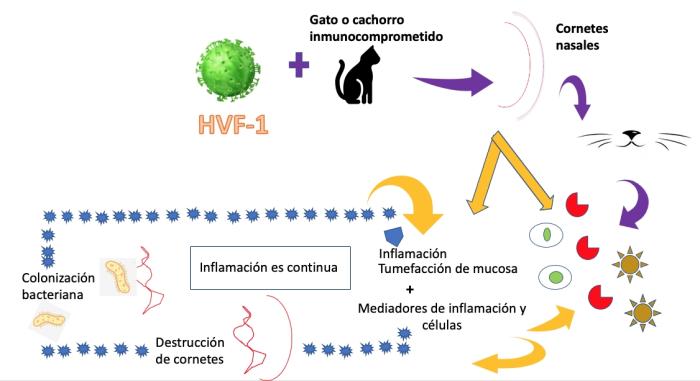
Figura 1. Proceso inflamatorio causado por HVF-1 Figura 1: Proceso inflamatorio causado por HVF-1 (Fuente: Sherk, M. Snots and snuffles, rational approach to chronic feline upper respiratory síndrome. Journal of Feline Medicine and Surgery, Vol. 12, 548 – 557. 2010.)
Además, el virus viaja a través del nervio al ganglio trigémino en donde permanece latente. La mayoría de gatos infectados se convierten en portadores, con reactivación de la infección ante cualquier evento estresante o el uso de corticosteroides. Los signos clínicos son causados por la rinitis (secreción nasal serosa, mucoide o sanguinolenta, asociada a estornudos y congestión). Además, se pueden encontrar signos oculares como quemosis, blefaritis, úlceras dendríticas, simblefarón, queratitis o uveítis (Figura 2). También podemos encontrar signos clínicos generales como fiebre, anorexia y depresión.
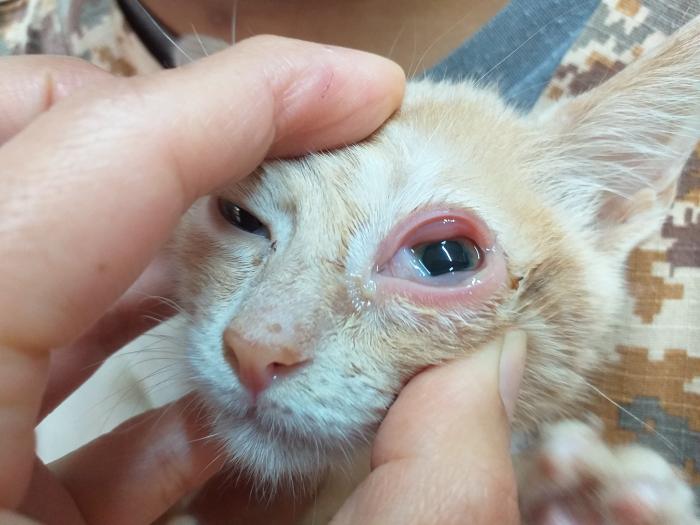
Figura 2. Gatito con conjuntivitis, quemosis, epifora y secreción nasal (color cremoso) compatible con infección por HVF-1.
El CVF infecta a los gatos vía nasal, oral o conjuntival a través de aerosoles de secreciones nasales o conjuntivales. Los signos clínicos incluyen fiebre, conjuntivitis, rinitis y estomatitis vesicular (que puede desarrollar a úlceras), con glositis, faucitis y palatitis (Figura 3).

Figura 3. Gato con úlcera en lengua (glositis) y leve secreción nasal con ulceración del filtrum nasal; compatible con infección por CVF.
Otros tejidos (pulmones, articulaciones), se pueden afectar, aunque en menor proporción. Una presentación poco usual del CVF es la enfermedad sistémica virulenta en donde el paciente padece una vasculitis generalizada; siendo generalmente fatal. La infección crónica por CVF genera un estado de portador, con eliminación continua del virus por periodos variables de tiempo, incluso de por vida.
El diagnóstico tanto del HVF-1 como del CVF se hace evaluando la sintomatología clínica; sin embargo, el diagnóstico definitivo se logra a través de pruebas de PCR (de secreciones conjuntivales o faríngeas principalmente). El tratamiento suele ser sintomático y de soporte. El uso de antipiréticos y antinflamatorios son fundamentales para el mantenimiento del paciente. Se requiere el uso de antibióticos de amplio espectro (generalmente doxicilina, azitromicina, marbofloxacino, amoxicilina, amoxicilina con ácido clavulánico) para controlar las infecciones bacterianas secundarias y el uso de gotas oftálmicas para controlar los signos oculares. La mayoría de antivirales no son de utilidad contra estos virus, siendo el famciclovir el único con resultados positivos, siendo utilizado para el tratamiento del HVF-1. El interferón omega felino puede ser usado como inmunomodulador, sin embargo, su real efectivad aún está en estudio.
En caso de daño crónico de la mucosa nasal, ocasionado por HVF-1, se requiere terapia de mantenimiento con antiinflamatorios. Los AINEs (antinflamatorios no esteroideos) como el meloxicam o piroxicam, han demostrado tener buenos resultados en algunos pacientes. Por otro lado, otros requieren el uso de glucocorticoides (prednisolona, dexametasona) para reducir los signos de inflamación. El uso de antibióticos a largo plazo es controversial, pues las bacterias pueden cambiar con el tiempo, pudiendo al mismo tiempo generarse resistencia antibiótica. Pocos pacientes responden al uso de antihistamínicos. Además, se puede requerir de nebulizaciones o vaporizaciones, suero intranasal o mucolíticos que ayudan a fluidificar la secreción nasal.
Causas micóticas
Las rinitis fúngicas en los gatos son causadas principalmente por especies de Cryptococcus, Aspergillus y Penicllium. Cryptococcus neoformans tiene una distribución mundial y se encuentra principalmente en heces de palomas. Cryptococcus gattii tiene una distribución limitada y se encuentra en material vegetal (eucalipto). El contagio es a través de la inhalación de las esporas, siendo la cavidad nasal el principal sitio de infección; sin embargo, también puede afectar la piel, ganglios linfáticos, cerebro y ojos. Los signos clínicos asociados a la cavidad nasal son estornudos, descarga mucopurulenta uni o bilateral, epistaxis y en algunos casos presencia de protuberancias que emanan de las narinas. El daño en los senos nasales produce inflamación severa, resultando en deformación facial y ulceración dérmica (Figura 4).
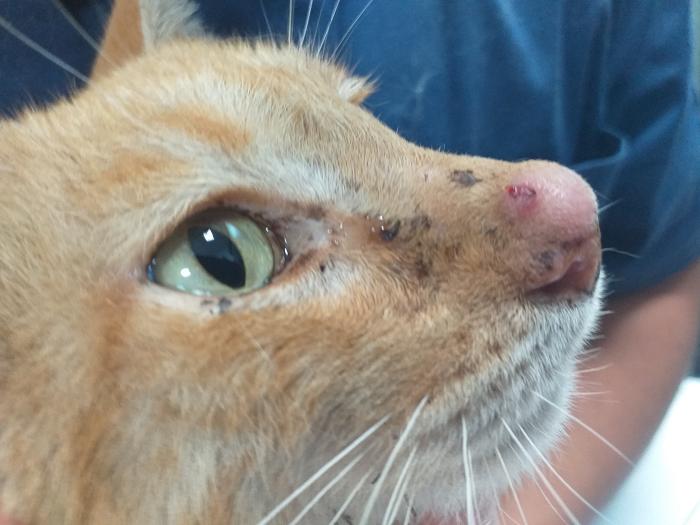
Figura 4. Paciente positivo a criptococosis, se observa la característica deformación nasal conocida como nariz de payaso.
En casos en los que llega al sistema nervioso se pueden evidenciar cambios en comportamiento, ataxia, paresia y convulsiones. En caso de compromiso dérmico se observan lesiones ulcerantes y en ciertas ocasiones se puede producir una enfermedad sistémica afectando diversos órganos (pulmones, vejiga p, ej.). El diagnóstico se realiza mediante citología de las lesiones, serología (detección del antígeno), histopatología y cultivo fúngico.
La aspergilosis es una entidad menos común, ubicua del medio ambiente (considerada oportunista), sin embargo, puede producir un cuadro bastante agresivo localizado en la cavidad nasal y seno orbital. Los signos clínicos incluyen descarga nasal, estornudos y masas que protruyen por las narinas; puede invadir el tejido orbital ocasionando descarga ocular, exoftalmos, protrusión del tercer párpado, conjuntivitis y keratitis. El hueso palatino puede verse comprometido, presentándose una úlcera del paladar duro con distorsión facial. El diagnóstico se realiza mediante citología e histopatología, pudiéndose realizar PCR, cultivo fúngico y serología.
Los antifúngicos orales son el tratamiento de elección para estas patologías. Para criptococosis se puede utilizar anfotericina B, ketoconazol, 5 flucitosina, itraconazol y fluconazol (siendo estos dos últimos los más empleados). Para aspergilosis itraconazol y voriconazol son los más recomendados.
Causas parasitarias
Las infecciones nasales parasitarias son raras. Cuterebra es considerado el agente más común. El diagnóstico se realiza visualizando el parásito en el exudado nasal o identificando los huevos en las heces del gato infectado. La miasis nasal causada por Oestrus ovis también ha sido reportada.
Causas bacterianas
La mayoría de casos de ETRS están complicados con infección bacteriana secundaria a infecciones virales, deformaciones anatómicas, traumatismos o neoplasias (benignas o malignas). Los cultivos y sensibilidad antimicrobiana son parte de la evaluación de un paciente con rinitis crónica, sin embargo, las zonas nasal y orofaríngea tienen una población bacteriana normal, en altas cantidades. Debido a esto, la mayor parte de cultivos salen positivos y no siempre indican el patógeno primario. Estas pruebas deben ser interpretadas con cautela y se considera que su utilidad es baja en la clínica diaria. Las principales especies halladas en los cultivos de secreción nasal son: Pasteurella, Moraxella, Simonsiella, Enterobacter, Clostridium, Streptococcus, Staphylococcus, Corynebacterium, Haemophilus, Bacillus, Flavobacterium y Mycobacterium, así como Escherichia coli. Existen algunas especies de bacterias que pueden ser patógenos primarios en las ETRS. Estas son: Bordetella bronchiseptica, Chlamydophila felis y Mycoplasma sp.
Bordetella bronchiseptica es la causante de la llamada tos de perrera en los caninos. La transmisión entre especies es posible, encontrándose la bacteria en secreciones nasales y orales. La bacteria se adhiere a los cilios del tejido respiratorio, causando inflamación, ciliostasis y su destrucción. Los signos clínicos incluyen tos, fiebre, linfoadenopatía submandibular, estornudos y secreción ocular. El cultivo bacteriano y el PCR son los métodos diagnósticos de elección y el para el tratamiento se usa doxiciclina. Existe una vacuna intranasal que es considerada no esencial en gatos.
La Chlamydophila felis tiene una distribución mundial, y es un patógeno ocular responsable de un porcentaje alto de cuadros de conjuntivitis en gatos. La transmisión ocurre por contacto directo con las secreciones oculares o vía fómites. Los signos clínicos incluyen conjuntivitis, quemosis, blefaroespasmo, secreción ocular y nasal, rinitis, estornudos, fiebre, entre otros, El diagnóstico final se realiza mediante PCR, aislamiento bacteriano y serología. El uso de doxiciclina por periodos prolongados (4 a 6 semanas) se usa para prevenir la eliminación y recrudescencia. Otras opciones son fluoroquinolonas, amoxicilina con ácido clavulánico y azitromicina; sin embargo, estos pueden no eliminar la infección. Debido a que la enfermedad no es considerada como muy grave, la vacuna se considera no esencial en gatos.
Ciertas especies de Mycoplasma, especialmente M. felis, son responsables de cuadros de ETRS, siendo una de las bacterias más comúnmente halladas, aunque es considerada un comensal normal de las membranas mucosas. La coinfección con Chlamydophila felis es posible. Su presencia es común en los cuadros agudos de ETRS, causando signos oculares, pero su presencia en los cuadros crónicos puede ser importante para aumentar la morbilidad. El PCR es el método de diagnóstico y para el tratamiento se prefieren doxiciclina o azitromicina.
Causas traumáticas de ETRS
Los traumatismos, como heridas penetrantes o fracturas de la cavidad nasal, pueden ser uni o bilaterales y ser causa común de epistaxis. La corrección quirúrgica de las fracturas nasales no siempre es necesaria. Sin embargo, sí lo es la extracción de pequeños fragmentos de hueso sueltos, debido a que la formación de un secuestro óseo puede llevar a daño crónico, dañando el pasaje nasal.
Los cuerpos extraños en la cavidad pueden causar estornudos, congestión, manoteo de la cara, intento para deglutir, tos y vómito. Los cuerpos extraños más comúnmente hallados son hojas de gras, semillas, agujas, piedras y arena sanitaria.
Causas neoplásicas de ETRS
Pólipos benignos
Los pólipos nasofaríngeos son masas benignas, compuestas de células inflamatorias y tejido conectivo fibrovascular, cubiertas por epitelio respiratorio estratificado, escamoso y ciliado. Generalmente se originan en la bulla timpánica y a través del conducto de Eustaquio entran a la nasofaringe. También pueden localizarse en el oído medio y extenderse al canal auditivo. Se diagnostican mayormente en gatos jóvenes por lo que se ha propuesto una posible causa congénita, sin embargo, eso no está del todo establecido. Se considera que crecen como resultado de un proceso inflamatorio crónico, no habiéndoseles relacionado a ningún agente infeccioso. Su presencia origina descarga nasal, estornudos, tos, disnea y respiración ruidosa. Puede presentarse síndrome de Horner, enfermedad vestibular, otitis externa y descarga ocular. El diagnóstico se realiza visualizándolo en la nasofaringe (retrayendo el paladar blando en el paciente anestesiado, (Figura 5)). Se extraen mediante remoción manual con tracción o cirugía (oral u osteotomía de la bulla). Algunos pólipos pueden reaparecer.
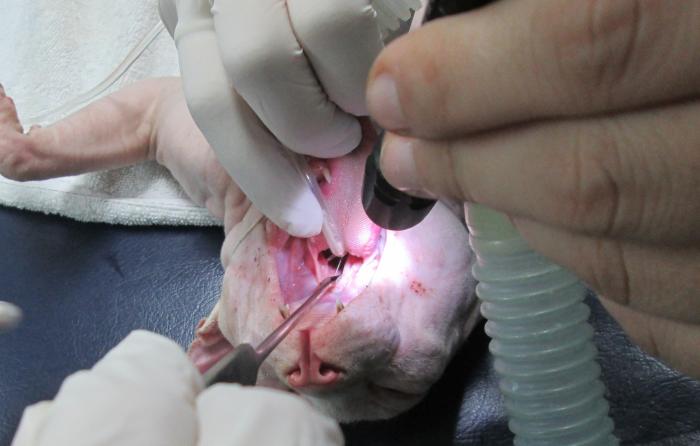
Figura 5. Retracción del paladar blando con un gancho para ovario histerectomía, permitiendo la observación de la nasofaringe. El paciente esta anestesiado e intubado.
Otro tipo de pólipo diagnosticado en gatos, es el inflamatorio de los cornetes nasales. Son un poco raros y también más comunes en animales jóvenes. Histológicamente son similares a los hamartomas humanos. Los signos clínicos son similares a los de los pólipos nasofaríngeos. Se diagnostican con la visualización de los mismos y la extracción es por medio de tracción (Figura 6 (A, B)).
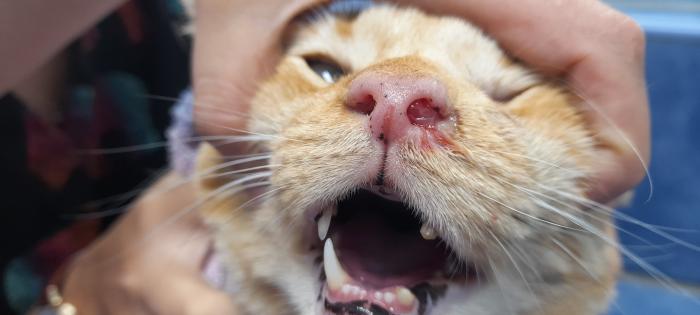
Figura 6 (A, B). (A) Paciente con secreción hemorrágica unilateral, evidenciándose la presencia de un pólipo en el cornete nasal. (B) Paciente anestesiado en donde se está realización la extracción del pólipo nasal por medio de tracción del mismo.
Neoplasias malignas
Las neoplasias malignas son causa común de ETRS. Los linfomas, carcinomas de células escamosas (CCE) y el adenocarcinoma son las más comunes. Estas alteran la función y forma, llevando a deformación facial, epistaxis y signos de ETRS (Figura 7).
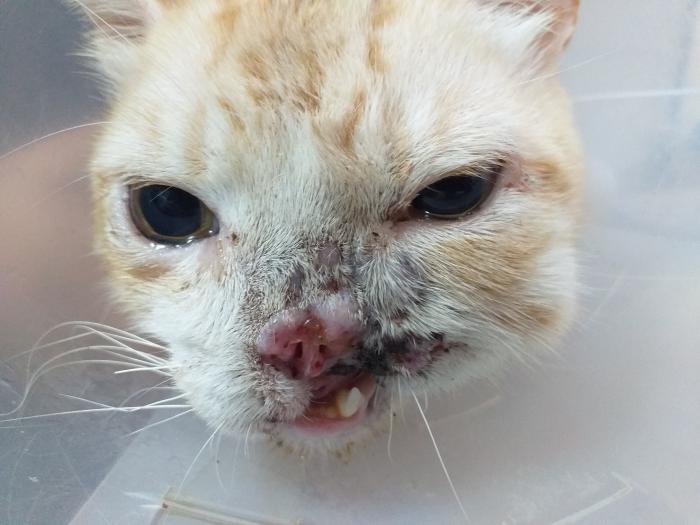
Figura 7. Paciente con CCE, se observa la deformación facial y pérdida de tejido nasal.
Generalmente son localmente invasivas (senos frontales y paranasales) y puede extenderse a través de la membrana cribiforme causando signos oculares y neurológicos. Imágenes de la cabeza como tomografías computadas (CT) y rayos X, así como la rinoscopia y endoscopia permiten la visualización del área. La destrucción ósea es sugestiva del diagnóstico. El diagnóstico final se realiza mediante biopsia e histopatología. Según el diagnóstico se elegirá el tratamiento correspondiente (cirugía, quimioterapia, radioterapia, etc.) (Figura 8).

Figura 8. Paciente que fue sometido a electro quimio cirugía para el tratamiento de CCE. Se observa una cicatrización total del tejido, habiéndose recuperado en su totalidad de la neoplasia.
Rinosinusitis crónica (RSC)
Muchos de los gatos que se recuperan de ETRS viral o bacteriana aguda, pueden desarrollar una RSC crónica. Esta desarrolla cuando los microorganismos destruyen la estructura y función inmunológica de la mucosa. Estos gatos pueden presentar descarga oculonasal mucopurulenta (uni o bilateral), estornudos y respiración ruidosa. El desarrollo de rinitis eosinofílica o linfoplasmocítica (RLP) son causa importante de rinitis crónica. La etiología de estos dos procesos inflamatorios no está del todo clara, pero se sospecha una reacción alérgica e inmunomediada. El diagnóstico de RSC es de exclusión, una vez que se descartan otras patologías.
Las radiografías nasales revelan la presencia de fluido en la cavidad nasal, con un vómer intacto. Se necesita citología e histopatología ya que el diagnóstico final es con biopsia nasal. Para el tratamiento de la RLP y eosinofílica se utilizan drogas antiinflamatorias. Los glucocorticoides inhalados (fluticasona o beclometasona), topicales (fluticasona) u orales son de utilidad. El uso de prednisolona oral puede requerir altas dosis al inicio, que deben ser reducidas gradualmente. La inflamación nasal también puede ser controlada con AINEs como piroxicam o meloxicam. Los casos resistentes pueden responder al uso de inmunosupresores como ciclosporina o clorambucilo. Algunos gatos pueden beneficiarse de los antihistamínicos. Los antibióticos de amplio espectro se usan para controlar las infecciones bacterianas secundarias y las vaporizaciones o nebulizaciones contribuyen al bienestar de algunos pacientes.
Causas extranasales de ETRS
La enfermedad dental y el paladar hendido son las causas extranasales más comunes de ETRS. El paladar hendido puede ser congénito o adquirido después de un trauma (fractura del paladar duro (Figura 9)). La comida, especialmente los líquidos, pueden ingresar a la cavidad nasal ocasionando inflamación local. La visualización de la lesión es diagnóstica. El pronóstico depende de la localización, extensión de la lesión, edad y estado general del paciente. La fractura de paladar puede cicatrizar por segunda intención, pero el paladar hendido congénito o los adquiridos con extensión muy amplia pueden requerir cirugía.
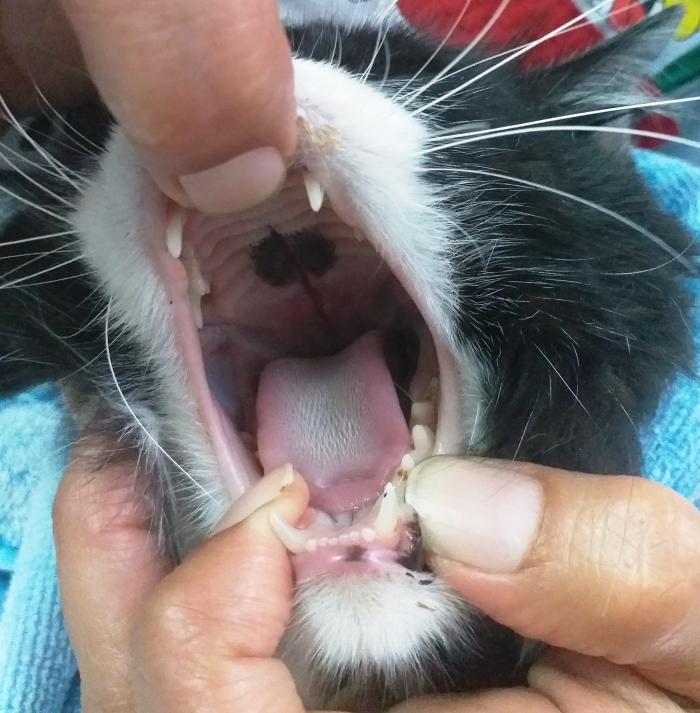
Figura 9. Paciente que sufrió un trauma y presenta fractura de paladar duro.
Los abscesos periodontales, que progresan a una fístula oronasal generan descarga nasal por el lado ipsilateral. Siempre es necesaria una buena evaluación de la cavidad oral en todo paciente con ETRS. Es necesario tomar radiografías de buena calidad para identificar posibles lesiones resortivas odontoclásticas y abscesos. Los dientes afectados deben ser retirados.
Aproximación general al paciente con ETRS
La aproximación implica primero verificar los signos de ETRS para así poder tener un plan de evaluación clínica y análisis eficiente. El examen clínico debe incluir:
- Evaluación de los ojos, en busca de conjuntivitis, quemosis, blefaroespasmo, etc. Se deben realizar test de Schirmer y fluoresceína (para evaluar úlceras y la patencia del conducto lacrimal). En caso de que cualquiera de los anteriores esté presente, se puede considerar enfermedades infecciosas principalmente. En el caso de exoftalmia y dolor descartar neoplasia y enfermedades fúngicas.
- Evaluación ótica completa, observando la integridad del tímpano, para descartar un pólipo.
- Examen de la cavidad oral. Evaluación de todas las piezas dentales (descartando fracturas, abscesos, fístulas oronasales), lengua (descartando úlceras por CVF u otra anormalidad), observación de ambos paladares y gingivas.
- Evaluación del pasaje nasal, se utiliza un espejo (compacto o dental) o una lámina portaobjeto retirados del congelador (donde se observaría el calor emitido en cada respiración). También se puede usar una hebra de algodón que debería moverse en cada respiración. Adicionalmente podemos acercar nuestro oído a cada narina y escucharlas.
- Evaluación de la descarga nasal. Determinar el tipo (serosa, mucosa, purulenta, hemorrágica) podrían ayudar a determinar la causa. Si es unilateral se tiene mayores probabilidades de que sea neoplásica, mientras que si es bilateral hay mayores probabilidades de ETRS infeccioso o RSC.
- Observar la cara por posible deformación, de ser el caso considerar neoplasia o ETRS fúngica.
- Escuchar los patrones respiratorios. La enfermedad nasofaríngea generalmente causa disnea inspiratoria con un patrón obstructivo, teniéndose una fase inspiratoria prolongada. Si el paciente respira con la boca abierta, se debe considerar una patología severa.
- Evaluar la posibilidad de un trauma (dientes y/o huesos fracturados, descarga hemorrágica nasal, ocular u ótica).
- Evaluación general e integral de paciente para descartar la posibilidad de una enfermedad sistémica que se manifieste con signos de ETRS como, por ejemplo, hipertensión y coagulopatías que podrían generar epistaxis.
Una vez establecido que el cuadro es de una ETRS, se inicia la investigación con análisis de laboratorio. Un hemograma completo, panel bioquímico con electrolitos, uroanálisis, descarte retroviral y en pacientes mayores de 7 años (o menores si lo ameritan) medición de la presión arterial y hormona tiroidea, están indicados para descartar alguna patología sistémica y evaluar el riesgo anestésico; pues posteriormente se pueden requerir análisis que requieren anestesia general. En caso la evaluación clínica lo justifique se pueden solicitar ecografía abdominal y/o ecocardiografía. La presencia de eosinofilia podría indicar rinitis alérgica o parasitaria. En caso el paciente sea positivo al virus de leucemia felina, considerar la asociación con linfoma nasal y en caso de gatos positivos a cualquiera de los dos retrovirus considerar posible inmunosupresión.
En caso estén disponibles se deben realizar pruebas serológicas para criptococosis y aspergilosis (siendo esta última no confirmatoria de la infección, pues pacientes sanos pueden tener anticuerpos). La prueba PCR para patógenos infecciosos se puede solicitar, pero se debe considerar que gatos sin enfermedad clínica pueden ser portadores a algunos microorganismos y dar positivos a la prueba; por otro lado, la presencia de alguno de estos patógenos no confirma que sea el responsable directo de la ETRS.
A pesar que las radiografías torácicas suelen ser normales en pacientes con ETRS, se recomiendan para descartar posible metástasis y compromiso respiratorio inferior. Las radiografías de cráneo son necesarias para evaluar posible trauma nasal, opacidad (fluido) en los senos nasales y frontales, otitis media (lesión en bullas timpánicas), periodontitis, pólipos nasofaríngeos y neoplasias. Para estas radiografías se necesita anestesia general para poder posicionar correctamente al paciente. Las proyecciones laterales (ambos lados) y ventrodorsal son las básicas. Posteriormente, según el área de interés se pueden necesitar otras vistas como p. ej.: intraoral ventrodorsal de los senos nasales (permite mejor visualización de los cornetes nasales, vómer y opacidad de los senos (Figura 10); oblicua lateral, intraoral con proyección del rayo en el paladar blando (permite evaluación de bullas), etc. De ser el caso, también se deben tomar radiografías dentales.
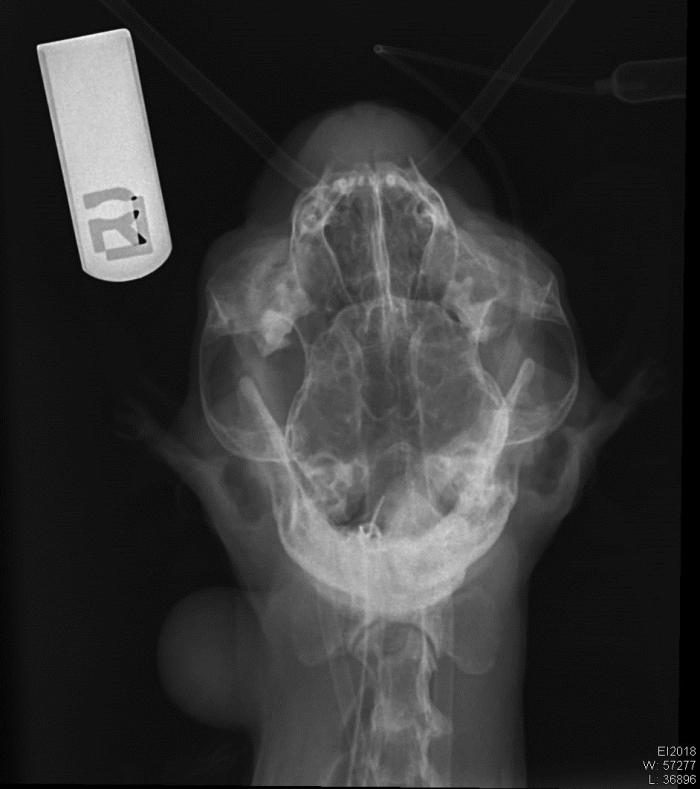
Figura 10. Radiografía VD boca abierta, incidiendo el rayo en la zona del paladar para visualizar los senos nasales y estructuras óseas. En este caso se observa el vómer intacto con radioopacidad en ambos senos nasales (posible fluido o secreción).
Otras técnicas de imágenes, son la CT y resonancia magnética (MRI). La CT permite mejor visualización de los senos, bullas timpánicas, lisis ósea y del cerebro por lo que es la técnica de elección. Sin embargo, estas pueden no estar disponibles en todas las localidades o pueden tener un costo alto.
Con el paciente ya anestesiado, se debe tener un orden para realizar los procedimientos. Se inicia con las radiografías de cráneo y/o CT o MRI; para luego pasar el examen de la orofaringe retrayendo el paladar con un gancho de ovario histerectomía, ayudándonos con un espejo dental (descartar masas, pólipos, material extraño). Se realiza la evaluación dental completa. El siguiente paso es realizar lavados de los senos nasales para la colecta de muestras para cultivo bacteriano y fúngico (no olvidar que los cultivos bacterianos pueden no ser de gran utilidad). Para realizarlos debemos asegurar que el suero no ingrese a la tráquea (usando traqueotubos con maguito inflado y poniendo compresas estériles en la zona orofaríngea). Una sonda ingresa por la cavidad nasal, se introducen de 5 a 15 ml de suero (solución salina), que es recuperado para su procesamiento. De esta misma muestra se pueden hacer citologías. La citología también se puede realizar de hisopados o raspados de mucosa nasal.
Si todo lo anterior no nos llevó al diagnóstico se considera una nasofaringoscopía (anterior y posterior). Idealmente se debe usar un rinoscopio flexible que gire 160 a 180° con un diámetro de 1 a 2 mm; también se puede usar uno rígido para la rinoscopia anterior. Esta técnica permite detectar y/o remover cuerpos extraños, masas, placas fúngicas, inflamación o destrucción del tejido. Al mismo tiempo permite tomar muestras para cultivos, citologías e histopatologías. Las biopsias deben ser tomadas aun así se vea la mucosa normal. Se debe recalcar que la rinoscopia se realiza después de tomar las radiografías para evitar que el posible sangrado altere la imagen radiográfica.
Una vez establecido el diagnóstico, se inicia el tratamiento. En algunos casos la patología puede no tener cura definitiva y se requiere mantenimiento y colaboración y comprensión por parte del tutor del gato. En todos los casos debemos asegurar la hidratación y alimentación del paciente.
Caso clínico
Un gato macho castrado, europeo pelo corto, de 11 años de edad, se presentó con signos de ETRS de 3 meses de duración. El gato fue importado a Lima, Perú, desde Europa (Italia) 6 meses antes de la consulta. El tutor reportó que el problema inició con un fuerte ronquido al respirar. El paciente había sido evaluado y tratado previamente por un médico veterinario que prescribió clindamicina y dexametasona (no pudiéndose precisar las dosis) por 7 días, mostrando mejoría. Un mes después el cuadro reaparece por lo que buscaron la opinión de un segundo médico veterinario quien recetó enrofloxacino y dexametasona (no pudiendo precisar las dosis), sin mejoría. No se había realizado ningún análisis de laboratorio.
El paciente había recibido la vacunación contra HVF-1, CVF, panleucopenia felina, leucemia viral felina y rabia 8 meses atrás. Tenía un descarte de retrovirus felinos realizado en Europa un año atrás; no había sido desparasitado en los últimos 8 meses. El tutor reportó buen apetito y ánimo, uso normal de la caja de arena con eliminación de heces (de buena consistencia) y orina diariamente. El paciente convivía con otro gato que se encontraba saludable en el momento y ambos gatos vivían en interiores exclusivamente.
Al momento de la presentación se evidenció secreción nasal mucoide, de color cremoso, bilateral, siendo más abundante en el lado derecho (Figura 11).
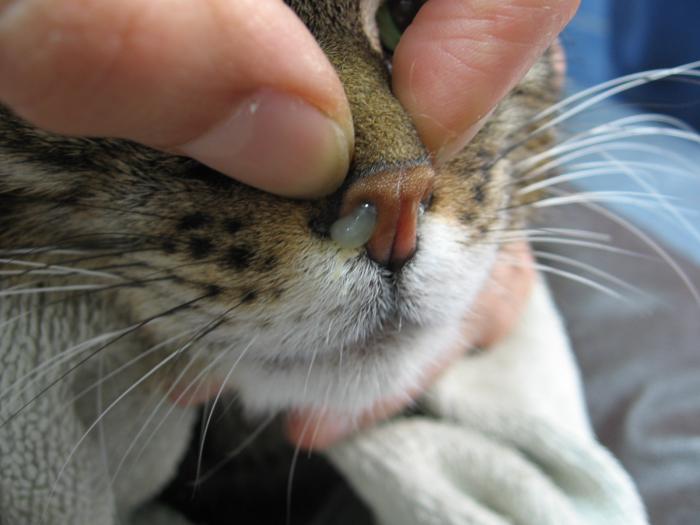
Figura 11. Paciente con secreción nasal color crema, bilateral.
El paciente también tenía disnea inspiratoria y fuerte congestión nasal; se utilizó una hebra de algodón para evaluar el pasaje de aire y no se observó movimiento alguno en el lado derecho (indicando obstrucción) y muy leve movimiento en el izquierdo (indicando obstrucción parcial). La frecuencia cardiaca y temperatura corporal estaban normales. La frecuencia respiratoria, se encontró levemente alta: 36 por minuto (normal 20 – 30). El gato pesaba 4.100 kg, tenía condición corporal 5/9 y buen índice de masa muscular. Las membranas mucosas se observaron rosadas y húmedas, con un retorno venoso capilar menos a 2 segundos. El grado de hidratación era normal. A la auscultación torácica se escucharon sonidos cardiacos y respiratorios normales, así mismo no se encontró ninguna molestia a la palpación abdominal. La evaluación de la cavidad oral evidenció muy leve placa dental y ligera inflamación de la tonsila derecha.
Se realizó un hemograma completo, bioquímica sanguínea (ALT, fosfatasa alcalina, GGT, bilirrubina total, BUN, creatinina, glucosa, proteínas totales, albúmina, globulina), electrolitos (P, Na, K, Cl), uroanálisis y medición de T4 total, encontrándose todos los valores dentro de los rangos referenciales. A pesar de la recomendación, el tutor no aceptó repetir el descarte de retrovirus. Se tomaron radiografías laterolateral derecha (LLD) y dorsoventral (DV) de tórax, en donde se evidenció un leve patrón bronquial en la parte media del lóbulo diafragmático y apical, sin ninguna otra anormalidad. Se recomendó realizar un panel respiratorio PCR, pero fue rechazado.
Debido a la cronicidad del caso y la falta de respuesta completa a los tratamientos previos se recomendó anestesiar al paciente para radiografías de cabeza, observación de la zona orofaríngea y rinoscopía. El tutor solicitó tomar las radiografías de cabeza sin anestesia ese mismo día (siendo advertido de la posibilidad de que no se pudiera tener buena visualización). Se accedió y se tomaron radiografías LLD y DV de cráneo. En la LLD no se observó nada relevante, sin embargo, en la DV el seno nasal derecho presentaba radio opacidad al compararlo con el izquierdo; este último no pudo ser evaluado en su integridad pues la mandíbula obstruyó su visualización. El vómer y las estructuras óseas estaban intactas (Figura 12).
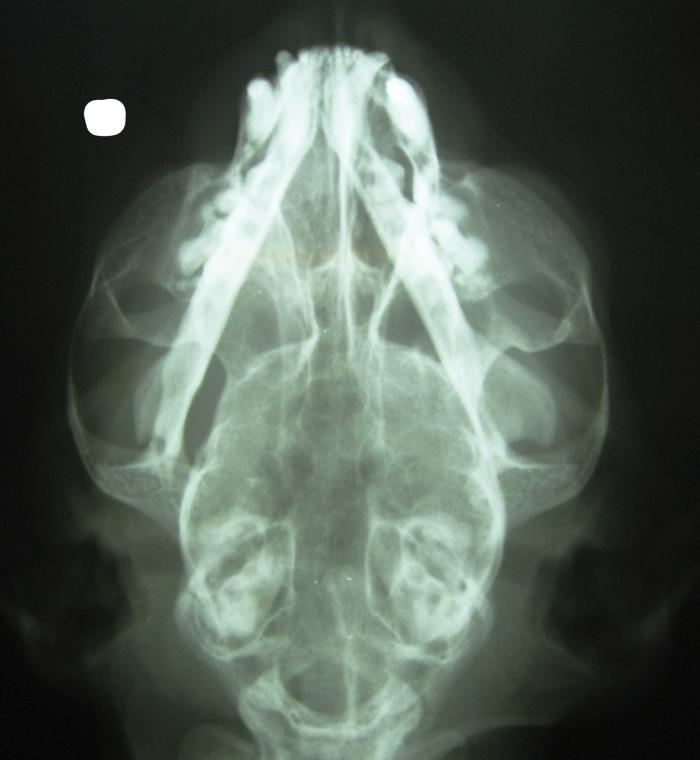
Figura 12. Radiografía DV de cabeza, en donde se observa radiopacidad en el seno nasal derecho, integridad del vómer e interferencia del hueso mandibular en la evaluación del seno nasal izquierdo.
Al momento no se podía precisar ningún diagnóstico por lo que, el paciente fue programado para anestesia en 48 horas. Se recomendó realizar una MRI, la que fue rechazada por el tutor.
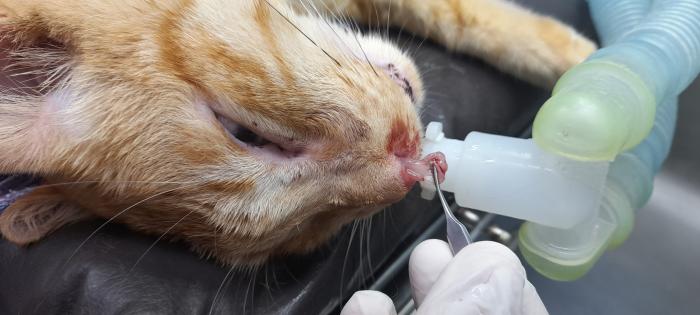
Dos días después el gato ingresó y se midió la presión arterial encontrándose normal: 138 mmHg (normal: <150). Se inyectó butorfanol (0.01 mg/kg/intramuscular), Midazolam (0.1 mg/kg/intramuscular) y se colocó lactato de Ringer, vía endovenosa (EV) en dosis de mantenimiento (3 ml/kg/hora). Se induce con ketamina, 5 mg/kg EV, y el gato fue intubado con un tubo endotraqueal con manguito. Se anestesia con isoflurano (iniciando con 4 l/min, reduciendo a 2 l/min para mantenimiento). Se retrae el paladar blando para visualización de la zona orofaríngea y se realiza examen oral y dental completo, no encontrándose ninguna anormalidad. Se toman muestras de la secreción nasal para citología rápida, realizada durante el proceso de anestesia, siendo negativa a microorganismos. No se realizan lavados para obtener muestras para cultivo bacteriano y micótico, debido a que el propietario solicitó hacer sólo lo indispensable. Un endoscopista realiza la rinoscopía anterior y posterior. Se observó edema de la mucosa y abundante moco; se tomaron muestras con cepillo para citología y biopsias de la mucosa nasal. El paciente se recuperó sin eventualidades y fue enviado a casa con una prescripción de prednisolona 1.2 mg/kg vía oral, una vez al día.
El resultado de la citología de la secreción nasal no aportó nada al diagnóstico, sólo se observaron algunos leucocitos, principalmente neutrófilos. La citología de los cornetes nasales mostró células linfocíticas con modera anisocitosis y anisocariosis y pequeña cantidad de plasmocitos (Figura 13).
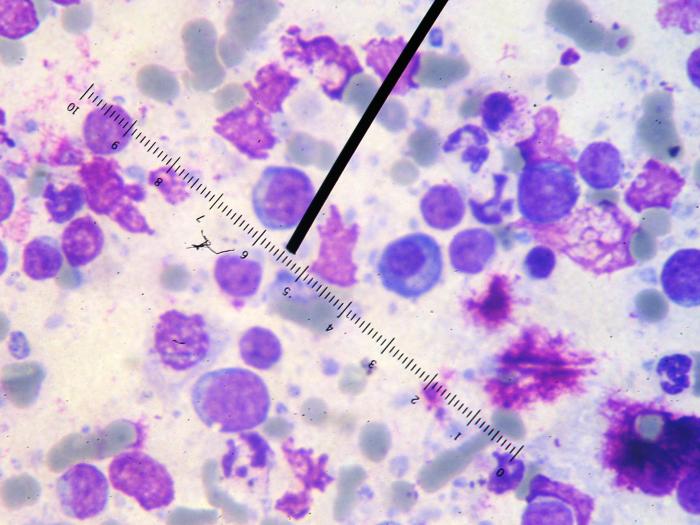
Figura 13. Citología de la mucosa nasal en donde se observan células linfocíticas con moderada anisocitosis y anisocariosis y pequeña cantidad de plasmocitos.
Esto fue corroborado con el resultado histopatológico que describía sinusitis no supurativa con infiltrado de linfocitos y plasmocitos. El diagnóstico final fue de rinitis linfoplasmocítica (RLP). El propietario reportó mejoría por lo que se indicó continue con el tratamiento prescrito previamente.
Doce días después de haber realizado la rinoscopia, el gato fue evaluado encontrándose clínicamente bien, con todas las constantes fisiológicas dentro de lo normal, sin secreción nasal; adicionalmente el tutor reportó buena actitud en casa. El peso era 4.200 kg. Se continúo con la medicación con la intención de empezar a reducir la prednisolona gradualmente al cumplirse un mes de tratamiento. Sin embargo, 10 días después el gato fue ingresado con decaimiento, anorexia parcial y secreción nasal del lado derecho (de las mismas características que antes de la rinoscopia). Las constantes fisiológicas estaban normales, no había signos evidentes de deshidratación y el llenado capilar era menor a 2 segundos. El peso era 3.950 kg. Se realizó un hemograma completo, bioquímica con electrolitos y uroanálisis, encontrándose todos los valores dentro de los límites normales. Se realizó el descarte de ambos retrovirus siendo negativo. Se decide cambiar a dexametasona 0.5 mg/kg vía oral una vez por día, además de omeprazol 0.7 mg/kg vía oral cada 12 horas y mirtazapina 1.88 mg vía oral cada 48 horas. Tres días después no mostraba secreción nasal y estaba comiendo con normalidad, por lo que se bajó las dosis a 0.3 mg/kg diario por 5 días, luego cada 48 horas.
Veinte días después el paciente mostró signos respiratorios otra vez. Estaba con buena actitud y apetito en casa; pero una leve cantidad de secreción empezó a aparecer por el lado derecho. A la evaluación clínica las constantes fisiológicas estaban normales, el peso era de 4.45 kg. Se observó secreción mucosa color crema por el orificio nasal derecho. Se cambió la medicación a doxiciclina 10 mg/kg una vez por día, vía oral, por 21 días y meloxicam vía oral a una dosis inicial de 0.1 mg/kg por 3 días y luego 0.05 mg/kg cada 48 horas, junto con omeprazol 0.7 mg/kg cada 12 horas. La mejoría del gato fue rápida y continua, Las revaluaciones a los 15, 30, 60, 120 y 180 días fueron normales. Después de esta última evaluación el tutor se mudó de ciudad junto con sus gatos. Tres meses después de la mudanza, el tutor se comunicó indicando que había retirado la medicación 45 días atrás y el gato se encontraba normal sin ningún signo clínico.
Discusión
Este caso representa la presentación típica de un gato con ERTS con secreción nasal, en el que fue necesario realizar diferentes análisis para llegar al diagnóstico final. El paciente había sido tratado previamente con antibióticos y corticosteroides, generalmente prescritos como primera opción, mostrando resultados discrepantes al inicio. Sin embargo, ya que el cuadro mostraba recidivas, fue necesario explicarle al tutor todas las posibles causas de ETRS y RSC para que acceda a toda la batería de análisis que fueron realizados.
El paciente era un gato sénior que acababa de pasar por un evento estresante (mudarse de un continente a otro, con un vuelo largo, llegando a una ciudad con un clima y ambiente totalmente diferentes). Se consideró que este factor, o los tratamientos previos con corticosteroides, pudieron reactivar una posible infección viral previa. En caso el HVF-1 estuviese presente pudo dañar la mucosa, generando un proceso destructivo crónico, permitiendo la colonización bacteriana secundaria. Debido a esto se recomendó realizar PCR en busca de los patógenos respiratorios superiores, sin embargo, esto no fue aceptado por el tutor. Hay que considerar que el HVF-1 puede estar presente, también en animales clínicamente sanos, por lo que en caso hubiera salido positivo, tampoco se tendría la confirmación de que este fuese la causa primaria; o si estuviese contribuyendo de manera secundaria al cuadro clínico.
La descarga mucopurulenta presente en el paciente, llevó a pensar en una larga lista de diferenciales. Además de infección viral estos incluían: infección bacteriana (raramente primaria) e infección fúngica (poco probable siendo un gato de interior; criptococosis y aspergilosis no son muy prevalentes en la ciudad de Lima, sin embargo, se desconocía la prevalencia de esos patógenos en la zona donde vivía en Europa, por lo que no se descartaron). Los procesos no infecciosos incluían neoplasia, siendo una alta probabilidad en pacientes mayores y enfermedad dental (poco probable pues generalmente es unilateral y a la exploración no se vieron anormalidades orales). Los cuerpos extraños y trauma suelen producir epistaxis, que no era el caso. Un desorden congénito no estaba en lo alto de la lista de diferenciales, pues la edad de aparición de estos suele ser al inicio de la vida del paciente. Se descartó enfermedades sistémicas debido al buen estado general del paciente y a la ausencia de hallazgos anormales en los análisis y medición de presión arterial. Las coagulopatías y vasculitis generalmente producen secreción hemorrágica, por lo que también fueron descartadas.
En práctica privada se deben recomendar todos los análisis y técnicas diagnósticas posibles; lamentablemente en muchos casos nos vemos limitados a sólo poder realizar los que el tutor quiere y/o puede. Por motivos económicos, en este caso la anestesia para las radiografías de cráneo no fue aceptada, lo que impidió tomarlas con boca abierta. Al mismo tiempo el tutor declinó la opción de una CT o MRI. El hecho de no tener estas pruebas de imágenes o tenerlas con técnica incorrecta, pudo generar que el diagnóstico sea pasado por alto; afortunadamente no fue el caso. Se debe explicar siempre a los tutores las limitaciones que estas decisiones pueden generar. Debido a las limitaciones económicas, el propietario solicitó tratar de evitar algunos análisis durante el proceso anestésico previo a la rinoscopia. Esto generó que no se hicieran lavados para cultivo bajo dos conceptos: 1.- no se vieron placas ni destrucción del tejido compatible con infección micótica y 2.- a pesar que es importante saber qué bacteria puede estar presente, la citología rápida no reportó bacterias; a pesar de que las muestras para cultivo deben ser tomadas del fondo de los cornetes nasales con lavados, se decidió no hacerlo basándonos en nuestros resultados. Se debe mencionar que esto no es lo ideal, sin embargo, como ya se dijo, se tenían limitaciones económicas. Afortunadamente posteriormente la biopsia confirmó la ausencia de bacterias en la muestra.
La citología e histopatología fueron quienes llevaron al diagnóstico final. Las causas exactas de la RLP se desconocen, aunque se considera multifactorial. Se ha demostrado que una pobre regulación de los mecanismos protectores del sistema inmune local, son clave para su desarrollo. Bajos niveles de IgA empeoran el cuadro. En este caso, como ya se explicó el paciente tuvo episodios de estrés que pudieron generar disminución de la inmunidad local; a pesar de que todos los análisis sanguíneos estaban dentro del rango.
Tradicionalmente los inmunosupresores son la droga de elección para este tipo de RSC. Sin embargo, este paciente no mostraba mejoría con su uso de corticosteroides. Se planteó la posibilidad de usar ciclosporina, sin embargo, debido a limitaciones económicas el propietario solicitó otra opción. Se decidió probar con meloxicam, un AINE, ya que se tenían estudios de su efectividad en algunos casos de RSC en perros y gatos. Sin embargo, se decide asociarlo al inicio con doxiciclina, un antibiótico que, en gatos, se considera puede tener propiedades inmunomoduladoras. Esto para tratar de lograr una posible sinergia de ambos productos, además de eliminar cualquier posible bacteria secundaria que pudiera haber colonizado el tejido durante la terapia inmunosupresora con corticoides. La terapia a largo plazo con meloxicam fue efectiva, por lo que se sugirió mantenerla. Sin embargo, el tutor observó mejoría clínica al mudarse de ciudad y retiró la medicación, por lo que se concluyó que la RLP fue producto del estrés, asociado a cambios en el sistema inmune local nasal (posible presencia de alergenos en el medio ambiente, que eran totalmente diferentes a los que el gato se exponía en Europa, que desaparecieron al mudarse).
En resumen, este caso presenta la forma de aproximación diagnóstica en un caso crónico de ETRS. Sin embargo, se debe considerar que en práctica privada podemos tener limitaciones (económicas por parte del propietario o de accesibilidad a pruebas diagnósticas, por parte del médico veterinario, según la ubicación geográfica). En caso tengamos alguna de estas limitaciones, se debe priorizar lo que se considere necesario y primordial para poder llegar a un buen diagnóstico. Para esto la comunicación con el propietario es fundamental, así como para tener éxito en el tratamiento. Este caso demostró que a veces es necesario probar varias drogas antes de encontrar la que realmente beneficia y cura al paciente.
Bibliografía
- Bouyssou, S. Hammond. G. Eivers, C. Comparison of CT features of 79 cats with intranasal mass lesions. Journal of Feline Medicine and Surgery, Vol. 23(10) 987– 995. 2021
- Burns, R. Wagner, D. Leutenegger, C. Pesavento, P. Histologic and Molecular Correlation in Shelter Cats with Acute Upper Respiratory infection. Journal of clinical microbiology. 2454–2460. 2011
- Ferguson, S. Smith, K. Welsh, C. Dobromylskyj, M. A retrospective study of more tan 400 feline nasal biopsy samples in the UK (2006–2013). Journal of Feline Medicine and Surgery, Vol. 22(8) 736– 743. 2020.
- Henderson, S. Bradley, K. Day, MJ. Tasker, S. Caney, MA. Moore, H. Gruffydd-Jones, TJ. Investigation of nasal disease in the cat - a retrospective study of 77 cases. Journal of Feline Medicine and Surgery: 6, 245 – 257. 2004.
- Kang, M. Park, HM. Diagnosis and Management of Lymphoplasmacytic Rhinitis in a Cat. J Vet Clin 28(4): 438-441 (2011). Korea.
- Lamb, C. Richbell, S. Mantis, P. Radiographic signs in cats with nasal disease. Journal of Feline Medicine and Surgery: 5, 227–235. 2003.
- Michiels, L. Day, MJ. Snaps, F. Hansen, P. Clercx, C. A retrospective study of non-specific rhinitis in 22 cats and the value of nasal cytology and histopathology. Journal of Feline Medicine and Surgery: 5, 279–285. 2003.
- Reed, N. Gunn-Moore, D. Nasopharyngeal disease in cats. 1. diagnostic investigation. Journal of Feline Medicine and Surgery: 14, 306–315. 2012.
- Reed, N. Gunn-Moore, D. Nasopharyngeal disease in cats. 2. Specific conditions and their management. Journal of Feline Medicine and Surgery: 14, 317–326. 2012.
- Roccabianca,P. Turchetto, S. Ferrari, N. Romeo, C. Bonacini, S. Mortellaro, CM. Godizzi, F. Tecilla, M.; Feline lymphoplasmacytic rhinitis (FLPCR): Severity of inflammation correlates with reduced mucosal IgA expresión. Veterinary Immunology and Immunopathology. Volume 234. 2021.
- Sherk, M. Snots and snuffles, rational approach to chronic feline upper respiratory síndrome. Journal of Feline Medicine and Surgery, Vol. 12, 548 – 557. 2010.
- Sobel, D. Upper respiratory tract endoscopy in the cat. A minimally invasive approach to diagnostics and therapeutics. Journal of Feline Medicine and Surgery:15, 1007–1017. 2013.
- Veir, J. Ruch-Gallie, R. Spindel, M. Lappin, M. Prevalence of selected infectious organisms and comparison of two anatomic sampling sites in shelter cats with upper respiratory tract disease. Journal of Feline Medicine and Surgery 10, 551 - 557. 2008.
- Vekšins A. Feline upper respiratory tract disease – Computed tomography and laboratory diagnostic, Veterinary World, 15(7): 1880–1886. 2022 Letonia.
 by Multimédica
by Multimédica