Transición de PIF efusiva a PIF neurológica y uso exitoso de EIDD-1931 tras falta de respuesta a GS-441524 en un gato con peritonitis infecciosa felina
Resumen breve
Se describe el caso de un felino con PIF efusiva que desarrolló signos neurológicos y respiratorios bajo tratamiento con GS-441524. Debido a la falta de respuesta a GS-441524, se reemplazó la terapia antiviral por EIDD-1931 (principio activo de molnupiravir), lo que resultó en la remisión de los síntomas. Los objetivos de este caso clínico son describir un curso inusual de la PIF bajo tratamiento y las alternativas terapéuticas en casos refractarios a GS-441524.Índice de contenidos
Peritonitis infecciosa felina: un nuevo horizonte
La peritonitis infecciosa felina (PIF) ha representado durante décadas uno de los mayores desafíos para los veterinarios de pequeños animales, debido a su desenlace inevitablemente fatal en ausencia de tratamientos antivirales efectivos. Afortunadamente, a partir de 2016, las investigaciones del Dr. Niels Pedersen y sus colaboradores demostraron tanto in vitro como in vivo la eficacia de diversos antivirales de uso humano contra el coronavirus felino (FCoV)1-6. En particular, su publicación de 2019, que evidenció la cura en la mayoría de los gatos con PIF tratados con el análogo nucleósido GS-441524, marcó un punto de inflexión en el manejo de la PIF, transformándola de una enfermedad fatal a una condición potencialmente curable4.
Aunque la PIF se considera una enfermedad curable en más del 80 % de los casos tratados con GS-441524, persisten desafíos importantes, como la falta de respuesta al tratamiento o la recurrencia de los síntomas7-9. Además, el virus puede cambiar su manifestación clínica durante o después del tratamiento por causas aún no determinadas, lo que todavía dificulta más su manejo7.
El siguiente caso clínico reporta la progresión de PIF efusiva a PIF neurológica y la remisión de los signos clínicos tras el cambio de tratamiento de GS-441524 a EIDD-1931 (principio activo de molnupiravir) en un gato con peritonitis infecciosa felina.
Caso clínico
Un paciente felino Doméstico de pelo corto, macho entero de 4 meses, fue referido al Hospital Veterinario de la Universidad de Berna el 24 de agosto de 2024 debido a apatía, hiporexia y distensión abdominal de cuatro días de evolución. En el examen físico, se constató una condición corporal 4/9, deshidratación del 6 %, temperatura rectal de 40.6 °C y un abdomen severamente distendido por la presencia de líquido libre. No se registraron derrame pleural ni signos oculares o neurológicos evidentes. Debido a la edad, el sexo y los síntomas del paciente, la primera sospecha fue una PIF efusiva. Como diagnóstico diferencial se consideró un abdomen séptico.
Los exámenes complementarios incluyeron una hematología con evaluación de frotis sanguíneo, una bioquímica sanguínea, una prueba de detección rápida para los virus de la inmunodeficiencia felina (FIV) y la leucemia felina (FeLV), un análisis de la efusión abdominal, la prueba de Rivalta y una prueba RT-qPCR para la detección de FCoV en la efusión. Se obtuvieron los siguientes resultados (Tabla 1):
| Parámetro (Valor de referencia) | Diagnóstico | Semana 2 GS-441524 | Semana 6 GS-441524 | Semana 8 GS-441524 | Semana 9 GS-441524 | Semana 10 GS-441524 | Semana 2 EIDD-1931 |
|---|---|---|---|---|---|---|---|
| Hematocrito (0.32-0.48 l/l) | 0.26 | 0.29 | 0.32 | 0.35 | - | 0.35 | 0.41 |
| Leucocitos (3.78-15.6 x 109/l | 10.58 | 8.54 | 8.01 | 8.97 | - | 7.66 | 7.40 |
| Neutrófilos segmentado (1.6-8.5 x 109/l) | 7.62 | 4.78 | 4.73 | 4.71 | - | 4.10 | 2.63 |
| Neutrófilos en banda (0-0.1 x 109/l) | 0.95 | 0.13 | 0.08 | 0.36 | - | 0.00 | 0.04 |
| Proteínas totales (63.3-83.2 g/l) | 59.1 | 72.9 | 58.2 | 61.9 | - | 61.7 | 58.2 |
| Albúmina (30.0-43.3 g/l) | 20.9 | 30.2 | 32.0 | 35.5 | - | 35.8 | 32.7 |
| Globulinas (25.8-50.6 g/l) | 38.2 | 48.7 | 26.2 | 26.4 | - | 25.9 | 25.5 |
| Bilirrubina (0.0-2.2 μmol/l) | 14.4 | 1.1 | 0.6 | 0.0 | - | 0.0 | 0.0 |
| Relación alb/prot (> 1) | 0.55 | 0.62 | 1.22 | 1.34 | - | 1.38 | 1.28 |
| Creatinina (64-163 μmol/l) | 44 | 49 | 68 | 75 | - | 64 | 70 |
| ALT (GPT)(25-87 U/l) | 22 | 27 | 28 | 24 | - | 37 | 32 |
| Creatina quinasa (68-555 U/l) | 99 | - | - | 91 | - | 163 | - |
| Potasio (3.26-5.11 mmol/l) | 4.01 | - | - | 3.74 | - | 3.74 | - |
| Calcio total (2.34-2.88 mmol/l) | 2.28 | - | - | - | - | 2.57 | - |
| SAA (< 5.2 mg/l) | 63.8 | 1.1 | 1.8 | 3.0 | 0.7 | 1.7 | 6.3 |
Tabla 1. Parámetros sanguíneos relevantes al momento del diagnóstico y durante las terapias con GS-441524 y EIDD-1931.
- Hematología y frotis sanguíneo: anemia leve normocítica normocrómica no regenerativa, desviación a la izquierda degenerativa (neutrófilos en banda aumentados y neutrófilos segmentados normales), presencia de neutrófilos tóxicos en baja cantidad.
- Bioquímica sanguínea: hipoproteinemia leve, hipoalbuminemia moderada, relación albúmina/globulina de 0.55, hiperbilirrubinemia moderada, hipocalcemia total leve, incremento moderado de la proteína amiloide A sérica (SAA).
- Test rápido para FIV y FeLV: negativo.
- Análisis de la efusión: trasudado alto en proteínas, inflamación neutrofílica, ausencia de microorganismos.
- Prueba de Rivalta: positiva.
- RT-qPCR para FCoV en efusión: positivo con carga viral alta (Ct: 21.6).
Sobre la base de los exámenes complementarios, se pudo establecer el diagnóstico definitivo de PIF efusiva. El paciente fue hospitalizado y tratado con infusión endovenosa ajustada al grado de deshidratación, una dosis de metamizol como antipirético (20 mg/kg IV; Novalgin®, Sanofi) y el antiviral GS-441524 (10 mg/kg/24 h PO; comprimido magistral, BOVA, Reino Unido). El acceso legal a este medicamento fue posible gracias al estudio FIP Projekt de la Universidad de Berna, Suiza, vigente desde diciembre de 20239.
El paciente mostró una rápida mejoría en su estado general, temperatura y apetito tras dos días de tratamiento. Fue dado de alta con GS-441524 a una dosis de 10 mg/kg/24 h PO por 12 semanas. El propietario reportó diarrea durante los primeros días, que se controló con un suplemento alimenticio compuesto de bentonita, pectina y Saccharomyces cerevisiae (Korvimin® Diar, Streuli Tiergesundheit AG). En la segunda semana de tratamiento, el paciente no presentó signos clínicos y solo se observó una cantidad mínima de efusión abdominal. El hematocrito mostró un aumento (aunque permanecía levemente disminuido) y la química sanguínea se normalizó, a excepción de la relación albúmina/globulina (ver Tabla 1).
La dosis de GS-441524 se mantuvo en 10 mg/kg/24 h PO. En la sexta semana de tratamiento, no se detectó efusión abdominal, el hematocrito se normalizó y se observó una hipoproteinemia leve con niveles normales de albúmina y globulinas (ver Tabla 1). La dosis de GS-441524 se mantuvo sin cambios.
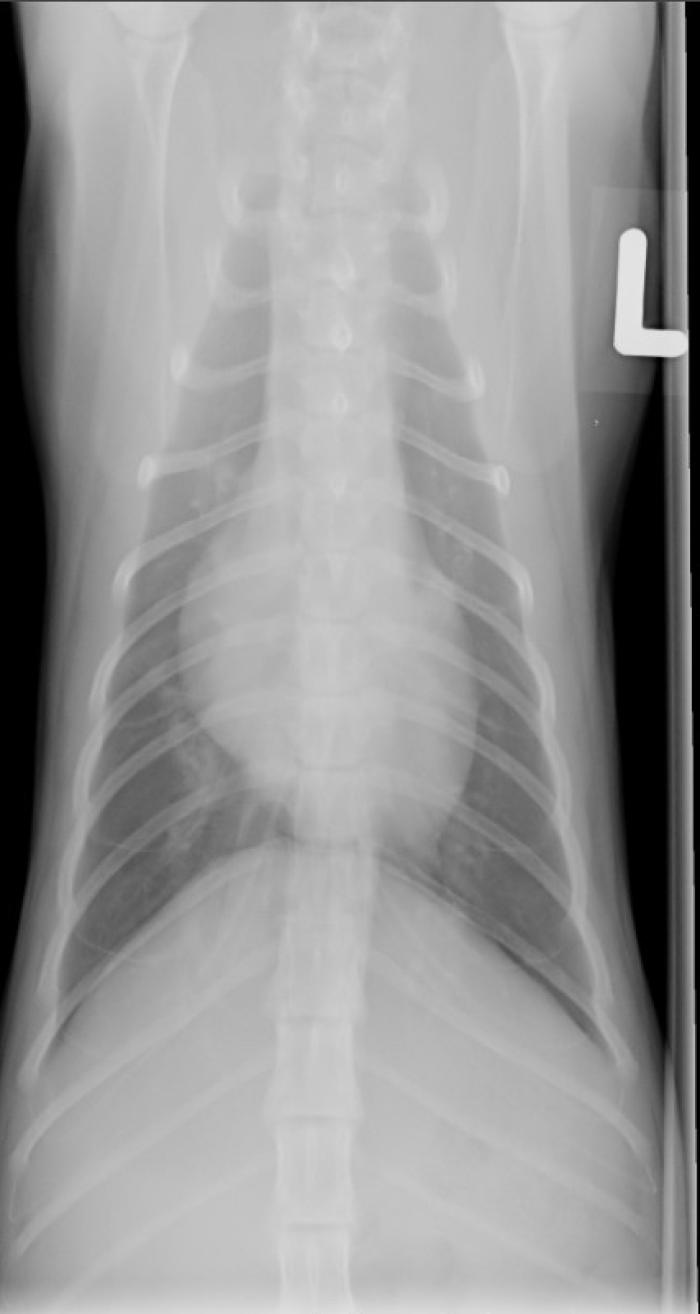
En la octava semana de tratamiento, el propietario reportó letargia, debilidad en la marcha, temblores en los miembros posteriores y respiración con boca abierta después de jugar. El examen físico reveló un estado de conciencia levemente reducido, taquipnea de 60 rpm, sonidos broncovesiculares aumentados, linfadenomegalia submandibular moderada, marcha débil y plantigradismo. No se detectaron fiebre, efusiones ni dolor en la columna vertebral. Los análisis sanguíneos mostraron una ligera desviación a la izquierda degenerativa, hipoproteinemia marginal y niveles normales de potasio, calcio total, creatina quinasa y SAA (ver Tabla 1). El estudio radiográfico de tórax evidenció una leve cardiomegalia generalizada y un patrón pulmonar broncointersticial y vascular multifocal, más acentuado en el lóbulo caudal derecho (Figura 1A-B).
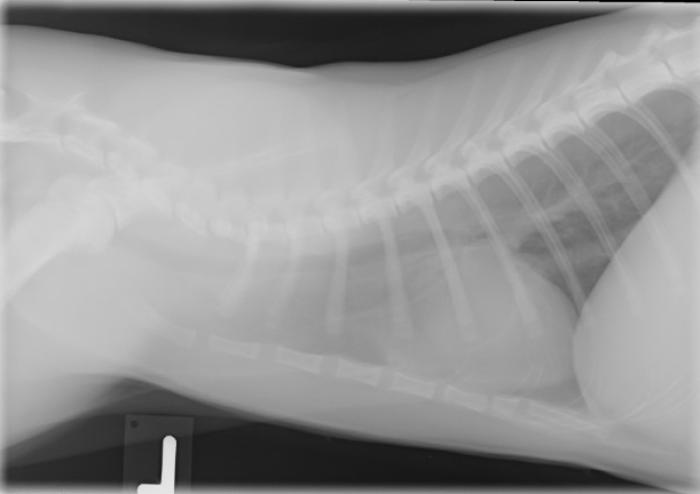
Figura 1. Radiografías (A) laterolateral y (B) ventrodorsal de tórax. Se observa una leve cardiomegalia generalizada y un patrón pulmonar broncointersticial y vascular multifocal, más acentuado en el lóbulo caudal derecho.
La ecocardiografía descartó enfermedad cardíaca subyacente, mientras que la citología de los linfonodos submandibulares mostró linfonodos levemente reactivos.
Los signos neurológicos se clasificaron como de origen neuromuscular, con una sospecha principal de polineuropatía inmunomediada primaria o secundaria. Otros diagnósticos diferenciales incluyeron miopatía y miastenia gravis. Los cambios pulmonares se interpretaron como de origen inflamatorio o viral. También se evaluó la posibilidad de un efecto adverso relacionado con la terapia prolongada con GS-441524. Sin embargo, dado el diagnóstico previo de PIF, se decidió incrementar la dosis de GS-441524 a 10 mg/kg/12 h PO, correspondiente a la dosis recomendada para PIF neurológica.
En la novena semana de tratamiento, el paciente mostró una mejora parcial de sus signos clínicos. El plantigradismo se resolvió, aunque persistían la letargia y la intolerancia al ejercicio. El examen neurológico evidenció una mejora significativa en la marcha. Las radiografías torácicas de control no mostraron cambios en comparación al estudio previo. Los niveles de SAA permanecieron normales (ver Tabla 1) y una serología para Toxoplasma sp. descartó una infección activa. Se decidió continuar el tratamiento con GS-441524 y se adicionó tiamina 15 mg/kg/12 h PO (Benerva®, Teofarma) por 4 semanas.
En la décima semana de tratamiento, los propietarios reportaron apatía, somnolencia, ventroflexión cervical y temblores de cabeza. El examen físico confirmó estos signos y evidenció plantigradismo intermitente, marcha débil y disminución de los reflejos espinales en los miembros anteriores. Los hallazgos sugirieron nuevamente una localización neuromuscular, aunque con un posible componente medular cervical y/o central. Los análisis sanguíneos no revelaron anormalidades, a excepción de una hipoproteinemia marginal (ver Tabla 1), y las radiografías torácicas mostraron una leve mejoría de los cambios pulmonares previamente descritos.
Una progresión de la PIF continuó siendo la principal sospecha, por lo que se decidió suspender el tratamiento con GS-441524 e iniciar EIDD-1931 (componente activo de molnupiravir) a una dosis de 18 mg/kg/12 h PO (comprimido magistral, BOVA, Reino Unido) durante 12 semanas. El tratamiento con tiamina se mantuvo. Tras cuatro días, el paciente mostró una mejora considerable en su estado neurológico. Al quinto día, un examen de electromiografía reveló una alteración leve en la actividad neuromuscular. El análisis de líquido cefalorraquídeo lumbar indicó un leve incremento en las proteínas, mientras que el análisis RT-qPCR fue negativo para FCoV (Ct > 45). Se concluyó que el cuadro correspondía a una posible polineuropatía en vías de remisión.
En la segunda semana de tratamiento con EIDD-1931, el propietario reportó un muy buen estado general del paciente, salvo por la presencia de heces blandas. El examen físico no mostró anormalidades. Los análisis sanguíneos revelaron una leve hipoproteinemia por hipoglobulinemia y un ligero aumento en los niveles de SAA (ver Tabla 1). Se decidió continuar el tratamiento con EIDD-1931 y tiamina, y se añadieron probióticos a la dieta (Fortiflora®, Purina). Al 8 de diciembre de 2024, el paciente se encuentra en la cuarta semana de tratamiento con EIDD-1931, sin signos clínicos, salvo episodios intermitentes de heces blandas. Los próximos controles están programados para las semanas seis y doce de tratamiento con EIDD-1931.
Discusión
La mayoría de los gatos con PIF tratados con GS-441524 o molnupiravir muestran una evolución favorable, requiriendo un tratamiento único de entre 6 y 12 semanas para entrar en remisión7-9,11-15.No obstante, esporádicamente se observan patrones inusuales, como la aparición de signos neurológicos tras el inicio de la terapia. Esto ha sido reportado previamente y también lo hemos observado en 4 de 144 gatos de nuestra cohorte del FIP Projekt (datos no publicados). Los signos neurológicos asociados a la PIF suelen ser de origen multifocal, central vestibular y/o medular, y se manifiestan principalmente como alteración del estado de conciencia, tetraparesia o paraparesia, ataxia, nistagmo, convulsiones y/o incontinencia fecal o urinaria16-18.
En nuestro caso, el paciente presentó signos neuromusculares compatibles con una polineuropatía, algo que no se ha descrito previamente en el contexto de PIF neurológica. Sin embargo, las publicaciones sobre este tema son anteriores al advenimiento de las terapias antivirales, y es posible que ahora observemos otras manifestaciones clínicas debido a que los pacientes sobreviven más tiempo con el virus o con sus efectos sobre el sistema inmunitario. Aunque no se pudo confirmar que el virus fuera el desencadenante de la polineuropatía, la corrección de los síntomas tras cambiar el tratamiento a EIDD-1931 sugiere fuertemente que el virus desempeñó un papel en el desarrollo de estos signos.
La aparición de signos respiratorios durante la terapia antiviral, en ausencia de efusión pleural, es otro evento que no se ha descrito de manera consistente en la literatura y que también hemos observado en 4 de los 144 gatos de nuestra cohorte (3 durante la terapia y uno a las 12 semanas de haber finalizado el tratamiento). En general, el pulmón no se considera un órgano clásicamente afectado por la PIF, aunque los estudios en base a necropsias reportan lesiones pulmonares con frecuencia19. En nuestro caso, se sospechó que los cambios pulmonares eran principalmente de origen viral o inflamatorio, aunque también se consideró un efecto adverso inusual asociado a la terapia prolongada con GS-441524. Sin embargo, el paciente no presentó un empeoramiento de los signos respiratorios ni de los hallazgos radiográficos tras duplicar la dosis de GS-441524, disminuyendo la probabilidad de una reacción adversa al medicamento. Aunque no se repitieron las radiografías una vez iniciado el tratamiento con EIDD-1931, los signos respiratorios se resolvieron, lo que sugiere un posible efecto favorable de este medicamento sobre las lesiones pulmonares.
El análogo nucleósido GS-441524 se considera la terapia de elección contra la PIF debido a su alta eficacia y su baja tasa de efectos adversos7-9,11. No obstante, es un medicamento costoso y no está disponible de forma legal en muchos países. Molnupiravir (o su componente activo, EIDD-1931) ha recibido especial atención debido a su tasa de éxito similar a la de GS-441524, su utilidad en casos refractarios a este último, su considerable menor costo y su disponibilidad legal en países donde está autorizado para pacientes con COVID-1912-15. En nuestro estudio FIP Projekt, usamos EIDD-1931 como medicamento antiviral de segunda línea importado de la farmacia magistral BOVA en Reino Unido.
Molnupiravir también es un análogo nucleósido que mimetiza citidina o uridina y, al incorporarse en el ARN viral, provoca un emparejamiento incorrecto de bases nitrogenadas. A diferencia de GS-441524, que detiene la replicación viral al interrumpir la síntesis de ARN, el molnupiravir la detiene al inducir un exceso de mutaciones20. Esta capacidad para inducir mutaciones ha generado controversia, ya que se teme que pueda dar lugar a cepas más virulentas o causar mutaciones en el ADN humano20. Sin embargo, hasta el momento no se ha documentado ninguna implicancia epidemiológica relevante en medicina humana, y su uso para tratar la PIF se considera una alternativa válida, ya sea como tratamiento de primera línea o en casos refractarios12-15.
GS-441524 y molnupiravir/EIDD1931 son generalmente bien tolerados, aunque un efecto adverso comúnmente reportado es la diarrea, como ocurrió en este paciente11. La diarrea suele ser autolimitante o resolverse con manejo dietético, probióticos o simbióticos. Otro efecto adverso reportado con ambos medicamentos es la elevación de ALT, generalmente leve a moderada7-9,11-15.Entre los efectos adversos raros se encuentran la formación de urolitos (GS-441524), pancitopenia (molnupiravir), azotemia (molnupiravir), plegamiento de orejas (GS-441524 y molnupiravir) y alopecia facial (GS-441524 y molnupiravir)12-15,21. Aunque estos efectos son poco frecuentes, es importante monitorizar de cerca a los pacientes e informar a los propietarios sobre su posible aparición.
Este es el primer caso dentro de la cohorte FIP Projekt tratado con EIDD-1931. Dado que el paciente continúa bajo tratamiento, aún no es posible determinar si alcanzará una remisión definitiva de la PIF. Por ello, se realizarán controles frecuentes para monitorizar su evolución y se mantendrá un contacto estrecho con el propietario para detectar de manera temprana cualquier signo de deterioro.
Conclusiones
La PIF es una enfermedad multifacética cuya manifestación clínica puede agravarse o complicarse durante el tratamiento antiviral, lo que resalta la importancia de una monitorización continua y una buena comunicación con los propietarios. Aunque la mayoría de los gatos tratados con GS-441524 experimentan una remisión de los signos clínicos, hasta un 20 % no responden adecuadamente. Por ello, es importante contar con opciones antivirales alternativas, como por ejemplo el molnupiravir o su componente activo, EIDD-1931.
Bibliografía
- Kim Y, Liu H, Galasiti Kankanamalage AC, et al. Reversal of the progression of fatal coronavirus infection in cats by a broad-spectrum coronavirus protease inhibitor. PLoS Pathog. 2016 Mar;12(3):e1005531.
- Pedersen NC, Kim Y, Liu H, et al. Efficacy of a 3C-like protease inhibitor in treating various forms of acquired feline infectious peritonitis. J Feline Med Surg. 2018 Apr;20(4):378–392.
- Murphy BG, Perron M, Murakami E, et al. The nucleoside analog GS-441524 strongly inhibits feline infectious peritonitis virus in tissue culture and experimental cat infection studies. Vet Microbiol. 2018 Apr;219:226–233.
- Pedersen NC, Perron M, Bannasch M, et al. Efficacy and safety of the nucleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis. J Feline Med Surg. 2019 Apr;21(4):271–281.
- Dickinson PJ, Bannasch M, Thomasy SM, et al. Antiviral treatment using the adenosine nucleoside analogue GS-441524 in cats with clinically diagnosed neurological feline infectious peritonitis. J Vet Intern Med. 2020 Jul;34(4):1587–1593.
- Cook SE, Vogel H, Castillo D, et al. Investigation of monotherapy and combined anticoronaviral therapies against feline coronavirus serotype II in vitro. J Feline Med Surg. 2022 Oct;24(10):943–953.
- Taylor SS, Coggins S, Barker EN, et al. Retrospective study and outcome of 307 cats with feline infectious peritonitis treated with legally sourced veterinary compounded preparations of remdesivir and GS-441524 (2020–2022). J Feline Med Surg. 2023 Sep;1–26.
- Coggins SJ, Norris JM, Malik R, et al. Outcomes of treatment of cats with feline infectious peritonitis using parenterally administered remdesivir, with or without transition to orally administered GS-441524. J Vet Intern Med. 2023 Sep;37(5):1772–1783.
- Green J, Syme H, Tayler S. Thirty-two cats with effusive or non-effusive feline infectious peritonitis treated with a combination of remdesivir and GS-441524. J Vet Intern Med. 2023 Sep;37(5):1784–1793.
- https://www.kleintierklinik.unibe.ch/forschung/innere_medizin/fip_projekt_bern/index_ger.html
- Zuzzi-Krebitz AM, Buchta K, Bergmann M, et al. Short treatment of 42 days with oral GS-441524 results in equal efficacy as the recommended 84-day treatment in cats suffering from feline infectious peritonitis with effusion—a prospective randomized controlled study. Viruses. 2024 Jul;16(7):1144.
- Roy M, Jacque N, Novicoff W, et al. Unlicensed molnupiravir is an effective rescue treatment following failure of unlicensed GS-441524-like therapy for cats with suspected feline infectious peritonitis. Pathogens. 2022 Oct;11(10):1209.
- Sase O. Molnupiravir treatment of 18 cats with feline infectious peritonitis: A case series. J Vet Intern Med. 2023 Oct;37(5):1876–1880.
- Sase O, Iwami T, Sasaki T, Sano T. GS-441524 and molnupiravir are similarly effective for the treatment of cats with feline infectious peritonitis. Front Vet Sci. 2024 Jul;11:1422408.
- Reagan KL, Brostoff T, Pires J, et al. Open label clinical trial of orally administered molnupiravir as a first-line treatment for naturally occurring effusive feline infectious peritonitis. J Vet Intern Med. 2024 Sep;1–8.
- Crawford AH, Stoll AL, Sanchez-Masian D, et al. Clinicopathologic features and magnetic resonance imaging findings in 24 cats with histopathologically confirmed neurologic feline infectious peritonitis. J Vet Intern Med 2017, 31: 1477-1486.
- Rissi DR. A retrospective study of the neuropathology and diagnosis of naturally occurring feline infectious peritonitis.Journal of Veterinary Diagnostic Investigation. 2018;30(3):392-399.
- Timmann D, Cizinauskas S, Tomek A, et al. Retrospective analysis of seizures associated with feline infectious peritonitis in cats. J Feline Med Surg. 2008 Feb;10(1):9-15.
- Slaviero M, Cony FG, da Silva RC, et al. Pathological findings and patterns of feline infectious peritonitis in the respiratory tract of cats. J Comp Pathol. 2024 Feb;210:15–24.
- Sanderson T, Hisner R, Donovan-Banfield I, et al. A molnupiravir-associated mutational signature in global SARS-CoV-2 genomes. Nature. 2023 Nov;623:594–600.
- Allinder M, Tynan B, Martin C, et al. Uroliths composed of antiviral compound GS-441524 in 2 cats undergoing treatment for feline infectious peritonitis. J Vet Intern Med. 2024 Jan;38(1):370–374.
 by Multimédica
by Multimédica

