Wolbachia pipientis: más que una simple bacteria
Resumen breve
Dirofilaria immitis alberga la bacteria endosimbionte Wolbachia pipientis. Esta bacteria se encuentra en todas las fases vitales del parásito, y es indispensable para su supervivencia y reproducción; además, puede estar implicada en la supervivencia a largo plazo del parásito dentro del hospedador, al contribuir a la regulación del sistema inmune de este último. Por otro lado, Wolbachia contribuye a la fisiopatología de la dirofilariosis generando una fuerte reacción inflamatoria y provocando…Índice de contenidos
Resumen
Dirofilaria immitis alberga la bacteria endosimbionte Wolbachia pipientis. Esta bacteria se encuentra en todas las fases vitales del parásito, y es indispensable para su supervivencia y reproducción; además, puede estar implicada en la supervivencia a largo plazo del parásito dentro del hospedador, al contribuir a la regulación del sistema inmune de este último. Por otro lado, Wolbachia contribuye a la fisiopatología de la dirofilariosis generando una fuerte reacción inflamatoria y provocando daños en diferentes órganos, tanto en perros como en gatos. Por ello, es indispensable la eliminación de esta bacteria previamente al tratamiento adulticida mediante la administración de doxiciclina. En este artículo se revisa la historia de Wolbachia, bacteria ampliamente presente en artrópodos y nematodos filariales. se explicará las implicaciones de su presencia en artrópodos y su posible uso en la lucha contra diversas enfermedades, así como los efectos que presenta en nematodos filariales y en sus hospedadores. Se detallarán las opciones para su eliminación durante el protocolo adulticida de la dirofilariosis canina y las líneas de investigación en el desarrollo de nuevos protocolos y antibióticos bactericidas.
¿Qué es la dirofilariosis cardiopulmonar?
La dirofilariosis cardiopulmonar, conocida comúnmente como la “enfermedad de gusano del corazón”, es una enfermedad que está producida por el nematodo parásito Dirofilaria immitis. Afecta principalmente a perros y gatos, tanto domésticos como silvestres. Es una enfermedad de trasmisión vectorial, mediante la picadura de mosquitos culícidos (principalmente los géneros Culex spp., Aedes spp., y Anopheles spp.). La dirofilariosis es también una enfermedad zoonótica, ya que el ser humano también puede ser infectado, siendo considerado un hospedador accidental; aquí, el parásito no se desarrolla hasta la etapa adulta y forma nódulos pulmonares de carácter benigno que, en ocasiones, se confunden con tumores.
La primera observación de este parásito fue realizada en 1926, durante la necropsia que Francesco Birago, un noble lombardo, realizó a uno de sus perros de caza y que publicó en su “Tratado Cinegético”. Poco después, en 1679, el médico francés J.B. Panthot describió la presencia de 31 gusanos en el corazón de una perra que usaba para demostraciones anatómicas y publicó el primer dibujo del parásito. Sin embargo, hasta el siglo XX, la dirofilariosis no ha sido estudiada en la búsqueda de tratamientos y medidas preventivas.
La dirofilariosis es una enfermedad cosmopolita. Principalmente se localiza en zonas con temperatura media y humedad elevada, aunque también se ha descrito en lugares con climas fríos. En Europa, los países de la cuenta del Mediterráneo han sido tradicionalmente considerados como endémicos; sin embargo, actualmente la enfermedad se ha expandido a países del Norte y Este de Europa. Las prevalencias más elevadas se encuentran en España (incluida las Islas Canarias), Portugal, el sur de Francia, el sur de Suiza, Italia, Grecia, Turquía, la República Checa, Eslovenia, Rumania y Bulgaria. Los factores que ha facilitado la expansión de la dirofilariosis son, entre otros, el cambio climático, el aumento de las poblaciones de vectores, el movimiento de perros microfilaremicos que viajan desde zonas endémicas y la actuación del ser humano sobre el paisaje (p. ej. con la creación de áreas de cultivo o zonas urbanas).
En su hospedador definitivo, los nematodos adultos se localizan en la arteria pulmonar y en el ventrículo derecho del corazón. Tras la fecundación, las hembras liberan microfilarias al torrente circulatorio, que serán ingeridas por el mosquito al alimentarse. Durante un intervalo de 2 semanas, se desarrolla la larva infectante. Cuando el vector vuelve a ingerir sangre, inocula esta larva en el tejido subcutáneo, desplazándose hacia el sistema circulatorio, continuando su desarrollo y realizando varias mudas, hasta que alcanzan su localización definitiva y terminan su desarrollo como adultos (Figura 1).
Dirofilaria immitis alberga una bacteria simbionte intracelular llamada Wolbachia pipientis, siendo esta especie la única que ha sido identificada hasta la fecha dentro de su género. Son bacterias gramnegativas que pertenecen al orden orden Rickettsiales, y están estrechamente relacionados con otras bacterias que pertenecen al mismo grupo, como Ehrlichia spp. y Anaplasma spp. Estas bacterias se encuentran en todos los estadios del ciclo de vida del parásito y son más abundantes en las últimas fases larvarias. Se localizan en los cordones hipodérmicos de los adultos y en los órganos reproductores de las hembras. Las bacterias se encuentran aisladas, en pequeños grupos o en grupos numerosos que ocupan el citoplasma de las células afectadas. Wolbachia pipientis participan directamente en funciones tan importantes para Dirofilaria immitis como la muda y la embriogénesis, y está implicada en la patogénesis y la respuesta inmunitaria que desencadena su infección.
En este artículo se explica el papel de Wolbachia pipientis durante la patogénesis de la dirofilariosis, así como la importancia de su eliminación durante el tratamiento adulticida.
La historia del descubrimiento de Wolbachia
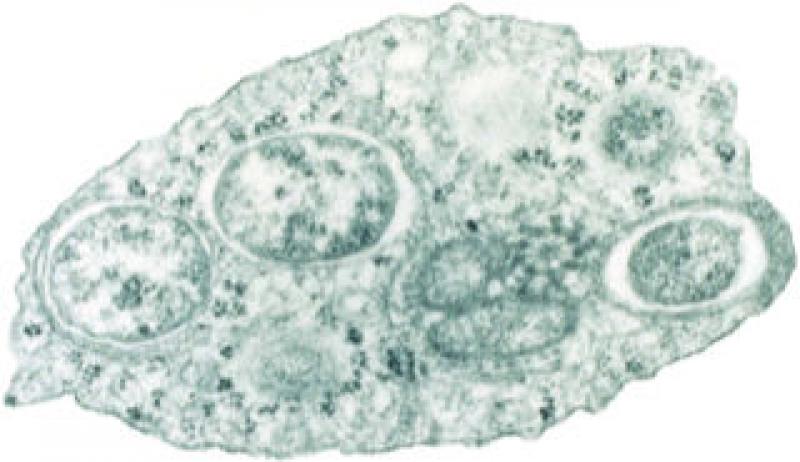
En 1924, los científicos Hertig y Wolbach identificaron Wolbachia por primera vez como un microorganismo similar a Rickettsia en el tejido ovárico del mosquito Culex pipiens. Posteriormente, en 1936 Hertig describió formalmente el género como Wolbachia pipientis (Figura 2).
En los nematodos, Wolbachia fue descubierto décadas después. Entre los años 1971-1975, varios investigadores revelaron la presencia de cuerpos densos dentro de los órganos reproductivos y microfilarias de Dirofilaria immitis y Brugia phangi mediante estudios de microscopía electrónica, que identificaron como microorganismos intracelulares gramnegativos. En 1977, descubrieron que dichos microorganismos se transmitían por vía transovárica en estadios adultos y larvales del nematodo Brugia malayi.
Sin embargo, no fue hasta 1995, que estos microorganismos fueron identificados como bacterias pertenecientes al género Wolbachia por un equipo de científicos de la Universidad de Milán que trabajaban con D. immitis. Desde entonces, Wolbachia ha sido identificada en varias especies de gusanos filariales que afectan a humanos como Wuchereria bancrofti, Onchocerca volvulus, Brugia malayi y Dirofilaria repens que produce la elefantiasis, la ceguera de los ríos, la filariasis linfática y la dirofilariosis subcutánea/ocular respectivamente.
¿Cómo actúa Wolbachia en sus huéspedes?

En los artrópodos
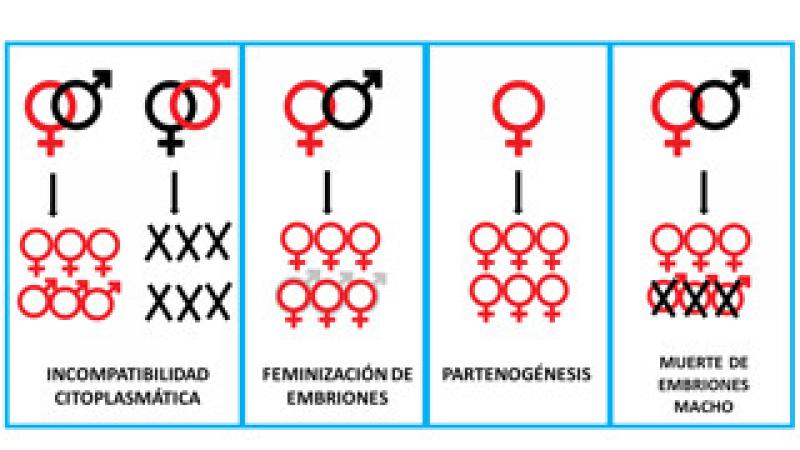
Wolbachia está presente en un gran número de artrópodos (ácaros, isópodos, insectos) (Figura 3). En estos, se descubrió que Wolbachia puede ejercer efectos profundos en su biología, pudiendo determinar alteraciones en su reproducción, como la feminización de los machos (aquellos embriones que se desarrollarían como machos en condiciones normales, lo hacen como hembras), favorecer la partenogénesis (reproducción sin intervención del macho, por la cual, los huevos no fertilizados se desarrollan dando lugar a individuos del sexo femenino) y la muerte de embriones masculinos. También se describió la incompatibilidad citoplasmática; esta incompatibilidad hace referencia a que los machos infectados únicamente pueden generar descendencia si se aparean con hembras infectadas. Un cruce incompatible (machos infectados con hembras no infectadas) no tendrá descendencia, porque no se lleva a cabo la fecundación o porque los embriones mueren. Esto es debido a que Wolbachia está presente en los ovocitos maduros, pero no en el esperma. La incompatibilidad citoplasmática puede describirse como una forma en que Wolbachia esteriliza a las hembras que no portan la bacteria modificando el esperma de los machos infectados. Así, las hembras infectadas pueden aparearse exitosamente con machos infectados y no infectados y, por lo tanto, siempre transmitirán la infección, mientras que las hembras no infectadas pueden aparearse exitosamente solo con machos no infectados (Figura 4).
Hay evidencias de que Wolbachia, además de actuar como un “parásito reproductivo”, en algunos casos también puede ser necesaria para la supervivencia de quién la alberga. Hay ejemplos de asociaciones Wolbachia-insecto en las que la bacteria está implicada en la regulación de la homeostasis del hierro, o en otros casos confieren protección contra las infecciones virales. De hecho, estudios recientes han demostrado que la infección de Aedes aegypti con Wolbachia conduce a una fuerte activación de la inmunidad del mosquito, y esto a su vez le confiere protección contra las infecciones por nematodos filariales, el parásito de la malaria o virus como el Dengue. Así, en los insectos, Wolbachia podría considerarse como una herramienta para reducir la capacidad de vector, lo que podría emplearse como herramienta de control biológico contra algunas enfermedades de trasmisión vectorial, estrategia que se está empleando en la lucha contra algunas enfermedades como la malaria, o virus del Dengue y Zika. Además, parece ser que algunas cepas de Wolbachia también son capaces de reducir la vida útil del insecto, y esto es importante porque el desarrollo de patógenos - como filarias o virus - en el vector huésped, requiere un tiempo de maduración determinado. Por lo tanto, una reducción significativa de la expectativa de vida del insecto reducirá la capacidad del insecto mismo como vector. En esta línea, se está desarrollando un proyecto para reducir la transmisión del virus del Dengue y Chikungunya por los mosquitos Aedes aegypti.
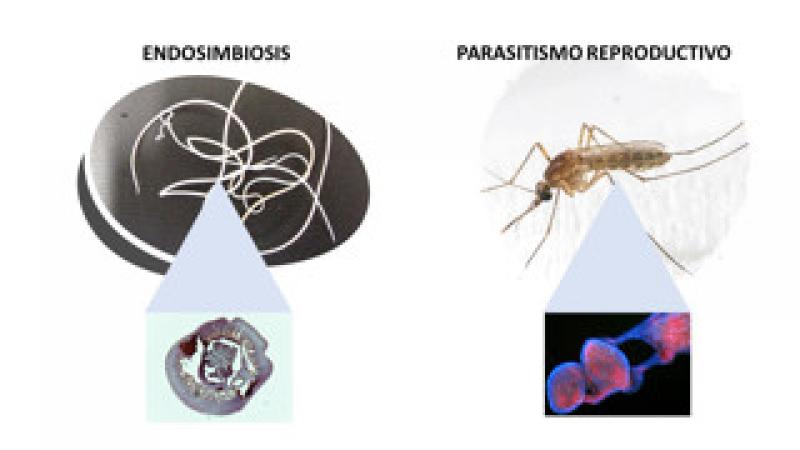
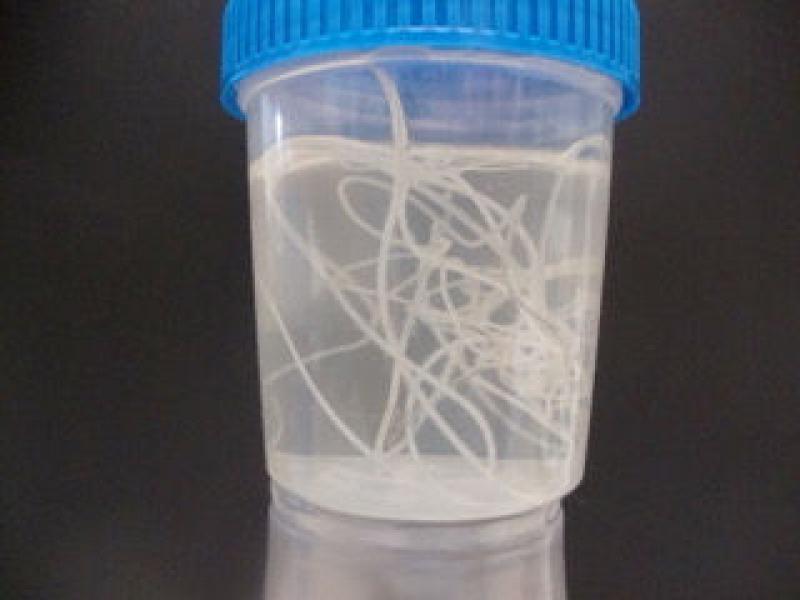
En Dirofilaria immitis y otras filarias
Aunque aún no se conoce con exactitud el papel biológico de Wolbachia, la bacteria y el nematodo tienen una relación de simbiosis y es, por tanto, necesaria para el crecimiento, desarrollo, embriogénesis y supervivencia del nematodo (Figura 5).
Esta bacteria se presenta en proporciones variables de manera individual entre diferentes gusanos y entre diferentes etapas del desarrollo. En adultos de D. immitis, Wolbachia se encuentra predominantemente en todas las células hipodérmicas de los cordones laterales; en las hembras, Wolbachia también está presente en los ovarios, los ovocitos y las etapas embrionarias en desarrollo dentro del útero. No se ha evidenciado su presencia en el sistema reproductor masculino, lo que sugiere que la bacteria se transmite por vía materna a través del citoplasma del óvulo y no a través del esperma, al igual que sucede en los artrópodos (Figuras 6 y 7).
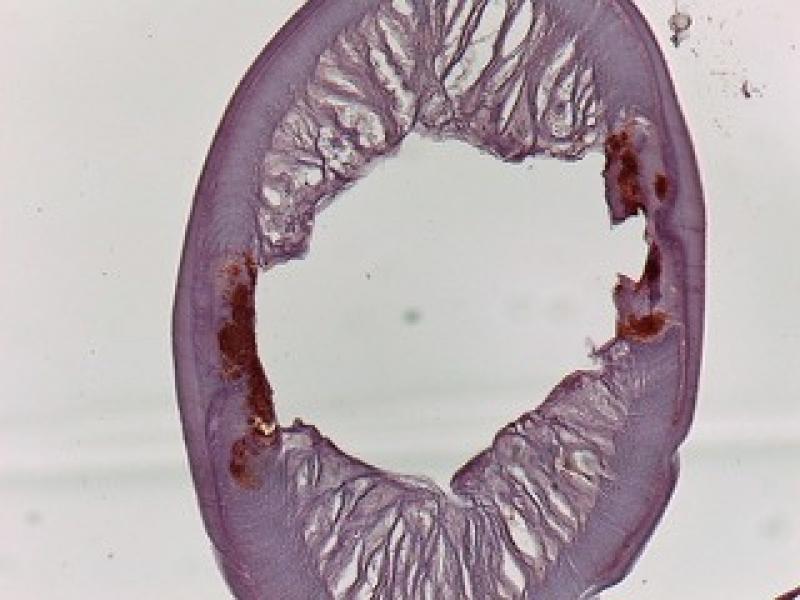
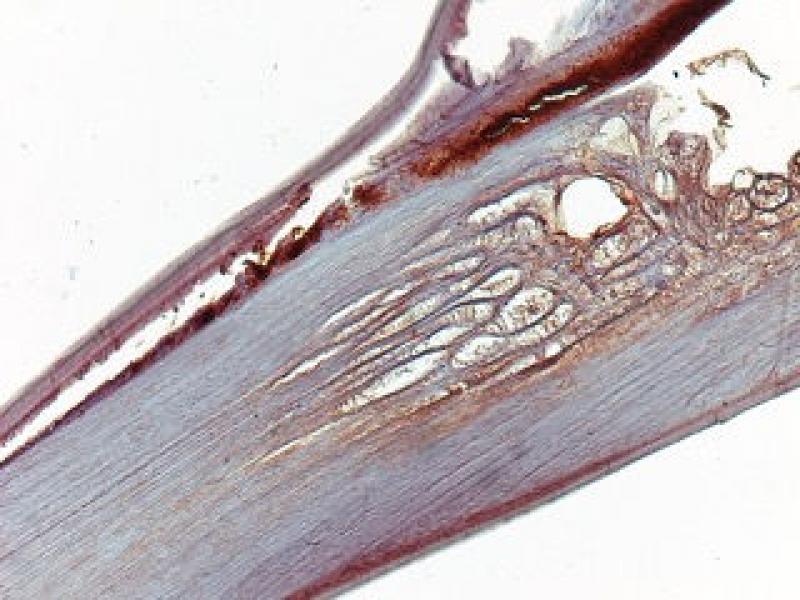
Está ampliamente aceptado que la presencia de W. pipientis en los gusanos adultos de D. immitis y otras filarias es vital para su supervivencia y reproducción, estableciendo una relación de simbiosis. Un proceso simbiótico es aquel en el que se establece una relación íntima y constante entre dos especies diferentes y un organismo endosimbionte aquel que vive dentro del cuerpo o células de otro organismo. Muchos casos de endosimbiosis son obligatorios; es decir, ni el endosimbionte ni el huésped pueden sobrevivir el uno sin el otro. Estos hechos se demostraron a través de estudios en los que se administraron tetraciclina y derivados en animales y humanos con infecciones filariales. En estos, después del tratamiento, se observaron varios efectos perjudiciales sobre el nematodo, siendo el más notable el bloqueo de la producción de embriogénesis y microfilarias, y el bloqueo del desarrollo de larvas infecciosas a gusanos adultos. También se reveló la existencia de efectos adulticidas, tanto en D. immitis, como en filarias que afectan al ganado (Onchocerca ochengi) y en filariasis humanas. Así, los experimentos con medicamentos antibacterianos en filarias condujeron constantemente a efectos perjudiciales sobre el nematodo del huésped, lo que respalda firmemente la hipótesis de que Wolbachia es requerida por el propio nematodo.
Curiosamente, varios estudios han demostrado que la bacteria también puede regular la respuesta inmune del huésped, contribuyendo a la tolerancia inmune que es característica de estas infecciones parasitarias a largo plazo. Así, el hecho de que los parásitos adultos puedan sobrevivir durante años en hospedadores inmunocompetentes probablemente se deba a la capacidad del parásito para evitar o modular la respuesta inmune. Si esto es cierto y Wolbachia puede ayudar al parásito a evadir el ataque inmunológico por parte del huésped, ¿qué sucede cuando eliminamos Wolbachia a través del tratamiento con antibióticos? Como ejemplo, el estudio de los nódulos en ganado bovino producidos por O. ochengi, reveló que Wolbachia permitía el reclutamiento de neutrófilos intactos del huésped como un medio de protección contra un ataque inmune. Los investigadores hicieron este descubrimiento al administrar un régimen de dosis apropiado de oxitetraciclina para eliminar Wolbachia, que causó que las barreras de neutrófilos de los gusanos se desgranularan, y también atrajo a los eosinófilos, que dañaron a los gusanos tras la desgranulación.
¿Cómo contribuye Wolbachia a la fisiopatología de la dirofilariosis?
En los hospedadores infectados con nematodos filariales, Wolbachia es liberada después de las mudas larvales, el recambio microfilarial y la muerte de gusanos, ya sea de forma natural o debido a fármacos antiparasitarios. Se ha demostrado que la liberación de esta bacteria está asociada con la regulación positiva de citocinas proinflamatorias, el reclutamiento de neutrófilos y un aumento de las inmunoglobulinas específicas. Los estudios llevados a cabo en humanos infectados con Onchocerca volvulus, Brugia malayi y Wuchereria bancrofti han demostrado que las reacciones adversas tras la terapia filaricida con ivermectina están asociadas con la presencia de Wolbachia y/o su ADN en el torrente sanguíneo, y que los niveles de esta bacteria en sangre correlacionaban con los niveles de citocinas proinflamatorias.
En perros y gatos infectados por D. immitis se ha observado una interacción entre Wolbachia y el sistema inmune humoral.
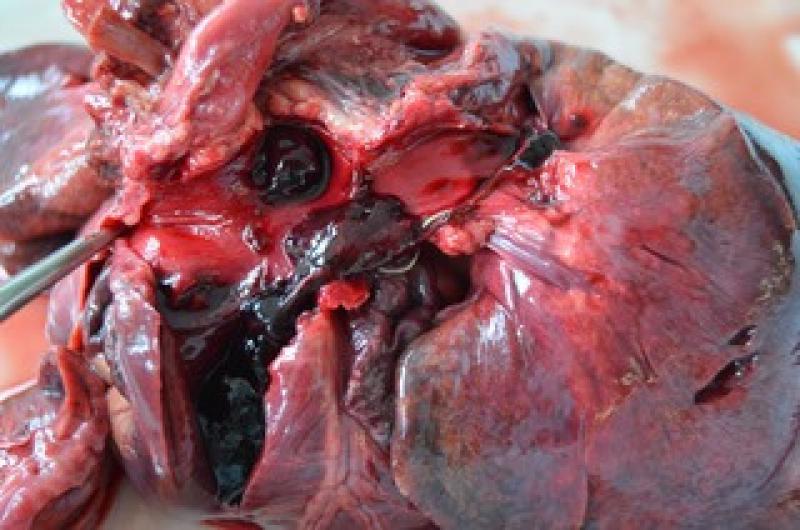
En un estudio se ha demostrado que gatos infectados por D. immitis desarrollaron una respuesta inmune desarrollando IgG contra antígenos de la bacteria, concretamente una proteína de superficie de Wolbachia (WSP). Estudios adicionales han confirmado este hecho y que la respuesta de anticuerpos IgG contra WSP aumenta después de la terapia larvicida.
Además, en el gato se ha descrito la posibilidad de que esta bacteria participe en la reacción bronquial que se produce en la dirofilariosis felina, participando de la sintomatología respiratoria asociada a esta enfermedad. En perros, se ha demostrado que la infección por D. immitis también produce una respuesta inmune con anticuerpos circulantes contra WSP, y que estas proteínas activan neutrófilos polimorfonucleares caninos induciendo actividad quimiotáctica y producción de interleucinas. Además, los anticuerpos anti-WSP también están presentes en la orina de los perros infectados, lo que sugiere que los antígenos derivados de bacterias pueden desempeñar un papel en la glomerulonefritis inmunomediada.
La presencia de la bacteria en los tejidos del animal, una vez que los gusanos de D. immitis han muerto, es suficiente para causar lesiones en los pulmones, riñones, el hígado y el bazo (Figura 8). También se ha observado una respuesta inflamatoria severa del tejido vascular después de una terapia adulticida intensiva, tal vez debido a esta liberación de Wolbachia. Además, esta respuesta inmune se ha observado tras la inoculación de larvas infecciosas en estudios en ratones, lo que indica que el papel de Wolbachia puede ser significativo en la respuesta inflamatoria en la dirofilariosis en las primeras etapas de la infección.
¿Por qué es importante la doxiciclina en el tratamiento de la dirofilariosis?
Debido a que Wolbachia son miembros de la familia Rickettsiaceae, se ha investigado el efecto de los antibióticos comúnmente utilizados para tratar las infecciones por rickettsias en estas bacterias. Así, Wolbachia es susceptible a tetraciclina y doxiciclina.
En dirofilariosis canina, estudios preliminares han demostrado que los perros tratados con una combinación de ivermectina y doxiciclina, reduce la población bacteriana endosimbiótica de Wolbachia en todas las etapas de la vida de D. immitis, lo que provoca la esterilidad de las hembras, inhibe la embriogénesis del parásito, el desarrollo larval, produce la muerte de las microfilarias y, a largo plazo, la muerte de los adultos. Esta reducción de Wolbachia no solo afecta severamente el tracto reproductor femenino del gusano del corazón, sino que también reduce en gran medida las reacciones proinflamatorias a los gusanos moribundos (Figura 9). Además, el tratamiento con doxiciclina reducirá la masa antigénica de las hembras adultas de D. immitis, al eliminar los embriones en desarrollo dentro del útero. De hecho, la pérdida de masa antigénica y la reducción en las poblaciones de Wolbachia en D. immitis inducida por doxiciclina es capaz de reducir notablemente los efectos potencialmente dañinos de la terapia con adulticida y, por lo tanto, mejorar el estado de salud de los perros tratados.
Esto fue demostrado por varios estudios, en los que perros infectados experimentalmente que recibieron un protocolo combinado de doxiciclina e ivermectina antes del tratamiento con melarsomina mostraron lesiones arteriales menos graves y la ausencia virtual de trombos en comparación con los perros tratados únicamente con melarsomina.
Además, es posible que el tratamiento con doxiciclina aumente la eficacia del tratamiento adulticida, ya que sabemos que durante la infección es posible que Wolbachia esté involucrada en la tolerancia inmune hacia el parásito. Así, eliminar la bacteria probablemente contribuya a una respuesta inmune renovada y efectiva contra el parásito.
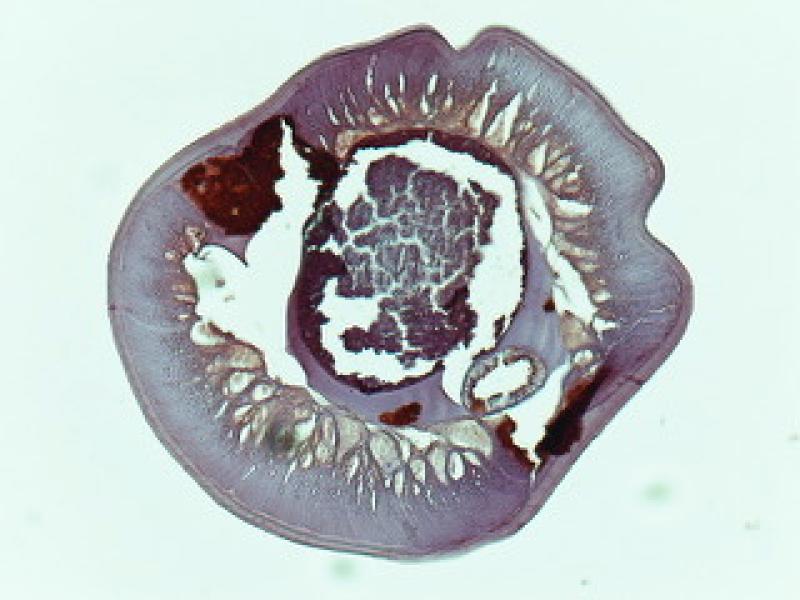
También se ha observado que la administración de doxiciclina es capaz de prevenir el desarrollo de la larva infectante en adulto. Esto se observó en perros con dirofilariosis que recibieron doxiciclina a 10 mg/kg/ 12h durante 30 días. Cinco meses después, un grupo de mosquitos fueron alimentados con sangre microfilarémica de estos animales, se permitió que la larva se desarrollara hasta su estadio infectante, y posteriormente varios perros sanos fueron infectados con estas larvas; sin embargo, ninguna se desarrolló como adulta. Seguramente, la ausencia de Wolbachia en la larva infectante haya provocado que no pudiera continuar su desarrollo en el nuevo hospedador. Resultados similares se observaron en huéspedes humanos infectados por O. volvulus y tratados con doxiciclina, dando como resultado la producción de microfilarias que no pueden continuar el desarrollo en el vector de la mosca negra. De hecho, el número de larvas infecciosas recolectadas de moscas que se alimentaron de hospedadores tratados con doxiciclina fue significativamente menor que las encontradas en moscas que se alimentaron de controles no tratados.
El hecho de que la doxiciclina pueda prevenir la transmisión de filaria lo hace interesante de cara a los casos de dirofilariosis canina en los que se sospecha de resistencia a las lactonas macrocíclicas. Los resultados son extremadamente interesantes y muy relevantes en términos de romper el ciclo de vida del parásito y bloquear la transmisión de cepas resistentes de D. immitis.
En la dirofilariosis felina, no existen estudios que determinen la utilidad de la administración de doxiciclina. Aunque la lógica indica que sería igualmente eficaz para eliminar Wolbachia en los pacientes felinos, se desconoce las implicaciones de su uso en esta especie, y dado que podría acelerar la muerte de los gusanos adultos provocando graves daños en el gato hospedador, hasta que se lleven a cabo más estudios actualmente no se recomienda su administración.
¿Cómo se debe administrar la doxiciclina?
Tratamiento adulticida
Las guías actuales recomiendan una pauta de doxiciclina, administrada vía oral durante 30 días, a una dosis de 10 mg/kg/12 h. Su administración debe iniciarse desde el momento del diagnóstico, junto con la primera dosis mensual de lactonas macrocíclicas (Tabla 1). El tratamiento adulticida podría iniciarse al terminar los 30 días del tratamiento antibiótico, o bien podría esperarse otros 30 días adicionales, continuando la administración mensual de lactonas macrocíclicas, en cualquier caso. Se desconoce si dejar un mes entre la finalización de la administración de doxiciclina y la primera dosis de adulticida es necesario para obtener una disminución en la patología pulmonar asociada a la eliminación de Wolbachia. Es decir, se desconoce si la bacteria está eliminada completamente tras un mes de doxiciclina, o si es necesario dejar pasar más tiempo para la completa eliminación de la bacteria y sus antígenos circulantes. Además, el uso combinado de lactonas macrocíclicas a dosis preventivas junto a doxiciclina reduce el número de microfilarias mucho más rápidamente, apareciendo perros amicrofilarémicos en menos de 3 meses.
| Tabla 1. Resumen del protocolo de tratamiento adulticida recomendado. |
| Día | Tratamiento Opción A | Tratamiento Opción B |
| Día 0 | Iniciar restricción de tratamiento Administrar lactona macrocíclica mensual Administrar doxiciclina (10 mg/kg/BID) durante 28-30 días | |
| Día 30 | Administrar lactona macrocíclica mensual | Administrar lactona macrocíclica mensual 1ª dosis IM de melarsomina (2,5 mg/kg) |
| Día 60 | Administrar lactona macrocíclica mensual 1ª dosis IM de melarsomina (2,5 mg/kg) | Administrar lactona macrocíclica mensual 2ª dosis IM de melarsomina (2,5 mg/kg) |
| Día 61 | 3ª dosis IM de melarsomina (2,5 mg/kg) | |
| Día 90 | Administrar lactona macrocíclica mensual 2ª dosis IM de melarsomina (2,5 mg/kg) | Revisión y alta, continuar tratamiento mensual con lactonas macrocíclicas |
| Día 91 | 3ª dosis IM de melarsomina (2,5 mg/kg) | |
| Día 120 | Revisión y alta, continuar tratamiento mensual con lactonas macrocíclicas | |
| Dia 241 | Prueba de antígenos y test de microfilaremia 6 meses después de la última inyección | |
| Día 271 | Prueba de antígenos y test de microfilaremia 6 meses después de la última inyección | |
Iniciar restricción de tratamientoAdministrar lactona macrocíclica mensualAdministrar doxiciclina (10 mg/kg/BID) durante 28-30 días
Tratamientos alternativos
Se ha demostrado que la combinación de lactonas macrocíclicas y doxiciclina son adulticidas tanto en perros infectados de forma experimental como natural. La mayoría de los estudios se han concentrado en dosis preventivas de ivermectina, ya sea semanal o quincenalmente durante 6 meses, combinadas con doxiciclina a 10 mg/kg, ya sea cada 12 o 24 horas. Los perros infectados generalmente comienzan a ser negativos para los antígenos circulantes aproximadamente a los 12 meses desde el comienzo de la terapia. Los efectos adulticidas de la moxidectina combinada con doxiciclina también se han demostrado después de nueve dosis mensuales de moxidectina tópica combinada con 30 días de 10 mg/kg de doxiciclina, apareciendo perros serológicamente negativos desde los 10 meses.
Parece ser que la acción conjunta de ambos medicamentos (doxiciclina y lactonas macrocíclicas) es capaz de eliminar una gran población de gusanos en un período de tiempo relativamente corto (8-10 meses). Todavía no se sabe si esto se debe a un simple efecto sumatorio o si existe una cierta sinergia entre los dos fármacos. La ivermectina causa disfunción neuromuscular, parálisis faríngea y engrosamiento del epitelio intestinal, y puede ser que la ingesta retenida y la mayor permeabilidad intestinal causada por la ivermectina aumenten la concentración de doxiciclina dentro del gusano.
Los dos medicamentos también pueden estar interactuando a nivel molecular. La ivermectina es capaz de reducir el flujo celular de antibióticos en animales de granja, aumentando así la concentración intracelular de este último. Parece que esto se debe a la capacidad de la ivermectina para inhibir la actividad de varios sistemas de transporte celular. Otra posibilidad es una pérdida de tolerancia inmune debido a la pérdida de Wolbachia, y que los efectos adulticidas de doxiciclina e ivermectina estén asociados con una disminución en la tolerancia inmune hacia el parásito.
La European Society of Dirofilariosis y Angiostrongylosis (ESDA) y la American Heartworm Society (AHS) no recomiendan el uso de dosis múltiples de preventivos de lactonas macrocíclicas junto la doxiciclina para el tratamiento de la infección por D. immitis. No obstante, en situaciones clínicas en las que el tratamiento con melarsomina no es factible, la doxiciclina y las lactonas macrocíclicas se han utilizado como tratamiento alternativo; en la literatura, sólo se ha evaluado este tratamiento con ivermectina (semanal o quincenalmente) y moxidectina (mensualmente).
El seguimiento a largo plazo y la evaluación clínica de perros infectados de forma natural tras emplear este protocolo aún se está estudiando. El efecto adulticida de la combinación de lactonas macrocíclicas y doxiciclina requiere un periodo prolongado de tiempo antes de que los parásitos sean eliminados completamente. Además, cuanto más viejo sea el parásito al ser expuesto a la ivermectina por primera vez, más tiempo tarda en morir. Mientras tanto, la infección persiste y empeora debido a la persistente irritación de la vasculatura pulmonar por parte de los parásitos. Esta, además, es exacerbada por la nula restricción de ejercicio durante ese periodo de tiempo. Si durante el intervalo en que dura el tratamiento los perros estuvieran en un régimen de restricción de ejercicio, el daño a nivel de vasculatura pulmonar sería mínimo. Sin embargo, debido a la duración del tratamiento esta no es una opción viable. Finalmente, la muerte del parásito no se realiza en condiciones controladas y puede coincidir con un momento de elevada actividad física del perro, lo que podría agravar considerablemente el cuadro de tromboembolismo.
¿Cuáles son las perspectivas y líneas de investigación en la interacción entre Wolbachia y D. immitis?
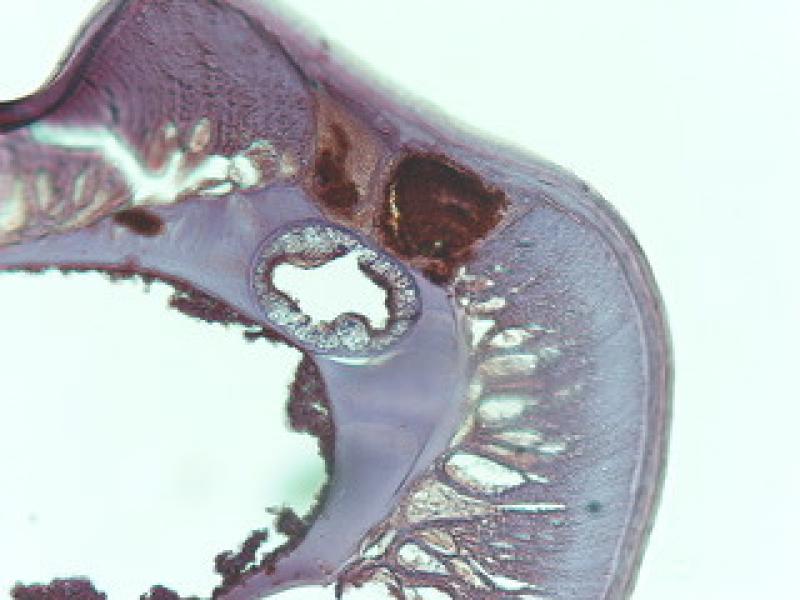
Aún existen muchas incógnitas en torno al papel de Wolbachia y su tratamiento. ¿Se necesita un mes completo de doxiciclina para que tenga efecto durante el tratamiento del parásito? En otras palabras, ¿cuál es el tiempo de administración mínimo necesario para la eliminación de Wolbachia en D. immitis? (Figura 10).
Respecto a la dosis administrada, ¿podrían emplearse dosis menores manteniendo la misma eficacia frente la bacteria? Actualmente se recomienda administrar 10 mg/kg/12 horas, dosis extrapolada de los tratamientos antibióticos administrados a otras bacterias rickettsiales, así como de diversos tratamientos experimentales llevados a cabo en situaciones laboratoriales. Por tanto, ¿podría administrarse con igual eficacia dosis de 10 mg/kg cada 24 horas, o 5 mg/kg cada 12 horas? Actualmente, existen estudios evaluando estas opciones terapéuticas.
Además, hay indicios de que el uso actual de doxiciclina en perros con dirofilariosis probablemente esté favoreciendo la aparición de cepas resistentes en otras bacterias, como Staphylococcus o Enterococcus. Por lo tanto, es necesario llevar a cabo más estudios que ayuden a determinar si realmente estamos dando la mejor dosis de doxiciclina a nuestros pacientes o si hay una mejor manera de dosificar este antibiótico, manteniendo la eficacia.
Responder estas preguntas avanzará nuestro conocimiento de las aplicaciones prácticas de la doxiciclina en el protocolo de tratamiento de la dirofilariosis. Incluso sin estas respuestas, sabemos que Wolbachia es un contribuyente significativo en el origen de la patología en perros infectados con D. immitis y, debido a que la doxiciclina puede eliminar Wolbachia, reducir la inflamación y la presencia de tromboembolismos pulmonares, ésta debe usarse siempre que sea posible.
En Estados Unidos, sucede con cierta frecuencia escasez nacional de doxiciclina, causada principalmente por una mayor demanda y algunos retrasos en la fabricación debido a la escasez de materias primas. Esto ha llevado a varios grupos de investigación a identificar nuevos antibióticos capaces de eliminar Wolbachia. Varios estudios han reportado la eficacia de rifampicina contra Wolbachia in vitro, si bien la minociclina parece ser la opción más próxima a doxiciclina cuando esta última no está disponible. Las estrategias de dosis de minociclina todavía se están evaluando, pero los datos hasta la fecha sugieren que dosis similares a la doxiciclina son efectivas. En perros, dosis de 5-10 mg/kg vía oral cada 12 h parecen alcanzar concentraciones suficientes para la mayoría de los organismos estudiados. Además, recientemente se han identificado varios fármacos novedosos con una cinética anti-Wolbachia superior, que son capaz de eliminar eficazmente la bacteria en 7 días, en comparación con los 30 días necesarios para los antibióticos existentes. Existen varios candidatos en sus etapas preclínicas, denominados AWZ1066, ABBV-4083 y ABBY-4083.
Referencias
American Heartworm Society. Guidelines for the Diagnosis, Prevention, and Management of Heartworm (Dirofilaria immitis) Infection in Dogs and Cats. 2018. Disponible en: http://www.heartwormsociety.org
Dingman P, Levy JK, Kramer LH, Johnson CM, Lappin MR, Greiner EC, Courtney CH, Tucker SJ, Morchon R. Association of Wolbachia with heartworm disease in cats and dogs. Vet Parasitol. 2010;170(1-2):50-60.
European Society for Dirofilariosis and Angiostrongylosis. Guidelines for clinical management of canine heartworm disease. 2017. Disponible en: https://www.esda.vet
García-Guasch L, Caro-Vadillo A, Manubens-Grau J, Carretón E, Morchón R, Simón F, Kramer LH, Montoya-Alonso JA. Is Wolbachia participating in the bronchial reactivity of cats with heartworm associated respiratory disease? Vet Parasitol. 2013;196(1-2):130-5.
Kozek WJ. Ultrastructure of the microfilaria of Dirofilaria immitis. J Parasitol. 1971;57(5):1052-67.
Kramer L, Crosara S, Gnudi G, Genchi M, Mangia C, Viglietti A, Quintavalla C. Wolbachia, doxycycline and macrocyclic lactones: New prospects in the treatment of canine heartworm disease. Vet Parasitol. 2018;254:95-97.
Kramer LH, Tamarozzi F, Morchón R, López-Belmonte J, Marcos-Atxutegi C, Martín-Pacho R, Simón F. Immune response to and tissue localization of the Wolbachia surface protein (WSP) in dogs with natural heartworm (Dirofilaria immitis) infection. Vet Immunol Immunopathol. 2005;106(3-4):303-8.
McHaffie J. Dirofilaria immitis and Wolbachia pipientis: a thorough investigation of the symbiosis responsible for canine heartworm disease. Parasitol Res. 2012;110(2):499-502.
Morchón R, Ferreira AC, Martín-Pacho JR, Montoya A, Mortarino M, Genchi C, Simón F. Specific IgG antibody response against antigens of Dirofilaria immitis and its Wolbachia endosymbiont bacterium in cats with natural and experimental infections. Vet Parasitol. 2004;125(3-4):313-21.
O'Neill, S. Genome Sequence of the Intracellular Bacterium Wolbachia. PLoS Biol 2004: e76.
Simón F, Kramer LH, Román A, Blasini W, Morchón R, Marcos-Atxutegi C, Grandi G, Genchi C. Immunopathology of Dirofilaria immitis infection. Vet Res Commun. 2007;31(2):161-71.
Sironi M, Bandi C, Sacchi L, Di Sacco B, Damiani G, Genchi C. A close relative of the arthropods endosymbiont Wolbachia in a filarial worm. Mol Biochem Parasitol. 1995;74(2):223-7.
 by Multimédica
by Multimédica