Aproximación diagnóstica al paciente con efusión pleural: Criterios de light
Resumen breve
En el perro y el gato, el derrame pleural es una de las alteraciones más comunes de la cavidad torácica. Para llegar al diagnóstico, la clasificación etiopatogénica resulta fundamental.Índice de contenidos
Resumen
En el perro y el gato, el derrame pleural es una de las alteraciones más comunes de la cavidad torácica. Para llegar al diagnóstico, la clasificación etiopatogénica resulta fundamental.
Inicialmente, en medicina veterinaria se distinguían entre trasudados (consecuencia de un aumento en la presión hidrostática o disminución en la presión oncótica) y exudados (como resultado del aumento de la permeabilidad vascular en vasos dañados/inflamados), analizando la gravedad específica, el contenido en proteínas totales y la celularidad del derrame para diferenciarlos.
Debido a la superposición común de los valores de estos parámetros entre el trasudado y el exudado, se introdujo el grupo de trasudado modificado. Este fue definido como un trasudado con proteínas totales y recuento de células nucleadas entre el trasudado y el exudado, en el que la pérdida de fluido se produce a través de los vasos no inflamados. Sin embargo, la gran cantidad de patologías asociadas a trasudados modificados y la superposición de contenido en proteínas y celularidad con trasudados y exudados de esta categoría, limitan la clasificación mencionada anteriormente.
Recientes estudios llevados a cabo en perros y gatos sobre la clasificación fisiopatológica de las efusiones pleurales, demuestran la mayor precisión de los criterios de Light frente a la clasificación tradicional. La determinación de la enzima lactatodeshidrogenasa y las proteínas totales en líquido pleural, así como la relación entre los valores séricos y pleurales, tienen una mayor capacidad para diferenciar entre trasudado y exudado.
Introducción
El espacio pleural se define como el área o espacio potencial entre los pulmones y la pared torácica, y está revestido por la pleural visceral y parietal respectivamente1. La división entre los hemitórax derecho e izquierdo es incompleta en los pequeños animales, pero es común observar enfermedades unilaterales o con distribución desigual cuando hay una gran cantidad de fibrina dentro del espacio pleural2.
No hay estructuras de tejido blando o aire en este espacio de forma normal. Sin embargo, puede haber una cantidad muy pequeña de líquido (1-5 ml) de forma fisiológica que no es detectable en las pruebas de imagen habitualmente realizadas1. Este líquido, facilita el movimiento de los pulmones en relación con la cavidad torácica y entre ellos, y distribuye las fuerzas durante la ventilación normal3,4.
El flujo fisiológico del líquido dentro del espacio pleural, está gobernado por la ley de Starling, el grado de permeabilidad mesotelial y endotelial y el drenaje linfático5. La pleura visceral tiene un papel importante para determinar la presión neta y favorece la reabsorción de líquido desde el espacio pleural, donde existe un mayor aporte vascular y una menor presión hidrostática4,6. Los vasos linfáticos pleurales también son un componente importante para la reabsorción de líquido y células desde el tórax2.
El derrame pleural ocurre cuando se produce una entrada de líquido pleural en mayor volumen del que se elimina7. En derrames crónicos, se pueden producir adherencias fibrosas en presencia de una enfermedad unilateral, pero como regla general, en perros y gatos el mediastino es incompleto y los derrames se dividen entre ambos hemitórax1.
El derrame pleural afecta a la función pulmonar, creando un efecto restrictivo con una disminución de la capacidad pulmonar. Los signos clínicos de la enfermedad del espacio pleural pueden incluir taquipnea, ortopnea, dificultad respiratoria evidente y la manifestación más frecuente es la clásica respiración rápida/superficial con esfuerzo abdominal marcado1. Se ha observado una asociación muy fuerte entre la ventilación paradójica y la enfermedad del espacio pleural, particularmente en gatos8. La auscultación revela sonidos ventilatorios y cardíacos atenuados, debido a la presencia de líquidos o tejidos, así como sonidos anormalmente fuertes o desplazados cuando hay enfermedades unilaterales o focales9.
Clasificación de la efusión pleural
Los derrames pleurales se clasifican en trasudados puros, trasudados modificados, exudados, hemotórax y quilotórax.
Trasudados
Cuando se alteran los factores que influyen en la formación y reabsorción del líquido pleural, se produce un derrame conocido como trasudado.
Los trasudados puros o bajos en proteínas se caracterizan por un bajo contenido en proteínas totales y un bajo recuento de células nucleadas totales (Figura 1) y se suelen desarrollar en forma secundaria a una disminución de la presión oncótica (p. ej., hipoalbuminemia) dentro de los vasos sanguíneos. También puede originarse a partir de un aumento de la presión hidrostática presinusoidal o sinusoidal (p. ej., hipertensión portal, obstrucción linfática)9.
Los trasudados modificados o ricos en proteínas se asocian con un aumento de la presión hidrostática poshepática (insuficiencia cardíaca) o de la permeabilidad vascular (p. ej., torsión de lóbulo pulmonar, hernia diafragmática) y originan derrames pleurales con mayor contenido proteico10. Sin embargo, en los animales con efusión crónica, la irritación de la pleura puede causar un aumento del recuento de células nucleadas totales y el agua puede ser reabsorbida en mayor medida que las proteínas y las células, lo que aumenta el recuento celular y la concentración de proteínas11.
Exudados
Las efusiones exudativas son el resultado de alteraciones de la permeabilidad de los capilares y se clasifican en sépticas y asépticas12.
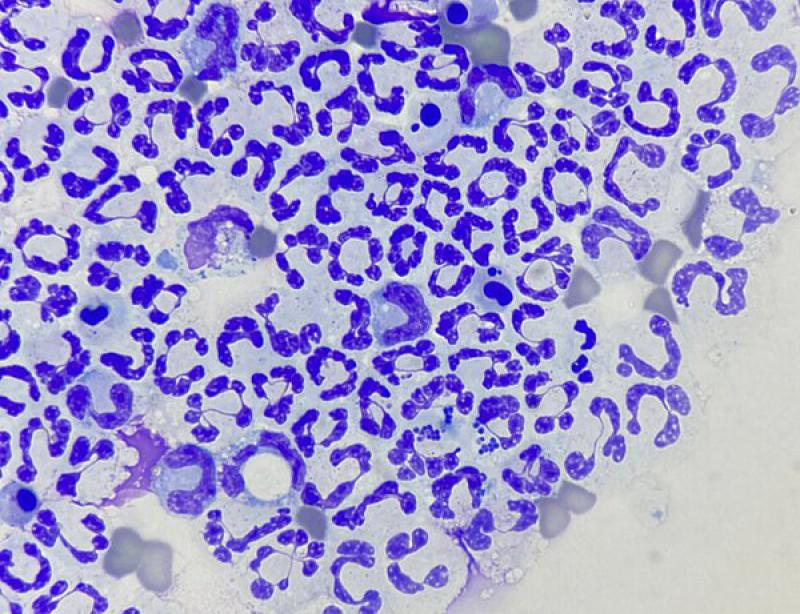
Los neutrófilos degenerados suelen predominar en los procesos infecciosos propios de exudados sépticos10 (Figura 2). Las bacterias pueden viajar por diseminación hematógena o linfática, lesiones penetrantes (iatrogénicas, cuerpos extraños inhalados o externos), heridas por mordedura, trauma o diseminarse a partir de órganos infectados (pulmones, tractos gastrointestinal) dando lugar al piotórax9. Otros tipos de microorganismos como hongos, protozoos y Rickettsia spp. también pueden causar exudados pleurales10.
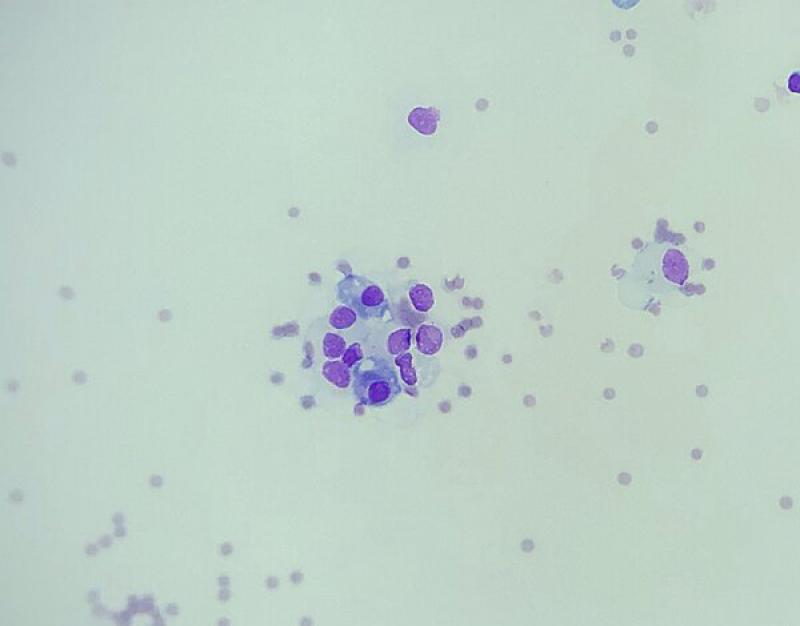
En el exudado aséptico, el tipo de célula predominante puede variar e incluir neutrófilos no degenerados (inflamación), linfocitos pequeños y macrófagos con variable actividad fagocítica. Los diagnósticos diferenciales en animales con exudado no séptico incluyen peritonitis infecciosa felina (PIF) (aunque con frecuencia tienen baja celularidad), hernia diafragmática crónica, torsión de lóbulo pulmonar y resolución de exudados sépticos12.
Aunque el quilotórax y las efusiones neoplásicas pueden tener características de exudados en lo referente al contenido de proteínas y al recuento de células nucleadas, estos se clasifican como categorías independientes por sus características particulares.
Quilotórax
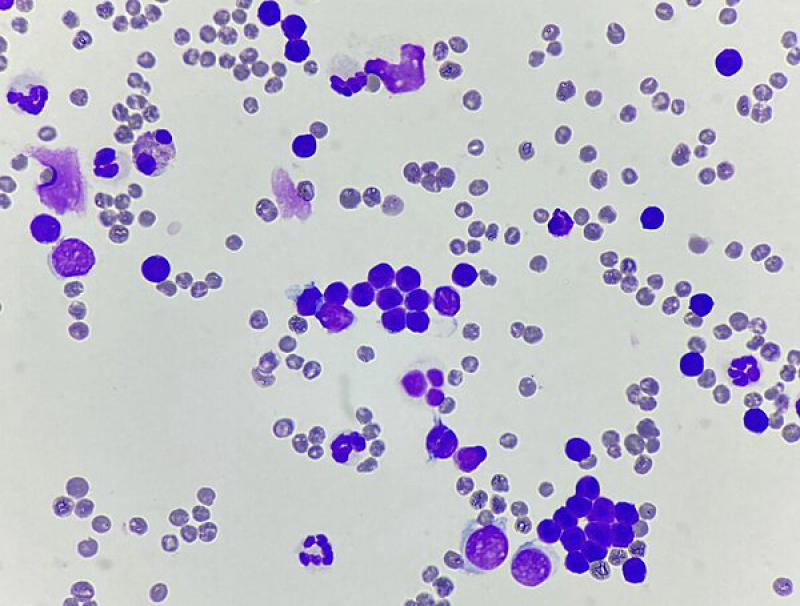
La efusión quilosa (quilotórax) se debe a la pérdida de linfa de los vasos linfáticos. El quilotórax tiene una concentración moderada de proteínas y el recuento de células nucleadas es de bajo a moderado12. Al principio de la enfermedad, la célula predominante es el linfocito pequeño (Figura 3), aunque también pueden estar presentes algunos neutrófilos10. Con el tiempo, los neutrófilos no degenerados se vuelven más predominantes y los linfocitos disminuyen. Además, puede aumentar el número de macrófagos y haber células plasmáticas. El diagnóstico se confirma midiendo las concentraciones de triglicéridos en el líquido pleural y el suero, siendo superiores en la efusión12.
La etiología puede ser idiopática o congénita, o puede ser secundaria a traumatismo, neoplasia, enfermedad cardíaca, enfermedad pericárdica, dirofilariosis, torsión de lóbulo pulmonar o hernia diafragmática13,14. La mayoría de los casos de quilotórax son idiopáticos, pero solo se puede llegar a este diagnóstico descartando otros trastornos9,15.
Hemotórax
El hemotórax se define como una efusión en el espacio pleural con un hematocrito superior al 10 %16, aunque esta definición es variable según la literatura consultada. La hemorragia dentro de la cavidad pleural puede ser causada por una coagulopatía grave, que suele estar relacionada con la ingestión de un rodenticida anticoagulante. Otras causas son traumatismos, hernia diafragmática, hernia de hiato, hemorragia tímica, neoplasia, tromboembolismo pulmonar, torsión de lóbulo pulmonar, infección por Spirocerca lupi, pancreatitis y dirofilarosis. La causa más común de hemotórax espontáneo en perros con un perfil de coagulación normal es la neoplasia17.
Efusiones neoplásicas
Las neoplasias intratorácicas pueden provocar la mayoría de los tipos de derrames (trasudados modificados, exudados, quilotórax o hemotórax), ya que pueden afectar a cualquier estructura intratorácica, incluidos los pulmones, los tejidos mediastínicos, le pleura, el corazón y los ganglios linfáticos18. La técnica de elección para este tipo de efusiones es el examen citológico del fluido (Figura 4), aunque en ocasiones pueden estar causadas por neoplasias no exfoliativas.
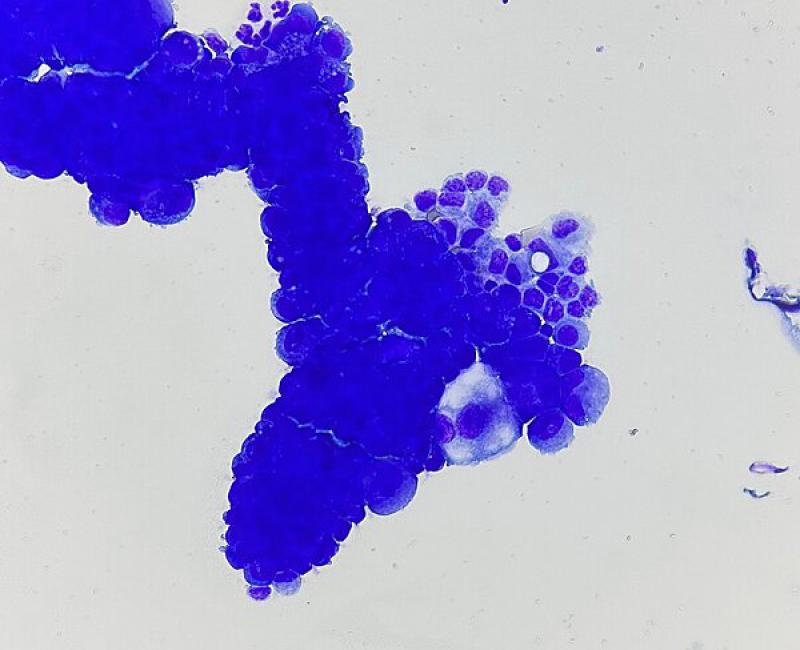
Protocolo diagnóstico de la efusión pleural
El diagnóstico de derrame pleural se realiza mediante pruebas de imagen1.
Estudio radiológico
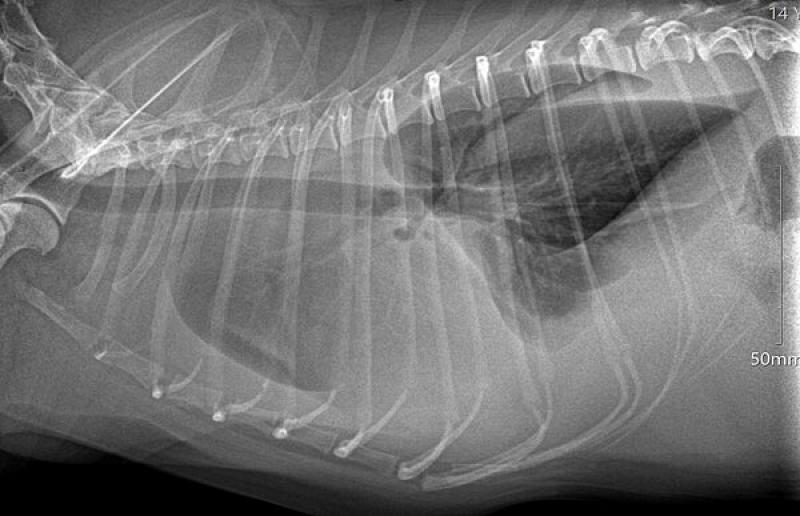
La radiografía ha sido tradicionalmente la técnica de imagen más utilizada, siendo útil para el diagnóstico y la cuantificación de la enfermedad del espacio pleural y otras patologías intratorácicas9. Los signos radiológicos de derrame pleural incluyen pérdida de definición, redondeo de los bordes pulmonares, líneas de fisura entre los lóbulos pulmonares y silueta cardíaca poco definida1 (Figura 5).
Las radiografías de haz horizontal tienen una mayor sensibilidad para la detección de la efusión pleural de volúmenes pequeños16.
La interpretación de las radiografías obtenidas en presencia de líquido es propensa a errores12. Por ello, la repetición de las radiografías después de la toracocentesis puede ser de utilidad para el diagnóstico, ya que permite evaluar la mejoría y optimizar la visualización de las estructuras intratorácicas9.
Ecografía
El examen ecográfico, es muy útil para identificar de manera rápida la presencia de líquido pleural en situaciones de emergencia y para guiar la toracocentesis19. En pacientes en estado crítico, permite su examen con un estrés mínimo y la colocación directa de la aguja para efectuar la toracocentesis12. En ecografía, el derrame pleural se reconoce como un área anecoica, apareciendo de color negro1.
Tras realizar el diagnóstico de efusión pleural, la ecografía torácica, puede ser útil para identificar una patología subyacente, como una hernia diafragmática, procesos neoplásicos, enfermedad de la pared torácica o torsión de lóbulo pulmonar20. La presencia de líquido pleural facilita el estudio ecográfico del tórax. Si el paciente está estable, es preferible evaluar el tórax por ecografía antes de la extracción del líquido pleural12.
Toracocentesis
El tratamiento de la enfermedad del espacio pleural está dirigido, tanto a mejorar el estado respiratorio mediante la eliminación del líquido/aire, como a identificar la causa subyacente1 o, al menos, acotar la lista de diagnósticos diferenciales.
Los volúmenes de líquido o aire retirados deben ser medidos y anotados; en general de 5-30 ml/kg son necesarios para mejorar la mecánica ventilatoria. Sin embargo, una cantidad más pequeña puede ser útil con fines diagnósticos. Debe retirarse tanto derrame como sea posible1.
Análisis del líquido pleural
El diagnóstico del derrame pleural no es complejo. Sin embargo, la clasificación etiopatogénica del mismo puede resultar un desafío. Por ello, el análisis del líquido resulta fundamental1.
En medicina veterinaria, los derrames pleurales se han clasificado tradicionalmente como trasudados o exudados, utilizando el contenido de proteínas, la gravedad específica y la celularidad del derrame para diferenciarlos21. Debido a la superposición común en los valores de estos parámetros entre el trasudado y el exudado, posteriormente se introdujo el grupo de trasudado modificado, con valores intermedios en cuanto a contenido proteico y celularidad, pero como resultado de una mayor presión hidrostática22,23. Sin embargo, el gran número de trastornos asociados con trasudados modificados y el hecho de que esta categoría tiene superposición de contenido en proteínas y celularidad con trasudados y exudados, limitan el esquema de clasificación tradicional de las efusiones pleurales en medicina veterinaria24.
En medicina humana, las efusiones pleurales se clasifican únicamente como trasudados o exudados. Los criterios de light se usan ampliamente para realizar esta clasificación, evaluando el cociente de proteínas totales del derrame con las proteínas séricas (PTr), así como los niveles de lactato deshidrogenasa en fluido pleural (LDHp)1.
Examen macroscópico
La apariencia macroscópica del líquido puede ser purulenta, quilosa (lechosa), hemorrágica, serosa, serosanguinolenta o ictérica1. Aunque varios tipos de fluidos tienen un aspecto macroscópico característico, basar la tipificación solo en el aspecto puede dar lugar a una clasificación errónea y por lo tanto, también a un diagnóstico erróneo al no identificar poblaciones de organismos o de células anómalas12.
Análisis bioquímico
En personas, el análisis bioquímico del derrame pleural se realiza de forma más rutinaria que en perros y gatos. Las características bioquímicas del análisis del líquido pleural incluyen pH, concentración de glucosa, amilasa, creatinina o BUN, colesterol, triglicéridos y una variedad de otras sustancias. Sin embargo, este análisis en perros y gatos está limitado ya que, por ejemplo, valores bajos de glucosa no están asociados de forma tan consistente al derrame pleural séptico como en el caso del derrame abdominal séptico.
La determinación de la concentración de triglicéridos en líquido pleural y suero, permitirá el diagnóstico de quilotórax, siendo superior en la efusión12.
Lactato deshidrogenasa
La lactato deshidrogenasa (LDH), es una enzima citoplasmática con una masa molecular de 140 kDa. Está presente en prácticamente todos los sistemas de órganos y se libera de las células únicamente después del daño o muerte celular25,26,27. Por tanto, esta enzima puede servir como indicador de alteración patológica de la integridad celular25. La concentraciones elevadas de LDH en el líquido pleural pueden surgir de leucocitos activados, lesionados o muertos, células neoplásicas o células mesoteliales pleurales y representan un marcador sensible de un proceso exudativo subyacente24.
Un estudio realizado al respecto mostró que la concentración de LDHp era significativamente más baja en gatos con un trasudado y usando LDHp > 226 UI/1 como valor de corte (Tabla 1), la sensibilidad y especificidad fueron del 100 % al diferenciar los trasudados de los exudados24.
Aunque los eritrocitos contienen una gran cantidad de LDH, un estudio en humanos no demostró correlación entre el nivel de LDH y los eritrocitos en líquido pleural, mientras que otro si lo apoyó28,29. Por ello, en casos de hemólisis marcada, se debe cuestionar el uso de LDHp24.
Proteínas totales
La determinación de las proteínas totales en la efusión pleural (PTp) y el cociente de proteínas totales del derrame con las proteínas séricas (PTr) también resulta útil en la clasificación de los derrames pleurales. Un nivel de corte de PTp de 35 g/l y de PTr 0.57 para separar exudados de trasudados (Tabla 1), mostró una sensibilidad del 91 % y especificidad del 100 %21,24.
| Tabla 1. Valores de corte para LDHp (concentración de lactatodeshidrogenasa en efusión pleural) y PTr (cociente de proteínas totales del derrame entre las proteínas totales séricas) para la diferenciación de las efusiones entre trasudados y exudados. . |
| Fluido pleural | LDHp | PTr |
| Trasudado | ≤ 226 | ≤ 0.56 |
| Exudado | > 226 | > 0.56 |
Una de las causas que provocan que un trasudado presente PTp en rango exudativo es la administración de diuréticos previa a la recolección de la muestra. Esto ocurre ya que se produce una eliminación del componente de agua del derrame, dando valores de PTp y PTr más altos30,31. En estos pacientes, determinar el gradiente de albúmina puede ser de utilidad7,32,33. Además, también pueden verse aumentados en los trasudados producidos por un aumento de la presión hidrostática, ya que este conlleva la apertura de los poros más grandes en el endotelio34.
También podrán observarse exudados que presenten una PTp menor que el valor de corte para esta categoría, en pacientes cuyas proteínas totales séricas se encuentren disminuidas. Esto se debe a que la mayor parte del contenido de proteínas en el derrame se deriva de la pérdida de proteínas séricas a través de la microvasculatura pulmonar o pleural comprometida, observándose una correlación positiva entre las proteínas del suero y del líquido pleural. Dado que la mayoría de las proteínas de la efusión pleural se derivan del suero, la PTr no debería verse afectada en el mismo grado en el caso de una alteración del valor de las proteínas séricas35.
Una vez clasificado el derrame como trasudado, la determinación de albúmina sérica es útil para determinar si se debe a una diminución de la presión oncótica24.
NT-proBNP
La concentración de NT-proBNP en derrame pleural es alta en gatos con fallo cardíaco congestivo. Una concentración de NT-proBNP en el líquido pleural > 322.3 pmol/ml se asoció con una sensibilidad del 100 % y una especificidad del 94 % para diferenciar derrames cardiogénicos de no cardiogénicos en una serie de casos felinos1.
Si los resultados son compatibles con exudado, deberán realizarse pruebas complementarias para alcanzar el diagnóstico definitivo24.
Recuento de células nucleadas
Aunque en medicina humana el recuento total de células nucleadas en el derrame pleural (TNCCp) no se ha encontrado útil para distinguir entre exudado y trasudado, en medicina veterinaria un TNCCp > 700 µl es uno de los valores de corte sugeridos para este propósito10. Sin embargo, estudios realizados recientemente en gatos, muestran una sensibilidad del 55 % y especificidad del 100 % para clasificar el derrame como un exudado. Aunque TNCCp no parece ser tan útil como TPr y LDHp para discriminar correctamente entre un trasudado y un exudado, el análisis citológico y el recuento celular del líquido sigue siendo de suma importancia en la investigación de la causa de una enfermedad24. Los hallazgos citológicos incluyen la presencia de células neoplásicas, linfocitos pequeños, neutrófilos, bacterias, células de la serie roja, macrófagos y células mesoteliales1.
Detección de agentes infecciosos
El cultivo bacteriano y antibiograma debe realizarse en casos en los que se sospeche de infección o con derrames neutrofílicos. Se usa frecuentemente para evaluar organismos aeróbicos, aunque el piotórax a menudo está causado por infecciones anaeróbicas. Los cultivos bacterianos anaeróbicos pueden ser difíciles de realizar, y se puede tener poca información sobre la sensibilidad1.
En todos los casos de exudados, se recomienda realizar los cultivos para microorganismos aerobios y anaerobios. Nocardia spp., Actinomyces spp. y Fusobacterium spp. son bastones filamentosos difíciles de hacer crecer o de identificar en los medios de cultivo o exámenes citológicos o histológicos10,14.
La infección vírica puede producir derrame pleural, siendo las pruebas de PCR muy útiles para detectar organismos infecciosos1.
Otras pruebas complementarias
Las pruebas laboratoriales rutinarias, incluyendo hemograma, perfil bioquímico y urianálisis, están recomendadas para investigar una enfermedad sistémica. Se recomienda realizar pruebas de tiroides en gatos y pruebas para la dirofilariosis en zonas endémicas1.
La ecocardiografía es útil para el diagnóstico de enfermedades cardíacas, tumores de base cardíaca y enfermedades de pericardio9.
La tomografía computarizada (TC) y la resonancia magnética (RM), también pueden evidenciar derrames pleurales pero se usan de forma menos frecuente como modalidad diagnóstica inicial1. La TC torácica está indicada en pacientes con enfermedad pleural o mediastínica si no se consigue alcanzar el diagnóstico con las pruebas de imagen de rutina para evaluar causas subyacentes del derrame12.
En casos complicados, puede resultar necesario realizar una toracotomía para obtener un diagnóstico12.
La toracoscopia es otra herramienta de diagnóstico y tratamiento útil en pacientes con efusión pleural y otras patologías intratorácicas, ya que permite una buena visualización de las estructuras torácicas y es de ayuda para la obtención adecuada de muestras para biopsia36,37.
Conclusión
Las efusiones pleurales deben ser clasificadas según los criterios de Light, ya que numerosos estudios realizados recientemente en medicina veterinaria muestran una mayor precisión en la diferenciación entre exudados y trasudados que la clasificación tradicional24,33,38.
En el caso de un trasudado, la evaluación posterior de la albúmina sérica aclarará si el derrame formado se debe a una disminución de la presión osmótica coloide o al resultado de un aumento de la presión hidrostática. Sin embargo, en caso de identificar un proceso exudativo deberán llevarse a cabo pruebas complementarias para alcanzar el diagnóstico definitivo (recuento celular, cultivo microbiológico, etc.)24.
Bibliografía
- Ettinger SJ, Feldman EC, Côté E. Tratado de medicina interna veterinaria. 8ed. Zaragoza: Asis. 2021.
- Noone KE. Pleural effusion and diseases of the pleura. Vet Clin North Am Small Anim Pract. 1985;15:1069.
- Dyce KM, Sack WO, Wensing CJC. Textbook of veterinary anatomy. 3ed. St Louis; 2002.
- Dempsey SM, Ewing PJ. A review of the pathophysiology, classification and analysis of canine and feline cavitary effusions. J Am Anim Hosp Assoc. 2011;47:1.
- Starling EH, Tubby AH. On absorption from and secretion into the serous cavities. J Physiol. 1894;16:140-55.
- Miserocchi G. Physiology and pathophysiology of pleural fluid turnover. Eur Respir J 1997;10: 219-25.
- Porcel JM, Light RW. Diagnostic approach to pleural effusions in adults. Am Fam Physician. 2006;73:1211-20.
- Le boedec K, Arnaud C, Chetbould V. Relationship between paradoxical breathing and pleural diseases in dyspneic dogs and cats: 389 cases (2011-2009). J Am Vet Med Assoc. 2012; 240(9): 1095.
- Silverstein DC, Hopper K. Small animal critical care medicine. 2ed. St. Louis: Elsevier. 2015.
- Cowell RL, Tyler RD, Meinkoth JH. Abdominal and thoracic fluid.Diagnostic Cytology and Hematology of the Dogs and Cats.2ed. St Louis. 1999;142–158.
- King LG. Textbook of respiratory disease in dogs and cats. St Louis. 2004, Saunders.
- Nelson RW, Couto CG. Medicina interna de pequeños animales. 6ed. Zaragoza: Asis. 2020.
- Bichard SJ, Smeak DD, McLoughlin MA. Treatment of idiopathic chylothorax in dogs and cats. J Am Vet Med Assoc. 1998:212:652.
- Greenberg MJ, Weisse CW. Spontaneus resolution of chylothorax in a cat. J Am Vet Med Assoc. 2005; 226:1667.
- Fossum TW, Mertens MM, Miller MW. Thoracic duct ligation and pericardiectomy for treatment of idiopathic chylothorax. J Vet Intern Med. 2004;18:307.
- Lynch KC ,Oliveira CR, Matheson JS, et al. Detection of pneumothorax and pleural effusion with horizontal beam radiography. Vet Radiol Ultrasound. 2012; 53(1):38.
- Nakamura RK, Rozanski EA, Rush JE. Non-coagulopathic spontaneus hemothorax in dogs. J Vet Emerg Crit Care. 2008; 18(3):292.
- Taubert J. Treatment of malignan pleural effusion. Nurs Clin North Am. 2001;36:665.
- Lisciandro GR. Abdominal and thoracic focused assesment with sonography for trauma, triage and monitoring in smalll animals. J Vet Emerg Crit Care. 2011; 21(2):104.
- Larson MM. Ultrasound of the thorax (noncardiac). Vet Clin North Am Small Anim Pract. 2009; 39 (4): 733.
- Gilmore CH, Munson TO. Abnormal chest fluids including chylothorax.Current Veterinary Therapy III Small Animal Practice.3ed. WB Saunders; Philadelphia. 1968;174–177.
- Perman P. Transudates and exudates.Clinical Biochemistry of Domestic Animals.2ed. Academic Press. New York and London. 1971;255–270.
- Perman V, Osborne CA, Pleural effusion.Current Veterinary Therapy IV Small Animal Practice.4ed. Philadelphia. 1971;157–160.
- Zoia A, Slater LA, Heller J, et al. A new approach to pleural effusion in cats: markers for distinguishing trasudates from exudates. J Feline Med Surg. 2009;11: 847-855.
- Drent M, Cobben NAM, Henderson RF, Jacobs JA, Wouters EFM, Van Dieijen-Visser MP. Usefulness of lactate dehydrogenase and its isoenzymes as indicator of lung damage or inflammation.Eur Respir J.1996;9:1736–1742.
- Lott JA, Nemensanszky E. Lactate dehydrogenase.Clinical enzymology, a case oriented approach.Year Book Medical Publishers. Chicago. 1986;213–244.
- Glick JH. Serum lactate dehydrogenase isoenzyme and total lactate dehydrogenase values in health and disease, and clinical evaluation of these tests by means of discriminant analysis.Am J Clin Pathol.1969;52:320–328.
- Eid AA, Kedissi JI, Samaha M, Tawk MM, Kimmell K, Kinasewitz T. Exudative effusion in congestive heart failure.Chest.2002;122:1503–1505.
- Light RW, MacGregory MI, Luchsinger PC, Ball WC. Pleural effusion: the diagnostic separation of transudates and exudates.Ann Intern Med.1972;77:507–513.
- Chakko SC, Caldwell SH, Sforza PP. Treatment of congestive heart failure. Its effect on pleural fluid chemistry.Chest.1989;95:789–802.
- Shinto RA, Light RW. Effects of diuresis on the characteristics of pleural fluid in patients with congestive heart failure.Am J Med.1990;107:340–343.
- Burgess LJ, Martiz FJ, Talljaard JJF. Comparative analysis of the biochemical parameters used to distinguish between pleural transudates and exudates.Chest.1995;107:1604–1609.
- Zoia A, Drigo M. Diagnostic value of Light’s criteria and albumin gradient in classifying the pathophysiology of pleural effusion formation in cats. J Feline Med Surg. 2016; 18:666-72.
- Joseph J, Badrinath P, Basran GS, Sahn SA. Is albumin gradient or fluid to serum albumin ratio better than the pleural fluid lactate dehydrogenase in the diagnostic of separation of pleural effusion?BMC Pulm Med.2002;2:1–5.
- Joseph J, Badrinath P, Basran G.S., Sahns S.A. Is the pleural fluid transudate or exudate? A revisit of the diagnostic criteria.Thorax.2001;56:867–870.
- Kovac JR, Bergman PJ, Baer KE: Use of thoracoscopy to determine the etiology of pleural effusion in dogs and cats: 18 cases (1998-2001). J Am Vet Med Assoc. 2002;221(7):990.
- Monet E. Interventional thoracoscopy in small animals. Vet Clin North Am Small Anim Pract. 2009;39(5); 965-975.
- Zoia A, Petini M, Righetti D, Caldin M, Drigo M. Discriminating transudates and exudates in dogs with pleural effusion: diagnostic utility of simplified Light's criteria compared with traditional veterinary classification. Vet Rec. 2020;187(1)
 by Multimédica
by Multimédica