El frotis sanguíneo y la citometría de flujo como herramientas claves para el diagnóstico de la leucemia linfocítica crónica canina
Resumen breve
La citometría de flujo es una herramienta esencial para el diagnóstico de la LLC en perros. Esta técnica permite identificar con precisión las células tumorales y proporciona información valiosa para la toma de decisiones terapéuticas. El diagnóstico temprano y el tratamiento adecuado son cruciales para mejorar el pronóstico de los perros con LLC.Índice de contenidos
Resumen
El frotis sanguíneo representa una técnica diagnóstica económica, que se puede utilizar en la práctica diaria para confirmar o detectar alteraciones en el hemograma, así como valorar la morfología de las células sanguíneas.
La leucemia linfocítica se define como la proliferación de linfocitos neoplásicos en la médula ósea. Estas células generalmente se originan en la médula ósea, y ocasionalmente en el bazo, pudiendo aparecer en la sangre periférica.
En el caso de la leucemia linfocítica crónica, los síntomas pueden ser inespecíficos. La realización de un hemograma con estudio de frotis sanguíneo puede dar mucha información útil para el diagnóstico, siendo la citometría de flujo clave para la correcta y completa caracterización del proceso.
El objetivo de este artículo es realizar una revisión de la técnica e interpretación del frotis sanguíneo, recordar la importancia de su uso en la práctica clínica diaria, así como explicar de manera asequible para el veterinario generalista la citometría de flujo y su interés en la caracterización de los procesos linfoproliferativos.
Se concluye que el frotis es una técnica sencilla y de bajo coste, muy útil en la clínica diaria. Aunque se debe tener en cuenta que requiere de cierto entrenamiento a la hora de realizar una buena interpretación. La citometría de flujo resulta una gran herramienta para el diagnóstico y pronóstico de los procesos linfoproliferativos.
Caso clínico
Anamnesis
Acude a consulta una Labrador retriever de doce años, hembra castrada, con síntomas de apatía y fatiga de una semana de evolución.
Dicha paciente se encuentra en tratamiento con Librela® (INN-bedinvetmab) desde hace un año, debido a un proceso de artrosis.
Exploración
La paciente presenta las mucosas ligeramente pálidas. La auscultación cardíaca y respiratoria son normales, abdomen depresible y no se observan linfadenopatías evidentes. Temperatura 39 °C.
Se observa dolor articular en columna debido a discoespondiloartrosis y artrosis de ambas articulaciones coxofemorales.
Diagnóstico
Se realiza hemograma y bioquímica completos.
El hemograma muestra una anemia leve junto a error en la lectura de la serie blanca. Se procede a realizar un frotis sanguíneo en el que se confirma la presencia de marcada linfocitosis.
Se decide remitir la muestra de sangre entera en EDTA al laboratorio, observándose abundantes linfocitos atípicos, que hacen sospechar de un posible proceso linfoproliferativo (leucemia linfoide/linfoma estadio V) (Figura 1).
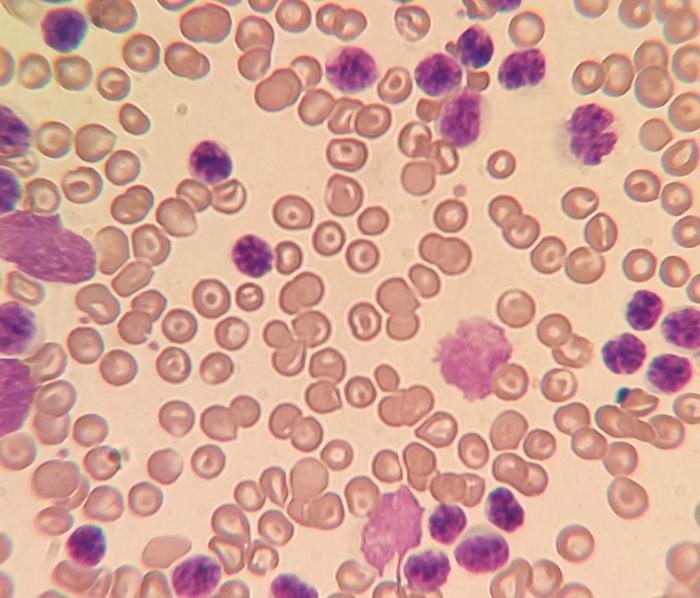
Figura 1. Frotis realizado en el hospital al obtener la lectura errónea de glóbulos blancos en la máquina de hematología. Dicho frotis revela la presencia de abundantes linfocitos atípicos.
Para confirmar la sospecha se extrae una nueva muestra de sangre entera en EDTA y se solicita la realización de una citometría de flujo (se requiere una muestra reciente de menos de 24 horas para la realización de la prueba).
El resultado de la citometría de flujo muestra una población linfoide homogénea de tamaño pequeño-intermedio que es positiva a CD5 y a CD8. Este hallazgo indica una proliferación de linfocitos T CD8 que es compatible con una leucemia linfoide crónica.
Tratamiento
Se programa una visita con el servicio de oncología y se propone a los propietarios la posibilidad de administrar un tratamiento quimioterápico.
Dicho tratamiento consiste en:
- Clorambucilo 2 mg/m2/48 h.
- Prednisona 20 mg/m2/48 hVO.
- Omeprazol 20 mg/24 h.
Evolución
Inicialmente la respuesta de la paciente es favorable, aunque 3 meses después del inicio del tratamiento, la paciente tiene un episodio de debilidad, anorexia y dolor, posiblemente atribuido a la artrosis. Se hospitaliza y se maneja la deshidratación con fluidoterapia y el dolor con buprenorfina. Pasados tres días la paciente mejora, se encuentra más animada y come un poco. Se vuelve a administrar el tratamiento con Librela® y se añade gabapentina a 5 mg/kg/8 h. Durante los siguientes 10 días la paciente se encuentra estable, pero tras este intervalo presenta una nueva recaída. En este caso la paciente se encuentra con debilidad marcada y severo dolor articular, que no se controla, por lo que los propietarios deciden que se realice la eutanasia humanitaria.
Introducción a la leucemia linfocítica
Definición
La leucemia linfocítica se define como la proliferación de linfocitos neoplásicos en la médula ósea. Estas células generalmente se originan en la médula ósea, pero ocasionalmente también son producidas en el bazo, pudiendo en ocasiones encontrarse circulando en la sangre periférica1.
Biología de los linfocitos
Los linfocitos son un grupo de células funcionalmente heterogéneo, pero con una morfología muy similar, que los hace casi indistinguibles morfológicamente entre ellos,pero que, sin embargo, pueden ser reconocidos gracias al inmunofenotipaje por las diferencias en sus marcadores de superficie. Se pueden subclasificar en linfocitos B, linfocitos T, natural killer (NK)2.
Los linfocitos cumplen diversas funciones según su tipo. Los linfocitos Bse encargan del sistema inmunitario mediado por anticuerpos, mientras que los linfocitos T se encargan del sistema inmunitario mediado por células2.
Para ser inmunitariamente competentes, los linfocitos deben migrar a compartimentos corporales específicos, con el objeto de madurar y expresar marcadores y receptores de superficie específicos.Los linfocitos destinados a ser linfocitos B migran a lamédula ósea, mientras que los linfocitos destinados a ser linfocitos T van a la corteza deltimo. Allí maduran a un estado inmunitariamente competente para posteriormente entrar en el sistema linfoide, donde sufrirán un proceso de mitosis, para formar un grupo de células idénticas conocido como clon, cuyos miembros reconocen y responden al mismo antígeno. Una vez estimulados por un antígeno específico, tanto los linfocitos B como los T proliferan y se diferencian en dos subpoblaciones2:
- Linfocitos de memoria (linfocitos B de memoria o bien linfocitos T de memoria), que no participan directamente en la respuesta inmunitaria, si no que perduran con una memoria inmunitaria, preparados para producir una respuesta de división y activación ante una exposición posterior a ese antígeno.
- Células efectoras (tanto de linfocitos B como de linfocitos T y sus subtipos). Estas células son linfocitos inmunocompetentes, preparados para la eliminación de antígenos, células extrañas o células alteradas por virus. En el caso de los linfocitos B, median la respuesta inmunitaria con anticuerpos, de manera que se diferencian en células plasmáticas que producen anticuerpos frente a los antígenos. Mientras que los linfocitos T median la respuesta inmune celular, diferenciándose en linfocitos T citotóxicos y linfocitos T citolíticos naturales (natural killer), que establecerán contacto físico con el agente agresor y tratarán de destruir las células dañadas por virus o células extrañas. Además, los linfocitos T se encargan de muchas respuestas inmunitarias, en su inicio y desarrollo (conocidos como linfocitos T helper) y supresión (linfocitos T reguladores), con la liberación de moléculas encargadas de la señalización, llamadas citoquinas (linfocinas), que inducirán respuestas específicas de otras células del sistema inmune.
Incidencia y factores de riesgo
La leucemia linfocítica es más común que la leucemia mieloide aguda y los trastornos mieloproliferativos, siendo la leucemia linfocítica crónica (CLL) mucho más frecuente que la leucemia linfocítica aguda (ALL)1.
Los perros de raza pequeña son más propensos a ser afectados, y generalmente ocurre en perros de mediana a avanzada edad, salvo en Bulldog que es más frecuente en una edad media, en torno a los 6 años3.
En el caso de los perros de raza Bóxer, se ha apreciado una supervivencia menor que en otras razas4.
Una alta expresión del marcador Ki67 (aproximadamente mayor al 40 %) parece indicar una menor supervivencia, al ser más agresiva la enfermedad4.
Clasificación y patología
Las leucemias linfocíticas se subdividen en crónicas (linfocitos pequeños, maduros) y agudas (linfocitos grandes e inmaduros). La evaluación inmunofenotípica puede caracterizar estos subtipos. En los perros, aproximadamente dos tercios de las CLL son de células T (T-CLL) y un tercio de células B (B-CLL)1.
En el caso de la leucemia linfocítica crónica, las células predominantes son células bien diferenciadas (neutrófilos o linfocitos), no blastos inmaduros como en la leucemia aguda5.
Signos clínicos
Se puede encontrar hepatoesplenomegalia, fiebre, palidez, vómitos y poliuria /polidipsia, hiporexia, fatiga5.
Diagnóstico
En el hemograma se puede encontrar leucocitosis y en algunas ocasiones citopenias (en un 80 % de los casos sepuede encontrar anemia y en el 50 % trombocitopenia)5. Con la ayuda de un frotis sanguíneo, se confirmarán las anomalías que aparecen en el hemograma. Es importante tener en cuenta que la integración de los hallazgos del frotis realizado, junto con la información de la historia clínica, será esencial para la realización de la citometría de flujo, así como su interpretación.
Gracias a la citometría de flujo se puede analizar las características de las células individuales, incluyendo su tamaño, forma y la presencia de marcadores específicos en la superficie celular.
Las pruebas de diagnóstico por imagen, como radiografías y ecografías, pueden ayudar a detectar el agrandamiento de los ganglios linfáticos, el bazo o el hígado6.
La capacidad de diagnosticar leucemias linfocíticas ha mejorado significativamente con técnicas morfológicas, de citometría de flujo, inmunofenotípicas y citoquímicas. Cabe citar, además, como diagnósticos diferenciales a la presencia de linfocitosis, se encuentra la ehrlichiosis crónica, la respuesta posvacunal en animales jóvenes, la elevación fisiológica transitoria o la respuesta inducida a la epinefrina2.
Tratamiento de la leucemia linfocítica crónica
El tratamiento se basa en hallazgos clínicos y de laboratorio. Muchos oncólogos recomiendan vigilancia activa sobre la terapia. Se recomienda el tratamiento en los casos en los que existan citopenias, organomegalia o gammapatías. Cuando se requiere tratamiento, el fármaco más efectivo es el clorambucilo, administrado oralmente. El tratamiento es principalmente paliativo, siendo muy poco frecuentes las remisiones completas1:
Clorambucilo 20 mg/m2 /2 semanas VO o 2 mg/m2/48 h.
Se puede añadir de forma opcional prednisona 20 mg/m2/48 h VO.
Otras opciones:
- Ciclofosfamida 50 mg/m2 4 días a la semana o cada 48 h VO.
- Prednisona 20mg/m2/48 h VO.
- Protocolo COP (ciclofosfamida 50 mg/m2/48 hVO o 300 mg/m2/3 semanas VO; vincristina 0.5 mg/m2/semanaIV; prednisona 40-50 mg/m2/24 hVO durante 1 semana y posteriormente 20-25 mg/m2/48 hVO)7.
Tratamiento de la leucemia linfocítica aguda
La ALL causa morbilidad significativa debido a la afectación de la médula ósea y citopenias periféricas graves. Requiere quimioterapia agresiva y terapias de soporte1.
Discusión
Citometría de flujo
La citometría de flujo, también conocida como citometría de fluorescencia de flujo (CFF), es una técnica biofísica de gran relevancia en el ámbito científico. Se basa en el empleo de luz láser para analizar y clasificar células individuales en suspensión, proporcionando información detallada sobre sus características físicas y químicas. Esta técnica ha revolucionado diversos campos, desde la inmunología y el diagnóstico oncológico hasta la investigación básica en biología celular1.
Ventajas de la citometría de flujo:
- Análisis multiparamétrico: permite evaluar simultáneamente múltiples características de las células individuales, proporcionando una imagen completa de su estado.
- Alta sensibilidad: detecta pequeñas poblaciones de células raras o con características aberrantes.
- Rapidez: analiza miles de células por segundo, permitiendo procesar grandes cantidades de muestras.
- Versatilidad: se puede aplicar a una amplia variedad de células y tipos de muestras.
Limitaciones de la citometría de flujo:
- Preparación de la muestra: requiere experiencia y cuidado para obtener resultados precisos.
- Análisis de datos: la interpretación de los datos complejos puede ser desafiante y requiere conocimientos especializados.
- Coste: el equipo y los reactivos pueden tener un precio elevado.
Aplicaciones en investigación veterinaria9:
- Inmunología veterinaria: la citometría de flujo permite caracterizar las células del sistema inmunitario de animales sanos y enfermos, evaluar su respuesta a patógenos y vacunas, y estudiar mecanismos de enfermedades inmunomediadas.
- Oncología veterinaria: esta técnica facilita la detección y el diagnóstico de diversos tipos de cáncer en animales, como linfomas, leucemias y tumores sólidos. Permite clasificar las células cancerosas, evaluar su proliferación y apoptosis, y monitorizar la respuesta al tratamiento.
- Enfermedades infecciosas: la citometría de flujo es crucial para el estudio de patógenos intracelulares y extracelulares, permitiendo identificar células infectadas, evaluar la respuesta inmune del huésped y desarrollar estrategias terapéuticas.
- Reproducción animal: esta técnica se utiliza para evaluar la calidad del semen, analizar la viabilidad y funcionalidad de los espermatozoides, y estudiar mecanismos de infertilidad.
- Fisiología veterinaria: la citometría de flujo permite estudiar diversos procesos fisiológicos en animales, como la diferenciación celular, la señalización celular y la respuesta al estrés.
Aplicaciones en veterinaria clínica10:
- Diagnóstico de enfermedades: la citometría de flujo se utiliza para diagnosticar diversas enfermedades, como leucemias, linfomas, inmunodeficiencias y enfermedades infecciosas, particularmente en caso de leishmaniosis visceral, mejorando la sensibilidad y especificidad en el diagnóstico11.
- Monitorización de la respuesta al tratamiento: esta técnica permite evaluar la eficacia de tratamientos quimioterapéuticos, inmunoterapéuticos y antibióticos en animales enfermos.
- Selección de animales de alto rendimiento: en el ámbito de la producción animal, la citometría de flujo se utiliza para seleccionar animales con características deseables, como una fuerte respuesta inmune o una alta calidad del semen.
- Medicina regenerativa: esta técnica se emplea para el estudio y desarrollo de terapias celulares en medicina veterinaria, como el trasplante de células madre.
Obtención y preparación de la muestra para la realización de la técnica:
Para evitar la obtención de datos incorrectos debido a la muerte de las células, la muestra de sangre, debidamente extraída al paciente, depositada en un tubo EDTA, debe ser enviada al laboratorio en el menor tiempo posible, ya que es muy importante que las células estén vivas para la realización de la prueba. Aun así, siempre será recomendable consultar al laboratorio de referencia, si hay algún requisito específico que se requiera para el envío de la muestra destinada a la realización de la citometría de flujo.
Frotis
Los frotis son una técnica sencilla, al alcance de la mayoría de los clínicos, que no requiere de una gran inversión. Con ellos se puede confirmar o reevaluar la información aportada por el equipo de hematología, además de obtener información extra que no se podría conseguir de otro modo. Algunos cambios en la morfología de los glóbulos rojos, pueden sugerir una pérdida crónica de sangre, exposición a tóxicos endógenos o exógenos, desórdenes vascularesy/oanemias hemolíticas inmunomediadas. Enel caso de los glóbulos blancos, cambios en su morfología pueden ser el primer hallazgo laboratorial de inflamación que puede llevar al diagnóstico de ciertas patologías, y principalmente la leucemia.
Igualmente, se pueden encontrar ciertos hallazgos en el frotis que permiten un diagnóstico temprano y posterior elección de la terapia más apropiada para el paciente. Un buen ejemplo son cierto tipo deparásitos (Babesia, amastigotes de Leishmania), inclusiones celulares patognomónicas y ciertas células neoplásicas12.
Los frotis sanguíneos son una herramienta diagnóstica esencial en la medicina veterinaria por varias razones13,14:
- Diagnóstico de enfermedades infecciosas: los frotis sanguíneos permiten la identificación de patógenos en la sangre, como bacterias, parásitos y protozoos. Esto es especialmente útil en el diagnóstico de enfermedades como la babesiosis, ehrlichiosis, anaplasmosis y leishmaniasis, entre otras.
- Evaluación de morfología celular: permiten una evaluación detallada de la morfología de los glóbulos rojos, blancos y plaquetas. Las anormalidades en la forma, tamaño y coloración de estas células pueden indicar diversas condiciones patológicas, como anemia, leucemia y otros trastornos hematológicos.
- Monitorización de tratamiento: los frotis sanguíneos se utilizan para monitorizar la respuesta al tratamiento en diversas enfermedades hematológicas e infecciosas. Esto es crucial para ajustar terapias y asegurar la eficacia del tratamiento.
- Diagnóstico de enfermedades metabólicas: pueden ayudar en la identificación de enfermedades de tipo metabólico y deficienciasnutricionales al mostrar cambios específicos en la morfología y número de células sanguíneas.
- Detección de intoxicaciones: los cambios en las células sanguíneas pueden ser indicadores de intoxicaciones por sustancias nocivas o medicamentos. La identificación de estas anormalidades puede ayudar a diagnosticar y tratar casos de envenenamiento.
- Evaluación de la salud general: los frotis sanguíneos proporcionan información sobre el estado general de salud del animal, permitiendo la detección temprana de enfermedades sistémicas que podrían no ser evidentes en los análisis de sangre de rutina.
Técnica de realización de un frotis15:
- Extracción de sangre y recolección en un bote con ácido etilendiaminotetraacético (EDTA) como anticoagulante de elección. Idealmente, se debería realizar la extensión antes de 4 horas posextracción, siempre que sea posible.
- Se coloca una gota de sangre (2-3 mm de diámetro) del bote de EDTA en el extremo de un portaobjetos, previamente homogeneizado, por inversión del mismo de forma manual o sobre balanza, de 4 a 6 veces, de forma suave y constante.
- Con la ayuda de otro portaobjetos limpio, se coloca en 30 grados sobre la gota (en caso de muestras con sangre muy concentrada) o de 40 a 45 grados (en el caso de muestras anémicas), permitiendo a la misma que impregne el borde por capilaridad.
- Con un movimiento suave pero firme, se arrastra la gota hacia el otro extremo del portaobjetos.
- Se deja secar al aire.
- Se introduce en la tinción disponible en el centro. En el caso de la tinción Romanowsky (Wright; Wright- Giemsa) son generalmente muy fiables y buenas para la posterior lectura del frotis, pero un poco más difíciles de manejar. En cambio, la tinción Rápida Romanowsky (Diff-Quik) es menos sensible al pH de la solución y forma precipitados con menos probabilidad; en contraposiciónes menos eficaz a la hora de demostrar la existencia de policromasia en eritrocitos inmaduros, gránulos de algunas células o cambios tóxicos en los neutrófilos.
- Evaluación del frotis: se habla de un frotis de buena calidad, cuando en la preparación se pueden diferenciar tres zonas que son el cabeza, cuerpo y cola. La importancia de las mismas, radica en la probabilidad de encontrar en cada zona unas células u otras. Así en el cuerpo del frotisse encuentran la mayoría de las células que se necesitan analizar y se puede observar la formación de pilas de monedas osignos de aglutinación. Encambio, en la cola es más probable encontrar monocitos y neutrófilos, o también parásitos como microfilarias, organismos fagocitados y células atípicas, y en la cabeza del frotis los linfocitos.
A la hora de interpretar el frotis, puede haber ciertos artefactos que pueden llevar a confusión, principalmente, a personal más novel. Entre ellos se encuentran16:
- Manchas de precipitado: se localiza como material granular de coloración rosa púrpura, normalmente pequeño, pero ciertamente, con un tamaño variable. Se pueden encontrar en los glóbulos rojos o en el fondo de la preparación. La distribución que presentan y su tamaño variable, serán la pista que permitirán diferenciarlos de parásitos hemáticos.
- Punteado basófilo: agregados de RNA retenidos. Son gránulos redondeados muy pequeños, azulados, que aparecen en el citoplasma de los glóbulos rojos. Son difíciles de diferenciar de los cuerpos de Pappenheimer, que también se muestran como gránulos pequeños azulados en los glóbulos rojos, y se corresponden con agregados por acumulación de hierro en los glóbulos rojos. Cuando aparecen dichos cuerpos de Pappenheimer en glóbulos rojos anucleados o nucleados, reciben el nombre de siderocitos o sideroblastos, respectivamente (latinción azul de Prusia es la única manera de confirmar si son cuerpos de Pappenheimer).
- Artefacto refráctil de los glóbulos rojos: pueden ser confundidos con parásitos hemáticos. Pueden tener diferentes tamaños, y se pueden confundir con parásitos como Mycoplasma spp. La manera de diferenciarlos de los parásitos es valorar si aparecen en diferentes tamaños, y ajustar el micrómetro en su eje vertical para ver si aparece refringencia.
Inicialmente, a bajo aumento (10x) se pueden ya identificar ciertas cosas que orientan en el proceso diagnóstico:
- Pilas de monedas: indican hiperproteinemia o inflamación. Se dispersan al echar una gota de solución salina fisiológica. En poca cantidad, puede considerarse normal en la especie felina.
- Aglutinación: indicador de anemia inmunomediada. No se dispersa al poner solución salina fisiológica. En el caso de las pruebas de aglutinación salina, debe tenerse en cuenta el tipo de dilución realizada, para la posterior interpretación del resultado, y poder minimizar la incidencia de falsos positivos. Se considera que, a mayor dilución salina en sangre, mayor especificidad, pero menor sensibilidad17.
Durante la interpretación de la morfología de cada grupo celular, se encuentran las siguientes anomalías15:
Anomalías en los eritrocitos:
- Anisocitosis y policromasia son indicadores de regeneración.
- Esferocitos, en número relevante, puede indicar toxicidad por Zinc, anemia inmunomediada o incluso, envenenamiento.
- Cuerpos de Heinz: en el caso de la especie canina, su presencia resulta patológicapor exposición del paciente a productos que pueden resultar tóxicos como el acetaminofén, zinc, cebolla, ajo, etc. En el caso de la especie felina, es posible encontrarlos en procesos de estrés metabólico, en un porcentaje superior al 75 % de los eritrocitos.
- Esquistocitos: su aparición se relaciona con la presencia de patología vascular, principalmente de coagulación intravascular diseminada y hemangiosarcoma.
- Células fantasma: presentes en un pequeño porcentaje de los eritrocitos en casos de hemólisisinmunomediada17.
- Acantocitos: asociados a la presencia de patología hepática, desechos metabólicos o anormalidades vasculares.
- Equinocitos: indican posible alteración electrolítica.
- Eritrocitos nucleados: indican regeneración medular, pero también son señal de daño endotelial (sepsis), neoplasia hematopoyéticao toxicidad.
Anomalías en los glóbulos blancos:
- Neutrófilos tóxicos: es un indicador de inflamación, incluso con un contaje total normal, por parte del analizador. Pueden presentar cuerpos de Döhle, los cuales son normales en gatos, siempre que estén en poca cantidad.
- Desviación a la izquierda: indicador de inflamación, principalmente de tejidos periféricos.
- Linfocitos reactivos: indicativo de estimulación antigénica.
- Inclusiones en los glóbulos blancos: indican la presencia de un agente infeccioso (por ejemplo, provocado por el virus del moquillo).
- Linfoblastos, mastocitos e histiocitos malignos: su presencia indica la necesidad de un diagnóstico diferencial de proceso neoplásico.
Plaquetas
- La observación al microscopio de la preparación, es muy útil a la hora de confirmar resultados compatibles con agregados plaquetares o la ausencia de las mismas, por consumo excesivo, en una coagulación vascular diseminada o trombocitopenia inmunomediada.
- Existen algunas razas que presentan macrotrombocitopenia, resultando en recuentos plaquetares bajos.
El análisis de frotis de sangre periférica es crucial en los laboratorios hematológicos para diagnosticar enfermedades como leucemias y linfomas, u otras patologías que el analizador de hemograma no puede diferenciar. Sin embargo, este análisis es subjetivo, requiere tiempo y depende de la experiencia del examinador. Gracias a las nuevas tecnologías, se ha podido desarrollar procesamiento automático para aprendizaje y reconocimiento de imágenes de células de sangre periférica, que permiten ayudar en la práctica laboratorial cotidiana.
Estas técnicas trabajan en la segmentación eficiente y la clasificación precisa de los diferentes tipos de células18.
La integración de estos sistemas automáticos, con capacidad de aprendizaje, resulta extremadamente útil en la práctica clínica y laboratorial cotidiana.
Conclusiones
La citometría de flujo es una herramienta esencial para el diagnóstico de la LLC en perros. Esta técnica permite identificar con precisión las células tumorales y proporciona información valiosa para la toma de decisiones terapéuticas. El diagnóstico temprano y el tratamiento adecuado son cruciales para mejorar el pronóstico de los perros con LLC. Esta técnica ha emergido como una herramienta fundamental en el campo de la veterinaria, ofreciendo un sinfín de posibilidades tanto en investigación como en el ámbito clínico. Su capacidad para analizar células individuales con precisión y rapidez la convierte en una técnica valiosa para el estudio de diversos aspectos de la salud animal.
Es importante destacar que la prevalencia real de la LLC canina podría ser subestimada, ya que algunos perros pueden no presentar síntomas o ser diagnosticados en etapas tardías de la enfermedad.
En cuanto al valor del frotis en la práctica diaria, se puede observar en aquellos pacientes con una inflamación marcada y una población de células neoplásicas circulantes, que reflejan un recuento normal de células blancas, en los analizadores convencionales, pues estos no son capaces de identificar las anomalías morfológicas. Es importante saber el número total células, pero por otro lado es imperativobuscar:
- Desviación a la izquierda.
- Cambios tóxicos.
- Células reactivas.
- Presencia de células neoplásicas (p. ej.: linfoblastos).
Con la ayuda de máquinas de automatización y aprendizaje, se puede además minimizar el error en la lectura de los mismos, debido a falta de experiencia del veterinario a la hora de interpretar el frotis; y se ahorra el tiempo dedicado a la interpretación del mismo.
En el caso clínico expuesto, la paciente presentaba un número de células linfocitos superior a 60000 células/microlitro, y anemia, por lo que lo que la esperanza de vida era menor de la esperada, para un paciente de su edad. Por este motivo se decidió realizar el tratamiento quimioterápico. En otros pacientes, con mejores resultados de sus parámetros de hemograma, puede decidirse no instaurar tratamiento.
Bibliografía
- Withrow S, MacEwen , Vail DM, Thamm DH, Liptak JM. Small animal clinical oncology. 6th ed. Missouri: Elsevier; 2020.
- Workman HC, Vernau W. Chronic lymfocytic leukemia in dogs and cats: the veterinary perspective. Veterinary Clinics of North America: Small Animal Practice. 2003;: p. 1379-1399.
- Bromberek JL, Rout ED, Agnew MR, Yoshimoto J, Morley PS, Avery AC. Breed distribution and clinical characteristics of B Cell Chronic Lymphocytic Leukemia in Dogs. Journal of Veterinary Internal Medicine. 2016 january; 30(1): p. 215-222.
- Rout ED, Labadie JD, Yoshimoto JA, Avery PR, Curran KM, Avery AC. Clinical outcome aand prognosis factors in dogs with B cell chronic lymphocytic leukemia: a retrospective study. Journal Internal Medicine. 2021 Mayo; 35(4): p. 1918-1928.
- Couto G, Moreno N. Oncología canina y felina, de la teoría a la práctica Zaragoza: Servet; 2013.
- Otoni LC, Valadares SM, Tonello R, Bandoch DG, Félix CH. Canine chronic lymphocytic leukemia: An update on diagnosis, prognosis and therapeutic aspects. Veterinary Research. 2021; 52(1): p. 1-10.
- Ruano R. Oncología práctica para el clínico de pequeños animales Barcelona: Multimédica Ediciones Veterinarias; 2013.
- Comazzi S, Gelain ME, Martini V, Riondato F, Miniscalco B, Marconato L, et al. Immunophenotype Predicts Survival Time in dogs with Chronic Lymphocytic Leukemia. Journal of Veterinary Internal Medicine. 2011; 25: p. 100-106.
- Evans SJM. Flow cytometry in veterinary practice. Veterinary clinics of North America Small Animal Practice. 2023 enero; 53: p. 89-100.
- Sanchez -Torres LE, Espinosa- Bonilla A, Diosdado-Vargas F. La citometría de flujo, un universo de posibilidades. Revista mexicana de ciencias pecuarias. 2022; 13: p. 763-786.
- Ker H, Coura-Vital W, Valadares D, Aguiar-Soares R, Brito RC, Veras F, et al. Multiplex flow cytometry serology to diagnosis of canine visceral leishmaniasis. Applied Microbiology and Biotechnology. 2019 agosto; 103: p. 8179-8190.
- Irwin PJ. Companion animal parasitology: A clinical perspective. International Journal for Parasitology: Parasites and Wildlife. 2002; 12: p. 177-187.
- Nelson W, Couto G. Manual de Medicina interna de pequeños animales. 1st ed. España E, editor. Madrid: Harcourt Mosby; 2006.
- Shuda Rani Chowdary C, Chaitanya Y, Rajesh K, Sai Krishna K, Lakshmi Rani N. Blood smear examination- A powerful tool for clinical diagnosis. Indian Journal. 2018; 19(2): p. 284-287.
- Valenciano AC, Cowell RL, Rizzi TE, Tyler RE. Atlas of canine and feline peripheral blood smears St Louis: Elsevier; 2014.
- Reagan W, Irizarry Rovira AR, DeNicola DB. Veterinary Hematology: Atlas of common domestic and non-domestic species Nueva Jersey: Wiley Blackwell; 2019.
- Sun PL, Jeffery U. Effect if dilution of canine blood samples on the specificity of saline agglutination test for immunemediated hemolysis. Journal of Veterinary Internal Medicine. 2020; 34(6): p. 2374-2383.
- Rodellar J, Alférez S, Acevedo A, Molina A, Merino A. Image processing and machine in the morphological analisys of blood cells. International Society for Laboratory Hematology. 2018; 40(1): p. 46-53.
 by Multimédica
by Multimédica
