Mieloma múltiple en un perro
Resumen breve
El mieloma múltiple es un tumor maligno poco frecuente en animales que se origina por una proliferación clonal de células plasmáticas o de sus precursores en la médula ósea. Cursa con hiperglobulinemia, a menudo marcada, que es responsable de gran parte de la patogénesis y del cuadro clínico, el cual puede afectar a diferentes sistemas (nervioso, ocular, renal y cardíaco, así como problemas de coagulación y de inmunosupresión con predisposición a infecciones secundarias). Los resultados…Índice de contenidos
Resumen
El mieloma múltiple es un tumor maligno poco frecuente en animales que se origina por una proliferación clonal de células plasmáticas o de sus precursores en la médula ósea. Cursa con hiperglobulinemia, a menudo marcada, que es responsable de gran parte de la patogénesis y del cuadro clínico, el cual puede afectar a diferentes sistemas (nervioso, ocular, renal y cardíaco, así como problemas de coagulación y de inmunosupresión con predisposición a infecciones secundarias). Los resultados del hemograma incluyen una anemia no regenerativa y otras posibles citopenias, y la bioquímica suele cursar con hipoalbuminemia, azotemia e hipercalcemia, entre otras alteraciones.
El diagnóstico se basa en la identificación de un mínimo de dos criterios entre los siguientes: un pico monoclonal en un trazado electroforético de proteínas séricas, la presencia de proteínas de Bence Jones en orina, evidencia radiográfica de lesiones osteolíticas y/o una infiltración medular por parte de células las plasmáticas (>20% de las células nucleadas)1. La quimioterapia permite una mejora notable de los síntomas y confiere una esperanza de vida alta.
A continuación, se expone el caso de un paciente canino que se presenta en consulta por pérdida de visión, poliuria y polidipsia. La clínica y la analítica sanguínea mostraban hiperglobulinemia e hipercalcemia, asociadas a una azotemia severa y una ligera anemia. Se diagnosticó un mieloma múltiple en base a los resultados de una electroforesis de proteínas séricas, radiografía torácica y citología de médula ósea. Se discuten los análisis de laboratorio, con elementos atípicos, así como la evolución después del tratamiento.
Caso Clínico
Un Basenji de 8 años, macho entero, se presenta en consulta por una historia de dos meses de pérdida progresiva de visión y un aumento del consumo de agua. El veterinario referente había realizado una analítica que mostraba una hiperglobulinemia y una hipercalcemia marcadas, así como una leucopenia y una anemia leves. Se instauró un tratamiento antibiótico y antiinflamatorio (AINES) que no produjo mejoras en el cuadro clínico. El examen oftalmológico puso en evidencia un desprendimiento y hemorragia retiniana bilateral. Una segunda analítica sanguínea evidenció una trombocitopenia, que se trató con doxiciclina y prednisolona sin éxito.
En su visita al centro de referencia, los principales problemas expuestos por los propietarios eran decaimiento, hiporexia, poliuria y un vómito aislado. El paciente había perdido unos 500 gramos en dos semanas. No constaban viajes al extranjero. En el examen físico general, el paciente se mostraba decaído y presentaba una deshidratación de entre 8 y 10 %, mucosas pálidas y taquicardia. La temperatura rectal era de 36 °C y durante la palpación rectal se detectó una pequeña cantidad de sangre fresca. La condición corporal era de 3/9. Por último, un examen neurológico confirmó la ceguera bilateral.
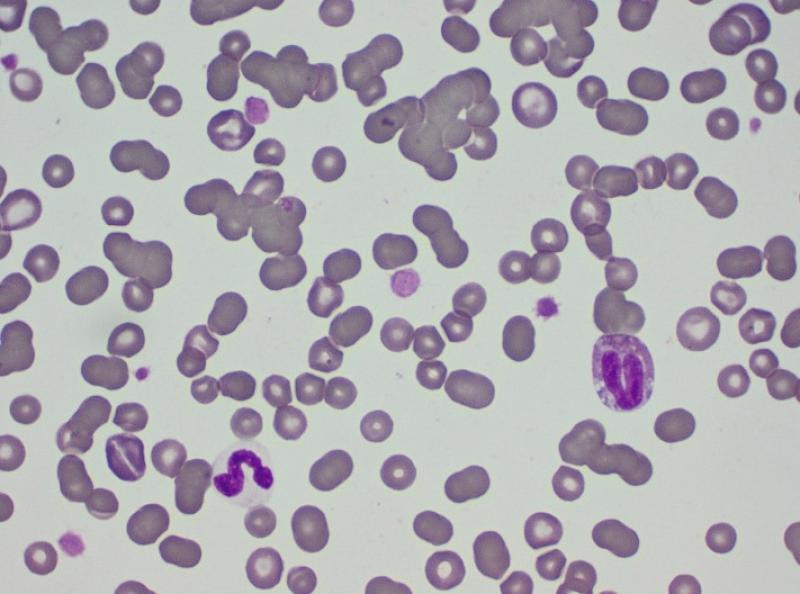
El hemograma (Tabla 1) muestra una anemia leve, normocítica y normocrómica. En el frotis (Figura 1) se puede comprobar la presencia de una población homogénea de glóbulos rojos, sin presencia de células macrocíticas ni eritrocitos policromatófilos. Estos datos indican que la anemia es probablemente no regenerativa, provocada por una producción insuficiente de eritrocitos (Tabla 2). La anemia parece por lo tanto secundaria a otra patología en este caso. En el frotis se observa también la formación de pilas de monedas por parte de los glóbulos rojos. Este fenómeno es de esperar en un animal con un aumento marcado de las globulinas, cuyas cargas positivas provocan la unión entre los glóbulos rojos. Esta imagen no debe confundirse con una agregación tridimensional causada por la presencia de anticuerpos en la superficie eritrocitaria, como en el caso de anemias inmunomediadas. Estas últimas suelen mostrar una imagen de regeneración evidente, con eritrocitos macrocíticos policromatófilos (Figura 2). Las pilas de monedas se deshacen al diluir la sangre con solución salina, mientras que la aglutinación puede persistir (aunque existen falsos negativos, en los que el test de dilución permite quebrar la unión entre los glóbulos rojos)2.
| Tabla 1. Hemograma. |
| Variable | Valor | Intervalo de referencia |
| Eritrocitos (E^12 células/L) | 4.36 | 5,5 – 8,5 |
| Hemoglobina (g/dL) | 10.3 | 12 – 18 |
| Hematocrito (%) | 31.3 | 37 – 55 |
| VCM (fL) | 71.7 | 60 – 77 |
| HCM (pg) | 23.6 | 19 – 25 |
| CCMH (g/dL) | 32.9 | 31 – 34 |
| Leucocitos (E^9 células/L) | 5.3 | 6 – 15 |
| Plaquetas (E^9 células/L) | 311 | 200 – 500 |
| Neutrófilos (E^9 células/L) | 4.66 | 3,0 – 11,4 |
| Linfocitos (E^9 células/L) | 0.42 | 0,72 – 4,8 |
| Monocitos (E^9 células/L) | 0.16 | 0,18 – 1,5 |
| Eosinófilos (E^9 células/L) | 0.05 | 0,12 – 1,5 |
| Basófilos (E^9 células/L) | 0 | 0 – 1 |
| Tabla 2. Causas de anemia no regenerativa. |
| Disminución de la eritropoyesis |
|
| Eritropoyesis inefectiva |
|
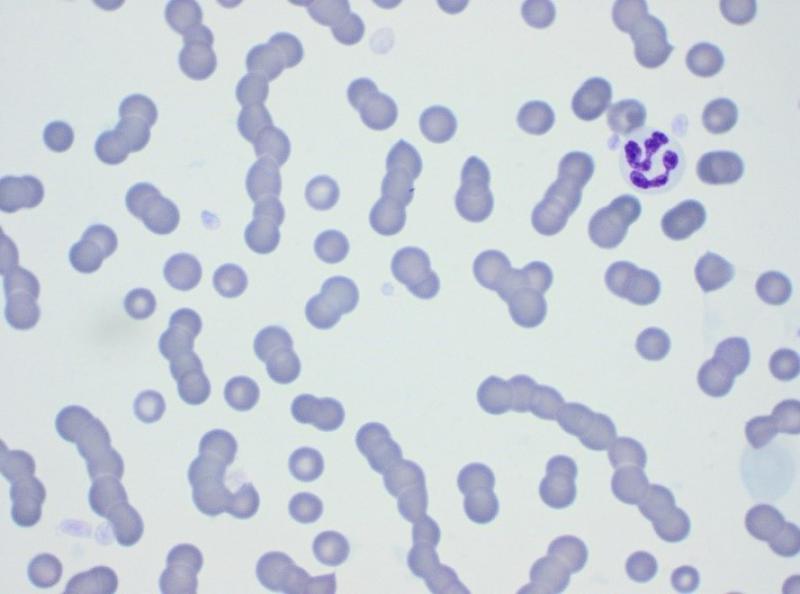
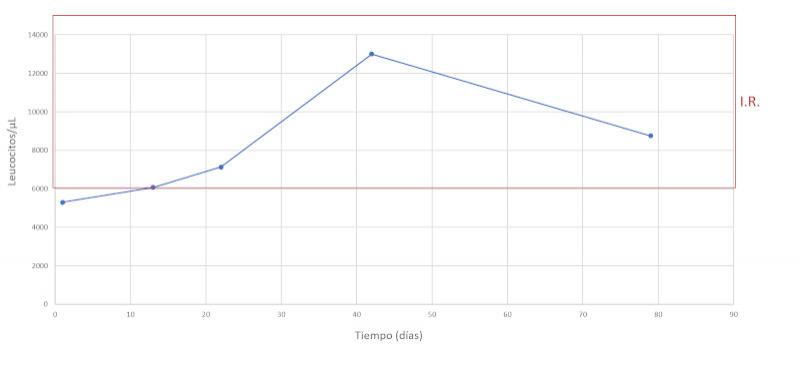
La leucopenia leve es de dudosa importancia en este caso, especialmente teniendo en cuenta que los neutrófilos se encuentran dentro del intervalo de referencia. La linfopenia y la eosinopenia forman parte de un leucograma de estrés, frecuente en animales enfermos como consecuencia de un aumento del cortisol en sangre. La disminución de los monocitos circulantes no tiene relevancia clínica.
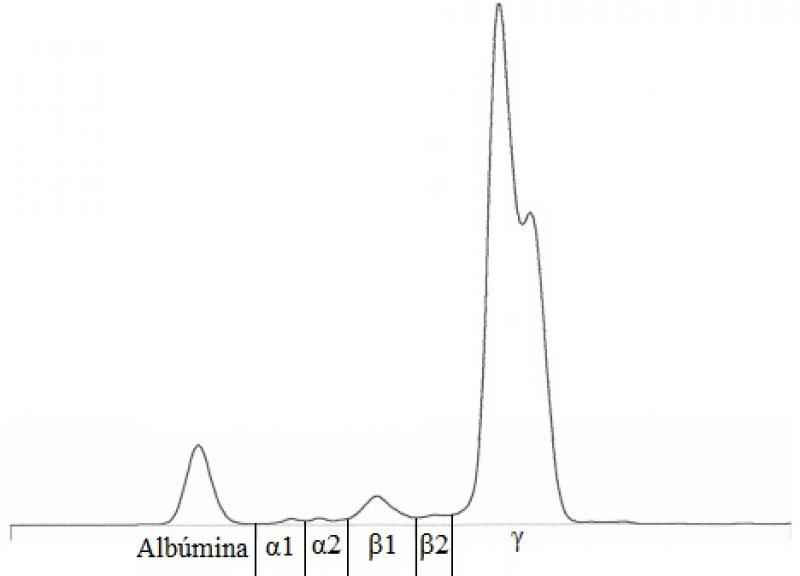
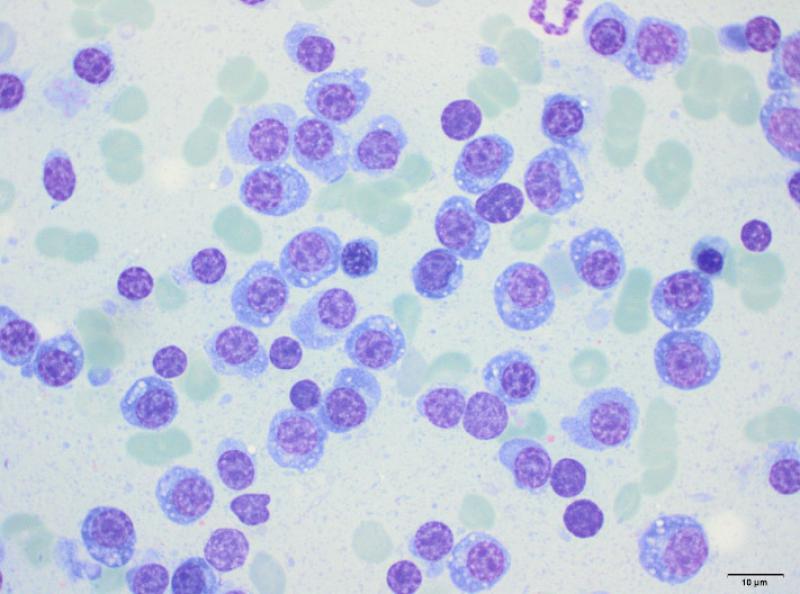
En el perfil bioquímico (Tabla 3), el dato más significativo es la presencia de una hiperproteinemia severa. Varias condiciones pueden causar un aumento de las proteínas (Tabla 4). Teniendo en cuenta los síntomas del paciente, el aumento marcado de las globulinas y la ausencia de linfocitosis, uno de los principales diagnósticos diferenciales en este caso es la presencia de un tumor hematopoyético como el mieloma múltiple. Otros diferenciales posibles incluyen la macroglobulinemia de Waldenstrom, la amiloidosis, la ehrlichiosis o la leishmaniasis. Se realizó una electroforesis de proteínas séricas que dio como resultado un pico monoclonal en gamma (Figura 3), apoyando la hipótesis de un fenómeno tumoral. Una radiografía torácica evidenció la presencia de lesiones osteolíticas en vértebras torácicas y costillas, y una aspiración de médula ósea reveló una infiltración de la misma por células plasmáticas (Figura 4).
| Tabla 3. Bioquímica. |
| Variable | Valor | Intervalo de referencia |
| Proteínas (g/dL) | 13.8 | 5.3 – 7.0 |
| Albúmina (g/dL) | 2.0 | 3.1 – 4.2 |
| Globulinas (g/dL) | 11.8 | 2.2 – 3.5 |
| Cociente AG | 0.17 | |
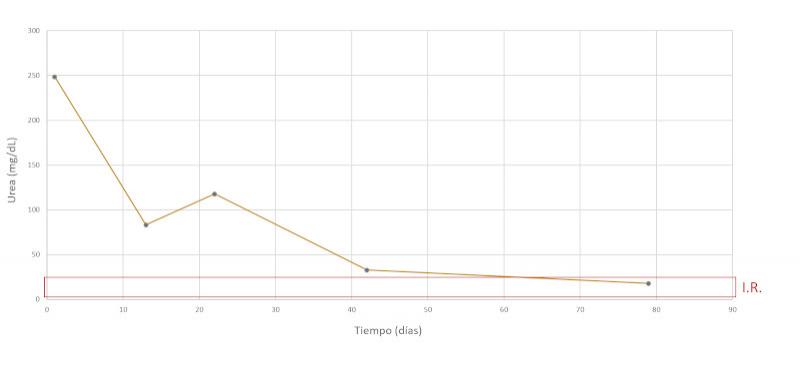
| Urea (mg/dL) | 248 | 4.6 – 23.3 |
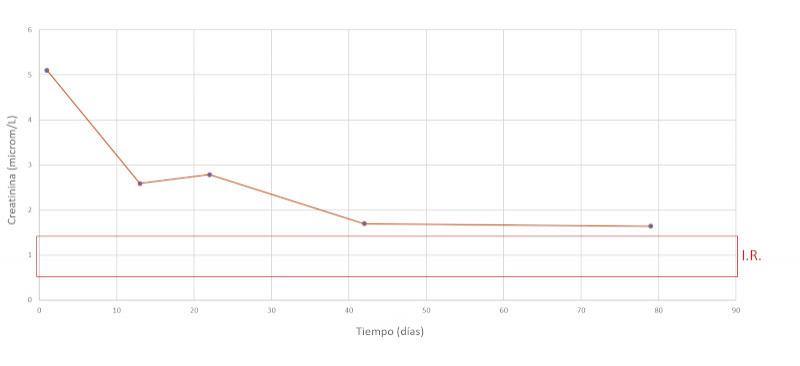
| Creatinina (mg/dL) | 5.1 | 0.6 – 1.4 |
| Na (mEq/L) | 144 | 145 – 153 |
| K (mEq/L) | 3.8 | 4.1 – 5.6 |
| Cl (mEq/L) | 96 | 105 – 116 |
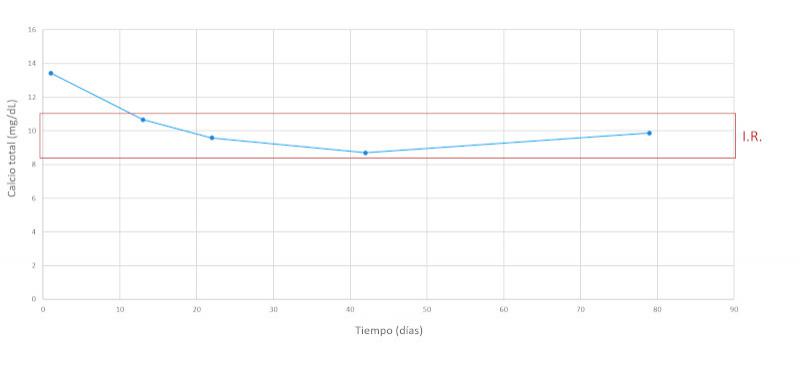
| Calcio total (mg/dL) | 13.43 | 9.30 – 12.02 |
| Calcio libre ionizado (mg/dL) | 4.97 | 5.21 – 5.85 |
| Fósforo (mg/dL) | 15.42 | 2.50 – 5.00 |
| GGT (IU/L) | 11.3 | 0 – 10 |
| ALT (IU/L) | 315 | 5 – 62 |
| AST (IU/L) | 142 | 10 – 55 |
| Fosfatasa alcalina (IU/L) | 258 | 27 – 74 |
| Bilirrubina total (mg/dL) | 0.18 | 0 – 0.6 |
| Colesterol (mg/dL) | 88.9 | 110 – 301.6 |
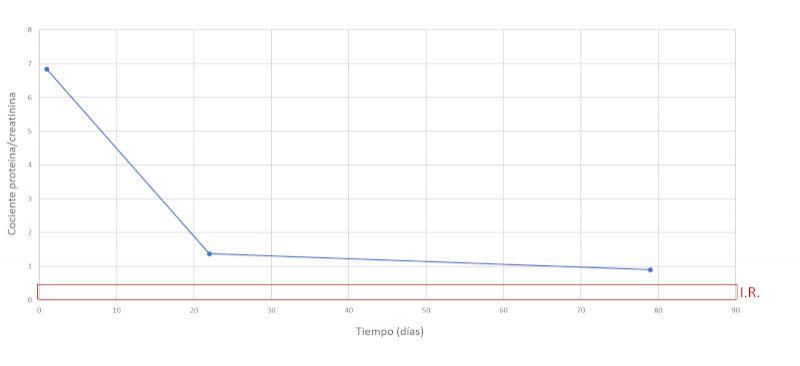
| Cociente proteína/creatinina en orina | 6.83 | < 0.5 |
| Tabla 4. Causas de hiperproteinemia. |
| Hemoconcentración | |
| Aumento de la producción de proteínas |
|
La patogenia del mieloma múltiple permitiría explicar el resto de los cambios bioquímicos: la azotemia (de origen renal y/o prerrenal), la disminución de los electrolitos (pérdidas renales probables) y el aumento secundario de las enzimas de daño hepático y de colestasis (por diferentes mecanismos, incluyendo un síndrome de hiperviscosidad por la hiperglobulinemia y la posibilidad de infiltración del hígado por las células tumorales). La insuficiencia renal se corroboró con un análisis de orina, que mostró una incapacidad de concentración (densidad urinaria de 1.016 en un animal deshidratado y azotémico), así como la presencia abundante de proteínas en ausencia de signos de inflamación urinaria (sedimento inactivo). Además, la ecografía abdominal permitió detectar una nefropatía bilateral, así como un efecto de masa de 2.7 cm en hígado y nódulos esplénicos normoecogénicos que deformaban la superficie del bazo. En el examen citológico se observó una infiltración de plasmocitos en ambos órganos (Figuras 5 y 6). El diagnóstico final fue el de mieloma múltiple, con síndrome de hiperviscosidad associado a un desprendimiento de retina bilateral, ceguera e insuficiencia renal.
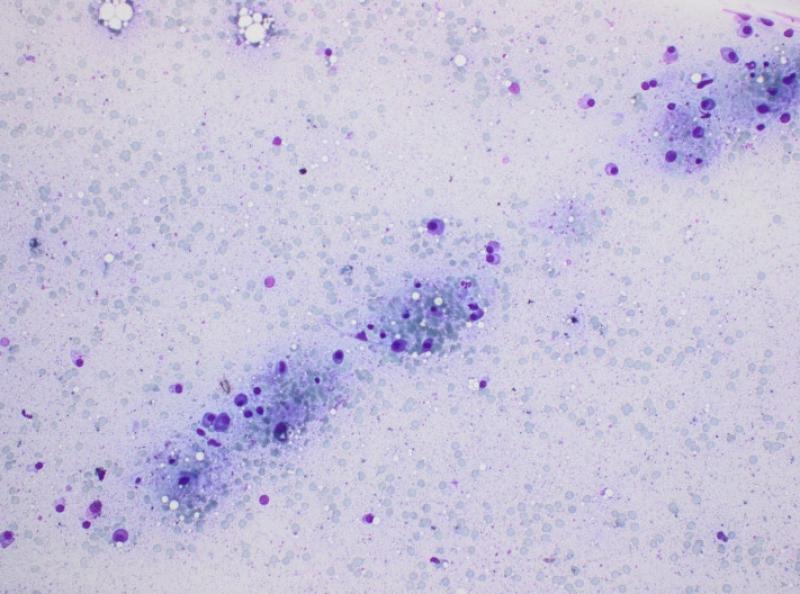
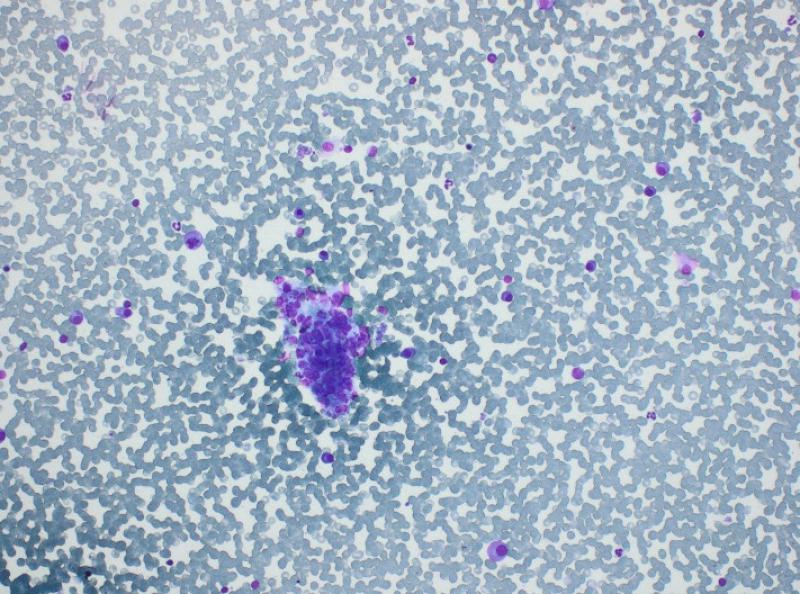
El paciente es hospitalizado con fluidoterapia (Hartmann 6 ml/kg/h), melfalán (0.2 mg/kg/día), prednisolona (0.5 mg/kg/día), omeprazol (1 mg/kg IV q 12 h), maropitant (1 mg/kg q 24 h) y metadona (0,1 mg/kg q 24 h). Tras 48 h de fluidoterapia, la perfusión del paciente mejora pero su estado general se degrada. Teniendo en cuenta la disminución del hematocrito (a 16 %) y el estado general del paciente, se realiza un tipaje sanguíneo (DEA 1.1 positivo) y se decide transfundir con 20 ml/kg de concentrado de glóbulos rojos. Se consigue un aumento del hematocrito al 27% y una mejora del paciente, que comienza a comer. Una semana después, el paciente desarrolla una taquicardia con extrasístoles ventriculares, probablemente asociadas al síndrome de hiperviscosidad. Se añade sotalol (1 mg/kg BID) al tratamiento, permitiendo la resolución de las arritmias. Después de 10 días de tratamiento, las proteínas del paciente siguen elevadas y se procede a una inyección de ciclofosfamida (200 mg/m2 IV). El paciente recibe el alta después de 12 días de hospitalización, con tratamiento a base de melfalán, prednisolona, omeprazol, riopan, primperán, sotalol y alimentación renal.
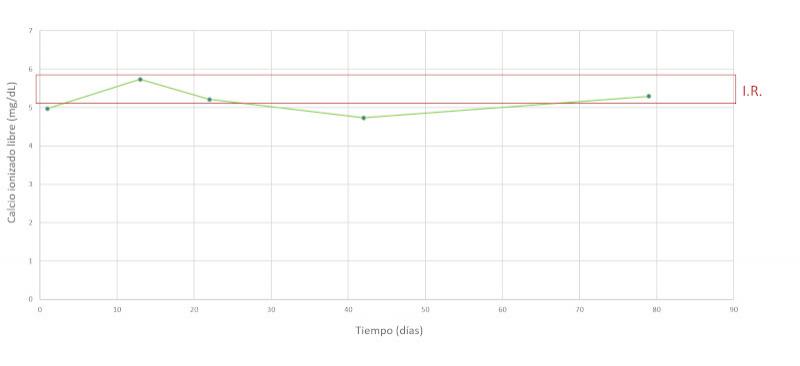
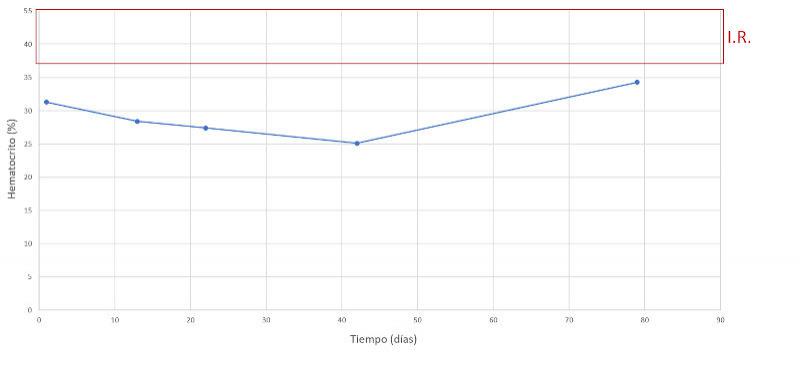
Se realiza un seguimiento a la semana, luego a las dos semanas y a los dos meses después, comprobando una evolución favorable y la remisión de los síntomas clínicos. En las Figuras 7-15 se observan los cambios bioquímicos y hematológicos desde su primera visita (día 1), el día el alta (día 13) y las tres visitas posteriores. Las globulinas se estabilizaron por completo en su primera revisión tras el alta (día 22), mientras que la albúmina y el cociente proteína/creatinina en orina tendían hacia valores fisiológicos sin haberlos alcanzado en la tercera visita (día 79), al igual que la creatinina. La urea llegó a niveles basales en la tercera visita, así como el calcio total, mientras que el calcio ionizado libre se mantuvo oscilando en torno al límite bajo del intervalo de referencia. El hematocrito se acercaba a valores fisiológicos bajos y la leve leucopenia no se repitió durante los tres primeros meses.
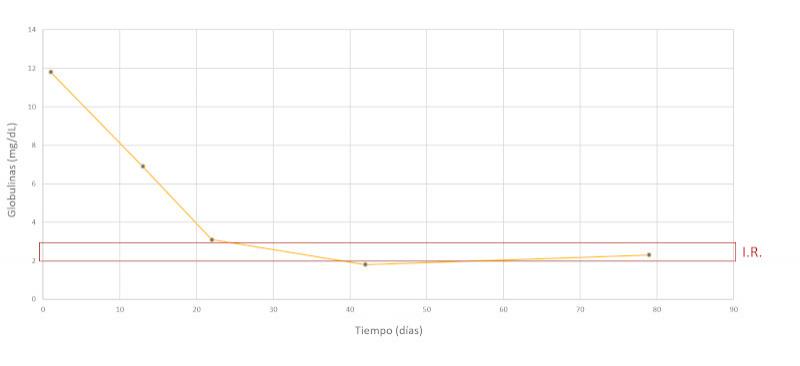
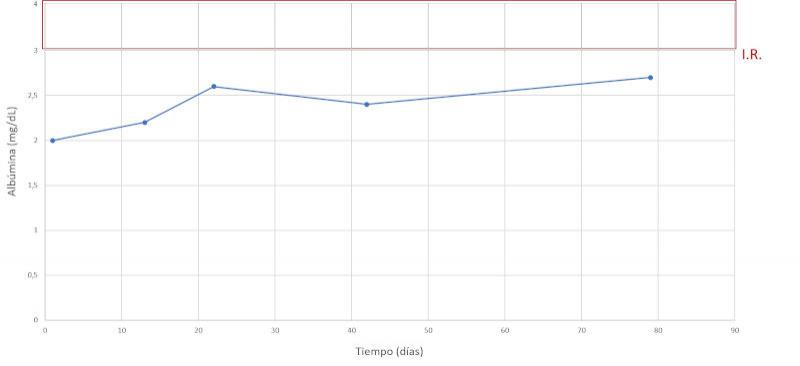
Discusión
El mieloma múltiple es una enfermedad poco común, responsable en perros del 8 % de los tumores hematopoyéticos y del 3.6 % de todos los tumores óseos. No parece tener una predisposición asociada al sexo, pero los perros de la raza Pastor alemán están sobrerrepresentados3. La enfermedad tiene su origen en la proliferación de un clon de células plasmáticas en la médula ósea.
Las células malignas producen grandes cantidades de inmunoglobulinas (principalmente IgM o IgG en el perro) de un único tipo, lo que se traduce en un pico monoclonal en el trazado electroforético, aunque también se han descrito casos con picos biclonales4,5,6,7. Estas proteínas se conocen como proteína M o paraproteínas, y su concentración guarda una relación con la carga tumoral. Las altas concentraciones de paraproteínas provocan lo que se conoce como síndrome de hiperviscosidad, que es una de las causas principales de la patogenia asociada a la enfermedad, provocando alteraciones nerviosas y oculares, llegando hasta la ceguera bilateral como la del paciente. La hiperviscosidad sanguínea puede asociarse también con una diátesis hemorrágica (por diferentes mecanismos, incluyendo la interferencia de las paraproteínas con el funcionamiento de las plaquetas y los factores de coagulación) así como con la enfermedad cardíaca. Esta última se debe a un aumento de la sobrecarga y a una oxigenación deficiente de las arterias coronarias. El problema de oxigenación afecta también a nivel renal, al que se suman la nefrotoxicidad de los complejos formados por las proteínas de Bence Jones (cadenas ligeras de las inmunoglobulinas), que son endocitadas por las células tubulares renales induciendo la liberación de citoquinas y una reacción inflamatoria8. Al daño renal se le suman la hipercalcemia y potencialmente la infiltración renal por parte de las células tumorales.
La hipercalcemia se debe a la liberación por parte de las células neoplásicas de factor activador de osteoclastos3,10,11, que estimula la resorción ósea, y también se han descrito casos con aumento de PTHrP12. En el caso de nuestro paciente, el calcio total está aumentado, sugiriendo una hipercalcemia, especialmente teniendo en cuenta que la concentración de albúmina es baja. Sin embargo, los niveles de calcio ionizado libre de nuestro paciente eran bajos. La presencia de un calcio total aumentado concomitante con un calcio iónico libre dentro del intervalo de referencia ha sido descrita previamente, proponiendo como explicación la unión del calcio a las paraproteínas circulantes13. En el caso de nuestro paciente, un mecanismo similar podría ser la causa de este resultado atípico. El aumento de la resorción ósea causa lesiones líticas, con frecuencia multifocales en el paciente canino, llegando a desarrollarse cojeras e incluso fracturas. Entre un cuarto y dos tercios de los pacientes muestran evidencias radiográficas de lisis ósea o de osteoporosis difusa1. La enfermedad renal y/o la hipercalcemia son responsables de la poliuria. El aumento marcado del calcio y del fósforo pueden poner al paciente en riesgo de mineralizaciones ectópicas.
La anemia observada en nuestro paciente, no regenerativa, es frecuente en casos de mieloma y puede deberse a varios factores, como la disminución de la eritropoyesis por enfermedad crónica, la destrucción de glóbulos rojos y la presencia de hemorragias y/o mieloptisis. La infiltración medular puede afectar a otras líneas celulares, provocando un estado de inmunosupresión al que se unen también la producción de inmunoglobulinas anormales y la alteración de la función de los linfocitos B. A menudo, la inmunodeficiencia y la susceptibilidad a infecciones son la causa final de la muerte3,10. En las Tablas 5 y 6 se recogen la frecuencia de los hallazgos clínicos y laboratoriales presentes en el mieloma múltiple canino3,10.
| Tabla 5. Síntomas y su frecuencia en perros con mieloma múltiple (n = 60). |
| Síntoma | Frecuencia (%) |
| Debilidad y letargia | 62 |
| Cojera | 47 |
| Diátesis hemorrágica | 37 |
| Anomalías oculares | 35 |
| Poliuria y polidipsia | 25 |
| Déficits neurológicos | 12 |
Fuente: Matus RE, Leifer CE, MacEwen EG, et al: Prognostic factors for multiple myeloma in the dog, J Am Vet Med Assoc 188:1288–1291, 1986.
| Tabla 6. Resultados de laboratorio y su frecuencia en perros con mieloma múltiple (n = 53). |
| Anomalía | Frecuencia (%) |
| Aumento de paraproteínas Monoclonal Biclonal IgG IgA | 100 < 5 46 54 |
| Infiltración de células plasmáticas en médula ósea (>10%)* | 100 |
| Hemograma Anemia no regenerativa Trombocitopenia Neutropenia Leucemia (células plasmáticas en circulación) | 68 33 25 10 |
| Hipoalbuminemia | 65 |
| Proteinuria | 35 |
| Proteínas de Bence Jones en orina | 38 |
| Lisis ósea | 51 |
| Hiperviscosidad | 32 |
| Azotemia | 33 |
| Hipercalcemia | 16 |
Fuente: MacEwen EG, Hurvitz AI: Diagnosis and management of monoclonal gammopathies, Vet Clin N Am Small Anim Pract 7:119–132, 1977.
* El criterio diagnóstico actual recomienda fijar el límite en más de 20 %.
El diagnóstico de mieloma múltiple puede confirmarse con la presencia de dos o más de los siguientes criterios:
- Evidencia de lesiones óseas.
- Infiltración de la médula ósea por células plasmáticas (>20%).
- Gamopatía monoclonal en suero.
- Presencia de proteínas de Bence Jones en orina.
En ausencia de lesiones óseas, el diagnóstico puede hacerse demostrando un aumento de células plasmáticas en médula ósea asociado a un incremento progresivo de paraproteínas1.
El tratamiento del mieloma múltiple tiene como objetivo disminuir la carga tumoral y mitigar sus efectos secundarios. El protocolo incluye melfalán, un agente alquilante, y prednisona. El primero puede causar mielosupresión, por lo que se recomienda realizar controles hematológicos frecuentes, cada dos semanas los dos primeros meses, y mensualmente después, ajustando la dosis según los resultados.
La ciclofosfamida puede usarse en lugar de o en combinación con el melfalán, pero suele reservarse para casos con hipercalcemia severa o infiltración tumoral sistémica, o también para aquellos pacientes que desarrollan trombocitopenia con el melfalán (algo que es menos frecuente con la ciclofosfamida)1.
Una mejora de los síntomas suele observarse después de tres o cuatro semanas. Las complicaciones oftalmológicas y las neuropatías paraneoplásicas tienden a resolverse también. La resolución de las lesiones osteolíticas puede tardar meses en ser evidente en radiografías, y en algunos casos no es completa. En cuanto a los resultados de laboratorio, después de tres a seis semanas de tratamiento se espera una reducción de las globulinas y del calcio, así como la normalización del hemograma. Una reducción de un 50 % de los niveles paraproteínas (de las inmunoglobulinas y/o de las proteínas de Bence Jones) puede interpretarse como una buena respuesta al tratamiento1,3,10. La disminución de las inmunoglobulinas puede demorarse más que la de las proteínas de Bence Jones. Esto se debe a sus diferentes semividas, más larga en inmunoglobulinas (entre 15 y 20 días), que en las proteínas de Bence Jones (entre 8 y 12 horas) 14. Se recomienda hacer seguimientos cuantificando las globulinas, inmunoglobulinas o proteínas de Bence Jones en orina todos los meses hasta su estabilización, y posteriormente cada dos a tres meses1.
La quimioterapia reduce eficazmente la carga tumoral y los síntomas, aunque es infrecuente que el tumor remita por completo. La calidad y la esperanza de vida son muy buenas, con una media de 540 días descrita en un estudio con un grupo de 60 perros3. En este estudio, un 43 % de los perros consiguió una normalización completa de las inmunoglobulinas, en un 49 % se observó una disminución de más de la mitad, y solo un 8 % no respondió al tratamiento con melfalán y prednisolona. La presencia de hipercalcemia, proteinuria de Bence Jones y lisis ósea extensa son factores pronósticos negativos. El pronóstico a largo plazo es malo ya que el tumor y los síntomas suelen reactivarse. Llegado un momento, el tumor deja de responder a la quimioterapia y el paciente sucumbe por enfermedad renal, sepsis o eutanasia por dolor óseo o espinal intratable1,3,10.
En conclusión, el mieloma múltiple debe incluirse en el diagnóstico diferencial de perros con hiperglobulinemia, además de aquellos que presenten sangrados de origen desconocido o en los que se encuentren lesiones osteolíticas. El diagnóstico puede confirmarse con la presencia de dos o más de los siguientes criterios: evidencia de lesiones óseas, infiltración de la médula ósea por células plasmáticas (>20%), gamopatía monoclonal en suero y/o presencia de proteínas de Bence Jones en orina. La respuesta al tratamiento es buena, permitiendo una calidad y una esperanza de vida altas.
Bibliografía
- Vail MD: Myeloma-related disorders. In Withrow SJ, et al, editors: Withrow & McEwen’s Small animal clinical oncology, ed 5, St. Louis, 2013, Saunders Elsevier, pp 665-678.
- Weiss DJ, Wardrop KJ; Schalm’s veterinary hematology. 6th ed.; Wiley-Blackwell, 2010; Ames, Iowa.
- Matus RE, Leifer CE, MacEwen EG, et al.: Pronostic factors for multiple mieloma in the dog, J Am Vet Med Assoc 188:1288-1291, 1986.
- Jacobs RM, Couto CG, Wellman ML: Biclonal gammopathy in a dog with myeloma and cutaneous lymphoma, Vet Pathol 23:211–213, 1986.
- Peterson EN, Neininger AC: Immunoglobulin A and immunoglobulin G biclonal gammopathy in a dog with multiple myeloma, J Am Anim Hosp Assoc 33:45–47, 1997.
- Ramaiah SK, Sequin MA, Carwile HF, et al: Biclonal gammopathy associated with immunoglobulin A in a dog with multiple myeloma, Vet Clin Pathol 31:83–89, 2002.
- Facchini RV, Bertazzolo W, Zuliani D, et al: Detection of biclonal gammopathy by capillary zone electrophoresis in a cat and a dog with plasma cell neoplasia, Vet Clin Pathol 39:440–446, 2010.
- Dimopoulos MA, Kastritis E, Rosinol L, et al. Pathogenesis and treatment of renal failure in multiple myeloma.Leukemia2008;22(8):1485-1493.
- Edwards CM, Zhuang J, Mundy GR. The pathogenesis of the bone disease of multiple myeloma.Bone2008;42(6):1007-1013.
- MacEwen EG, Hurvitz AI: Diagnosis and management of monoclonal gammopathies, Vet Clin North Am Small Anim Pract 7:119–132, 1977.
- Mundy GR, Bertolini DR: Bone destruction and hypercalcemia in plasma cell myeloma, Semin Oncol 13:291–297, 1986.
- Rosol TJ, Nagode LA, Couto CG, et al: Parathyroid hormone (PTH)-related protein, PTH, and 1,25-dihydroxyvitamin D in dogs with cancer associated hypercalcemia, Endocrinology 131:1157–1164, 1992.
- Tripp, C. D., Bryan, J. N., & Wills, T. B. (2009). Presumptive increase in protein-bound serum calcium in a dog with multiple myeloma. Veterinary Clinical Pathology, 38(1), 87–90. https://doi.org/10.1111/j.1939-165X.2008.00102.x
- Ferhangi M, Osserman EF: The treatment of multiple myeloma, Sem Hematol 10:149–161, 1973.
 by Multimédica
by Multimédica