Aplicación clínica de la prueba de aire en perros (air test)
Resumen breve
Una de las posibles complicaciones del posoperatorio inmediato es la hipoxemia. La gasometría arterial: es el gold standard para verificar la eficiencia de intercambio gaseoso, sin embargo, es una prueba invasiva, costosa y que no permite una monitorización continua. La pulsioximetría puede ser una buena alternativa de la PaO2 para monitorizar la función pulmonar mediante la realización de la llamada prueba de aire.Índice de contenidos
Introducción
La prevención de complicaciones respiratorias es muy importante para evitar la morbimortalidad perianestésica. En veterinaria la mayoría de las muertes se producen durante el período de recuperación (en torno al 81 % según los diferentes estudios)1,2.
Una de las posibles complicaciones del posoperatorio inmediato es la hipoxemia. La hipoxemia se define como una tensión arterial de oxígeno (PaO2) inferior a 80 mmHg (PaO2 < 80 mmHg) con una presión atmosférica a nivel del mar (Patm = 760 mmHg). Se considera que un paciente está en hipoxemia leve, con valores de PaO2 entre 80-90 mmHg, hipoxemia moderada entre 60-80 mmHg e hipoxemia severa cuando los valores de PaO2 < 60 mmHg.
La etiología de la hipoxemia3 suele ser multifactorial (Tabla 1), sin embargo, podemos dividir las posibles causas en:
- Disminución de la presión alveolar de oxígeno (PAO2) o insuficiente aporte de oxígeno en los alveolos.
- Alteración de la relación ventilación-perfusión (V/Q).
- Trastorno en la difusión.
- Disminución del contenido de oxígeno venoso (CvO2): no da tiempo a que los glóbulos rojos se oxigenen al pasar por los capilares alveolares.
↓ PAO2 | Trastorno de difusión | Alteración relación ventilación-perfusión (V/Q) | ↓ Contenido venoso oxígeno (CvO2) |
|---|---|---|---|
|
|
|
|
Tabla 1. Causas de hipoxemia.
El término hipoxemia posquirúrgica transitoria (HPT) ha sido descrito tanto en medicina humana como en veterinaria4. Puede ser debida a hipoventilación y tendencia de colapso de las vías aéreas causada por los efectos residuales de los fármacos anestésicos, a la transición a una respiración espontánea, a la reducción de la concentración de oxígeno y a la persistencia de atelectasias pulmonares5. Es importante diferenciar la HPT de otras complicaciones pulmonares más graves que también causan hipoxemia (p. ej.: fallo respiratorio agudo, neumonía por aspiración, síndrome de distrés respiratorio agudo (ARDS), etc.) y que pueden estar presentes antes, durante o empeorar tras la anestesia general si no se aplican estrategias ventilatorias adecuadas.
Incidencia de hipoxemia posquirúrgica transitoria (HPT) y complicaciones derivadas
Mantener un buen aporte de oxígeno a los tejidos (evitar la hipoxia tisular debido a la hipoxemia) es crucial para proporcionar una buena cicatrización de heridas y prevenir infecciones6-8. Además, se ha visto que la HPT durante el período de recuperación puede aumentar el riesgo de otras complicaciones: respiratorias, renales, cardiovasculares, aumentar el tiempo de hospitalización y admisión en la unidad de cuidados intensivos6,9.
La incidencia de HPT durante la recuperación anestésica en la especie canina puede variar entre el 20-62 % según estudios recientes4,10. Por ello, es importante evaluar la oxigenación de nuestros pacientes durante anestesia y justo antes de la recuperación, para tratar posibles factores que nos puedan llevar a la aparición de complicaciones.
Los signos clínicos asociados a hipoxemia son: membranas mucosas cianóticas, cambios en las frecuencias cardíaca y respiratorias y aparición de esfuerzo respiratorio. Sin embargo, estos signos son inespecíficos e inadecuados para una detección temprana de estadios leves o moderados de hipoxemia11,12.
Métodos de detección de la hipoxemia
Existen diferentes pruebas complementarias para detectar hipoxemia:
- Gasometría arterial: es el gold standard para verificar la eficiencia de intercambio gaseoso (midiendo los valores de PaO2 y SaO2), sin embargo, es una prueba invasiva que requiere una muestra de sangre arterial, que tiene un coste económico y que no permite una monitorización continua6.
- Pulsioximetría: es una técnica que nos permite una monitorización continua, no invasiva, económica, fácilmente disponible y que, en general, es bien tolerada por los pacientes13. Mide la saturación de la hemoglobina arterial mediante la emisión de luz roja e infrarroja a través de un tejido con flujo de sangre pulsátil. Como desventajas, hay que tener en cuenta todos los factores que alteran la correcta lectura de la pulsioximetría (movimiento del animal, pigmentación de membranas mucosas, luz ambiental, anemia severa, dishemoglobinemias, hipoperfusión/vasoconstricción periférica, etc.).
La curva de disociación de la oxihemoglobina describe la relación entre la saturación arterial de oxígeno (SaO2) y la presión de oxígeno en sangre arterial (PaO2) (Figura 1).
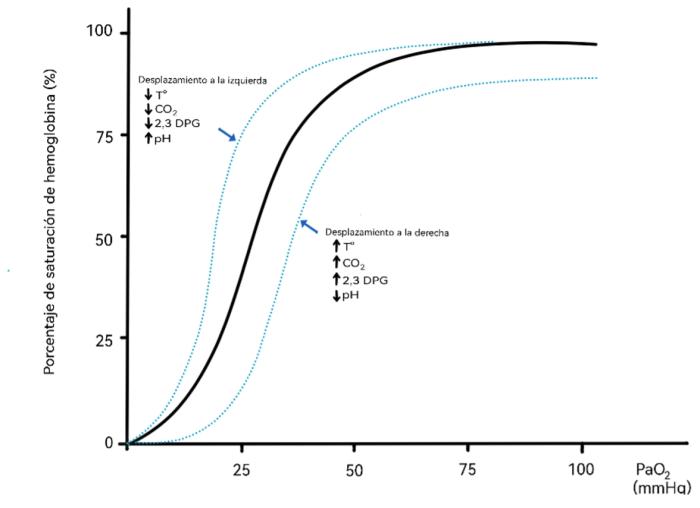
Figura 1. Diagrama de la curva de disociación de la hemoglobina.
Presenta una forma sigmoidea debido a que la afinidad de la hemoglobina (Hb) por el oxígeno (O2) se produce de forma cooperativa, es decir, la primera molécula de O2 se une con dificultad a la Hb, pero a medida que se van uniendo nuevas moléculas, la Hb presenta cada vez mayor afinidad por el O2. Esto es importante ya que, si nos movemos en la parte superior de la curva (al ser plana) cambios en la PaO2 apenas van a afectar a la SaO2. Sin embargo, si nos fijamos en el valor de PaO2 al que el 50 % de la Hb se encuentra unida al O2 (saturada) o valor P50 podemos distinguir varios escenarios14:
- Si la posición de la curva se desplaza hacia la derecha, la afinidad de la Hb por el O2 se va a reducir, por tanto, para un determinado valor de PaO2, la SaO2 será menor (ya que el O2 se libera más fácilmente). Esto puede ser causado por: un aumento de la temperatura, un aumento en el CO2 (efecto Bohr), aumento de 2,3-DPG (facilita la liberación de O2 a los tejidos disminuyendo la afinidad de la Hb por el O2), o acidosis (metabolismo anaeróbico).
- Si la posición de la curva se mueve hacia la izquierda, se produce un aumento de la afinidad de la Hb por unirse al O2. Se produce por una disminución de la temperatura, CO2, 2,3-DPG, o situaciones de alcalosis.
Debido a la morfología de la curva, los valores de SpO2 > 95 % normalmente se corresponden con PaO2 > 80 mmHg4,15, y valores de SpO2 < 90 % normalmente se corresponden con PaO2 < 60 mmHg, en pacientes que respiran aire ambiental (fracción inspirada de oxígeno [FiO2] 21 %) con una presión atmosférica a nivel del mar13.
Gracias a esta relación entre ambos parámetros, la pulsioximetría puede ser una buena alternativa de la PaO2 para monitorizar la función pulmonar13 mediante la realización de la llamada prueba de aire.
Cómo realizar la prueba de aire (air test)
Gracias a la utilización de una FiO2 ambiental (21 %) la pulsioximetría puede detectar hipoxemia, y ayudar a categorizar la función pulmonar, ya que, al movernos a la parte vertical de la curva de disociación de la hemoglobina, podemos utilizar los resultados de la saturación periférica de oxígeno para estimar el shunt alveolar. Para ello podemos basarnos en la aplicación clínica del diagrama de SpO2-FiO216,17 (Figura 2).
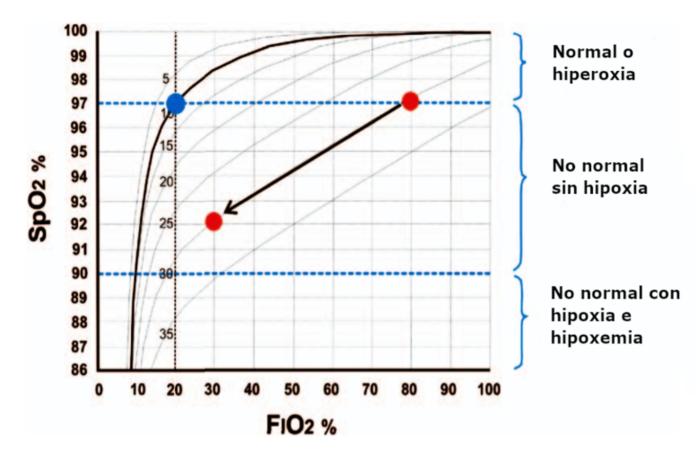
Figura 2. Diagrama SPO2-FiO2 adaptado de Tusman et al. 2017.
El diagrama SpO2/FiO2, define tres zonas:
- Zona normal (con FiO2 21 %) o hiperoxia (con FiO2 < 21 %): shunt bajo fisiológico.
- Zona no normal sin hipoxia: cuando los valores de SpO2 se encuentran entre 91-96 % con una FiO2 igual o superior al 21 %. La escala punteada sugiere el porcentaje de shunt estimado.
- Zona no normal con hipoxia e hipoxemia: cuando los valores de SpO2 ≤ 90 %. La escala punteada sugiere el porcentaje de shunt estimado.
Para que la prueba de aire sea fiable deben darse una serie de requisitos previos:
- El paciente debe estar normocápnico (EtCO2 35-45 mmHg), normoxémico (SpO2 > 95 %) y normotenso (PAM > 60 mmHg) antes de iniciar la prueba.
- El pulsioxímetro debe tener una buena señal pletismográfica (con un índice de perfusión (IP) > 1 %) y correlacionarse con la frecuencia cardíaca del paciente durante, durante al menos un minuto4.
Pasos en la realización de la prueba de aire:
- Tomamos una primera medida de SpO2 con la FiO2 que estemos administrando.
- En caso de estar suplementando con oxígeno, reducir gradualmente la FiO2 al 21 % durante, al menos, 5 minutos4,17. Ir recogiendo los valores de SpO2 que obtengamos, siempre que se cumpla con los requisitos previamente nombrados.
- El resultado de la prueba será en función del valor de SpO2 al final de la misma:
- SpO2 ≥ 95 % Prueba de aire negativa6.
- SpO2 < 95 % Prueba de aire positiva6.
Debemos tener en cuenta que nunca debemos dejar que la saturación baje del 90 % cuando realizamos la prueba de aire, por lo que en caso de que un paciente desature antes de tiempo (menos de 5 minutos a FiO2 21 %), la prueba se considera positiva y se debe volver a suplementar con oxígeno.
Adicionalmente, en caso de que la prueba de aire sea positiva, se puede volver a realizar tras instaurar un tratamiento y así ver la evolución del paciente.
Potenciales usos de la prueba de aire
La prueba de aire (air test) ha sido descrita en medicina humana en varios momentos:
- Durante la anestesia general para la detección de atelectasia previa a la maniobra de reclutamiento alveolar.
- En los primeros minutos tras la extubación, para la detección temprana de complicaciones respiratorias (HPT).
- Durante la recuperación anestésica, en aquellos pacientes que hayan dado positivo en la prueba de aire en la recuperación anestésica inmediata, para controlar que no vuelva a aparecer una complicación tipo HPT.
En veterinaria, la prueba de aire ha sido descrita en la especie canina para la detección de HPT inmediatamente tras la extubación y durante el período de recuperación, comparando con el gold standard (gasometría arterial). Por tanto, la pulsioximetría puede ser una buena alternativa de la PaO2 para monitorizar la función pulmonar en perros durante el período de recuperación anestésica13.
Discusión
En la mayoría de las personas bajo anestesia general el desarrollo de atelectasia es muy común (alrededor del 90 %) y estas pueden persistir durante el período de recuperación, y hasta días después de la cirugía. La atelectasia puede contribuir al desarrollo de complicaciones pulmonares posquirúrgicas más graves como el fallo respiratorio agudo, neumonía o el síndrome de distrés respiratorio, entre otras17. Aunque en pequeños animales el porcentaje de aparición de HPT es menor que el descrito en medicina humana (20-64 % según estudios recientes), podemos decir que esta complicación ha estado infravalorada hasta ahora. A no ser que haya ocurrido alguna complicación en el estado de oxigenación de nuestro paciente durante anestesia, o se trate de un procedimiento de alto riesgo de hipoxemia en un paciente predispuesto, la oxigenación no se suele controlar durante el período de recuperación anestésica de manera rutinaria.
Hasta hace poco no se conocía la sensibilidad y especificidad de la pulsioximetría para determinar la hipoxemia en el período de recuperación en perros. Sin embargo, en un estudio muy reciente6 se ha demostrado que un valor de corte de SpO2 del 95 % tenía una sensibilidad del 100 % y una especificidad del 97 % para predecir la presencia de hipoxemia (PaO2 < 80 mmHg) en perros sanos. Por lo que se puede decir que este método es fiable y preciso para detectar la hipoxemia posquirúrgica transitoria. Además, comparando indicadores de oxigenación, diferentes estudios han demostrado que existe una buena correlación entre la ratio SpO2/FiO2 y PaO2/FiO2 en perros que requerían una evaluación de su estado de oxigenación, respirando aire ambiental (FiO2 21 %)13,18. También se ha demostrado que en perros sanos recuperándose de anestesia general con una suplementación de oxígeno mediante sonda nasal a 100 ml/kg/min (FiO2 estimada del 37 %), por lo que existe una fuerte correlación entre PaO2/FiO2 y SaO2/FiO2 independientemente de la FiO2.
Cabe destacar que existe una diferencia con respecto al punto de corte o límite para la prueba de aire entre humanos y caninos. En humana consideran positivo el test cuando los valores de SPO2 son < 97 %, sin embargo, los resultados de los estudios realizados en la especie canina sugieren que valores de SpO2 > 95 % normalmente se corresponden con PaO2 > 80 %, por tanto, el punto de corte en perros es del 95 % para considerar la prueba positiva o negativa.
En un estudio6 realizaron una prueba de aire a los pacientes en tres momentos diferentes: al final de la anestesia general con el paciente en posición esternal, todavía intubado después de haber desconectado el circuito respiratorio y permitiéndole respirar aire ambiental (1ª prueba de aire); 5 minutos después de la extubación (2ª prueba de aire) y 10 minutos después de la extubación (3ª prueba de aire). Detectaron que hasta un 28 % de perros sanos tras la anestesia general presentó HPT. Adicionalmente, observaron que la tendencia de los valores de SpO2 en el grupo de la prueba de aire positiva (grupo hipoxémico) no mostró mejoría en el tiempo, es decir, los pacientes que estaban hipoxémicos en la primera prueba de aire (todavía intubados), también estuvieron hipoxémicos durante el período posquirúrgico temprano. Lo que lleva a pensar que realizar, al menos, una prueba de aire con el paciente todavía intubado, al finalizar la anestesia general, puede ser clínicamente relevante, y tener una aplicación clínica significativa a la hora de prevenir/detectar e intentar tratar la HPT en el período de recuperación evitando así la aparición de complicaciones asociadas futuras, como hacen en medicina humana17.
Es importante saber que hay multitud de factores que pueden contribuir a la aparición de atelectasias durante la anestesia, como: depresión respiratoria secundaria a la administración de fármacos (p. ej.: opioides), condición corporal elevada, posición en decúbito dorsal, aumento de la presión intraabdominal (laparoscopias, organomegalia, torsión volvulogástrica, etc.), utilización de FiO2 elevadas (FiO2 100 % vs. FiO2 40 %) y cualquier otra causa de hipoxemia durante anestesia.
Precisamente una de las limitaciones más importantes de la prueba de aire es que es muy sensible para detectar hipoxemia, sin embargo, no diferencia las posibles etiologías de la misma. Y, dependiendo de la causa que la esté produciendo, deberemos actuar de una forma u otra, por ejemplo:
- Si el paciente todavía está bajo anestesia general, valorar según el caso:
- Aumentar la FiO2.
- Realizar una maniobra de reclutamiento alveolar y aplicación de PEEP.
- Optimización de la PEEP para cada paciente y situación clínica.
- Si el paciente ya está extubado suele tratarse con oxigenoterapia:
- Existen diferentes formas de suplementar oxígeno y cada una permite administrar un porcentaje mayor o menor de FiO2 (Tabla 2).
| Método de administración | Flujo de gases | FiO2 aproximada |
|---|---|---|
| Flow by | 2-3 l/min | 0.25-0.4 (25-40 %) |
| Mascarilla facial (apretada) | 8-12 l/min | 0.5-0.6 (50-60 %) |
| Intranasal | 50 ml/kg/min 100 ml/kg/min 200 ml/kg/min 200 ml/kg/min bilateral | 0.3 (30 %) 0.38 (38 %) 0.6 (60 %) 0.77 (77 %) |
| Jaula de oxígeno | - | 0.4-0.5 (40-50 %) |
| Collar isabelino | 1-2 l/min | 0.3 - 0.4 (30-40 %) |
| Casco CPAP (continuous positive airway pressure) | 5-10 l/min | Regulable (21-100 %) |
Tabla 2. Métodos de suplementación de oxígeno descritos en veterinaria.
Conclusiones
La monitorización de la oxigenación de nuestros pacientes se puede realizar mediante diferentes tipos de técnicas: la gasometría arterial es la prueba de elección para ello, sin embargo, nos ofrece una medición de un momento concreto del estado de oxigenación de nuestro paciente; por otro lado, está la pulsioximetría, que ha demostrado ser una herramienta precisa y fiable, barata, no invasiva, y que permite una monitorización continua.
Mediante la pulsioximetría, podemos realizar la prueba de aire para valorar la posible presencia de atelectasias, y detectar de forma temprana posibles complicaciones como la hipoxemia posquirúrgica transitoria. Aunque no nos permitirá obtener información sobre el origen de estos problemas.
A pesar de estas limitaciones, podemos afirmar que la prueba de aire es una herramienta útil, sencilla y barata a la hora de evaluar el estado de oxigenación de nuestros pacientes, tanto durante la anestesia general como en la recuperación anestésica. Nos permite adelantarnos a posibles complicaciones futuras, y poder prevenirlas. Después de haberlas detectado, dependiendo del paciente, el tipo de procedimiento y las condiciones que tengamos en cada caso, deberemos discernir entre las posibles causas, para aplicar el tratamiento más adecuado.
Bibliografía
- Redondo JI, Otero PE, Martínez-Taboada F, Doménech L, Hernández-Magaña EZ, Viscasillas J. Anaesthetic mortality in dogs: A worldwide analysis and risk assessment. Vet Rec. 2024 Jul 6;195(1):e3604.
- Itami T, Aida H, Asakawa M, Fujii Y, Iizuka T, Imai A, et al. Association between preoperative characteristics and risk of anaesthesia-related death in dogs in small-animal referral hospitals in Japan. Vet Anaesth Analg. 2017; 44:461–72.
- Silverstein D, Hopper K. (2023). Hypoxemia in Haskins S, Silverstein D (Eds.), Small animal critical care medicine (3rd ed., pp 89 – 94). Elsevier Inc.
- Stabile M, Lacitignola L, Piemontese MR, Di Bella C, Acquafredda C, Grasso S, Crovace AM, Gomez de Segura IA, Staffieri F, 2021. Comparison of CPAP and oxygen therapy for treatment of postoperative hypoxaemia in dogs. The Journal of Small Animal Practice 62, 351–358.
- Miskovic A, Lumb AB, 2017. Postoperative pulmonary complications. British Journal of Anaesthesia 118, 317–334.
- Piemontese C, Stabile M, Di Bella C, Scardia A, Vicenti C, Acquafredda C, Crovace A, Lacitignola L, Staffieri F. The incidence of hypoxemia in dogs recovering from general anesthesia detected with pulse-oximetry and related risk factors. Vet J. 2024 Jun; 305:106135.
- Knighton DR, Halliday B, Hunt TK, 1984. Oxygen as an antibiotic. The effect of inspired oxygen on infection. Archieves of Surgery 119, 199–204.
- Hopf H, Sessler DI, 1994. Routine postoperative oxygen supplementation. Anesthesia Analgesia 79, 615–616.
- Rostin P, Teja BJ, Friedrich S, Shaefi S, Murugappan KR, Ramachandran SK, Houle TT, Eikermann M, 2019. The association of early postoperative desaturation in the operating theatre with hospital discharge to a skilled nursing or long-term care facility. Anaesthesia 74, 457–467.
- Campbell VL, Drobatz KJ, Perkowski SZ, 2003. Postoperative hypoxemia and hypercapnia in healthy dogs undergoing routine ovariohysterectomy or castration and receiving butorphanol or hydromorphone for analgesia. Journal of the American Veterinary Medical Association 222, 330–336.
- Dripps RD, Comroe JH, 1946. The respiratory and circulatory response of normal man to 100, 18, 16, 14, 12, 10 and 8 per-cent 02. Federation Proceedings 5, 24.
- Comroe JH, Botelho S, 1947. The unreliability of cyanosis in the recognition of arterial anoxemia. The American Journal of the Medical Sciences 124, 1–6.
- Calabro JM, Prittie JE, Palma DA, 2013. Preliminary evaluation of the utility of comparing SpO2 /FiO2 and PaO2 /FiO2 ratios in dogs. Journal of Veterinary Emergency and Critical Care (Sanoma Antonio) 23, 280–285.
- Chambers D, Huang C, Matthews G,(2019). Oxygen transport. Basic physiology for anaesthetists. (2nd ed., pp30 – 36). Cambridge University Press.
- Sumner C, Rozanski E, 2013. Management of respiratory emergencies in small animals. Veterinary Clinics of North America Small Animal Practice 43, 799–815.
- Tusman G, Bohm SH, Suarez-Sipmann F, 2017. Advanced uses of pulse oximetry for monitoring mechanically ventilated patients. Anesthesia Analgesia 124, 62–71.
- Ferrando C, Romero C, Tusman G, Suarez-Sipmann F, Canet J, Dosdá R, Valls P, Villena A, Serralta F, Jurado A, Carrizo J, Navarro J, Parrilla C, Romero JE, Pozo N, Soro M, Villar J, Belda FJ. The accuracy of postoperative, non-invasive Air-Test to diagnose atelectasis in healthy patients after surgery: a prospective, diagnostic pilot study. BMJ Open. 2017 May 29;7(5):e015560.
- Carver A, Bragg R, Sullivan L. Evaluation of PaO2 /FiO2 and SaO2 /FiO2 ratios in postoperative dogs recovering on room air or nasal oxygen insufflation. J Vet Emerg Crit Care (San Antonio). 2016 May;26(3):437-45.
- Loukopoulos P, Reynolds W, (1996).Comparative evaluation of oxygen therapy techniques in anaesthetised dogs: Intranasal catheter and Elizabethan collar canopy. Australian Veterinary Practitioner,26(4), 199-205.
- Loukopoulos P, Reynolds W, (1997).Comparative evaluation of oxygen therapy techniques in anaesthetised dogs: Face mask and flow-by technique. Australian Veterinary Practitioner,27(1), 34-9.
- Dunphy D, Mann FA, Dodam JR, Branson KR, Wagner-Mann CC, Johnson PA, Brady MA. (2002). Comparison of unilateral versus bilateral nasal catheters for oxygen administration in dogs. Journal of vet em and critical care, vol 12, issue 4, pp 245 – 251.
- Burkitt Creedon JM, Davis H. (2012). Oxygen therapy. In Boyle J (Ed.), Advanced monitoring and procedures for small animal emergency and critical care (pp. 263 – 273). John Wiley & Sons, Inc.
 by Multimédica
by Multimédica