Primer caso de síndrome de hiperestesia felina de origen neuropático con diagnóstico definitivo por histopatología del neuroma
Resumen breve
Paciente felino de 5 años se presenta para evaluación por dolor en el tren posterior e hiperacicalamiento de la cola, con 5 años de evolución. El paciente presenta antecedentes de subluxación intercoccígea 6 - 7 al mes de vida. Al examen clínico evidencia molestia del tren posterior y se torna agresivo. En el extremo distal de la cola, presenta una úlcera crónica por lamido. Se sospecha dolor neuropático con signos de síndrome de hiperestesia felina (SHF) como principal prediagnóstico.Índice de contenidos
Resumen
Paciente felino de 5 años se presenta para evaluación por dolor en el tren posterior e hiperacicalamiento de la cola, con 5 años de evolución. El paciente presenta antecedentes de subluxación intercoccígea 6 - 7 al mes de vida. Al examen clínico evidencia molestia del tren posterior y se torna agresivo. En el extremo distal de la cola, presenta una úlcera crónica por lamido. Se sospecha dolor neuropático con signos de síndrome de hiperestesia felina (SHF) como principal prediagnóstico. Se instaura tratamiento con pregabalina 2 mg/kg cada 12 h, con respuesta parcialmente favorable, deteniendo el lamido, pero continuando con algunos signos. Se agrega al tratamiento amitriptilina 1 mg/kg, con mejora completa de los signos. Se procede a realizar la caudectomía, obteniendo excelente respuesta, permitiendo discontinuar el tratamiento farmacológico, sin recidiva de los signos hasta la fecha. El tejido se envía a histopatología, evidenciando la formación de un neuroma en las fibras nerviosas de los nervios coccígeos, permitiendo realizar un diagnóstico definitivo de dolor neuropático.
Introducción
El dolor es una experiencia multidimensional, con elementos complejos que interactúan desde sus componentes sensorio-discriminativo, afectivo-emocional y cognitivo-evaluativo1. Este puede presentarse de maneras adaptativas o desadaptativas, dejando atrás el concepto de agudo/crónico que solía emplearse. El dolor desadaptativo da a entender un estado álgido patológico en el cual las vías sensoriales se encuentran alteradas, dando paso a la neuroplasticidad, logrando como resultado una desconexión entre el tipo de dolor percibido y el estímulo en sí2. Un tipo de dolor desadaptativo corresponde al dolor neuropático. Según la Asociación Internacional para el Estudio del Dolor (IASP), refiere al dolor neuropático como “dolor causado por una lesión o enfermedad del sistema nervioso somatosensorial”, cuyos signos son característicos, pero no patognomónicos. Es por esto que su identificación y diagnóstico consta de tres niveles de certeza: dolor neuropático posible, probable y definitivo3. La clasificación “posible” consiste en que el paciente presente antecedentes de lesión o enfermedad neurológica relevante y distribución del dolor neuroanatómico plausible. El dolor neuropático “probable” muestra, además, al examen clínico, signos sensoriales en la misma distribución neuroanatómicamente plausible. Por último, el dolor neuropático “definitivo” incluye exámenes complementarios confirmando la lesión o enfermedad del sistema somatosensorial a la que se atribuye el dolor. Conjuntamente, los signos objetivos de un trastorno sensorial en la distribución del dolor aumentan la certeza diagnóstica. Estos signos pueden indicar un déficit sensorial con pérdida de función o respuestas exageradas a estímulos normalmente dolorosos (hiperalgesia) o indoloros (alodinia). El dolor neuropático, asimismo, se puede presentar como dolor espontáneo, continuo o bien, ser de forma episódica4.
Dentro de las patologías causales de dolor neuropático en gatos, se encuentran: síndrome de dolor orofacial, cistitis felina idiopática, intersticial y estéril, herpes virus-1 felino, gingivoestomatitis crónica, osteoartrosis, enfermedad inflamatoria intestinal, pancreatitis, neuropatía diabética, lesión nerviosa grave y lesión de la médula espinal5,6.
El SHF es un desorden en gatos pobremente comprendido y con un amplio abanico de diagnósticos diferenciales, descrito por primera vez en 1980 por J. Tuttle, caracterizado por una amplia variedad de signos clínicos como la hiperestesia de la zona dorsal-lumbar, movimientos paroxísticos con fasciculaciones del área muscular dorsal, crisis paroxísticas de persecución de cola, mordidas o acicalamiento excesivo del área lumbar, perianal, flancos o cola, los cuales pueden ser espontáneos o provocados por tacto suave. También, los signos pueden incluir episodios de saltos y carreras incontroladas, movimientos involuntarios de orejas, presuntas alucinaciones y vocalización excesiva, lo que conlleva a trastornos del comportamiento caracterizado por conductas de evitación y agresividad reactiva5,7,8. El SHF es una afección multifactorial y varios agentes etiológicos pueden estar involucrados. Los más frecuentes son alteraciones neurológicas, ortopédicas, dermatológicas y problemas etológicos9. En cuanto a las causas neurológicas, las más probables son las crisis epilépticas y neuropatías, tumores cerebrales y medulares, así como la formación de zonas de hiperinervación dopaminérgica anormal en respuesta a un estímulo inflamatorio local8. Las causas dermatológicas más comunes son las relacionadas con un estímulo inflamatorio cutáneo e hipersensibilidades.
Hasta la fecha en medicina veterinaria, no se ha publicado ningún caso de dolor neuropático con certeza definitiva en gatos, y hay escasa evidencia del uso de amitriptilina y su empleo en conjunto con pregabalina en gatos con dolor crónico de carácter neuropático y su efecto en el SHF.
Descripción del caso
Felino macho castrado de 4 años, acude a consulta por dolor crónico y crisis de hiperacicalamiento en la cola. La tutora menciona haber adoptado al paciente a las 3 semanas de vida, con una evidente lesión en la cola, diagnosticada radiográficamente como una subluxación intercoccígea 6 - 7 (Figura 1).
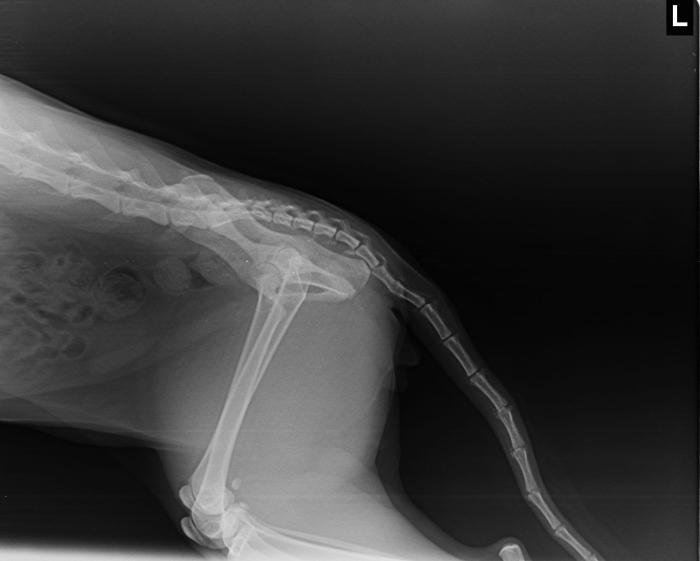
Figura 1. Eje axial evidencia pérdida parcial de contacto de carillas articulares entre cuerpos vertebrales de vértebra coccígea 6 y 7. Discreto desplazamiento a lateral izquierdo de coccígea 7 y apertura de espacio articular por lateral. Radiodiagnóstico: subluxación coccígea 6 -7.
Además, comenta que el paciente mantiene la cola hipotónica en casi toda su extensión, rechaza la manipulación del tren posterior, incluso tornándose agresivo, y manifiesta crisis de hiperacicalamiento en la punta de la cola, llegando incluso a automutilaciones por lamido, provocando una úlcera crónica. Las crisis se inician sin estímulo previo e interrumpen por largo tiempo la actividad diaria del paciente.
Al examen clínico, el paciente presentaba alodinia en los primeros segmentos de las vértebras coccígeas, con movimientos de anticipación y vocalización. A la palpación a nivel de la subluxación, se torna agresivo y muestra reacciones de escape. Alrededor de la úlcera, se evidencia pelaje hirsuto y tinción por lamido. A la observación del movimiento, se evidencia un uso precario de la cola con elevación aproximada de 45° (Figura 2).

Figura 2. Fotografía realizada por la tutora en el entorno hogareño. Se evidencia la precaria elevación de la porción distal de la cola.
Se inicia tratamiento con pregabalina 2 mg/kg cada 12 h, con resultados favorables evidentes pero parciales desde la primera semana de tratamiento: el hiperacicalamiento espontáneo se detiene, pero frente a golpes el estímulo retorna, vuelve al lamido excesivo y mordida de la cola. La úlcera, por tanto, persiste. Debido a los resultados parciales, se adiciona amitriptilina iniciando con 0.25 mg/kg cada 24 h, sumando 0.25 mg/kg por semana hasta llegar a 1 mg/kg.
Al mes de su tratamiento con ambos fármacos, la úlcera logra cicatrizar y ya no hay estímulos que gatillen el hiperacicalamiento. La calidad del pelaje mejora y el paciente permite la manipulación suave completa de la cola sin manifestar incomodidad o agresividad. Sin embargo, al tacto directo de la subluxación continúa manifestando signos de dolor.
Se procede a realizar caudectomía a nivel de Co4-Co5. Bajo anestesia general, se realiza epidural sacrococcígea con bupivacaína 0.12 % y dexmedetomidina 0.5 μg/kg. El manejo analgésico posquirúrgico consistió en meloxicam 0.2 mg/kg SC, metamizol 15 mg/kg EV y ketamina 0.3 mg/kg/h durante 36 h, con destete gradual durante 12 horas más. Las indicaciones al alta incluyen el mantener los tratamientos de pregabalina y amitriptilina, sumado a meloxicam a 0.1 mg/kg PO y metamizol 15 mg/kg PO. El paciente mantiene mejoría clínica previamente descrita, sin haber nuevos cambios. Sin embargo, la caudectomía permitió el retiro gradual de pregabalina y amitriptilina en un lapso de 2 meses. A la presente fecha, el paciente continúa sin recidivas de los signos clínicos sin recibir analgésicos.
Se envía la cola como muestra para estudio histopatológico, donde el examen de nervios coccígeos informa edema intrafascicular, fibrosis epineural, reemplazo de axones y células de Schwann por tejido fibroso intersticial, siendo estos hallazgos compatibles con neuroma terminal.
Discusión
Realizar el diagnóstico del dolor neuropático es desafiante y aún más definir el origen de este. Además del componente sensorial del dolor, se suman aspectos emocionales que pueden percibirse como cambios conductuales en nuestros pacientes6. Aun así, los cambios de comportamiento pueden no ser tan claros y dificultar el diagnóstico. Existen algunas publicaciones en las que esto se hace evidente, por ejemplo, en un reporte de caso sobre un canino con cambio de comportamiento 7 días posterior a una cirugía de hemilaminectomía, el paciente presenta conductas indeseables como ladrar, morder y lamer a nivel del sitio de incisión10. El prediagnóstico fue dolor neuropático, cuyo manejo fue gabapentina 10 mg/Kg y paracetamol 12 mg/Kg cada 8 horas, y posteriormente la gabapentina se aumentó a 20 mg/Kg cada 8 horas, sin cambios en el paciente. Los autores sospecharon de un tipo de desorden compulsivo, ya que el paciente comenzó a responder al castigo verbal del propietario cuando se presentaba el comportamiento indeseable, sin embargo, el diagnóstico no fue claro10.
En el caso aquí presentado, el diagnóstico fue más evidente, dado el historial de lesión traumática del paciente, que desencadena dolor en áreas plausibles con el nervio afectado, determinando un dolor neuropático “posible”. Al examen clínico, los signos permiten evidenciar cambios sensoriales en áreas nerviosas compatibles con la lesión, definiendo un dolor neuropático “probable”. Y finalmente diagnosticando un dolor neuropático “definitivo” dado por la presencia de neuromas en la histopatología.
Los neuromas son una lesión proliferativa no neoplásica de origen traumático, se consideran la lesión reparadora más común del sistema nervioso periférico en humanos11 y representan un desafío terapéutico con signos sumamente dolorosos, generando cambios del estilo de vida del afectado para adaptarse al dolor. Es por esta razón que muchas investigaciones se enfocan en descubrir los mecanismos de la formación de neuromas, técnicas preventivas y tratamientos12.
Es importante destacar que el presente estudio corresponde al primer caso de SHF de origen neuropático con diagnóstico definitivo dado por la histopatología del neuroma. Sí bien existen casos informados de neuromas en perros, son escasos, y es llamativo que no siempre están asociados con reportes de dolor en el paciente, lo que lleva a concluir que este puede estar muchas veces subdiagnosticado.
En medicina veterinaria la causa más común de formación de neuroma es la caudectomía. Los signos que pueden desarrollar los pacientes son dolor, autotrauma, alopecia, liquenificación e hiperpigmentación de la piel, y engrosamiento difuso del tejido conectivo13, sin embargo, también pueden formarse en otras partes del cuerpo por otras causas traumáticas. Se describe un caso de un perro cuyo motivo de consulta fue un nódulo cutáneo en la frente, la muestra del tejido fue enviada a histopatología, informando la presencia de un neuroma11. En el mismo sitio del nódulo, el paciente había presentado una lesión traumática previa, donde no se describen manifestaciones de dolor por parte del paciente11. En otro caso, se presenta un perro para extracción de múltiples masas, cuya histopatología confirma neuroma. El perro previamente había mordido la zona durante dos años, formando en un inicio pequeñas masas dérmicas que luego aumentaron en número, logrando un diagnóstico de un neuroma traumático13. En un reporte de un gato sometido previamente a oniquectomía, el paciente presentaba cojera de un miembro de al menos 6 meses de curso. Este previamente había sido tratado con meloxicam 0.05 mg/kg cada 24 h por 4 semanas con una leve mejora; luego fue añadido al tratamiento amitriptilina 10 mg totales cada 24 h por 6 semanas (no es informado el peso del paciente), presentando una moderada mejora. Al examen clínico, el paciente presentó dolor a la palpación de los metacarpos, donde se encontró una masa cerca del tercer metacarpiano, cuyo diagnóstico presuntivo fue un neuroma, sin embargo, no se envió muestra a histopatología para confirmar el diagnóstico. El paciente recibió gabapentina 5 mg/kg cada 12 h durante las semanas previas y posteriores a la cirugía. Los propietarios informaron una mejora significativa del 95 % del dolor durante más de 1 año14. No existen, hasta la fecha, reportes de gatos con diagnóstico de neuroma confirmado por histopatología, solo diagnósticos presuntivos.
Una vez realizado el diagnóstico, se inicia el abordaje terapeútico. En medicina humana los medicamentos descritos de primera línea son los gabapentinoides (gabapentina y pregabalina), antidepresivos tricíclicos (ATC) e inhibidores de la recaptación de serotonina y norepinefrina (duloxetina y venlafina); de segunda línea, opioides (tramadol, tapentadol), tratamientos tópicos (parches de lidocaína y capsaicina), y como tercera línea opioides fuertes y toxina botulínica15. En medicina veterinaria, se describen gabapentinoides y ATCs, pero también se mencionan opioides, antiinflamatorios no esteroidales, ketamina, amantadina, cannabinoides y anticuerpos monoclonales contra factor de crecimiento nervioso (FCN)5, siendo los más utilizados los gabapentinoides16. En medicina veterinaria no se hace diferencia aún entre tratamientos de primera línea y otros.
Los gabapentinoides inhiben la subunidad proteica auxiliar α2-δ de los canales de calcio dependientes, esto reduce la entrada de calcio en los terminales nerviosos, evitando la liberación de glutamato, norepinefrina y sustancia P. Se postula que la pregabalina presenta mayor potencia en comparación a la gabapentina, debido a la mayor afinidad que posee por la subunidad proteica α2-δ17.
En gatos, el único estudio farmacocinético de pregabalina disponible hasta la fecha, sugiere que una dosis de 4 mg/kg diaria sería adecuada para mantener al paciente dentro de un rango terapéutico17. Sin embargo, postulan que dosis más bajas podrían requerir una administración cada 12 horas, disminuyendo así algunos de los efectos secundarios, como sedación y polifagia, mientras se mantienen las concentraciones séricas deseadas. En este caso de manejo de dolor se optó por utilizar una dosis de pregabalina de 2 mg/kg cada 12 h, sin necesidad de aumentar la dosis, mostrando mejoras significativas sin evidenciar efectos secundarios asociados al uso de este medicamento.
Por otra parte, los ATCs actúan inhibiendo la recaptación de serotonina y norepinefrina en los terminales presinápticos, inhibiendo los canales de sodio. También presentan efectos anticolinérgicos, antihistamínicos y antagonismo en los receptores NMDA15,16,18. Dentro de los efectos secundarios, en humanos se ha descrito prolongación del segmento QT, somnolencia, mareos, sequedad de boca e hipotensión ortostática18. En el caso clínico expuesto en este trabajo, el paciente presentó algunos eventos de vómitos, que fueron asociados al mal sabor del medicamento, pero no fue reportado ninguno de los eventos adversos comentados en bibliografía.
La amitriptilina es el ATCs más recetado en medicina humana para el tratamiento de dolor neuropático19. Sin embargo, en veterinaria el uso de amitriptilina aún no es rutinario, lo que podría deberse a los escasos estudios disponibles. Existe solo un estudio farmacocinético en gatos, que reportó una vida media de 2 h del fármaco luego de una administración oral de una dosis total de 5 mg totales por gato; correspondiente a dosis 1.3-1.4 mg/kg de acuerdo al peso de los gatos en el estudio20. En perros existe un estudio farmacocinético más reciente, que concluye que una dosis de amitriptilina de 4 mg/kg es inadecuada para mantener concentraciones plasmáticas, cuestionando la dosis típica recomendada de 1-4 mg/kg21. Descrito en este estudio, una dosis de 1 mg/kg cada 24 h mostró clara mejora en la signología clínica, siendo una dosis menor a la recién expuesta. Esto sugiere que dosis menores podrían ser efectivas, sustentado bajo la posible sinergia entre ambos medicamentos, lo cual aún no ha sido estudiado.
Si bien los tratamientos para el dolor neuropático han sido muy bien estudiados en medicina humana, en medicina veterinaria contamos mayormente con presentaciones de casos, en donde los resultados son muy distintos entre pacientes. Por ejemplo, en un caso de sospecha de dolor fantasma posamputación en un gato, se prescribió como tratamiento amitriptilina a una dosis de 0.6 mg/kg, mostrando significativa mejoría al día 14, sin signos de dolor22. En otro caso de dolor neuropático posamputación en un gato, luego de una terapia con meloxicam sin éxito, se inicia tratamiento con gabapentina 10 mg/kg cada 12 h, mostrando leve e insuficiente mejora. La dosis fue aumentada a 20 mg/kg, sin embargo, los signos de dolor no lograron ser eliminados por completo por lo que se combina con amitriptilina 1.5 mg/kg cada 12 h, sin obtener mejoría. Los autores procedieron a un nuevo enfoque terapéutico, realizando una epidural con buprenorfina 0.01 mg/kg, triamcinolona 0.2 mg/kg y bupivacaína 0.5 %. Posterior a la epidural, los signos clínicos desaparecen completamente, y se retiran amitriptilina y gabapentina, no registrándose recidiva de signos clínicos posteriores a 9 meses de la terapia con epidural23. En otro reporte, una serie de casos de síndrome de dolor orofacial felino, se utilizó amitriptilina en algunos de los pacientes (dosis y ritmo horario no informados) teniendo buena respuesta en algunos, y en otros nula24. En un estudio clínico de uso de amitriptilina 10 mg totales en gatos con enfermedad del tracto urinario inferior, en un plazo de 7 días no se evidenció mejoría en los pacientes25, sin embargo, el tiempo de tratamiento fue probablemente muy corto para evaluar respuesta.
En otro estudio de serie de casos realizado en perros, donde se presentó dolor neuropático en tres pacientes, uno de ellos no respondió a las 2 semanas con amitriptilina 1.4 mg/kg cada 12 h, mostrando además como efecto secundario alteración del estado mental. Se procedió al reemplazo de la terapia por gabapentina 14.3 mg/kg cada 12 h, obteniendo un tratamiento exitoso. Los otros dos pacientes mantuvieron la amitriptilina como monoterapia a dosis de 1.1 y 1.3 mg/kg cada 12 h, teniendo una respuesta exitosa en ambos casos. Uno de esos pacientes previamente había sido tratado con gabapentina 12.5 mg/kg cada 12 h, sin ninguna mejora26.
En otro caso de un canino con sospecha de dolor neuropático y sensación de dolor fantasma posamputación por sarcoma de tejido blando, el paciente se trató con dosis de gabapentina a 10 mg/kg cada 12 h, sin respuesta, hasta que el tratamiento se modificó con amitriptilina 8 mg/kg cada 12 h, resolviendo los signos de dolor completamente27.
A través de los casos revisados, se logra constatar que no hay un manejo terapéutico definido para este tipo de dolor, utilizando distintas dosis, con ritmos horarios diferentes para un mismo tipo de medicamento. Además, en numerosas ocasiones, medicamentos que pueden ser complementarios, en vez de ser usados en conjunto, están siendo utilizados uno como reemplazo del otro cuando el primero no ha sido efectivo.
En uno de los ensayos clínicos cruzados más grandes de dolor neuropático en humanos hasta la fecha, se estudió el efecto de la amitriptilina suplementada con pregabalina, pregabalina suplementada con amitriptilina y duloxetina suplementada con pregabalina para el tratamiento del dolor neuropático periférico diabético. Este mostró que la monoterapia produjo un alivio significativo del dolor solo en poco más de un tercio de los participantes, y un alivio del dolor del 50 % en aproximadamente el 40 % de los pacientes. Dentro de los pacientes que no respondieron con la terapia, hubo necesidad de un tratamiento combinado, produciendo un alivio del dolor significativamente mejor. El ensayo demostró que los tres tratamientos proporcionaron una eficacia analgésica similar, siendo ninguno mejor analgésico que el otro19. Esto pudo observarse nuestro caso presentado, donde el tratamiento con pregabalina como monoterapia si bien fue efectivo, fue insuficiente, lo cual hizo evidente la necesidad de una suplementación, o bien un cambio de terapia. En esta circunstancia, la colaboración de la tutora fue esencial, para poder ir evaluando la dosis de amitriptilina de manera gradual y parcializada, iniciando desde 0.25 mg/kg cada 24 h, para ir escalando la dosis cada 7 días hasta lograr 1 mg/kg, logrando un alivio significativo en el paciente. Si bien no hay disponible escalas para este tipo de dolor en gatos, la mejora de los signos clínicos en conjunto con la información entregada por la tutora en cuanto al comportamiento en casa, evidencian una terapia exitosa.
Una de las consecuencias del dolor neuropático en este paciente, fue el desarrollo de SHF. Este corresponde a una entidad compleja de abordar, y dado su gran abanico de etiologías posibles, el tratamiento varía mucho entre una causal y otra. Por lo general, ninguno de los signos clínicos indica un origen específico, por lo que es necesario recurrir a algoritmos ordenados que permitan realizar una pesquisa cuidadosa de cada uno de los factores presentes. Algunos de estos, como el propuesto por Amenagual et al. el 2018, en su serie de casos, permite lograr un orden de factores, explorando minuciosamente los ámbitos dermatológicos, conductuales, musculoesqueléticos y neurológicos. En el caso aquí expuesto, la etiología estaba claramente identificada y la principal sospecha era dolor neuropático debido a la lesión reportada.
En un reporte de caso de SHF, se mencionó un paciente felino de raza Selkirk rex de pelo largo, quien, de manera aguda y concordante con un cambio de casa y estilo de vida, manifiesta hiperactividad sin razón aparente, rasquido y lamido de todo el cuerpo, especialmente la espalda baja y conducta anormal de micción. A nivel dermatológico, lo único inusual en el paciente fue una pequeña cantidad de cilindros foliculares. Los tutores no accedieron a ninguno de los exámenes complementarios sugeridos para descarte de otras patologías. Finalmente, se inició con terapia con gabapentina, con resultados parciales, posterior a lo cual se trató con dieta hidrolizada, obteniendo control total de los signos al completar una semana28.
Un estudio de caso realizado el 2021 señala epilepsia como posible etiología de SHF. Se mencionan dos gatos con signología concordante con SHF, con algoritmo de descarte completo del resto de patologías posibles, cuyos electroencefalogramas realizados cumplían con al menos 4 de los 6 criterios aceptados por la International Federation of Societies for Electroencephalography and Clinical Neurophysiology, pudiendo ser considerados como un patrón epileptiforme, con alteraciones en las zonas que pueden justificar mayormente los signos clínicos y patrón en la semiología epileptiforme8. Sin embargo, es el único reporte que correlaciona como causa única y directa la epilepsia con el desarrollo de SHF.
El gran interrogante que queda por analizar es el por qué algunos gatos con dolor neuropático desarrollan SHF, y otros no. A opinión de las autoras, el gatillante para el desarrollo del SHF no es solo uno, sino que una serie de factores que interactúan finamente, entre componentes emocionales, afectivos, sensoriales y comorbilidades presentes. La neuroplasticidad, entorno del paciente y factores individuales tanto fenotípicos como genotípicos pueden combinarse de maneras aún inciertas, determinando la expresión clínica de este síndrome como tal en algunos pacientes y en otros no.
De acuerdo a la revisión realizada, es incuestionable la urgencia de nuevos estudios farmacocinéticos y ensayos clínicos controlados para crear lineamientos veterinarios; mientras eso no suceda, el manejo de nuestros pacientes será mediante la extrapolación de información disponible en medicina humana e información obtenida por reportes de casos en medicina veterinaria.
Este reporte de caso es el primero que sigue el algoritmo diagnóstico indicado por la IASP y aporta fuerza a la necesidad de seguir esquemas ordenados para la obtención de diagnósticos definitivos en trastornos complejos como son el dolor neuropático en felinos y SHF.
Agradecimientos
Las autoras quisieran manifestar sus agradecimientos a la Dra. Claudia López A., del laboratorio de Patología Veterinaria Histovet; a la Dra. Daniela Zaror y el Centro Oncológico Veterinario Santiago, a la Dra. Paula Zamora, cirujana, y a nuestra futura colega Camila Cotroneo, tutora del paciente, quien, con su constancia, esfuerzo y trabajo en conjunto, posibilitó la mejora de LeBron.
Bibliografía
1. Monteiro B, Steagall P; Chronic Pain in Cats: Recent Advances in Clinical Assessment; Journal of Feline Medicine and Surgery; 2019
2. Monteiro B, Lascelles B, Murrel J, Robertson S, Steagall P, Wright, B; Directrices de WSAVA para el reconocimiento, evaluación y tratamiento del dolor; WSAVA; 2022
3. Finnerup NB, Haroutounian S, Kamerman P, Baron R, Bennett D, Bouhassira D, Cruccu G, Freeman R, Hansson P, Nurmikko T, Raja S, Rice A, Serra J, Smith B, Treede R, Jensen T; Neuropathic pain: an updated grading system for research and clinical practice; Pain; 2016
4. Scholz J, Finnerup N, Attald N, Aziz Q, Baron R, Bennett M, Benoliel R, Cohen M, Cruccu G, Davis K, Evers S, First M, Giamberardino M, Hansson P, Kaasa S, Korwisi B, Kosek E, Lavand’homme P, Nicholas M, Nurmikko T, Perrot S, Rajaw S, Rice A, Rowbotham M, Schug S, Simpson D, Smith B, Svensson P, Vlaeyen J, Wang S, Barke A, Rief W, Treede R; Classification Committee of the Neuropathic Pain Special Interest Group (NeuPSIG), and Task Force for the Classification of Chronic Pain of the International Association for the Study of Pain (IASP); The IASP Classification of chronic pain: chronic neuropathic pain; PAIN, 2020
5. Epstein M; Feline Neuropathic Pain; Veterinary Clinics of North America: Small Animal Practice; 2020
6. Mathews K; Neuropathic Pain in Dogs and Cats: If OnlyThey Could Tell Us If They Hurt; Veterinary Clinics of North America: Small Animal Practice; 2008
7. Amengual P, Rusbridge C, Nutall, T, Heath S, Mariony-Henty K; Feline hyperaesthesia syndrome withself-trauma to the tail: retrospective study of seven cases and proposal for integrated multidisciplinary diagnostic approach; Journal of Feline and Medicine Surgery; 2018
8. Gómez C, Soler E; Feline hyperesthesia syndrome: Epilepsy as possible aetiology in two cats; Vet Record Case Report; 2021
9. Schimanski L, Murillo V, Ghaouche de Moraes FA, Fredrichsen C; Síndrome da hiperestesia Felina - Relato de Caso; Veterinária e Zootecnia; 2023
10. Santifort K, Plonek M, Mandigers P; Case report: Neuropathic pain versus undesirable behavior in a Dachshund after hemilaminectomy surgery for an intervertebral disc extrusion; Frontiers In Veterinary Science; 2023
11.Dos Santos I; Raiter J, Serena, G, Bandinelli M, Pavarini S, Driemeier D; Cutaneous nodule at the site of previous trauma in a 9-year-old male dog; Journal of the American Veterinary Medical Association; 2024
12. Neumeister M, Winters J; Neuroma; Clinics in Plastic Surgery; 2020
13. Ozaki K, Ano N, Nomura K; Multiple traumatic neuromas with swollen nerve fascicles and perineurial hyperplasia; Journal of Comparative Pathology; 2012
14. Grubb T; Chronic Neuropathic Pain in Veterinary Patients; Topics in Companion Animal Medicine; 2010
15. Cavalli E, Mammana S, Nicoletti F, Bramanti P, Mazzon E; The neuropathic pain: An overview of the current treatment and future therapeutic approaches; International Journal of Immunopathology and Pharmacology; 2019
16. Moore S; Managing Neuropathic Pain in Dogs; Frontiers in Veterinary Science; 2016
17. Esteban M, Dewey C, Schwark W, Rishniw M, Boothe M. Pharmacokinetics of Single-Dose Oral Pregabalin Administration in Normal Cats; Frontiers in Veterinary Science; 2018
18. Attal N; Pharmacological treatments of neuropathic pain: The latest recommendations; Revue Neurologique; 2019
19. Tesfaye S, Sloan G, Petrie J, White D, Bradburn M, Julious S, Rajbhandari S, Sharma S, Rayman G, Gouni R, Alam U, Cooper C, Loban A, Sutherland K, Glover R, Waterhouse S, Turton E, Horspool M, Gandhi R, Maguire D, Jude E, Ahmed S, Vas P, Hariman C, McDougall C, Devers M, Tsatlidis V, Johnson M, Rice A, Bouhassira D, Bennett D, Selvarajah D; Comparison of amitriptyline supplemented with pregabalin, pregabalin supplemented with amitriptyline, and duloxetine supplemented with pregabalin for the treatment of diabetic peripheral neuropathic pain (OPTION-DM): a multicentre, double-blind, randomized crossover trial; The Lancet; 2022
20. Mealey K, Peck K, Bennett B, Sellon R, Swinney G, Melzer K, Gokhale S, Krone T; Systemic Absorption of Amitriptyline and Buspirone after Oral and Transdermal Administration to Healthy Cats; Journal of Veterinary Internal Medicine; 2004
21. Norkus C, Rankin D, Kukanich B; Pharmacokinetics of intravenous and oral amitriptyline and its active metabolite nortriptyline in Greyhound dogs; Veterinary Anaesthesia and Analgesia 2015
22. O’Hagan B; Neuropathic pain in a cat post-amputation; Australian Veterinary Journal; 2006
23. Primason L; Gleed R; Boesch J. Epidural anaesthesia for treatment of neuropathic pain associated with pelvic limb amputation in a domestic shorthair cat; Vet Record Case Reports; 2017
24. Rusbridge C, Heath S, Gunn-Moore D, Knowler S, Johnston N, McFadyen A; Case Series: Feline orofacial pain syndrome (FOPS): a retrospective study of 113 cases; Journal of Feline Medicine and Surgery; 2010
25. Kraijer M, Fink-Gremmels J, Nickel R; The short-term clinical efficacy of amitriptyline in the management of idiopathic feline lower urinary tract disease: a controlled clinical study; Journal of Feline and Medicine Surgery; 2003
26. Cashmore R, Harcourt-Brown T, Freeman P, Jeffery N, Granger N; Clinical diagnosis and treatment of suspected neuropathic pain in three dogs; Australian Veterinary Journal; 2009
27. Ferreira M, Antunes A, Pascoli A, Nazaret T, Gering N, Reis N, Costa M, Nardi A; Neuropathic pain and prognosis of a dog submitted to limb amputation after diagnosis of soft tissue sarcoma - case report; Arquivo Brasileiro de Medicina Veterinária e Zootecnia; 2019
28. Ruiz-Suarez N, Mareyam S, Hermans M, Baptista da Silva C, Hesta M; Food hypersensitivity and feline hyperaesthesia Syndrome (FHS): a case report; Veterinarni Medicina; 2021
 by Multimédica
by Multimédica