Ventilación mecánica en gatos anestesiados
Resumen breve
El empleo de la ventilación a presión positiva (VPP) ha cobrado importancia creciente en el ámbito de la anestesia y los cuidados intensivos veterinarios a nivel mundial. La VPP durante la anestesia facilita la prevención de la hipoventilación resultante del efecto de los fármacos anestésicos, permitiendo mejorar la oxigenación mediante la elevación de la presión alveolar y promoviendo un intercambio gaseoso eficiente. Por otro lado, en pacientes críticos que requieren asistencia ventilatoria…Índice de contenidos
Introducción
El empleo de la ventilación a presión positiva (VPP) ha cobrado importancia creciente en el ámbito de la anestesia y los cuidados intensivos veterinarios a nivel mundial. La VPP durante la anestesia facilita la prevención de la hipoventilación resultante del efecto de los fármacos anestésicos, permitiendo mejorar la oxigenación mediante la elevación de la presión alveolar y promoviendo un intercambio gaseoso eficiente. Por otro lado, en pacientes críticos que requieren asistencia ventilatoria mecánica (AVM), la VPP contribuye a optimizar el intercambio gaseoso, previene la fatiga de la musculatura respiratoria y permite ganar tiempo para el tratamiento de la patología subyacente.
Sin embargo, debe tenerse en consideración que la implementación de estrategias ventilatorias inadecuadas puede incrementar significativamente el riesgo de lesión pulmonar, así como de complicaciones pulmonares postoperatorias.
En esta revisión, se abordarán aspectos clave de la aplicación de la ventilación mecánica en anestesia y cuidados críticos en felinos.
Fisiología respiratoria aplicada
En cada inspiración, el aire ingresa al pulmón debido a un gradiente de presión. Este gradiente puede ser generado por el diafragma, que produce una presión pleural más negativa, o por un ventilador mecánico (VM) que genera presión positiva en la vía aérea. La impedancia al flujo está compuesta por dos componentes: resistivo y elástico.
El componente elástico está determinado principalmente por la distensibilidad (compliance) del pulmón y de las estructuras circundantes y el componente resistivo es generado por la resistencia de la vía aérea.
La compliance del sistema respiratorio (Csr) se refleja en la siguiente fórmula:
Csr = Δ volumen/ Δ presión
Cuando se administra un volumen específico mediante presión positiva, la presión resultante depende en gran medida de la compliance del pulmón, el tórax y el abdomen. Si la compliance disminuye, el volumen administrado por el VM generará una mayor presión.
El término elastancia refleja el retroceso elástico de las estructuras pulmonares. La elastancia es el inverso de la Csr:
Elastancia = Δ presión/ Δ volumen
Las curvas presión-volumen del sistema respiratorio muestran que la Csr varía en diferentes partes de la curva. Al analizar esta curva, pueden detectarse dos puntos de inflexión: un punto de inflexión inferior y otro de inflexión superior (Figura 1).
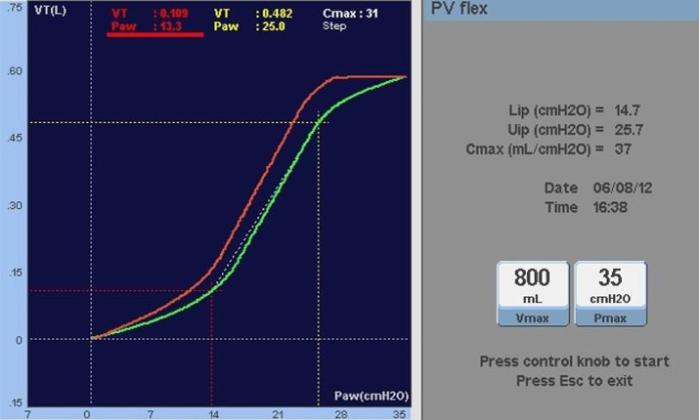
- El punto de inflexión inferior representa el inicio del reclutamiento alveolar en un pulmón colapsado o la apertura de vías aéreas previamente colapsadas.
- El punto de inflexión superior indica la capacidad pulmonar total.
El empleo de presiones en la vía aérea por encima del punto de inflexión superior debe evitarse, ya que generaría un estrés excesivo sobre el parénquima pulmonar.
Ecuación de movimiento del sistema respiratorio
El gradiente de presión necesario durante la inspiración varía proporcionalmente a la resistencia de la vía aérea e inversamente a la Csr. Así, al aumentar la resistencia de la vía aérea o disminuir la compliance del pulmón o del tórax, se eleva el gradiente de presión necesario para que el aire ingrese desde la boca hacia el pulmón. Esto se refleja en la ecuación de movimiento del sistema respiratorio:
Presión = volumen / compliance + flujo * resistencia
Esta ecuación expresa el trabajo respiratorio y, en consecuencia, el gasto de energía, que será mayor cuanto mayores sean los valores obtenidos en la ecuación.
Gases en sangre
Uno de los objetivos del empleo de VPP durante la anestesia y en pacientes críticos es optimizar el intercambio gaseoso. Debe considerarse que los valores normales de PaCO2 son, en general, más bajos en los felinos en comparación con otras especies como los caninos y los humanos (Tabla 1).
Tabla 1. Valores normales de gases arteriales en el perro y el gato.
| Perro | Gato | |
|---|---|---|
| pH | 7.407 (7.351-7.463) | 7.386 (7.310-7.462) |
| PCO2 (mmHg) | 36.8 (30.8-42.8) | 31.0 (25.2-36.8) |
| PO2 (mmHg) | 92.1 (80.9-103.3) | 106.8 (95.4-118.2) |
| HCO3− (mEq/L) | 22.2 (18.8-25.6) | 18.0 (14.4-21.6) |
En pacientes con pulmón sano se debería tener como objetivo mantener los valores de PaCO2 o sus subrogantes como la presión de CO2 de fin de espiración (ETCO2) en el rango fisiológico de la especie. Los autores habitualmente buscan un rango de ETCO2 de entre 30 y 35 mmHg en felinos sanos anestesiados. Sin embargo, en pacientes críticos se recomienda el empleo de una estrategia conocida como hipercapnia permisiva.Esta estrategia consiste en el empleo de valores de volumen corriente (Vc) menores a los normales con el objetivo de evitar un estrés excesivo en el pulmón a expensas de una PaCO2 no mayor de 55 mmHg.
Modos ventilatorios
Los modos ventilatorios se clasifican sistemáticamente según tres componentes fundamentales: la variable primaria controlada, el mecanismo de activación del ciclo inspiratorio y el criterio de terminación de la inspiración. Los modos ventilatorios más comúnmente empleados en medicina veterinaria son: ventilación controlada por volumen (VCV) y ventilación controlada por presión (PCV). En el modo VCV, la variable de control es el volumen, que permanece constante mientras la presión en la vía aérea varía según la mecánica respiratoria del paciente. Por otro lado, en PCV, la variable de control es la presión de la vía aérea, que se mantendrá constante a expensas de un flujo inspiratorio desacelerado.
Ventilación controlada por volumen (VCV)
En este modo ventilatorio, el flujo inspiratorio es fijo; no se modifica ante cambios en la mecánica respiratoria ni ante variaciones en el esfuerzo inspiratorio del paciente. El uso de VCV en este contexto tiene la ventaja de evitar la entrega de un Vc mayor al seleccionado, reduciendo el riesgo de volutrauma. Por ello, en medicina humana, es el modo más comúnmente empleado en pacientes con síndrome de distrés respiratorio agudo (SDRA). Sin embargo, en animales pequeños como los gatos, el uso de volúmenes pequeños puede aumentar el riesgo de hipoventilación alveolar en presencia de fugas en el circuito.
La variable central en este modo ventilatorio es el Vc. En medicina humana, se ha demostrado que la selección inapropiada del Vc aumenta el riesgo de injuria pulmonar inducida por la ventilación mecánica (VILI) y la mortalidad. El volumen corriente recomendado en pacientes caninos varía habitualmente entre 8 y 25 ml/kg de peso. En felinos, el Vc normal parece ser menos variable (probablemente debido a una menor variabilidad morfométrica entre felinos de diferentes razas), y sus valores suelen encontrarse entre 10 y 15 ml/kg de peso. Si bien hay perros que pueden requerir volúmenes corrientes similares a los empleados en felinos, en promedio el Vc empleado en esta especie suele ser menor que el empleado en perros. Esta diferencia puede deberse a un menor espacio muerto anatómico y una menor capacidad residual funcional relativa en los felinos en comparación con los perros.
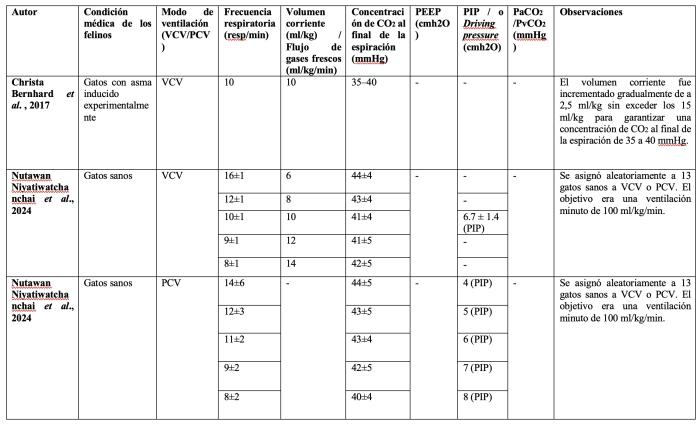
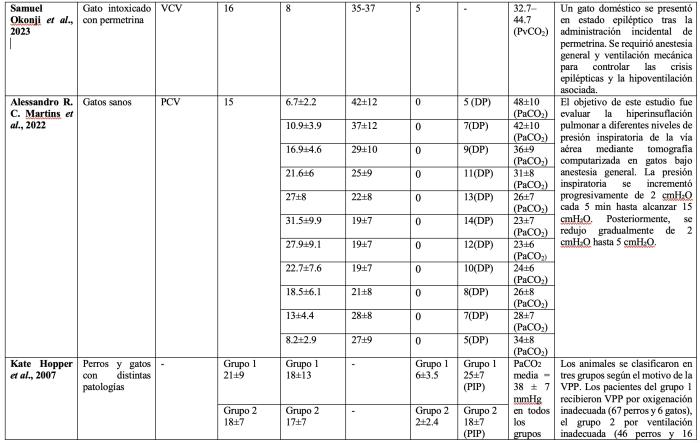
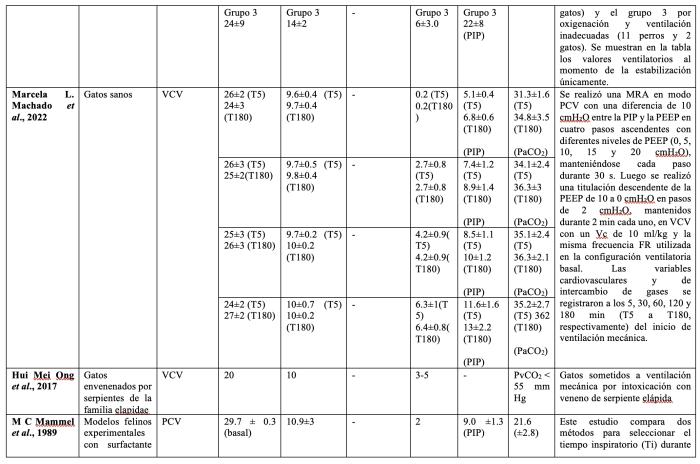
Es importante tener en consideración que un volumen minuto respiratorio (Vc x frecuencia respiratoria) adecuado debería generar valores de PaCO2 dentro del rango normal de la especie. Muchos trabajos experimentales realizados en felinos han buscado como objetivo de PaCO2 valores considerados normales en humanos (35-45 mmHg), pero que serían elevados para los felinos. Esto pudo haber favorecido el empleo de valores de Vc menores a los normales para esta especie en algunos estudios previamente publicados (Tabla 2).
Tabla 2. Mecánica ventilatoria y valores de dióxido de carbono en diferentes estudios donde ventilaron mecánicamente felinos sanos o enfermos. Abreviaturas: ETCO2: Concentración de CO2 al final de la espiración, DP: driving pressure, MRA: maniobra de reclutamiento alveolar, PaCO2: presión arterial de dióxido de carbono; PCV: ventilación controlada por presión, PEEP: presión positiva al final de la espiración; PIP: presión inspiratoria pico, PvCO2: Presión venosa de dióxido de carbono, Vc: volumen corriente, VCV: ventilación controlada por volumen.
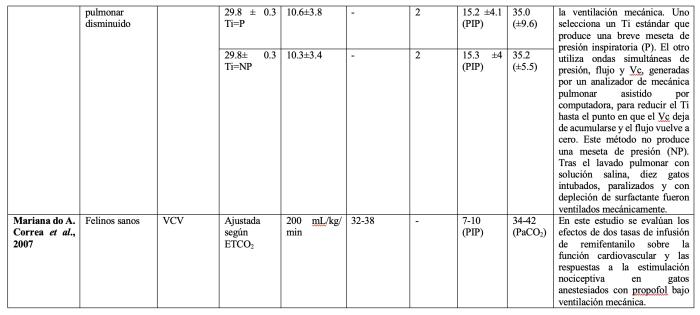
La aplicación de una pausa inspiratoria permite monitorear la presión meseta o plateau y favorece la distribución del gas alveolar dentro del pulmón, especialmente en pulmones con constantes de tiempo heterogéneas. Además, la pausa inspiratoria aumenta la presión media en la vía aérea, lo que permite mejorar la oxigenación. Se ha demostrado previamente que la pausa inspiratoria también favorece la eliminación de CO2, ya que prolonga el tiempo de distribución medio, disminuyendo el espacio muerto anatómico y mejorando el intercambio gaseoso.
En la modalidad VCV, el Vc constituye la variable independiente y, por lo tanto, no se modifica frente a cambios en la mecánica respiratoria del paciente. En este modo ventilatorio, la presión resultante necesaria para administrar el volumen programado refleja las variaciones en la mecánica respiratoria. Así, una disminución de la Csr se traduce en un aumento de la presión generada para un mismo volumen corriente.
Existen dos tipos de presiones en la vía aérea que son esenciales para el monitoreo de la mecánica respiratoria en la modalidad VCV: la presión pico (o máxima) y la presión plateau (o meseta).
- Presión pico: es la máxima presión generada por un volumen determinado y depende de las condiciones estáticas (elásticas) y dinámicas (resistivas) del paciente.
- Presión meseta (plateau): se obtiene mediante la oclusión de la válvula espiratoria, utilizando una pausa inspiratoria de 2 a 3 segundos al final de la inspiración. Durante esta pausa, el manómetro del respirador registra la presión intrapulmonar, que es equivalente a la presión alveolar. Dado que en ese momento no existe flujo aéreo, se elimina el componente resistivo y se evalúa exclusivamente el componente elástico del sistema respiratorio. La presión meseta aumenta cuando disminuye la Csr, pero no se ve influenciada por incrementos en la resistencia de la vía aérea.
Adicionalmente, la presión media en la vía aérea representa el promedio de las presiones que distienden el pulmón y la pared torácica a lo largo de un ciclo respiratorio. Su monitoreo es relevante, ya que valores más elevados suelen asociarse con una mejoría de la oxigenación; sin embargo, también pueden ejercer efectos hemodinámicos adversos.
Por último, la Driving pressure (DP) es la verdadera presión de distensión del pulmón que se calcula como la diferencia entre la presión meseta y la PEEP. Su monitoreo es esencial debido a que su aumento se ha asociado a una mayor mortalidad en humanos críticamente enfermos y a una mayor tasa de complicaciones pulmonares postoperatorias en el ámbito quirúrgico (Figura 2).
Ventilación controlada por presión (PCV)
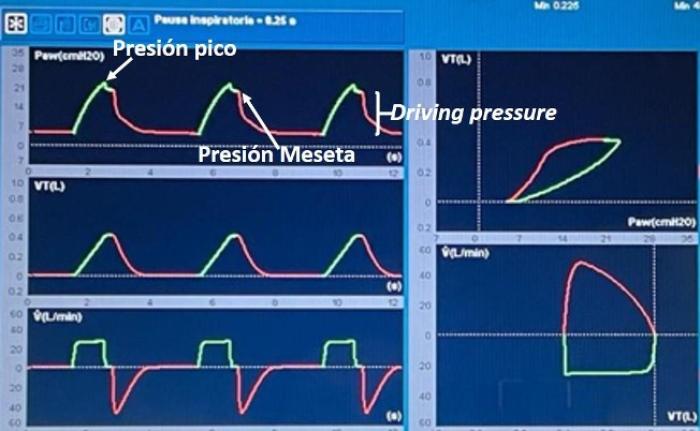
La modalidad PCV se caracteriza por tener la presión en la vía aérea como variable de control. En esta modalidad, el VM entrega un flujo inspiratorio desacelerado para alcanzar y mantener la presión seleccionada durante todo el tiempo inspiratorio. En este modo ventilatorio, el Vc se modifica según los cambios en la mecánica respiratoria del paciente, mientras que la presión en la vía aérea se mantiene constante. La variable de fase conocida como límite en este modo es la presión en la vía aérea y el ciclado es el tiempo. El patrón de onda de flujo es desacelerado y variable: el flujo aumenta rápidamente hasta alcanzar la presión seleccionada y luego se desacelera para mantener la presión constante durante el tiempo inspiratorio. La tasa de desaceleración del flujo dependerá de las condiciones de resistencia y Csr. En consecuencia, el análisis de la curva de flujo resulta fundamental en este modo para monitorear la mecánica respiratoria (Figura 3).
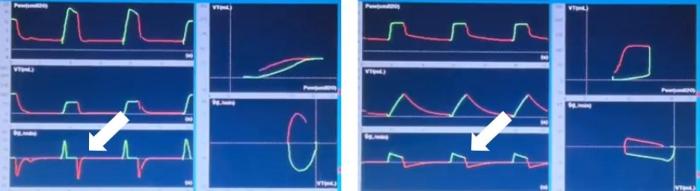
Dado que en este modo el flujo es variable, cuando el paciente realiza un mayor esfuerzo inspiratorio, el pico de flujo aumenta, lo que mejora el confort y reduce la aparición de asincronías de flujo. Sin embargo, en pulmones con lesión severa, el incremento del volumen administrado como consecuencia de un mayor pico de flujo puede tener efectos adversos, ya que aumenta el riesgo de volutrauma. En este contexto, algunos estudios sugieren que la distribución del gas dentro del pulmón sería más homogénea durante la ventilación controlada por presión en comparación con la ventilación controlada por volumen; no obstante, esta posible ventaja no se ha traducido hasta el momento en un beneficio clínico demostrado, como una reducción de la mortalidad.
La ventilación controlada por presión puede ser particularmente útil en animales pequeños, como los gatos, especialmente para evitar la hipoventilación alveolar en presencia de fugas. En felinos sanos, el valor normal de la presión aplicada por encima de la presión positiva al final de la espiración durante la ventilación dinámica varía ampliamente en función de la compliance torácica. En términos generales, este valor se sitúa entre 5 y 7 cmH₂O y puede ser incluso menor en gatos jóvenes y delgados.
Monitoreo de la presión transpulmonar
La medición de la presión transpulmonar se obtiene al sustraer el valor de la presión pleural a la presión alveolar. Esta medición puede realizarse a fin de inspiración (presión meseta – presión pleural inspiratoria) donde su valor refleja el estrés alveolar, o a fin de espiración (PEEP – presión pleural espiratoria) donde la presencia de valores negativos sugiere la presencia de colapso alveolar. Para realizar los cálculos de la presión transpulmonar se requiere, tal como se mencionó, la medición de la presión pleural (que habitualmente se mide en forma indirecta mediante la medición de la presión esofágica). Para dicho fin, se suelen emplear catéteres esofágicos que presentan un balón en el extremo (Figura 4).
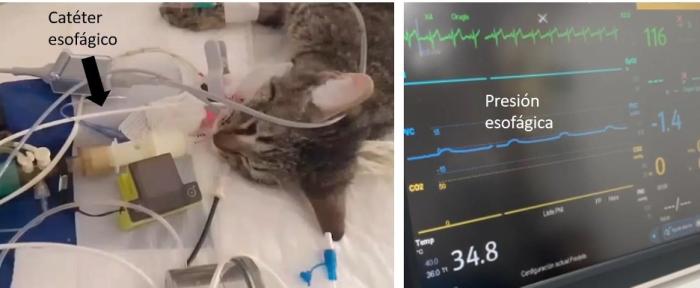
El insuflado del balón es un tema de gran relevancia práctica dado que el empleo de un volumen inadecuadamente bajo de insuflado puede hacer que se subestime la presión esofágica y, en consecuencia, la presión pleural. Por el contrario, un insuflado excesivo puede generar contracciones reflejas que sobreestimen las mediciones. Si bien los balones comerciales sugieren un volumen de insuflado, debe tenerse en consideración que las recomendaciones son generadas para seres humanos. Una forma de individualizar el volumen de insuflado consiste en construir una curva presión-volumen del balón. Para construir dicha curva es necesario registrar la variación entre la presión esofágica de fin de inspiración y de fin de espiración que produce cada volumen de insuflado empleado. El volumen de insuflado que genere la mayor variación entre dichas presiones sería el más adecuado. Habitualmente este volumen oscila entre 0.5 y 2 ml.
La medición de la presión transpulmonar de fin de espiración puede ser de particular interés durante la anestesia de cirugías laparoscópicas. La insuflación del abdomen con gas aumenta la presión abdominal y, secundariamente, la pleural. La presencia de valores de presión pleural de fin de espiración mayores a los valores de presión alveolar espiratoria (niveles de PEEP empleados) sugiere la presencia de colapso alveolar. La apertura inspiratoria y el colapso espiratorio de los alvéolos que podrían ocurrir en este contexto se han asociado previamente a VILI. En consecuencia, el monitoreo de la presión transpulmonar de fin de espiración permite guiar la selección de los valores de PEEP para que estén por encima de los valores de presión pleural y de esta manera se evite el colapso alveolar. En este contexto se suelen emplear valores de PEEP que permitan mantener la presión transpulmonar espiratoria positiva (entre 0 y 2 cmH2O).
En un estudio previo realizado en felinos se observó que el punto de inflexión superior de la curva Presión-Volumen transpulmonar se encuentra aproximadamente a los 12 cmH2O. Estos hallazgos sugieren que en felinos críticamente enfermos el monitoreo de la presión transpulmonar de fin de inspiración evitando superar los 12 cmH2O puede ser de utilidad para evitar un estrés excesivo disminuyendo el riesgo de VILI.
En humanos sanos, la elastancia de la caja torácica representa aproximadamente el 40–50 % de la elastancia total del sistema respiratorio. En perros, esta proporción es menor (≈0.3), lo que indica una caja torácica relativamente más complaciente y que una mayor fracción de la presión medida en la vía aérea se destina a la distensión pulmonar. En felinos, la información disponible es más limitada; sin embargo, en una cohorte de seis gatos sanos ventilados mecánicamente, evaluados por los autores mediante monitoreo de presión esofágica, la elastancia de la caja torácica representó aproximadamente el 45% de la elastancia total. Estos hallazgos sugieren que, en los felinos, la compliance pulmonar es relativamente mayor que en los perros, mientras que la compliance de la caja torácica es relativamente menor.
Estas diferencias interespecie son relevantes para la interpretación de la mecánica respiratoria, ya que la distribución de las elastancias condiciona la respuesta a cambios en Vc, PEEP y a la aplicación de maniobras de reclutamiento. En los gatos, la combinación de una mayor compliancepulmonar, un menor espacio muerto anatómico y una menor capacidad residual funcional determina que, en general, se requieran valores de Vc más bajos que en los perros, con una DP resultante habitualmente menor. Adicionalmente, la compliance torácica en felinos parece ser altamente variable —particularmente elevada en animales jóvenes y delgados—, lo que puede contribuir a una mayor variabilidad de la DP observada en comparación con los perros.
Por otro lado, a mayor elastancia torácica, las interacciones cardio-respiratorias suelen ser mayores (para el mismo Vc), lo que modifica los resultados de los test usualmente empleados para predecir la respuesta a fluidos en esta especie.
Maniobras de reclutamiento alveolar
La maniobra de reclutamiento alveolar (MRA) consiste en incrementar transitoriamente la presión transpulmonar (presión alveolar – presión pleural) con el objetivo de abrir unidades pulmonares no aireadas o pobremente aireadas. El grado de reclutamiento depende tanto de la magnitud de la presión aplicada en la vía aérea como del tiempo durante el cual se mantiene.
Existen dos técnicas principales de MRA. Una es la insuflación sostenida, que consiste en aplicar una presión fija durante un período breve (habitualmente 20–30 cmH₂O por 10–20 s). La otra técnica es el reclutamiento escalonado, en el que se incrementan progresivamente la presión meseta y la PEEP hasta alcanzar los valores diana (por ejemplo, presión meseta de 20–25 cmH₂O con PEEP de 10 cmH₂O). La evidencia comparativa es contradictoria. En un modelo canino de lesión pulmonar por inhalación de humo, ambas técnicas mejoraron la oxigenación y la compliance del sistema respiratorio; sin embargo, el método escalonado produjo una mayor mejoría en la compliance, mientras que la insuflación sostenida se asoció a un menor impacto hemodinámico.
La realización de una MRA permite implementar la estrategia de “pulmón abierto”, cuyo objetivo es reclutar las regiones mal ventiladas y mantenerlas abiertas mediante la aplicación de niveles adecuados de PEEP. En pequeños animales, la prevalencia de atelectasias parece ser menor que en humanos, posiblemente debido a las menores presiones gravitatorias sobre el parénquima (dada la mayor compliance torácica y menor peso mediastínico) y a una ventilación colateral más eficiente. No obstante, factores como la posición del paciente pueden influir. En un estudio en gatos sedados, el decúbito lateral aumentó la presencia de regiones hipoaireadas, lo que sugiere que en estas situaciones podría observarse un mayor beneficio del empleo de MRA.
En cualquier caso, las MRA deben aplicarse con monitoreo hemodinámico y respiratorio adecuado, dado el riesgo potencial de hipotensión transitoria o sobredistensión alveolar.
Injuria pulmonar inducida por la ventilación mecánica (VILI)
La ventilación mecánica puede producir daño pulmonar cuando se aplican estrategias injuriosas. La VILI resulta de la interacción de varios mecanismos: sobredistensión alveolar por volúmenes corrientes altos, apertura y cierre repetidos de unidades inestables (atelectrauma), aumento excesivo de la presión transpulmonar (barotrauma) y liberación de mediadores inflamatorios locales y sistémicos (biotrauma).
El marco conceptual de stress (presión aplicada al tejido) y strain (deformación pulmonar resultante) permite integrar estos mecanismos. Clínicamente, el stress se relaciona con la DP y con la presión transpulmonar inspiratoria. DP elevadas indican baja compliance y un volumen pulmonar funcional reducido. En humanos, una DP > 14 cmH₂O se asocia con mayor mortalidad en el SDRA y con un incremento de complicaciones pulmonares posoperatorias incluso en pacientes con pulmones sanos.
El strain depende del Vc y de la capacidad residual funcional (CRF). Un mismo Vc genera más deformación cuando el pulmón está reducido, como ocurre en el “baby lung” del SDRA. Por ello, volúmenes corrientes aparentemente “moderados” pueden inducir VILI si la CRF está disminuida. En humanos, el uso sistemático de Vc bajos (~6 ml/kg de peso ideal) ha demostrado reducir la mortalidad tanto en SDRA como en cirugía con pulmón sano.
En medicina veterinaria, las recomendaciones de Vc varían ampliamente. En perros sanos se utilizan valores entre 10 y 20 ml/kg, aunque estudios recientes muestran que ajustar el Vc para mantener la DP cerca de 7–8 cmH₂O mejora la mecánica respiratoria frente a un Vc fijo de 15 ml/kg. En gatos la evidencia es más limitada: el Vc inicial suele ser de ~12 ml/kg (rango 10–15 ml/kg) y se ajusta según el CO₂ espirado. En gatos con pulmón sano, las desviaciones leves del CO₂ se suelen corregir modificando la frecuencia respiratoria, mientras que discrepancias mayores requieren ajustar el Vc. Es importante recordar que la PaCO₂ normal en gatos es menor que en perros, lo que influye en la interpretación del CO₂ espirado y en la toma de decisiones ventilatorias.
En pacientes con enfermedad pulmonar, ajustar el Vc en función de la DP es especialmente útil, ya que un pulmón más pequeño y menos complaciente requiere Vc más bajos para evitar aumentos peligrosos de presión. En gatos con patología respiratoria, y considerando su alta compliance pulmonar, se recomienda evitar en la medida de lo posible valores de DP superiores a 10–12 cmH₂O, utilizar Vc cercanos a 10 ml/kg y aumentar la frecuencia respiratoria para prevenir hipercapnia significativa. Valores de PaCO₂ > 55 mmHg deben evitarse dado que pueden generar un aumento de la presión intracraneana y se asocian a una mayor mortalidad en humanos con SDRA. Esta estrategia de hipercapnia permisiva contribuye a reducir el riesgo de VILI al limitar el estrés y strain.
Conclusiones
La ventilación a presión positiva constituye una herramienta esencial en la anestesia y en el manejo de pacientes críticos felinos, pero su aplicación exige una comprensión profunda de la fisiología respiratoria y de los mecanismos de injuria pulmonar asociados. La variabilidad interespecie en la distribución de elastancias y las diferencias en el manejo del CO₂ hacen necesario ajustar la ventilación según las particularidades fisiológicas de los felinos, con especial énfasis en el monitoreo de la mecánica respiratoria. La selección cuidadosa del Vc, el uso juicioso de la PEEP, la evaluación del reclutamiento alveolar y la implementación de hipercapnia permisiva en pacientes críticos permiten minimizar el estrés y la deformación pulmonar, reduciendo así el riesgo de VILI. En conjunto, el manejo ventilatorio en felinos debe orientarse a una estrategia individualizada, basada en la fisiología y guiada por parámetros objetivos, para optimizar el intercambio gaseoso mientras se protege activamente al pulmón.
Bibliografía
- Acute Respiratory Distress Syndrome Netassignment. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000:4:342(18):1301–1308.
- Amato MB, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015 Feb 19;372(8):747-55.
- Balakrishnan A, King LG. Updates on pulmonary function testing in small animals.Vet Clin North Am Small Anim Pract 2014:44(1):1-18.
- Caironi P, Langer T, Carlesso E, Protti A, Gattinoni L. Time to generate ventilator-induced lung injury among mammals with healthy lungs: a unifying hypothesis. Intensive Care Med 2011 37:1913–1920.
- Chiumello D, Carlesso E, Cadringher P, et al. Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am J Respir Crit Care Med2008:178(4):346-55.
- Donati PA, Plotnikow G, Benavides G, Belerenian G, et al. Tidal volume in mechanically ventilated dogs: can human strategies be extrapolated to veterinary patients? J Vet Sci. 2019 May;20(3):e21.
- Donati PA, Gogniat E, Madorno M, et al. Sizing the lung in dogs: the inspiratory capacity defines the tidal volume. Rev Bras Ter Intensiva. 2018 Apr-Jun;30(2):144-152.
- Foo TS, Pilton JL, Hall EJ, Martinez-Taboada F, Makara M. Effect of body position and time on quantitative computed tomographic measurements of lung volume and attenuation in healthy anaesthetised cats. Am J Vet Res. 2018 Aug;79(8):874-883.
- Girotto CH, Ospina-Argüelles DA, Teixeira-Neto FJ, Assis-Vieira PV, Martins ARC, Kerr C. Dead space volumes in cats and dogs with small body mass ventilated with a fixed tidal volume. Vet Anaesth Analg. 2024 Nov-Dec;51(6):585-593.
- Hopper K, Powell LL. Basics of mechanical ventilation for dogs and cats. Vet Clin North Am Small Anim Pract 2013:43(4):955-69.
- Hubmayr RD. Point: Is low-tidal-volume mechanical ventilation preferred for all patients on mechanical ventilation? Yes. Chest 2011:140(1):9-11.
- Irvin CG, Bates JHT. Measuring lung function in mice: the challenge of size. Respir Res 2003 4:4 29.
- Johnson R. Respiratory acidosis: A Quick Reference in: Autran de Morais H, DiBartola SP. Advances in Fluid, Electrolyte, and Acid-Base Disorders. Vet Clin North Am Small Anim Pract 2008:38(3):431-434.
- King LG. Textbook of respiratory disease in dogs and cats, 1st edition. Saunders 2004:206-453 207:487-488.
- Leme Silva P, Pelosi P, Rocco PR. Mechanical ventilation in obese patients. Minerva Anestesiol 2012:78(10):1136-45
- Liu Q, Gao YH, Hua DM, et al. Functional residual capacity in Beagle dogs with and without acute respiratory distress syndrome. J Thorac Dis. 2015:7(8):1450-66
- Liu Q, Li W, Zeng QS, Zhong NS, et al. Lung stress and strain during mechanical ventilation in animals with and without pulmonary acute respiratory distress syndrome. J Surg Res. 2013 May;181(2):300-7.
- Mauri T, Yoshida T, Bellani G, et al. Oesophageal and transpulmonary pressure in the clinical setting: meaning, usefulness and perspectives. Intensive Care Med. 2016 Sep;42(9):1360-73.
- Mattingley JS, Holets SR, Oeckler RA, et al. Sizing the lung of mechanically ventilated patients. Crit Care 2011:15(1):R60
- Protti A, Votta E, Gattinoni L. Which is the most important strain in the pathogenesis of ventilator-induced lung injury: dynamic or static? Curr. Opin Crit Care 2014:20(1):33-8.
- Rodriguez PO, Bonelli I, Setten M, et al. Transpulmonary pressure and gas exchange during decremental PEEP titration in patients with pulmonary ARDS, Respir Care. 2013 May;58(5):754-63.
- Robinson NE, Gillespie JR, Berry JD, et al. Lung compliance, lung volumes, and single-breath diffusing capacity in dogs. J. Appl. Physiol. 1972:33(6):808-12.
- Sarge T, Talmor D. Targeting transpulmonary pressure to prevent ventilator-induced lung injury. Minerva Anestesiol. 2009:75(5):293-9.
- Servillo G, De Robertis E, Maggiore S, et al. The upper inflexion point of the pressure-volume curve. Influence of methodology and of different modes of ventilation. Intensive Care Med 2002:28(7):842-849.
- Watanabe S, Frank R. Lung volumes, mechanics, and single-breath diffusing capacity in anaesthetised cats. J Appl Physiol. 1975 Jun;38(6):1148-52.
- Rieser, T. M. (2013). Arterial and Venous Blood Gas Analyses. Topics In Companion Animal Medicine, 28(3), 86-90. https://doi.org/10.1053/j.tcam.2013.04.002
- Bernhard C, Masseau I, Dodam J, Outi H, Krumme S, Bishop K, Graham A, Reinero C. Effects of positive end-expiratory pressure and 30% inspired oxygen on pulmonary mechanics and atelectasis in cats undergoing non-bronchoscopic bronchoalveolar lavage. J Feline Med Surg. 2017 Jun;19(6):665-671. doi: 10.1177/1098612X16651471. Epub 2016 Jun 1. PMID: 27250742; PMCID: PMC11128820.
- Niyatiwatchanchai N, Rattanathanya H, Thengchaisri N. Comparative study of ventilation techniques with supraglottic airway devices in cats: volume-controlled vs pressure-controlled techniques. J Feline Med Surg. 2024 Jan;26(1):1098612X231225353. doi: 10.1177/1098612X231225353. PMID: 38294899; PMCID: PMC10949876.
- Okonji S, Bulgarelli C, Troìa R, Pontiero A, Foglia A, Giunti M, Gandini G. Electroencephalographic patterns in a mechanically ventilated cat with permethrin intoxication. JFMS Open Rep. 2023 Mar 29;9(1):20551169231160228. doi: 10.1177/20551169231160228. PMID: 37007979; PMCID: PMC10064162.
- Martins ARC, Ambrósio AM, Fantoni DT, Pinto ACBCF, Villamizar-Martinez LA, Soares JHN, Otsuki DA, Malbouisson LMS. Computed Tomography Assessment of Tidal Lung Overinflation in Domestic Cats Undergoing Pressure-Controlled Mechanical Ventilation During General Anesthesia. Front Vet Sci. 2022 Apr 1;9:842528. Doi: 10.3389/fvets 2022.842528. PMID: 35433898; PMCID: PMC9011143.
- Hopper K, Haskins SC, Kass PH, Rezende ML, Aldrich J. Indications, management, and outcome of long-term positive-pressure ventilation in dogs and cats: 148 cases (1990-2001). J Am Vet Med Assoc. 2007 Jan 1;230(1):64-75. doi: 10.2460/javma 230.1.64. PMID: 17199495.
- Machado ML, Soares JHN, Pypendop BH, Aguiar AJA, Braun C, Motta-Ribeiro GC, Jandre FC. Cardiovascular and Gas Exchange Effects of Individualized Positive End-Expiratory Pressures in Cats Anesthetized With Isoflurane. Front Vet Sci. 2022 May 4;9:865673. Doi: 10.3389/fvets 2022.865673. PMID: 35601404; PMCID: PMC9114870.
- Ong HM, Kelers K, Hughes D, Boller M. Retrospective evaluation of cats with elapid snake envenomation-associated neurotoxicity requiring mechanical ventilation: 12 cases (2005-2014). J Vet Emerg Crit Care (San Antonio). 2017 Sep;27(5):579-585. doi: 10.1111/vec 12632. Epub 2017 Aug 11. PMID: 28799698.
- Mammel MC, Boros SJ, Bing DR, Holloman KK, Connett JR. Determining optimum inspiratory time during intermittent positive pressure ventilation in surfactant-depleted cats. Pediatr Pulmonol. 1989;7(4):223-9. doi: 10.1002/ppul.1950070407. PMID: 2694088.
- Correa Mdo A, Aguiar AJ, Neto FJ, Mendes Gda M, Steagall PV, Lima AF. Effects of remifentanil infusion regimens on cardiovascular function and responses to noxious stimulation in propofol-anaesthetized cats. Am J Vet Res. 2007 Sep;68(9):932-40. doi: 10.2460/ajvr.68.9.932. PMID: 17764406.
 by Multimédica
by Multimédica