Adrenalectomía laparoscópica
Resumen breve
El manejo de la patología adrenal primaria en el caso de tumores malignos o causantes de signos clínicos, ha consistido tradicionalmente en la extirpación de la glándula afectada mediante adrenalectomía. Esta se ha llevado a cabo de manera rutinaria mediante abordaje por cirugía abierta, ya sea ventral o del flanco pero, como cada vez ocurre con más frecuencia en diversas técnicas quirúrgicas, el consenso cada vez es mayor en cuanto a las grandes ventajas del abordaje mínimamente invasivo…Índice de contenidos
Resumen
El manejo de la patología adrenal primaria en el caso de tumores malignos o causantes de signos clínicos, ha consistido tradicionalmente en la extirpación de la glándula afectada mediante adrenalectomía. Esta se ha llevado a cabo de manera rutinaria mediante abordaje por cirugía abierta, ya sea ventral o del flanco pero, como cada vez ocurre con más frecuencia en diversas técnicas quirúrgicas, el consenso cada vez es mayor en cuanto a las grandes ventajas del abordaje mínimamente invasivo frente al tradicional. En concreto se utiliza la cirugía laparoscópica para la extirpación de masas adrenales no complicadas con grandes resultados.
En este artículo explicamos cuales son aquellas complicaciones que pueden hacer descartar el abordaje laparoscópico así como las principales indicaciones. Describimos paso a paso las técnicas y tratamos las principales complicaciones así como la manera de minimizar su presentación o como solucionarlas si llegan a producirse.
Introducción
El aumento en la difusión de sistemas de diagnóstico por imagen avanzados y la mejoría en la resolución de los mismos (especialmente de la ecografía abdominal) han provocado un incremento en el hallazgo y diagnóstico de masas adrenales síntomáticas y asíntomáticas, denominadas estas últimas frecuentemente como “incidentalomas”.
Los tumores adrenales representan entre un 1%-2% de todos los tumores hallados en el perro y el tratamiento quirúrgico se considera de elección en aquellas masas funcionales que provocan signos clínicos o en las que presentan criterios de malignidad1.
Tradicionalmente, el abordaje quirúrgico estándar ha sido mediante laparotomía, ya sea mediante celiotomía ventral a través de la línea alba o por un abordaje paracostal por el flanco. Además, y pese a que en los primeros reportes la cirugía adrenal se consideró como de alto riesgo debido a sus altos pocentajes de mortalidad perioperatoria, estos han ido reduciéndose progresivamente hasta situarse entre un 6-8% en los últimos estudios.
El abordaje quirúrgico laparoscópico se considera el estándar en medicina humana, y a su vez, se va imponiendo cada vez más frente al abordaje tradicional en veterinaria desde su primera descripción por Jimenez, Bouvy y Dupré en 2008.
El uso de laparoscopia en el tratamiento quirúrgico de masas adrenales no invasivas se ha asociado en diferentes estudios recientes a menor tiempo quirúrgico, menor tiempo de hospitalización y menos complicaciones perioperatorias.
Indicaciones
Los tumores adrenales primarios se dividen normalmente en adenomas, adenocarcinomas y feocromocitomas. Como se ha indicado anteriormente, la adrenalectomía es el tratamiento de elección en masas que sean funcionales y provoquen signos clínicos o en aquellas que presenten criterios de malignidad.
Pese a los mejores resultados en recuperación y tiempo quirúrgico observados en el abordaje laparoscópico frente al tradicional, el cirujano debe conocer y valorar la existencia de dos importantes limitaciones a la hora de plantear la elección del abordaje por mínima invasión: el tamaño del tumor y la existencia de invasión vascular o de estructuras adyacentes por el mismo.
Se ha desaconsejado el uso de cirugía laparoscópica en tumores mayores de 5 cm por diversos autores, si bien la selección cuidadosa del paciente y el desarrollo de la curva de aprendizaje por parte del cirujano pueden hacer que se logren abordar con éxito tumores de mayor tamaño.
Se ha reportado entre un 20% a un 48% de existencia de invasión vascular a las venas cava, frenicoabdominal o la vasculatura renal en el caso de tumores adrenales (especialmente en el caso de feocromocitomas) y por consiguiente estos deberían ser excluidos para un abordaje puramente laparoscópico. Es por ello que el análisis y selección del paciente es una parte crucial del proceso prequirúrgico y para ello siempre debemos apoyarnos en el uso de técnicas de imagen avanzadas.
La ecografía abdominal con respaldo de doppler color y la Tomografía Computerizada junto con el uso de contraste son las pruebas de imagen más comúnmente empleadas en veterinaria, ofreciendo esta última una muy alta sensibilidad y especificidad como indicativo de invasión vascular.
Además de la valoración del tamaño de la masa y de la extensión de la misma es importante la determinación del origen de la misma mediante la realización de las pruebas endocrinas pertinentes. El diagnóstico de hiperadrenocorticismo adrenal debe confirmarse o descartarse mediante los análisis hormonales necesarios, siendo las más utilizadas normalmente en la clínica diaria la estimulación con ACTH o la supresión con dexametasona a dosis bajas.
A su vez, y si las pruebas de imagen y la clínica hacen sospechar de la existencia de un feocromocitoma puede emplearse la medición de metanefrina y normetanefrina libres en plasma para su diagnóstico.
Preparación del paciente
Una vez definidas las características y el tipo de masa a extirpar debemos valorar la estabilización médica del paciente previa a la cirugía, así, está recomendado el tratamiento previo con trilostano de los pacientes con hiperadrenocorticismo durante al menos 3 o 4 semanas previas a la intervención, a fin de minimizar las posibles complicaciones asociadas al desequilibro hormonal.
En el caso de los pacientes con sospecha de la existencia de un feocromocitoma se recomienda el uso de fenoxibenzamina previo a la cirugía (en dosis entre los 0,25-1,5 mg/kg cada 12 horas) como medio de control de la presión arterial (habitualmente durante al menos una semana antes de la cirugía).
Creemos necesario informar, que el potencial beneficio de estos tratamientos prequirúrgicos continua en estudio, siendo recientemente cuestionado por C. Appelgrein et al en un reciente artículo en base a 73 adrenalectomías.
A su vez, y para evitar el desarrollo de hipoadrenocorticismo agudo tras la exéresis de la glándula adrenal, especialmente en tumores secretores de cortisol o en adrenalectomías bilaterales, se administra de manera general 0,1-0,2 mg/kg de dexametasona IV previo a la extirpación.
Técnica quirúrgica
El material quirúrgico utilizado recomendado por el autor para la realización de un adrenalectomía laparoscópica constará de lo siguiente:
- Óptica de 30º y 5 mm de de diametro.
- 3 o 4 trócares de 5 mm de diámetro, es interesante considerar el uso de trocares con sistema de fijación con balón debido a la fragilidad de la pared abdominal de los pacientes en tumores secretores. Si estamos interviniendo una masa de gran tamaño y prevemos la necesidad de utilizar clips vasculares o bolsas de extracción de mayor tamaño puede cambiarse uno de los trocares de 5 mm por uno de 10 mm.
- Sistemas avanzados de coagulación como bisturí armónico o electrocoagulación bipolar (LigaSure®, Caiman® etc). El uso de instrumental monopolar como el L-hook también puede resultar de utilidad para la disección de determinados planos.
- Instrumental laparoscópico diverso como disectores de tipo maryland y de ángulo recto, pinzas tipo Babcock y atraumáticas, aspirador laparoscópico, aplicador de clips vasculares y separadores abdominales. Este material variará en función del paciente y las preferencias del cirujano.
- Bolsa de extracción laparoscópica.
La preparación del paciente debe incluir una amplia tricotomía del lateral a intervenir, incluyendo desde los 4 últimos espacios intercostales hasta la cadera y desde la línea media cómo borde ventral hasta las apófisis espinosas en dorsal.
Se han descrito diferentes abordajes laparoscópicos siendo los más utilizados en la clínica diaria el posicionamiento esternal y el lateral oblicuo mediante elevación de 30º (en decúbito contralateral a la glándula a intervenir). Figura 1 Adicionalmente, estos abordajes se pueden complementar mediante la elevación del tórax y las extremidades por medio del uso de almohadillas.
Una vez posicionado el paciente, el neumoperitoneo puede realizarse mediante aguja de veress o técnica de Hasson. El autor utiliza normalmente una técnica cerrada mediante aguja de veress, introduciendo esta inmediatamente caudal a la última costilla, utilizando la misma a modo de soporte para evitar laceraciones abdominales. Figura 2 Independientemente de la téccnica utilizada, una vez realizado el acceso, se establece y mantiene el neumoperitoneo con una presión de CO2 de 10 mmHg en perros o de 6 mmHg en gatos.
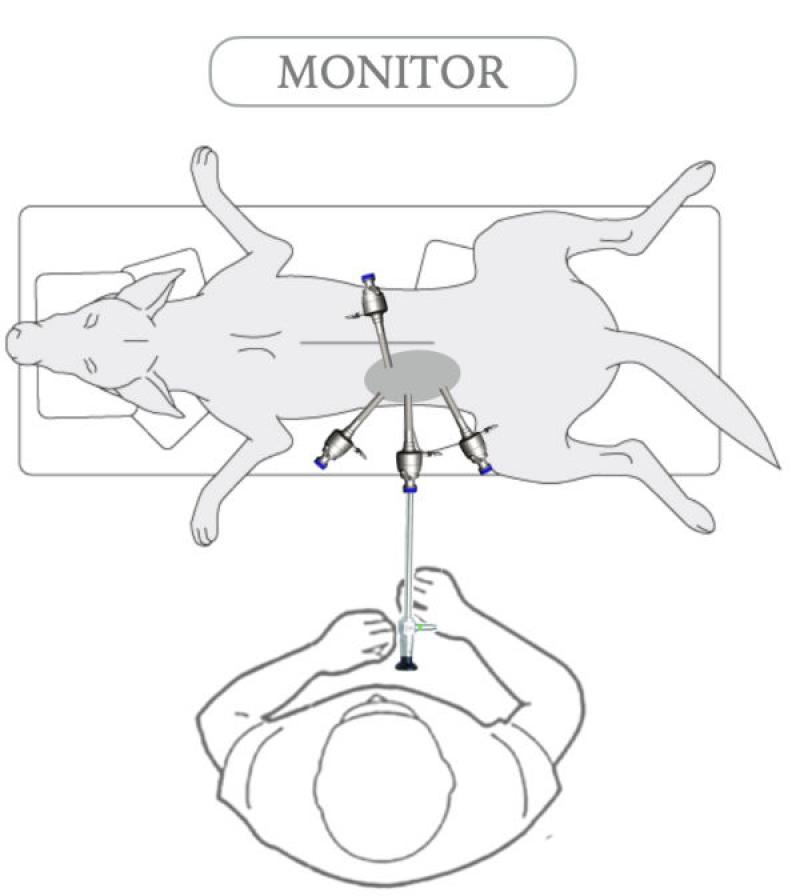
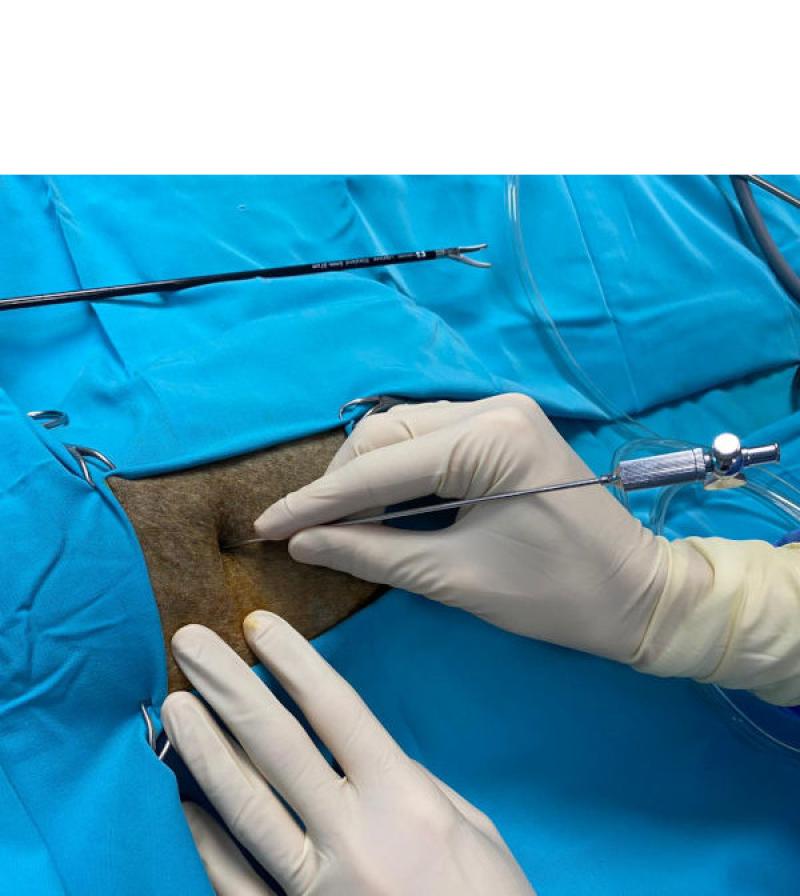
Normalmente se utilizaran 3 o 4 trócares de 5 mm triangulados sobre el área adrenal, el primer trocar será el empleado para la óptica y se debe colocar a la altura de la cicatriz umbilical y 3-4 cm lateral a la misma.
Los dos trocares restantes se situaran en posición craneal y caudal al de la óptica y ligeramente laterales, intentando mantener la distancia necesaria entre ellos para una manipulación sin complicaciones.
El uso de un cuarto trocar en situación más craneal y lateral a los anteriores (en una posición prácticamente subcostal) puede ser de utilidad, especialmente en adrenalectomías derechas, para la movilización y separación del lóbulo hepático caudado.
Adrenalectomía izquierda
Una vez introducido el primer trocar y establecido el neumoperitoneo siempre debemos realizar una primera exploración mediante la óptica del área de intervención. Aunque la glándula adrenal normal puede no ser visible a simple vista debido a su presencia en la grasa del retroperitoneo, en el caso de la existencia de masas generalmente esta se visualiza desde el primer momento.
El aporte vascular de la glándula consiste en pequeñas y múltiples ramas arteriales procedentes de la aorta, la arteria renal y la arteria frénicoabdominal. El drenaje venoso se realiza principalmente a través de la vena frenicoabdominal, que discurre desde lateral, pasando directamente por encima de la glándula para acabar en la cava caudal.
Para el abordaje de la glándula adrenal izquierda debemos tomar como referencia varios puntos importantes:
- En su extremo caudal se relaciona con el polo craneal del riñón izquierdo y bordea la vena y arteria renal izquierda.
- En su cara medial se relaciona con la aorta abdominal.
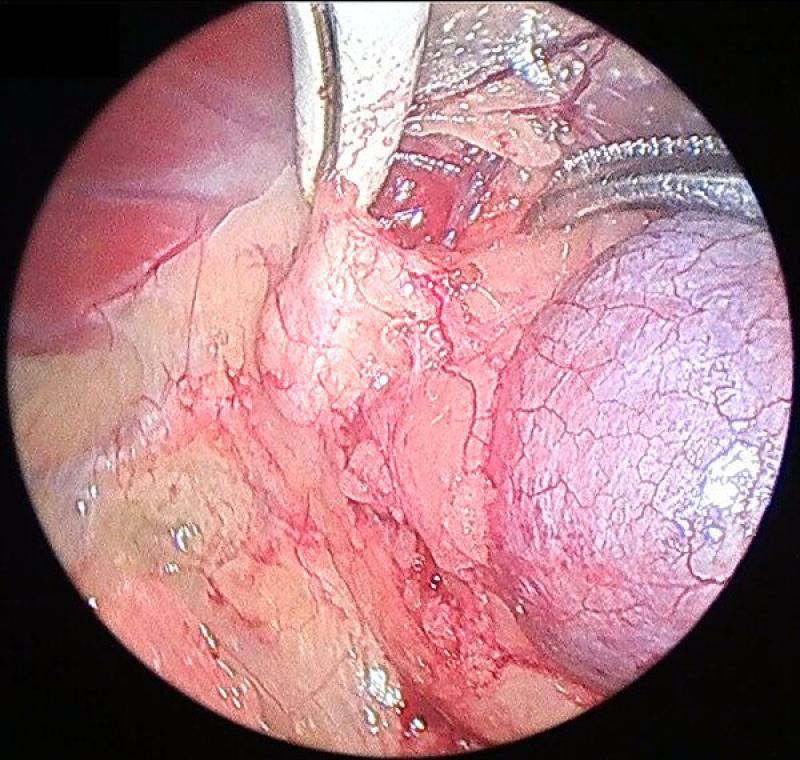
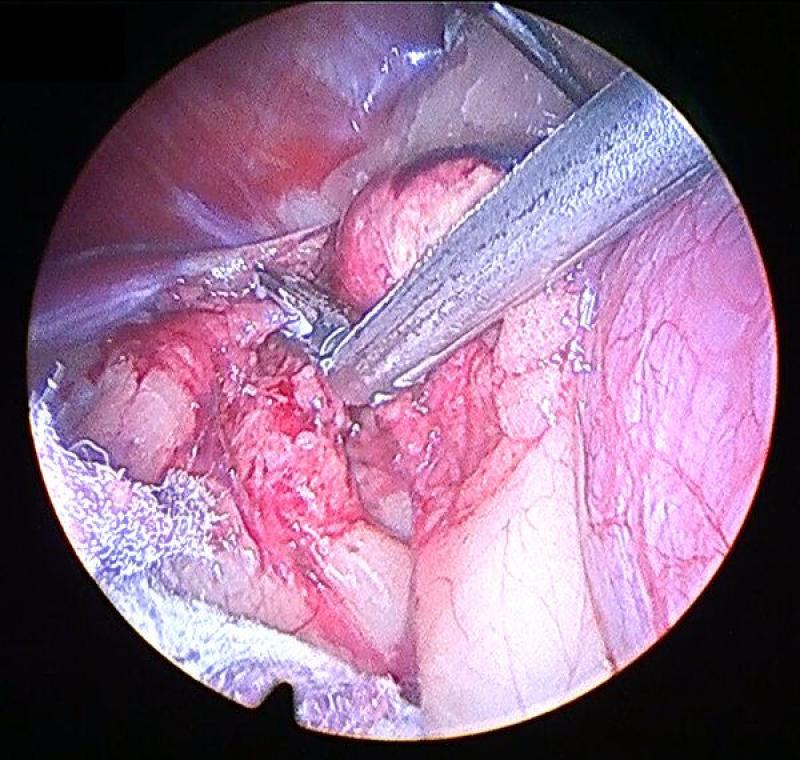
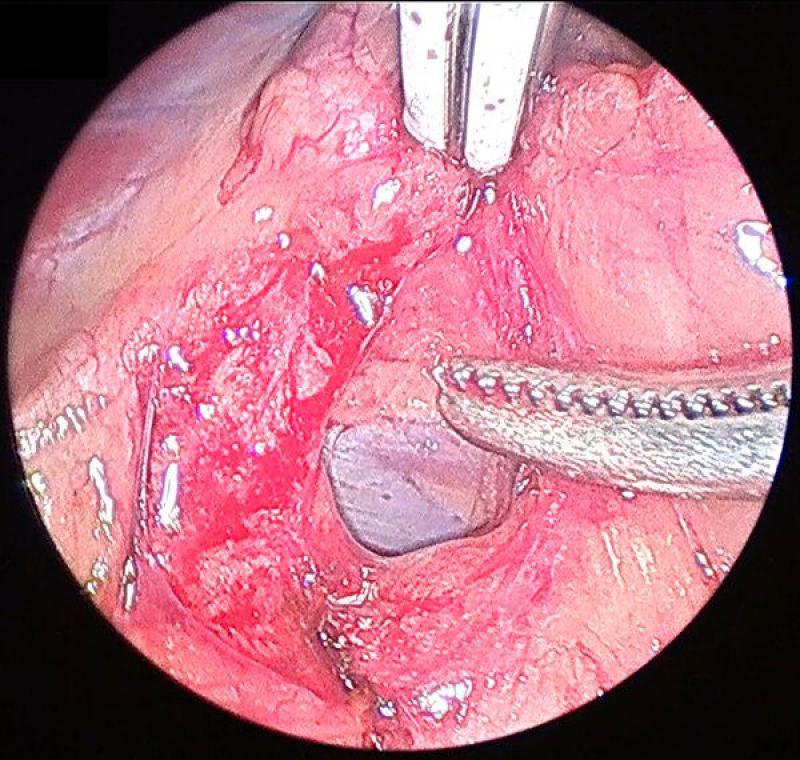
Generalmente la disección se comienza por el aspecto lateral de la glándula, que resulta el más sencillo. Esta debe realizarse mediante una combinación de disección y corte-coagulación mediante electrocauterizador bipolar o armónico. El uso de sistemas de coagulación avanzados resulta de gran importancia debido a la existencia previamente mencionada de múltiples vasos arteriales de pequeño tamaño, que si bien no generan sangrados de gravedad, sí que provocan un oscurecimiento del campo, una mayor absorción de luz y dificultan la visualización de las maniobras posteriores. A su vez, procedemos a identificar, coagular y seccionar la vena frénicoabdominal en su aspecto lateral.
Es conveniente el mantenimiento del campo de trabajo lo más limpio posible, retirando las pequeñas hemorragias mediante aspirador o usando una gasa recortada a un tamaño que permita su introducción a través de uno de los trocares.
En el polo caudal de la glándula continuamos con las mismas maniobras de disección teniendo especial cuidado en identificar y coagular la arteria frenicoabdominal, que en ocasiones puede tener un diámetro considerable.
Continuaremos con la disección medial de la glándula adrenal, identificando en este caso el recorrido medial de la vena frenicoabdominal. Para la exposición correcta de los planos medial y caudal de la glándula debemos combinar la manipulación y movilización de la glándula con la disección, para conseguir la mejor visualización. Este movilización debe realizarse siempre evitando el agarre directo de la glándula, y para ello podemos utilizar la fascia que rodea a la misma o los extremos seccionados de la vena y la arteria frénicoabdominales.
El polo caudal de la glándula puede extenderse hasta el hilio renal quedando en ocasiones muy cercano a la vena y arteria renales izquierdas, por lo que deben extremarse las maniobras en este punto para evitar laceraciones vasculares.
Una vez disecada la glándula por completo debemos asegurarnos de la ausencia de sangrados en el lecho de la misma, lavando y aspirando la zona si procediera. A continuación se introduce la glándula en una bolsa de extracción laparoscópica y se retira junto con los puertos, ampliando si fuera necesario la incisión.
Se eliminará el neumoperitoneo y se realizará el cierre por planos de las incisiones.
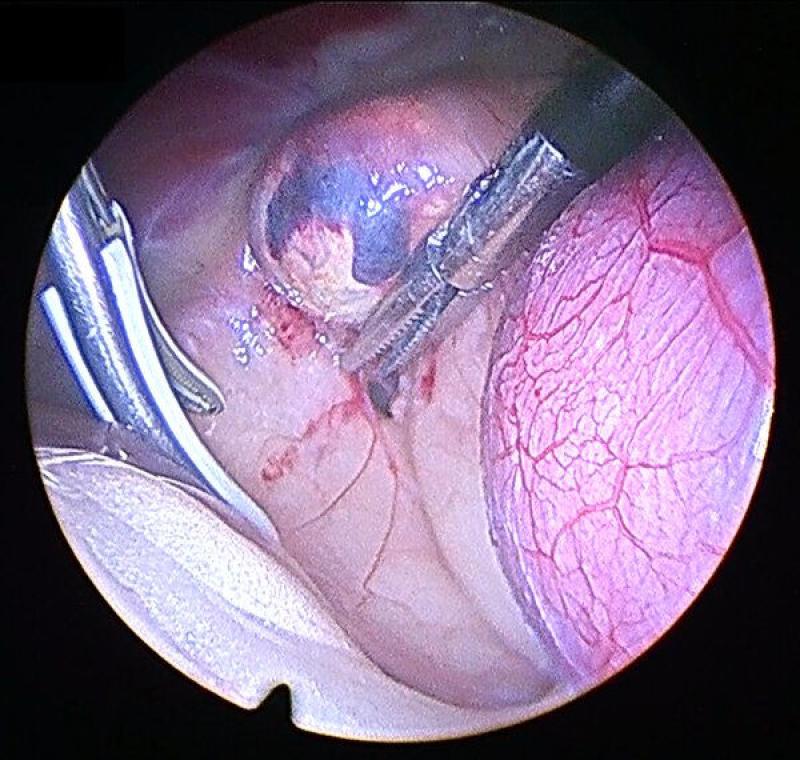
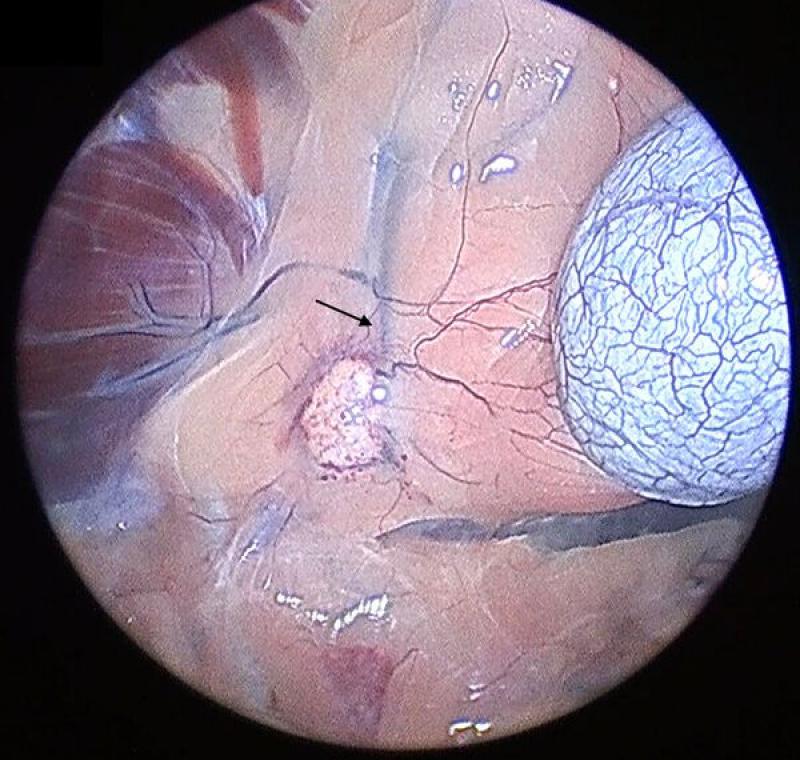
Adrenalectomía derecha
Pese a que para la glándula adrenal derecha se utilizarán los mismos principios generales de colocación de trocares y disección de planos que en la glándula izquierda, en este caso existen dos condicionantes que convierten la adrenalectomía derecha un reto mayor: la íntima relación anatómica de la adrenal con la vena cava así como la localización más craneal de la glándula.
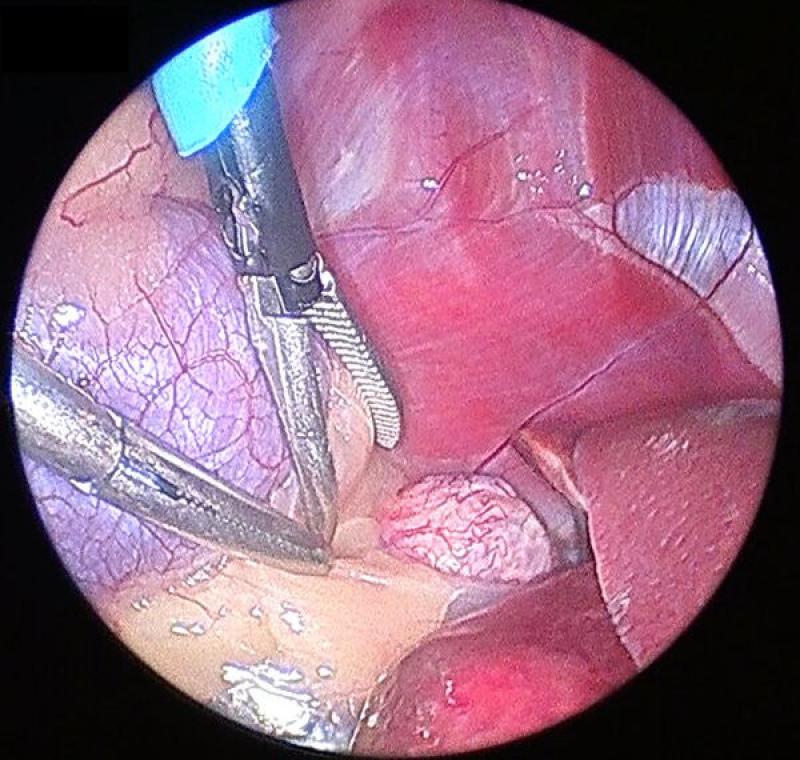
Además, en el caso de la adrenal derecha, esta se encuentra parcial o totalmente oculta por el proceso caudado del lóbulo caudado (que en ocasiones puede ser de gran tamaño debido a la existencia de hepatomegalia secundaria a hiperadrenecorticismo) por lo que para su correcta visualización, el uso de un cuarto trocar es muchas veces imperativo.
Para la retracción de este lóbulo hepático mediante pinza atraumática o separador de vísceras debemos cauterizar y seccionar el ligamento hepatorrenal, una estructura prácticamente avascular que lo ancla al polo craneal del riñón derecho.
La disección de la glándula se continuará en el orden y con los cuidados previamente explicados en la sección de la glándula izquierda. El abordaje medial de la adrenal derecha debe realizarse de manera muy delicada, ya que la adventicia de la cápsula adrenal se continua con la adventicia de la vena cava, convirtiendo el plano de disección entre ambas en un espacio virtualmente inexistente.
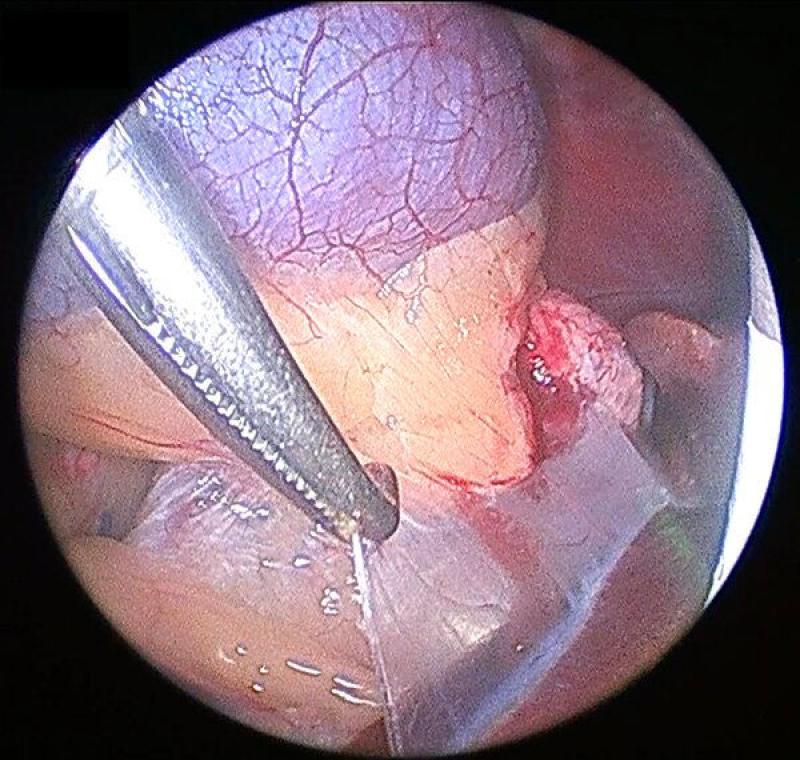
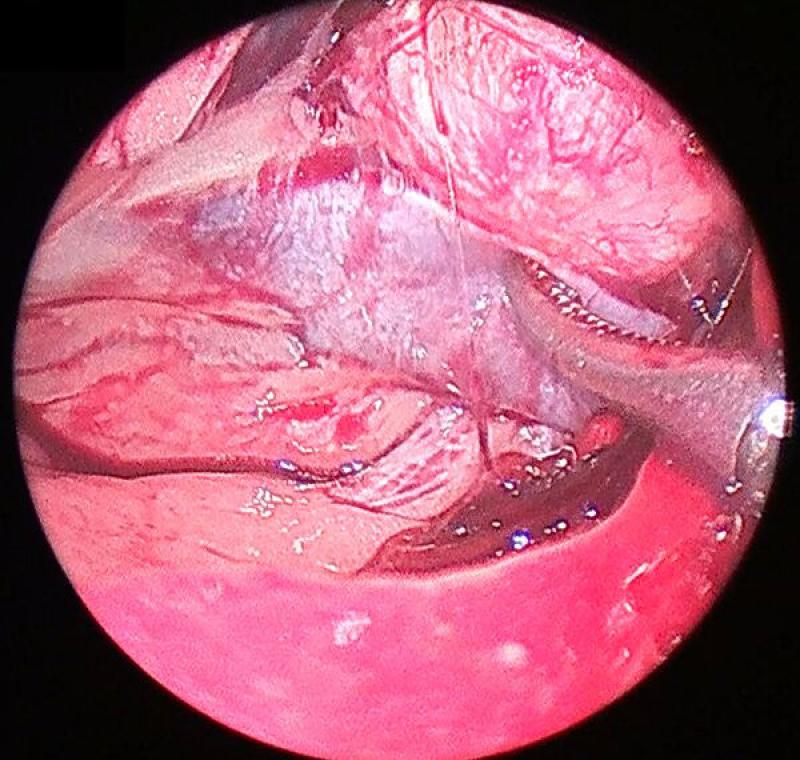
Postoperatorio y seguimiento
La hospitalización se extenderá normalmente durante las siguientes 48 horas si no se presentaran complicaciones. Durante este tiempo se debe procurar el manejo analgésico necesario así como control ecográfico ante la aparición de posibles hemorragias postquirúrgicas.
Debe continuarse con la suplementación de dexametasona intravenosa durante las primeras horas (a una dosis de 0,02 mg/kg/12 horas) hasta que el paciente tolere la vía oral, manteniendo la misma durante al menos las 3 semanas posteriores (prednisona o prednisolona a una dosis de 0,25-0,5 mg/kg/12 horas), momento en el que debe reevaluarse su necesidad tras la realización de una estimulación con ACTH.
A su vez deben monitorizarse los electrolitos durante las primeras horas para valorar un posible desarrollo de hipoadrenocorticismo agudo.
Complicaciones
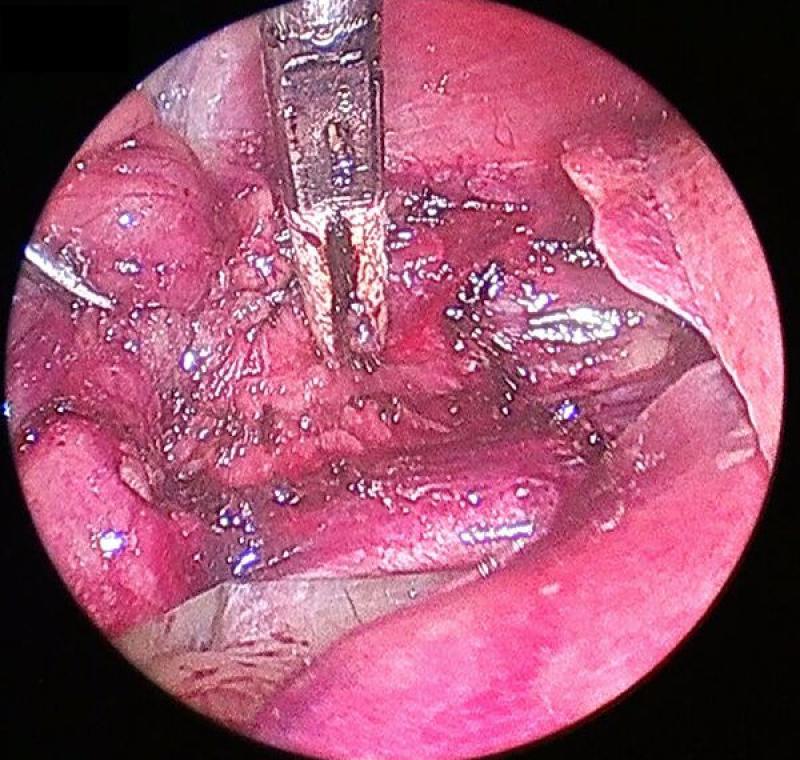
Pese a las evidentes ventajas de la cirugía laparoscópica en términos de tiempo quirúrgico, tiempo de estancia hospitalaria y dolor postoperatorio esta no excluye el potencial desarrollo de complicaciones durante la adrenalectomía, algunas de ellas de suma gravedad.
Las hemorragias de pequeña entidad de pequeñas arterias que no hayan quedado convenientemente cauterizadas, suelen resolverse por si mismas, pero podemos considerar el uso de parches de colágeno o esponjas de gelatina hemostáticas para una mayor tranquilidad. Algunos de estos sangrados pueden quedar enmascarados por las altas presiones utilizadas en el neumoperitoneo, es por ello conveniente dismunuir la presión hasta 4 mmHg al finalizar la cirugía mientras observamos el plano quirúrgico, en busca de una reactivación del sangrado.
La complicación más grave a la que nos podemos enfrentar es la laceración de los grandes vasos, la aorta abdominal en el caso de adrenales izquierdas, la vena cava en las derechas o la vasculatura renal en ambas. Si bien una perforación de la aorta abdominal es infrecuente, la laceración directa de los grandes vasos es un riesgo siempre presente y potencialmente fatal. Si esta se produjese debe intentarse el clampaje temporal del vaso lesionado y proceder a una conversión de emergencia a cirugía abierta para su reparación.
Además de la lesión quirúrgica vascular se han descrito las hemorragias tardías por lesiones térmicas de la vena cava durante la cirugía, lo que puede formar una escara que pase inadvertida en el momento de la cirugía pero provocar un sangrado retardado. Para ello debemos evitar el uso de instrumentos de electrocauterización en los tejidos cercanos a los grandes vasos, pudiendo utilizarse clips de titanio o de polimero en su sustitución.
La segunda complicación más frecuente es la rotura de la cápsula adrenal durante la manipulación quirúrgica. Esto puede provocar escasos efectos en el caso de adenomas, una potencial diseminación tumoral en caso de adenocarcinomas o importantes alteraciones hemodinámicas por liberación de catecolaminas en el caso de feocromocitomas. En cualquier caso, si esto ocurriera, debe realizarse la aspiración y lavado de la zona con abundante suero salino fisiológico.
En pacientes con hiperadrenocorticismo puede verse un aumento en la presentación de complicaciones menores como enfisema subcutáneo, dehiscencia o infección de los puntos de inserción de los trocares, esto se debe a una combinación de retraso en la cicatrización y de atrofia de los músculos abdominales.
Bibliografía
- Casas García D. L, Santana González A. J, Técnicas de mínima invasión en pequeños animales. 2018 Multimédica ediciones veterinarias.
- Sanders K, Kooistra HS, Galac S. Treating canine Cushing's syndrome: Current options and future prospects. Vet J. 2018 Nov;241:42-51. doi: 10.1016/j.tvjl.2018.09.014. Epub 2018 Sep 27. PMID: 30340659.
- Cavalcanti JVJ, Skinner OT, Mayhew PD, Colee JC, Boston SE. Outcome in dogs undergoing adrenalectomy for small adrenal gland tumours without vascular invasion. Vet Comp Oncol. 2020 Dec;18(4):599-606. doi: 10.1111/vco.12587. Epub 2020 Mar 12. PMID: 32141158.
- Lang JM, Schertel E, Kennedy S, Wilson D, Barnhart M, Danielson B. Elective and emergency surgical management of adrenal gland tumors: 60 cases (1999-2006). J Am Anim Hosp Assoc. 2011;47: 428-435
- Culvenor J. Surgery in the treatment of canine hyperadrenocorticism--1. Adrenalectomy. Aust Vet J. 2003 Jan-Feb;81(1-2):34-5. doi: 10.1111/j.1751-0813.2003.tb11416.x. PMID: 15084006.
- Anderson CR, Birchard SJ, Powers BE, Belandria GA, Kuntz CA, Withrow SJ. Surgical treatment of adrenocortical tumors: 21 cases (1990-1996). J Am Anim Hosp Assoc. 2001 Jan-Feb;37(1):93-7. doi: 10.5326/15473317-37-1-93. PMID: 11204483.
- Massari F, Nicoli S, Romanelli G, Buracco P, Zini E. Adrenalectomy in dogs with adrenal gland tumors: 52 cases (2002-2008). J Am Vet Med Assoc. 2011 Jul 15;239(2):216-21. doi: 10.2460/javma.239.2.216. PMID: 21756177.
- Schultz RM, Wisner ER, Johnson EG, MacLeod JS. Contrast-enhanced computed tomography as a preoperative indicator of vascular invasion from adrenal masses in dogs. Vet Radiol Ultrasound. 2009 Nov-Dec;50(6):625-9. doi: 10.1111/j.1740-8261.2009.01593.x. PMID: 19999346.
- Herrera MA, Mehl ML, Kass PH, Pascoe PJ, Feldman EC, Nelson RW. Predictive factors and the effect of phenoxybenzamine on outcome in dogs undergoing adrenalectomy for pheochromocytoma. J Vet Intern Med. 2008 Nov-Dec;22(6):1333-9. doi: 10.1111/j.1939-1676.2008.0182.x. Epub 2008 Sep 9. PMID: 18783351.
- Appelgrein C, Hosgood G, Drynan E, Nesbitt A. Short-term outcome of adrenalectomy in dogs with adrenal gland tumours that did not receive pre-operative medical management. Aust Vet J. 2020 Sep;98(9):449-454. doi: 10.1111/avj.12991. Epub 2020 Jun 24. PMID: 32583433.
- Oblak ML, Bacon NJ, Covey JL. Perioperative Management and Outcome of Bilateral Adrenalectomy in 9 Dogs. Vet Surg. 2016 Aug;45(6):790-7. doi: 10.1111/vsu.12514. Epub 2016 Jul 11. PMID: 27398811.
- Pitt KA, Mayhew PD, Steffey MA, Culp WT, Fuller MC, Della Maggiore A, Nelson RW. Laparoscopic Adrenalectomy for Removal of Unilateral Noninvasive Pheochromocytomas in 10 Dogs. Vet Surg. 2016 Nov;45(S1):O70-O76. doi: 10.1111/vsu.12552. Epub 2016 Sep 23. PMID: 27659055.
- Mayhew PD, Culp WT, Hunt GB, Steffey MA, Mayhew KN, Fuller M, Della-Maggiore A, Nelson RW. Comparison of perioperative morbidity and mortality rates in dogs with noninvasive adrenocortical masses undergoing laparoscopic versus open adrenalectomy. J Am Vet Med Assoc. 2014 Nov 1;245(9):1028-35. doi: 10.2460/javma.245.9.1028. PMID: 25313814.
- Taylor CJ, Monnet E. A comparison of outcomes between laparoscopic and open adrenalectomies in dogs. Vet Surg. 2021 Jan 8. doi: 10.1111/vsu.13565. Epub ahead of print. PMID: 33417739.
- Mayhew PD, Boston SE, Zwingenberger AL, Giuffrida MA, Runge JJ, Holt DE, Raleigh JS, Singh A, Culp WTN, Case JB, Steffey MA, Balsa IM. Perioperative morbidity and mortality in dogs with invasive adrenal neoplasms treated by adrenalectomy and cavotomy. Vet Surg. 2019 Jul;48(5):742-750. doi: 10.1111/vsu.13221. Epub 2019 Apr 29. PMID: 31034643.
 by Multimédica
by Multimédica