Maxilectomía rostral bilateral y lifting nasal en una perra con una neoplasia oral
Resumen breve
Las neoplasias orales en perros representan un desafío diagnóstico y terapéutico en la práctica clínica veterinaria por lo que requieren de un enfoque multidisciplinario que incluya una correcta estadificación, un abordaje quirúrgico adecuado y la consideración de terapias adyuvantes. La evolución favorable de esta paciente demuestra que, con un abordaje adecuado, es posible mejorar significativamente el pronóstico y bienestar de los pacientes afectados por estas patologías.Índice de contenidos
Introducción
Las neoplasias orales en perros representan un desafío diagnóstico y terapéutico en la práctica clínica veterinaria. Se estima que alrededor del 6 % de todos los tumores caninos afectan la región oral, siendo los más comunes el melanoma oral, el carcinoma de células escamosas y el fibrosarcoma1-3. La presentación clínica de estos tumores suele estar caracterizada por un crecimiento rápido, ulceración y sangrado, lo que genera malestar en los pacientes. El tratamiento quirúrgico es, a menudo, una pieza clave para el control de este grupo de enfermedades.
En este caso clínico se describe el abordaje integral de una paciente canina de raza Pastor alemán con una masa oral en la maxila rostral, desde la evaluación diagnóstica inicial hasta el tratamiento quirúrgico y la evolución posoperatoria. Se enfatiza la importancia de la estadificación y el manejo quirúrgico, con la descripción de técnicas quirúrgicas avanzadas.
Además, se discuten diferentes aspectos relacionados con el proceso de estadificación y se tratan algunos de los aspectos más importantes de la cirugía maxilofacial, como son la planificación quirúrgica, las complicaciones posquirúrgicas y el manejo de las secuelas cosméticas asociadas a estos procedimientos.
Presentación del caso clínico
Se presenta a la consulta una paciente canina de raza Pastor alemán, hembra esterilizada, de 13 años, referida por su centro veterinario habitual por la presencia de una masa en maxila rostral, de crecimiento rápido, con sospecha citológica de sarcoma.
En la exploración general se observa una masa multinodular, prominente y ulcerada, de aproximadamente 3 cm de diámetro, en la región palatina rostral en contacto con los incisivos superiores. El crecimiento le provoca malestar durante la ingesta de alimentos y sangra cuando manipula objetos duros con la boca. No existe linfadenomegalia periférica.
También presenta debilidad marcada del tercio posterior, de origen ortopédico según la historia médica. El resto de exploración física es compatible con la normalidad y los tutores describen una buena calidad de vida.
La paciente está en tratamiento crónico con condroprotectores.
Estadificación oncológica
Se realiza estadificación del tumor por parte del servicio de oncología.
- Analíticas sanguíneas: hemograma, bioquímica y ionograma compatibles con la normalidad.
- Tomografía computarizada (TC) de cabeza, cuello y tórax: masa en maxila rostral, predominantemente del lado izquierdo, sin lesiones óseas agresivas asociadas ni afectación dental. No se observa evidencia de linfadenopatía regional. Ausencia de metástasis a distancia (Figura 1A-B).

Figura 1. (A) TC, ventana tejido blando poscontraste, corte transversal. Masa maxilar rostral con captación heterogénea de contraste (indicada con puntas de flecha verdes). (B) TC, ventana tejido blando poscontraste, corte sagital. Masa indicada con puntas de flecha verdes.

- Citología de la lesión y linfonodo (LN) mandibular: compatible con una neoplasia maligna (diagnósticos diferenciales: melanoma amelanótico, carcinoma/sarcoma anaplásico) (Figura 2A-B).

Figura 2. (A) Citología de la masa oral. (B) Citología del linfonodo mandibular izquierdo compatible con linfonodo reactivo. Ausencia de malignidad (imágenes cedidas por T-Cito).
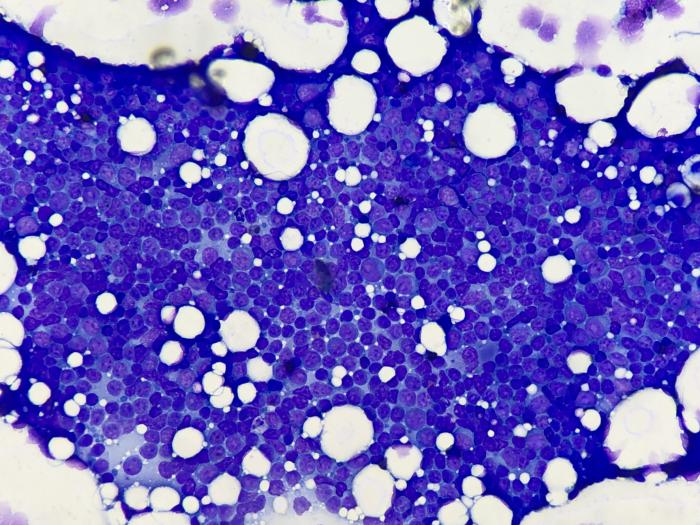
Ante este escenario, y dado que el estadiaje no revela la presencia de metástasis a distancia, se recomienda la intervención quirúrgica (maxilectomía rostral bilateral + linfadenectomía cervical completa) como opción terapéutica y diagnóstica de elección. El estudio histopatológico de la lesión potencialmente facilitará el diagnóstico definitivo de la neoplasia y permitirá emitir un pronóstico más certero que posibilite establecer una terapia adyuvante a medida.
Procedimiento quirúrgico
Anestesia y preparación del paciente
- Premedicación: metadona 0.2 mg/kg + dexmedetomidina 1µg/kg IV.
- Inducción: propofol a 2 mg/kg IV.
- Mantenimiento: oxígeno + isoflurano (CAM 1.0-1.3 %).
- Anestesia locorregional: bloqueo maxilar intraoral bilateral con bupivacaína 0.2 %.
- Fluidoterapia: Ringer lactato a 5 ml/kg/h.
- Tratamiento antibiótico profiláctico: amoxicilina-ácido clavulánico a 20mg/Kg IV cada 90 minutos.
- Tipificación grupo sanguíneo: DEA 1.1 positivo.
- Monitorización de la presión arterial invasiva.
Bajo anestesia general se rasura y prepara de forma aséptica la región cervical ventral. La cavidad oral se enjuaga con una dilución de clorhexidina al 0.2 % y se coloca un tapón de gasas en la faringe para prevenir la aspiración de fluidos durante la cirugía. La paciente se coloca en decúbito dorsal con un cojín debajo de la región cervical. La cabeza se coloca cercana al extremo de la mesa y las extremidades delanteras están extendidas y sujetas en dirección caudal.
Cirugía
- Linfangiografía con azul de metileno y linfadenectomía cervical completa
- Durante la preparación de la paciente, 10 minutos antes de la primera incisión, se inyectan 0.4 ml totales de azul de metileno 5 mg/ml en la periferia del tumor (Figura 3).
- Se realiza un abordaje a los linfocentros del cuello mediante una incisión única en la línea media cervical ventral (Figura 4), a través de la cual se realiza una linfadenectomía de los linfocentros mandibulares y retrofaríngeos mediales bilaterales (Figuras 5 a 7).

Figura 3. Masa maxilar, visión intraoral. La coloración azul es debida a la linfangiografía con azul de metileno.

Figura 4. Se realiza una incisión en la piel y el músculo platisma, a través de la línea cervical media), des del tercio caudal de la mandíbula hasta la laringe.

Figura 5. Identificación y disección del linfocentro mandibular izquierdo, que se encuentra caudal a la rama horizontal de la mandíbula. En este caso, el linfocentro está formado por dos linfonodos en cada lado.

Figura 6. Identificación y disección del linfonodo retrofaríngeo medial izquierdo. Este linfonodo se encuentra caudomedial a la glándula salivar mandibular.

Figura 7. Linfonodo mandibular derecho positivo a azul de metileno. Se considera, por lo tanto, linfonodo centinela.
- Maxilectomía rostral bilateral
Tras haber realizado la linfadenectomía cervical, se inicia el procedimiento intraoral, manteniendo a la paciente en decúbito dorsal (Figuras 8 a 16).

Figura 8. Visión de la masa oral. Se colocan suturas de tracción en los labios para limitar el traumatismo durante su manipulación y se mantiene la boca parcialmente abierta con el uso de un abrebocas.

Figura 9. Planificación de la osteotomía. En este caso, se toman 2 cm de márgenes laterales con relación a la base de la masa (en este caso, según las imágenes de TC, la masa es levemente más estrecha en su base).

Figura 10. Disección de los tejidos blandos. A nivel rostrolateral se realiza la disección en la unión labiogingival. Caudalmente, se incide la mucosa palatina y el mucoperiostio en el lugar previsto para la osteotomía. La succión es muy importante en este punto, al tratarse de una masa altamente vascularizada. La hemostasia se logra mediante el uso puntual de electrobisturí bipolar y la ligadura de las arterias palatinas.

Figura 11. Maxilectomía rostral bilateral. Se realizan dos osteotomías para realizar la maxilectomía: la primera en el plano transversal, caudal a las piezas 105-205. La segunda, en el plano dorsal, dorsal y paralelo al hueso palatino ya que la masa no presenta invasión intranasal. Después de la resección en bloque de la maxila afectada, se visualizan los cornetes nasales ventrales a través del abordaje y los restos de las piezas dentales afectadas por las osteotomías (raíces dentales de 104 y 204).

Figura 12. Elevación de dos colgajos de mucosa-submucosa vestibular para la reconstrucción palatina.

Figura 13. Comprobación de que el tamaño de los colgajos es correcto y permiten cubrir el defecto en ausencia de tensión en la línea de sutura.

Figura 14. Colocación de un parche hemostático para el control del sangrado en sábana que proviene de los cornetes nasales y de los alveolos dentales después de retirar los restos de las raíces dentales expuestas de 104 y 204.

Figura 15. Cierre del defecto mediante dos colgajos de mucosa-submucosa vestibular (labiales) de avance en forma de T. La aposición de los colgajos se realiza en dos capas con sutura monofilamento reabsorbible (poligliconato 4/0 USP).
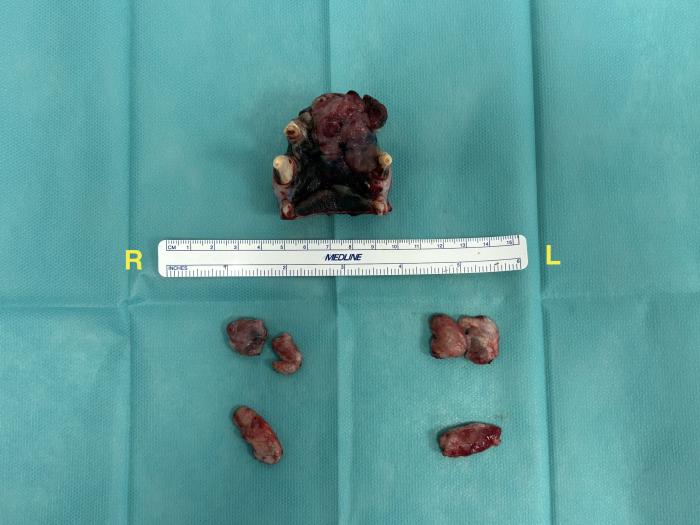
Figura 16. Piezas quirúrgicas. Maxila y linfonodos cervicales.
- Lifting nasal: sutura cantilevero voladizo descrita por Pavletic.

Figura 17. Visión tras la maxilectomía rostral bilateral. Debido a la pérdida de soporte óseo de la maxila rostral, la punta de la nariz se desploma.

Figura 18. Para realizar la técnica de sutura cantilever, se realiza una incisión cutánea a través de la línea nasal media nasal dorsal, de 3-5 cm. Se practica un túnel óseo transversal, ventral al hueso nasal, con una aguja de Kischner de 2 mm. A continuación, con una sutura monofilamento no absorbible del 2/0 USP y aguja recta, se realiza la sutura con el patrón indicado en la imagen.

Figura 19. Se realizan dos pequeñas incisiones a cada lado del plano nasal. La sutura discurre en dirección caudorostral a través del tejido subcutáneo y se exterioriza a través de las incisiones descritas para que el recorrido de la sutura quede completamente enterrado en el tejido subcutáneo.

Figura 20. La sutura de cantilever se aprieta y anuda, lo que permite la elevación de la punta de la nariz. Las incisiones cutáneas se aproximan con un patrón de sutura intradérmico.
Posoperatorio
La recuperación anestésica discurre sin incidencias. Durante la hospitalización posquirúrgica presenta inflamación cervical, episodios de salivación y náuseas y epistaxis bilateral leve-moderada (Figura 21) agravada por episodios de estornudos.

Figura 21. Epistaxis bilateral que resuelve completamente a las 72 horas de la cirugía. También se observa leve hundimiento y acortamiento de los labios superiores.
Se hospitaliza a la paciente con:
- Meloxicam 0.1 mg/kg/24 h SC.
- Gabapentina 10 mg/kg/8 h PO.
- Metadona 0.2 mg/kg SC, según necesidad basada en la escala de dolor agudo de Glasgow.
- Fluidoterapia de mantenimiento (Ringer lactato suplementado con 20 mEq/l de cloruro potásico).
- Aplicación de paños fríos cada 4 horas.
- Collar isabelino estricto.
- Dieta blanda.
Para el tratamiento específico de la epistaxis se administra ácido tranexámico a 10 mg/kg/8 h IV y se mantiene a la paciente en un estado de sedación ligero durante las primeras 24 horas con trazodona a 5 mg/kg/12 h PO. Las náuseas se tratan con maropitant a 1 mg/kg/24 h SC.
La evolución postquirúrgica es favorable, con un buen control del dolor y hemodinámicamente estable. A las 8 horas de la cirugía come de forma voluntaria sin dificultades.
Se da el alta hospitalaria a las 48 horas de la cirugía con:
- Meloxicam 0.1 mg/kg/24 h PO, 7 días.
- Gabapentina 10 mg/kg/8 h PO, 14 días.
- Ácido tranexámico 10 mg/kg/8 h PO, 3 días.
En la revisión a los 5 días la epistaxis ha resuelto de forma completa, la inflamación cervical se mantiene estable y no muestra signos de dolor. La paciente muestra apetito y come sin dificultades (Figura 22).

Figura 22. Estado de la paciente a los 5 días de la cirugía. La epistaxis ha desaparecido y el resultado cosmético es óptimo.
La evolución es favorable y se retiran los puntos de la linfadenectomía y el collar isabelino a los 14 días de la cirugía. La reconstrucción intraoral es completamente viable y no existe evidencia de dehiscencia de las suturas, con lo que se da el alta quirúrgica.
Histología y plan de seguimiento oncológico
La histología describe la presencia de una neoplasia oral maligna de células fusiformes, altamente infiltrativa y con elevada actividad replicativa (40 mitosis en 10 campos de máximo aumento). Los márgenes de tejido blando y óseo están libres de enfermedad, siendo el margen mínimo de 0.2 cm (márgenes limpios estrechos) y el máximo de 2 cm. No hay evidencia de enfermedad metastásica a nivel linfático.
Se sospecha de un posible origen melanocítico, pero dado que la histopatología no es concluyente se cursan marcadores inmunohistoquímicos. Los marcadores MELAN-A y PNL2 resultan negativos, lo que a priori descartaría el origen melanocítico del crecimiento. Sin embargo, un porcentaje mínimo de melanomas de subtipo histológico fusiforme pueden presentar negatividad a estos dos anticuerpos.
Ante este escenario, se basaron las recomendaciones terapéuticas y el pronóstico en relación con el carácter altamente infiltrativo y replicativo de la neoplasia, siendo los diagnósticos diferenciales más probables el fibrosarcoma y el melanoma oral amelanótico.
Tras discutir las diferentes opciones de tratamiento y monitorización con los tutores, se optó por administrar cuatro sesiones de doxorrubicina cada 21 días. La paciente toleró bien la quimioterapia intravenosa y no mostró signos de recidiva local ni metástasis a distancia durante las exploraciones seriadas. Tampoco en la tomografía computarizada de control realizada a las ocho semanas de la cirugía.
Evolución del caso
En el momento de escribir este artículo, ocho meses después de la cirugía, no existe evidencia de progresión de la enfermedad y la paciente sigue disfrutando de una calidad de vida excelente.
Discusión
Se han realizado muchos estudios para determinar la incidencia de tumores orales en perros y gatos, aunque no existen estudios recientes que aporten nueva información1-3. Las neoplasias orales son frecuentes, y representan el 6 % de todos los tumores que afectan a la especie canina1.
En una serie de casos de cáncer orofaríngeo en perros, el tumor más común fue el melanoma oral, seguido del carcinoma de células escamosas (CCE) y el fibrosarcoma1-3.
El diagnóstico y la estadificación clínica de los animales con masas orofaríngeas es crucial antes de plantear una potencial escisión quirúrgica1-3. Para un diagnóstico definitivo de las neoplasias orales, a menudo se requiere la toma de una biopsia incisional ya que las citologías de las masas orales no siempre son diagnósticas. Esto es debido a que muchos tumores orales presentan un alto grado de necrosis e inflamación1. En nuestro caso, tanto la citología como el comportamiento biológico del tumor permitieron determinar desde un principio el carácter agresivo de la neoplasia.
En el caso de tomar una biopsia incisional es muy importante planificar adecuadamente el lugar que se va a muestrear para que el trayecto de biopsia no afecte negativamente a la potencial cirugía de intento curativo1.
La estadificación clínica en los tumores orales consiste en la evaluación local del tumor (tumor primario y LN regionales) y la presencia de enfermedad metastásica, siendo los nódulos linfáticos regionales y los pulmones los dos lugares más comunes para metástasis en perros y gatos con neoplasias orales1-3.
En este caso la estadificación se realizó con tomografía computarizada (TC). La TC se prefiere generalmente a la resonancia magnética (RM) por su mayor detalle óseo, aunque ambas técnicas proporcionan más información sobre la extensión local del tumor que las radiografías simples1.
La lisis ósea no es evidente radiográficamente hasta que el 40 % o más del córtex está destruido. Por consiguiente, radiografías aparentemente normales no excluyen la afectación ósea por parte del tumor1-5.
La información obtenida con las pruebas de imagen avanzadas, el uso de reconstrucciones multiplanares y la exploración bajo sedación del paciente, son cruciales para la correcta planificación quirúrgica del tumor.
Por otro lado, la TC permite un estudio rápido y detallado de grandes regiones corporales, por lo que a menudo se usa para investigar la presencia de metástasis a distancia1,3-5.
La intervención quirúrgica recomendada en este caso fue una maxilectomía rostral bilateral. Este procedimiento está indicado en pacientes con neoplasias orales que estén localizadas rostrales a los segundos premolares superiores y que, a su vez, crucen la línea media1. Se puede combinar con la resección del plano nasal si es necesario, aunque en el caso descrito la masa no tenía afectación de la cavidad nasal1-3.
No existe evidencia científica suficientemente robusta que indique cuales son los márgenes de escisión quirúrgica concretos para cada tipo de tumor1. Estos van a depender del tipo de neoplasia, y en ocasiones, márgenes más estrechos de los recomendados pueden ser suficientes para la resección completa de un tumor1. Además, existen limitaciones anatómicas dónde la obtención de márgenes amplios no es posible1-3. Normalmente, los márgenes se toman con relación a tejido sano macroscópico o a los hallazgos de las pruebas de imagen avanzada1-3.
En este caso se consideraron 20 mm de márgenes laterales, siendo la recomendación para los tumores malignos como el CCE, melanoma oral y fibrosarcoma de 20-30 mm. En el caso de los tumores benignos la recomendación es de 5-10 mm1,3.
Por otro lado, a esta paciente se le realizó una linfadenectomía cervical completa (LN mandibulares y retrofaríngeos mediales bilateral) como parte del trabajo de estadificación oncológica. La decisión de extirpar todos estos LN regionales de forma no selectiva está basada en el hecho de que existe una gran variabilidad de los patrones de drenaje linfático en la cabeza del perro, junto a la falta de un consenso para la detección del LNC cuando no se realizan técnicas de mapeo linfático. Además, se ha descrito que hasta un 62 % de las neoplasias orales en perros pueden presentar afectación del LN contralateral4,5.
En este caso se realizó un mapeo intraoperatorio con azul de metileno, que permitió detectar como positivo (LN centinela) al LN mandibular izquierdo. Esta técnica consiste en la inyección de azul de metileno alrededor del tumor, y la posterior identificación de la tinción en los trayectos linfáticos eferentes o directamente en el LN centinela6,7. Esto implica que la detección de este LN se debe hacer mediante visualización directa de la tinción sobre el tejido linfático y por esta razón es una técnica que si se usa sola puede presentar un porcentaje elevado de falsos negativos. En cambio, si se combina con otras técnicas de mapeo linfático, permite la detección del 96 % de los LN centinelas7.
Nuestra paciente presentó complicaciones leves y esperables durante el posquirúrgico inmediato: epistaxis autolimitante e inflamación en la región cervical.
La complicación más frecuente después de una maxilectomía en perros y gatos es la dehiscencia de las suturas, descrita en un 5-33 % de los pacientes1. Esta puede conllevar la aparición de una fístula oronasal que, en ocasiones, requiere de una o varias cirugía de revisión1-3.
La causa más frecuente de dehiscencia es la presencia de tensión en el sitio de sutura1-3. Otras factores incluyen el uso excesivo de electrocirugía, la selección de material de sutura de rápida absorción y las alteraciones en la cicatrización derivadas de la administración de quimioterapia o radioterapia1,3.
Otras complicaciones posquirúrgicas asociadas a las maxilectomías son la aparición de úlceras orales por maloclusión, inflamación, hemorragia, dolor, enfisema subcutáneo, infección y secreción nasal por rinitis1-3. Durante el periodo intraoperatorio, las complicaciones más frecuentes son el sangrado y la hipotensión1-3.
Por otro lado, las principales complicaciones descritas en linfadenectomías de la cabeza están relacionadas con la creación de espacio muerto y la disrupción del drenaje linfático. Se ha descrito un porcentaje de complicaciones menores del 21 %, siendo las más comunes la formación de seroma, la aparición de hematoma, la dehiscencia parcial de la sutura y el linfedema8-10.
Otro aspecto muy importante tras una maxilectomía rostral bilateral es el impacto estético, ya que la pérdida de soporte óseo ventral conlleva la caída de la punta del hocico1. Con el objetivo de corregir esta secuela, que en algunos casos además de tener una implicación estética podría llegar a obstaculizar el paso del aire por las narinas, se han descrito distintas técnicas de lifting nasal. Estas técnicas incluyen el uso de suturas de cantilevero voladizo3 o variaciones de rinoplastias que permitan el acortamiento del hocico11 (Figuras 23 a 26).

Figura 23. Visión tras la maxilectomía rostral bilateral de una paciente distinta, a la que también se le realizó una maxilectomía rostral bilateral debido a un tumor maxilar rostral.

Figura 24. Colocación de un punto de sutura temporal, que permite determinar la cantidad de piel a eliminar para obtener el grado de lifting deseado.

Figura 25. Defecto cutáneo tras la resección de la porción de piel estimada.

Figura 26. Aposición del defecto cutáneo en dos capas. Patrón intradérmico.

Figura 27. Resultado cosmético definitivo (lifting nasal).
En este caso se decidió realizar un lifting nasal con una sutura de voladizo, lo que permitió corregir la desviación nasal secundaria a la maxilectomía. Se discutieron con los tutores los pros y contras del procedimiento, siendo una reacción de cuerpo extraño a la sutura no absorbible la complicación más probable. En el momento de redacción de este caso, pasados siete meses de la cirugía, no se han registrado complicaciones asociadas a la técnica.
Conclusión
El manejo de tumores orales en la especie canina requiere de un enfoque multidisciplinario que incluya una correcta estadificación, un abordaje quirúrgico adecuado y la consideración de terapias adyuvantes. En este caso, a pesar de la naturaleza altamente infiltrativa del tumor, la combinación de cirugía y quimioterapia con doxorrubicina ha permitido un buen control de la enfermedad, sin evidencias de recidiva a los ocho meses de seguimiento.
Este caso resalta la relevancia de una planificación quirúrgica meticulosa y la importancia de mantener una buena comunicación con los/las tutores/as de los pacientes con neoplasias orales. La evolución favorable de esta paciente demuestra que, con un abordaje adecuado, es posible mejorar significativamente el pronóstico y bienestar de los pacientes afectados por estas patologías.
Bibliografía
- Liptak JM, Lascelles BDX. Oral tumors. En: Kudnig ST, Séguin B. Veterinary Surgical Oncology. 1st Ed. Wiley-Blackwell. 2012.
- Lantz GG. Maxillectomy techniques. En: Verstraete FJM, Lommer MJ. Oral and maxillofacial surgery in dogs and cats. 1ª Ed. Saunders-Elsevier .
- Zacher AM, Marretta SM. Oral and maxillofacial surgery in dogs and cats.Vet Clin North Am Small Anim Pract. 2013;43(3):609-649.
- Skinner OT, Boston SE, Souza CHM. Patterns of lymph node metastasis identified following bilateral mandibular and medial retropharyngeal lymphadenectomy in 31 dogs with malignancies of the head. Vet Comp Oncol. 2017 Sep;15(3):881-889.
- Goldschmidt S, Stewart N, Ober C, Bell C, Wolf-Ringwall A, Kent M, Lawrence J. Contrast-enhanced and indirect computed tomography lymphangiography accurately identifies the cervical lymphocenter at risk for metastasis in pet dogs with spontaneously occurring oral neoplasia. PLoS One. 2023 Mar 2;18(3): e0282500.
- Tuohy JL, Milgram J, Worley DR, Dernell WS. A review of sentinel lymph node evaluation and the need for its incorporation into veterinary oncology. VetComp Oncol. 2009 Jun;7(2):81-91.
- Liptak JM, Boston SE. Nonselective Lymph Node Dissection and Sentinel Lymph Node Mapping and Biopsy. Vet Clin North Am Small Anim Pract. 2019 Sep;49(5):793-807.
- R Ferrari,LE Chiti,M Manfredi, et al.Biopsy of sentinel lymph nodes after injection of methylene blue and lymphoscintigraphic guidance in 30 dogs with mast cell tumors.Vet Surg.2020;49:1099–1108.
- Green K, Boston SE. Bilateral removal of the mandibular and medial retropharyngeal lymph nodes through a single ventral midline incision for staging of head and neck cancers in dogs: a description of surgical technique. Vet Comp Oncol. 2017 Mar;15(1):208-214.
- Chiti LE, Gariboldi EM, Ferrari R, Luconi E, Boracchi P, De Zani D, Zani D, Manfredi M, Spediacci C, Grieco V, Giudice C, Recordati C, Ferrari F, Stefanello D. Surgical complications following sentinel lymph node biopsy guided by γ-probe and methylene blue in 113 tumour-bearing dogs. VetComp Oncol. 2023 Mar;21(1):62-72.
- Herron VA, Skinner OT, Sidhu DS, Mickelson MA. Muzzle-shortening rhinoplasty as a novel reconstructive technique to prevent ventral nasal deviation after bilateral rostral maxillectomy in a dog. J Am Vet Med Assoc. 2024;263(1):1-4.
 by Multimédica
by Multimédica
