Panleucopenia felina en una gatita vacunada: presentación clínica y evolución desfavorable
Resumen breve
Se describe el caso clínico de una gata Maine coon de nueve meses, de vida interior y correctamente vacunada mediante un protocolo de tres dosis trivalentes, que desarrolló un cuadro agudo de panleucopenia. El objetivo de esta comunicación es describir la evolución clínica, el abordaje diagnóstico y las complicaciones asociadas, así como discutir el posible fallo vacunal en un paciente correctamente inmunizado.Índice de contenidos
Resumen breve
La panleucopenia felina es una enfermedad vírica altamente contagiosa que afecta principalmente a gatos jóvenes, con una elevada morbilidad y mortalidad. Se describe el caso clínico de una gata Maine coon de nueve meses, de vida interior y correctamente vacunada mediante un protocolo de tres dosis trivalentes, que desarrolló un cuadro agudo de panleucopenia. La sintomatología incluía anorexia, fiebre, diarrea hemorrágica, leucopenia grave, hipocolesterolemia e hipoalbuminemia. El objetivo de esta comunicación es describir la evolución clínica, el abordaje diagnóstico y las complicaciones asociadas, así como discutir el posible fallo vacunal en un paciente correctamente inmunizado.
Introducción
La panleucopenia felina (FP) es una enfermedad vírica altamente contagiosa y potencialmente mortal que afecta principalmente a gatos jóvenes. Está causada por el virus de la panleucopenia felina (FPV), un parvovirus de ADN monocatenario, icosaédrico y sin envoltura, perteneciente al género Protoparvovirus. Su elevada resistencia a factores físicos y químicos permite su persistencia ambiental durante meses o incluso años, favoreciendo la transmisión tanto directa como indirecta, a través de fómites o personas en contacto con animales infectados1,2.
Además, gatos sanos e inmunocompetentes pueden eliminar FPV e incluso parvovirus canino (CPV) en ausencia de signos clínicos, contribuyendo a la diseminación ambiental del virus¹.
Dado que el FPV depende de la ADN polimerasa celular para replicarse, infecta preferentemente tejidos con alta tasa de división celular, como la médula ósea, el tejido linfoide y el epitelio intestinal. Por ello, los signos clínicos más frecuentes incluyen fiebre, vómitos, diarrea, anorexia y deshidratación. En gatitos, el curso puede ser hiperagudo, provocando muerte súbita incluso antes de la aparición de signos evidentes³.
Gracias a la vacunación sistemática, la prevalencia del FPV en gatos domésticos ha disminuido significativamente en las últimas décadas. No obstante, aún se producen brotes en entornos con alta densidad felina, como refugios, donde la mortalidad puede ser elevada y el control del brote constituye un reto considerable¹. Las estrategias de prevención incluyen un manejo adecuado de la vacunación, medidas estrictas de higiene, desinfección efectiva y protocolos de cuarentena. En situaciones de brote, puede emplearse inmunización pasiva mediante suero hiperinmune que contiene anticuerpos específicos frente al FPV².
El tratamiento se basa en cuidados de soporte intensivo, con enfoque en la fluidoterapia, el control del dolor, la prevención de infecciones secundarias y el soporte nutricional, ya que no existe un tratamiento antiviral específico aprobado con eficacia demostrada en la práctica clínica³.
Caso clínico
Se presentó en consulta una gata Maine coon, esterilizada recientemente (hace 5 días), de 9 meses de edad, 4 kg de peso y vida interior. Convive con una gata y dos gatos aparentemente sanos. Recibió un protocolo vacunal completo con tres dosis trivalentes administradas con un mes de separación a partir de las 9 semanas de edad. Última desparasitación interna hace un mes con esafoxolaner, eprinomectina y prazicuantel (Nexgard Combo® solución spot-on para gatos, Boehringer Ingelheim, Alemania). Alimentada con pienso de alta gama (Kitten® Royal Canin). Testada frente a retrovirus FeLV/FIV, cuando tenía 5 meses de edad, negativa para ambos.
Presentaba signos de apatía, anorexia, diarrea blanda y salivación excesiva (descrita por los cuidadores como "mucho exceso de babas"), de un día de evolución.
A la exploración, la paciente se presentó con letargia y disminución del estado de alerta, con pupilas dilatadas pero reactivas, mucosas rosadas, ganglios linfáticos palpables sin alteración, auscultación cardíaca y pulmonar sin alteraciones, frecuencia cardíaca de 160 lpm y frecuencia respiratoria de 36 rpm, pulso fuerte, regular y sincrónico, deshidratación del 6 %, temperatura rectal de 40 ºC. Buena condición corporal (5/9), masa muscular 2/3 y abdomen blando a la palpación sin manifestar dolor.
Se consideraron los siguientes problemas clínicos: anorexia, apatía, deshidratación (6 %), fiebre, náuseas y diarrea. Entre los diagnósticos diferenciales considerados inicialmente se incluyeron panleucopenia felina, infecciones víricas como la peritonitis infecciosa felina (PIF), parasitosis intestinales, pancreatitis aguda y complicaciones posquirúrgicas (como peritonitis séptica o química). El estado febril, la deshidratación, la diarrea y la leucopenia orientaron el cuadro clínico hacia una enfermedad infecciosa aguda (Tabla 1), siendo la panleucopenia felina una de las principales sospechas a pesar del historial vacunal completo.
| Causa | Agente o categoría | Datos clave para diferenciación |
|---|---|---|
| Panleucopenia felina (FPV) | Parvovirus | Leucopenia severa, diarrea hemorrágica, PCR/ELISA positivo, historia de vacunación incompleta o fallo vacunal |
| Peritonitis infecciosa felina (PIF) | Coronavirus felino mutado | Signos sistémicos, efusión abdominal/torácica, hiperglobulinemia, PCR específica, inmunofluorescencia |
| Toxoplasmosis | Toxoplasma gondii | Signos neurológicos, respiratorios u oculares Serología (IgM alta) |
| Septicemia bacteriana | E. coli, Klebsiella, Streptococcus spp. | Letargia, hipotermia o fiebre, neutropenia, shock, sin hallazgo de enfermedad vírica clara |
| Salmonelosis | Salmonella spp. | Diarrea aguda, a veces hemorrágica Cultivo fecal positivo Riesgo zoonótico |
| Campilobacteriosis | Campylobacter spp. | Diarrea aguda en animales jóvenes Diagnóstico por coprocultivo o PCR |
| Giardiosis o coccidiosis | Giardia spp., Isospora spp. | Diarrea intermitente o aguda, especialmente en animales jóvenes o inmunodeprimidos Detección por flotación o ELISA |
| Clostridiosis | Clostridium perfringens/difficile | Diarrea aguda Diagnóstico por detección de toxinas en heces |
| Calicivirosis o Rinotraqueítis felina (Herpesvirus) | FCV/FHV-1 | Signos respiratorios predominantes, úlceras orales, fiebre |
| Leucemia felina (FeLV) / Inmunodeficiencia felina (FIV) | Retrovirus | Signos variables, inmunosupresión Diagnóstico por prueba rápida ELISA |
Tabla 1. Diagnóstico diferencial de enfermedad infecciosa aguda en gatos.
La aproximación diagnóstica inicial incluyó analítica sanguínea completa (hemograma y bioquímica), urianálisis, pruebas de imagen (radiografías y ecografía abdominal), estudio coprológico y pruebas serológicas (test FIV/FeLV y lipasa pancreática específica felina) (SNAP fPL®Idexx), con el fin de descartar causas metabólicas, dietéticas, infecciosas y sistémicas (parasitosis, enfermedades bacterianas, fúngicas o víricas, enfermedades endocrinas, pancreatitis, insuficiencia renal o hepática) y cuerpos extraños.
En el hemograma se observó una leucopenia marcada, con linfopenia y neutropenia marcada (Tabla 2). En la bioquímica destacó una ligera hipoproteinemia, con hipoalbuminemia y disminución de las globulinas, hipocolesterolemia y aumento de la fosfatasa alcalina (ALP) (Tabla 3). Las pruebas rápidas para FeLV y FIV (SNAP® Combo Plus, Idexx, Barcelona) fueron negativas. Se realizó también, de forma simultánea, una detección conjunta de antígenos de parvovirus canino, coronavirus canino y Giardia spp. en heces, resultando positivo a parvovirus canino.
| Parámetro | 16/02/22 | 18/02/22 | 20/02/22 |
|---|---|---|---|
| Hematocrito (%) | 27.0 | 22.0 | 18.0 |
| Hemoglobina (g/dl) | 8.7 | 7.1 | 6.2 |
| Eritrocitos (M/µl) | 4.94 | 4.3 | 3.8 |
| Leucocitos (K/µl) | 1.3 | 0.8 | 0.5 |
| Neutrófilos segmentados (K/µl) | 0.71 | 0.4 | 0.25 |
| Linfocitos (K/µl) | 0.33 | 0.2 | 0.15 |
| Monocitos (K/µl) | 0.06 | 0.05 | 0.04 |
| Eosinófilos (K/µl) | 0.2 | 0.15 | 0.1 |
| Plaquetas (K/µl) | 307.0 | 210.0 | 150.0 |
Tabla 1. Hemogramas y bioquímicas del caso clínico.
| Parámetro | 16/02/22 | 20/02/22 |
|---|---|---|
| Proteínas totales (g/dl) | 5.1 | 4.2 |
| Albúmina (g/dl) | 2.1 | 1.4 |
| Globulinas (g/dl) | 3.0 | 2.8 |
| ALT (GPT) (U/l) | 73.0 | 87.0 |
| Fosfatasa alcalina (U/l) | 79.0 | 58.0 |
| Colesterol (mg/dl) | 82.0 | 65.0 |
Tabla 2.
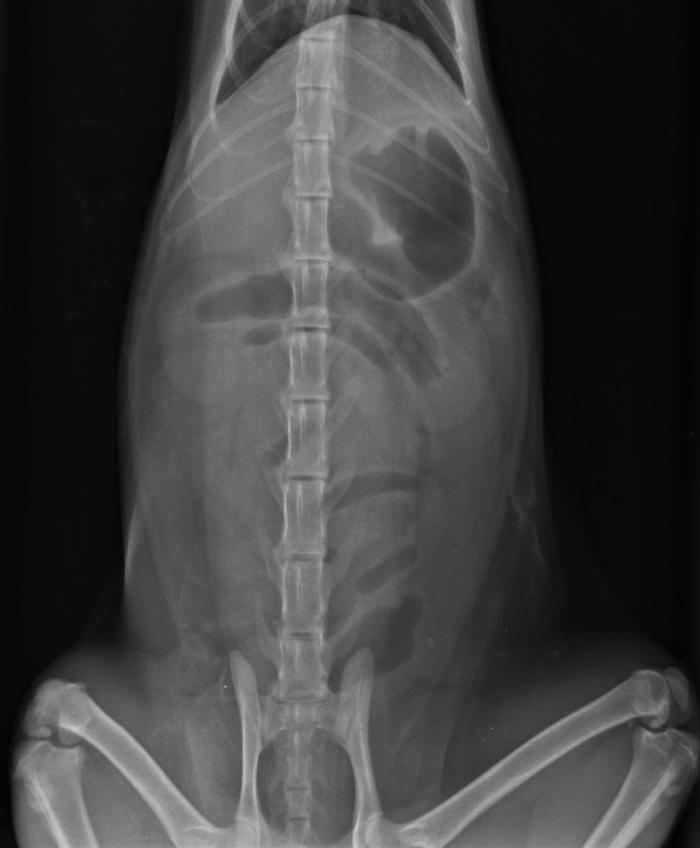
En las radiografías de abdomen se observaron asas del intestino delgado distendidas con gas (Figura 1A-B) y el estómago distendido con contenido gaseoso.
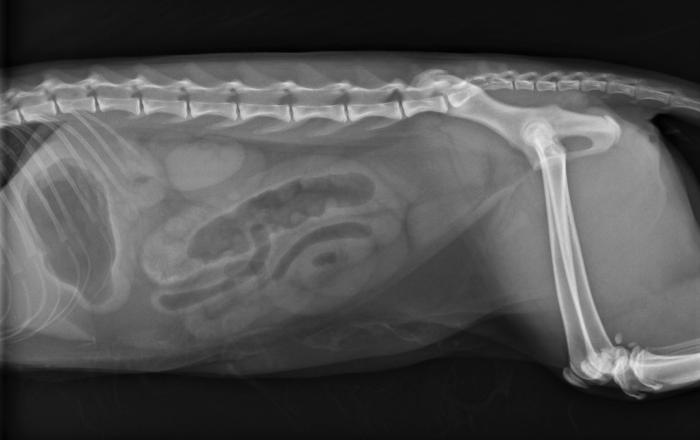
Figura 1.
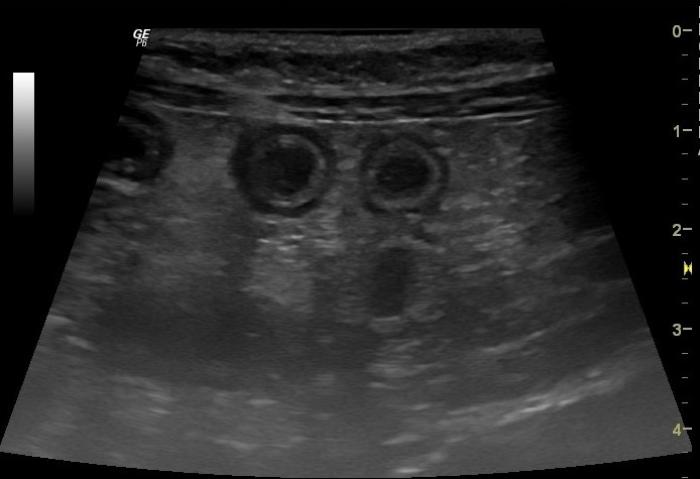
En la ecografía abdominal (Figura 2A-B), se evidenció engrosamiento difuso de la pared de todo el intestino delgado, íleo funcional, distensión gástrica, mesenterio hiperecogénico compatible con peritonitis y esplenomegalia difusa.
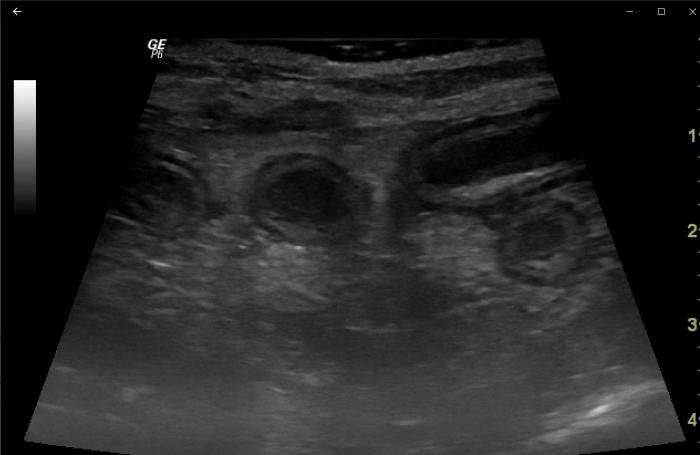
Figura 2.
Se amplió la analítica incluyendo la prueba SNAP fPL® para lipasa pancreática felina con resultado negativo y urianálisis (densidad urinaria 1050, sin alteraciones).
Se instauró tratamiento hospitalario con fluidoterapia intravenosa (Ringer lactato, 15 ml/h), buprenorfina (10 µg/kg/12 h IV), ampicilina (20 mg/kg/8 h IV), marbofloxacino (2 mg/kg/24 h IV), famotidina (0.5 mg/kg/24 h IV), omeprazol (0.7 mg/kg/12 h IV), maropitant (1 mg/kg/24 h IV) y multivitamínico (Catosal®, 0.1 ml/kg IV).
A continuación, se detalla la evolución clínica de la paciente durante los días siguientes a su hospitalización.
Evolución
- Día 1: la paciente permanecía estable, con fiebre moderada, diarrea persistente y sin ingesta voluntaria de alimento, aunque mantenía el consumo de agua. Se observó dolor abdominal leve. Se colocó una sonda nasogástrica y se inició alimentación enteral con Recovery® líquido (Royal Canin). Se añadió al tratamiento interferón omega recombinante felino (1 MU/kg/24 h SC) como inmunomodulador.
- Día 2: la paciente mostraba un estado deterioro clínico, con diarrea hemorrágica recurrente, hiporexia y aumento del consumo de agua. Aunque las constantes fisiológicas se mantenían dentro de los rangos normales (FC 138 lpm, FR 26 rpm, Tª 38.3 ºC), presentaba mucosas pálidas y secas, distensión abdominal marcada y dolor a la palpación. Se añadió vitamina K (5 mg/kg/12 h SC) ante la sospecha de pérdida por diarrea hemorrágica.
- Día 3: la paciente permanecía decaída, en decúbito lateral, con persistencia de la diarrea y sin ingesta voluntaria. Las constantes fisiológicas se mantenían dentro de los rangos normales (FC 140 lpm, FR 22 rpm, Tª 38.0 ºC, TRC 1 segundo), aunque las mucosas seguían pálidas y secas, y persistía la distensión y el dolor abdominal, junto con irritación y ulceración de la mucosa perianal. Se solicitó suero hiperinmune. Se recogieron muestras fecales durante tres días consecutivos para examen por flotación centrífuga con sulfato de zinc, sin hallazgos de parásitos; se observaron fibras vegetales y microbiota bacilar moderada. Se canalizó la extremidad posterior izquierda para la administración intravenosa de concentrado de eritrocitos tras un descenso del hematocrito del 27 % al 18 %. La transfusión se inició a 1 ml/kg/h durante 15 minutos, aumentando a 5 ml/kg/h durante los siguientes 15 minutos. Se monitorizaron los signos vitales cada 15 minutos durante la primera hora y nuevamente cada 2 horas, sin detectarse alteraciones. Previamente, se había solicitado tipificación del grupo sanguíneo para asegurar la compatibilidad.
- Día 4: la paciente presentaba un estado hipodinámico, con temperatura corporal fluctuante durante la noche (36.6-39.0 °C), pupilas dilatadas, escasa respuesta a estímulos externos. Se registraron: FC 170 lpm, FR 40 rpm, TRC 1 segundo, mucosas pálidas y húmedas, sin alteraciones cardiopulmonares a la auscultación. Se evidenció hundimiento del globo ocular y persistencia del pliegue cutáneo, sin consumo de alimento ni agua y deposiciones líquidas, fétidas y hemorrágicas. Se repitieron los análisis, observándose en el hemograma leucopenia marcada con linfopenia y neutropenia, anemia y trombocitopenia. En la bioquímica, las proteínas totales y la albúmina descendieron, las globulinas y la GPT aumentaron. Dada la evolución clínica desfavorable y el pronóstico reservado, se discutió con los cuidadores la posibilidad de instaurar medidas paliativas o considerar la eutanasia humanitaria. Se optó por continuar con tratamiento intensivo bajo monitorización estricta.
- Día 5: la paciente se encontraba en estado comatoso, hipodinámico e hipotérmico (36 ºC), y mínima respuesta a estímulos externos. Presentaba FC 180 lpm, FR 50 rpm, pulso de igual frecuencia, mucosas pálidas y húmedas, continuaba con deshidratación marcada (8 %), hundimiento del globo ocular, y persistencia del pliegue cutáneo y mantenían diarreas hemorrágicas constantes. Se inició tratamiento con dexametasona (0.5 mg/kg IV), como medida antiinflamatoria y antishock, ante la sospecha de sepsis grave en estadio terminal. Durante el turno nocturno presentó tres episodios de vómito. Se mantenía decaída, inapetente, con TRC mayor de 2 segundos y saturación de oxígeno del 85 %. Se administró oxigenoterapia. La paciente falleció a las 3:00 h. La causa de la muerte se atribuyó a un paro cardiorrespiratorio asociado a fallo multiorgánico secundario a sepsis grave.
Discusión
La paciente descrita en el presente caso clínico fue diagnosticada de una infección por el virus de la panleucopenia felina (FPV), con evolución fatal cinco días después del inicio del tratamiento médico intensivo. Como se ha descrito en la literatura, el tratamiento de la FPV es fundamentalmente sintomático, centrado en el soporte intensivo y la prevención de complicaciones secundarias, debido a la ausencia de una terapia antiviral específica eficaz1,3,4. En los últimos años, el FPV ha resurgido como una causa significativa de mortalidad, especialmente en gatos de refugio y en situaciones de alta densidad poblacional5,6.
La combinación de bacteriemia con neutropenia severa puede favorecer la instauración de un cuadro séptico en estos pacientes inmunocomprometidos. No obstante, debe señalarse que en la paciente no se realizó hemocultivo, por lo que la presencia de bacteriemia fue inferida con base en los hallazgos clínicos (letargia, fiebre y deterioro sistémico) y analíticos (neutropenia grave). Por ello, se recomienda iniciar antibioterapia empírica de amplio espectro, con acción frente a bacterias Gram-negativas y anaerobias4. En este caso, se utilizó una combinación de ampicilina y marbofloxacino, siguiendo las recomendaciones vigentes7.
Por otra parte, el uso de interferón omega recombinante felino, continúa siendo objeto de debate, estudios experimentales sugieren un efecto inmunomodulador beneficioso frente a infecciones virales8. Tras discutir con los cuidadores sus posibles efectos y limitaciones, se optó igualmente por su administración, con el objetivo de apoyar la respuesta inmunitaria de la paciente.
Los resultados de las pruebas complementarias realizadas durante la hospitalización evidenciaron una progresiva inestabilidad clínica. Se consideró que la causa de la muerte fue un fallo multiorgánico. En pacientes críticamente enfermos, se recomienda realizar un ionograma para evaluar el estado ácido-base, ya que permite detectar alteraciones metabólicas relevantes9. En este caso, el ionograma no se repitió en la fase final, por lo que no se pudo confirmar una posible acidosis metabólica secundaria a la pérdida de bicarbonato provocada por las diarreas hemorrágicas. En condiciones normales, dicha acidosis puede desencadenar una hiperventilación compensatoria, con descenso de CO₂ sin alcanzar una normalización del pH. El principio de electroneutralidad explica alteraciones del cloro, cuya relación inversa con el bicarbonato intenta compensar diversos desequilibrios metabólicos9,10. La hipernatremia y la hipocalemia son frecuentes en enfermedades gastrointestinales, asociadas a la pérdida de fluidos hipotónicos o contenido intestinal rico en potasio4. Sin embargo, en este caso los electrolitos se mantuvieron dentro de los valores normales hasta 1 día antes de su fallecimiento.
Además, se detectaron hipocolesterolemia e hipoalbuminemia durante la evolución clínica. Estudios recientes han demostrado que la presencia concurrente de estas dos alteraciones se asocia con un incremento significativo del riesgo de mortalidad en gatos hospitalizados, con una razón de probabilidades de 15.6 (IC 95 %: 5.2-46.6; P < 0.0001)11. Estos parámetros bioquímicos pueden reflejar tanto una respuesta inflamatoria sistémica grave como una pérdida intestinal de proteínas y lípidos, lo que refuerza su valor pronóstico en pacientes críticamente enfermos con panleucopenia.
En cuanto a la hematología, es común observar leucopenia en los primeros días de la infección por FPV, más acentuada cuanto mayor es la gravedad del cuadro clínico4. Si la evolución es favorable, los leucocitos tienden a normalizarse y puede aparecer una anemia progresiva, especialmente en presencia de diarrea hemorrágica. En la paciente descrita, se observó leucopenia grave desde el primer día, sin recuperación posterior, junto con el desarrollo progresivo de anemia y trombocitopenia, lo que motivó la realización de una transfusión de concentrado de eritrocitos. Aunque el valor de hematocrito descendió del 27 al 18 %, la indicación se basó también en parámetros clínicos como la hipoperfusión, mucosas pálidas y deterioro progresivo. La literatura actual indica que, más allá del hematocrito, la decisión transfusional debe apoyarse en la evaluación clínica del paciente.
También se reportan elevaciones de ALT y bilirrubina como manifestación de hepatopatía secundaria al estado séptico4. En este caso, se detectaron alteraciones leves en las enzimas hepáticas en ambas analíticas.
Ante la sospecha de sepsis y shock séptico, se decidió iniciar tratamiento con glucocorticoides como terapia adyuvante12. Estudios preclínicos en medicina humana han demostrado que los corticosteroides endógenos desempeñan un papel fundamental en la tolerancia a la sepsis, al mitigar la inflamación excesiva, los trastornos vasculares y la hipoglucemia12.
Durante la hospitalización se solicitó suero hiperinmune como medida adicional de soporte inmunológico, aunque no llegó a administrarse debido al fallecimiento de la paciente antes de su recepción. Este preparado, que contiene anticuerpos específicos frente a FPV, se ha utilizado como inmunoprofilaxis pasiva en gatitos no vacunados o en situaciones de brote. Aunque su eficacia terapéutica en animales ya sintomáticos es incierta, su uso puede considerarse como parte de un enfoque integral en contextos de alto riesgo5.
En conclusión, la panleucopenia felina es una enfermedad viral de elevada morbilidad y mortalidad, con tasas de letalidad que pueden alcanzar hasta el 90 % en gatitos no inmunizados4. Dada su alta prevalencia en animales jóvenes, la inmunización temprana sigue siendo la medida preventiva más eficaz¹. El tratamiento se basa en cuidados de soporte intensivos, con especial énfasis en la reposición de fluidos, el control del dolor y la prevención de infecciones secundarias mediante antibioterapia de amplio espectro4. El uso de agentes inmunomoduladores, multivitamínicos y una nutrición adecuada pueden contribuir a la estabilización del paciente4.
Entre las estrategias terapéuticas emergentes, el interferón omega recombinante felino ha mostrado eficacia en enteritis por parvovirus en perros, y se ha comprobado su capacidad para inhibir la replicación del virus de la panleucopenia en cultivos celulares8. No obstante, su eficacia clínica en gatos aún no ha sido validada mediante estudios controlados, aunque se considera prometedor dada su especificidad de especie8.
Cabe destacar que, a pesar de haber recibido tres dosis de la vacuna contra la panleucopenia felina, la paciente desarrolló la enfermedad, lo que sugiere un posible fallo vacunal. Este fenómeno, aunque infrecuente, puede deberse a una respuesta inmunitaria individual inadecuada o a una exposición a una carga viral ambiental elevada que supere la protección conferida por la vacuna13. En un estudio reciente, se demostró que la vacunación puede no conferir inmunidad suficiente en presencia de parásitos intestinales, lo que podría ser un factor contribuyente en casos como el descrito14. Este caso resalta la importancia de mantener estrictas medidas de bioseguridad incluso en animales vacunados, así como de seguir investigando los factores que pueden comprometer la eficacia vacunal.
Bibliografía
- Truyen, U., Addie, D., Belák, S., Boucraut-Baralon, C., Egberink, H., Frymus, T., & Horzinek, M. C. (2009). Feline panleukopenia. ABCD guidelines on prevention and management. Journal of Feline Medicine & Surgery, 11(7), 538-546.
- Jacobson L S, Janke K J, Giacinti J and Weese J S. Diagnostic testing for feline panleukopenia in a shelter setting: a prospective, observational study. Journal of Feline Medicine and Surgery 2021, Vol. 23(12) 1192–1199.
- Sykes JE. Infectious Diseases of the Dog and Cat. 2022. Chapter: Feline Panleukopenia.
- ABCD. European Advisory Board on Cat Diseases. Feline Panleukopenia. 2023.
- Addie DD, Frymus T, Boucraut-Baralon C, Egberink H, Gruffydd-Jones T, Hartmann K, et al. ABCD guidelines on the use of feline interferon-omega. J Feline Med Surg. 2009;11(7):630–637.
- Barrs VR. Feline Panleukopenia: A Re-emergent Disease. Vet Clin Small Anim. 2019;49(4):651–670.
- Litster A, Benjanirut C. Case series of feline panleukopenia virus in an animal shelter. J Feline Med Surg. 2014;16(4):346–353.
- Diakoudi G, Desario C, Lanave G, et al. Feline Panleukopenia Virus in Dogs from Italy and Egypt. Emerg Infect Dis. 2022 Sep;28(9):1822–1830.
- Strong S, Correa MT, Banks RE. Interventions and observations associated with survival of orphaned shelter kittens undergoing treatment for diarrhoea. J Feline Med Surg. 2020;22(4):292–298.
- Datz C. Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice. Elsevier. 2018.
- Wehner A, et al. Hypocholesterolemia in cats: a multicenter retrospective study of 106 cats. J Vet Intern Med. 2023.
- Annane D, Bellissant E, Bollaert PE, Briegel J, Keh D, Kupfer Y. Corticosteroids for treating sepsis. Cochrane Database Syst Rev. 2019;2019(12)
- Day, M. J., Horzinek, M. C., Schultz, R. D., & Squires, R. A. (2016). WSAVA Guidelines for the vaccination of dogs and cats. Journal of Small Animal Practice, 57(1), E1–E45
- Weidinger, C., Hagen-Plantinga, E., Sager, M., et al. (2024). Antibody response after feline panleukopenia virus vaccination in kittens with and without intestinal parasites. Journal of Feline Medicine and Surgery, 26(2), 146–155.
 by Multimédica
by Multimédica