Diagnóstico parasitológico a través del análisis coprológico en perros y gatos
Resumen breve
El estudio de las heces en perros y gatos permite la detección de formas parásitas que pueden confirmar una enfermedad parasitaria o en algunos casos la presencia de portadores asintomáticos. Los análisis coprológicos en perros y/o gatos están indicados siempre que el animal presente una patología digestiva (vómitos, diarreas, estreñimiento, dolor abdominal, flatulencias) y/ o cardiorrespiratoria (ya que hay parásitos respiratorios cuyas larvas son excretadas con las heces), pero también…Índice de contenidos
Introducción
El estudio de las heces en perros y gatos permite la detección de formas parásitas que pueden confirmar una enfermedad parasitaria o en algunos casos la presencia de portadores asintomáticos. Los análisis coprológicos en perros y/o gatos están indicados siempre que el animal presente una patología digestiva (vómitos, diarreas, estreñimiento, dolor abdominal, flatulencias) y/ o cardiorrespiratoria (ya que hay parásitos respiratorios cuyas larvas son excretadas con las heces), pero también debería recomendarse como medida de control, mínimo al menos una vez al año.
En muchas ocasiones se establecen planes de prevención a las mascotas que incluyen el uso de antiparasitarios y recomendaciones sanitarias (p. ej., no consumir carne cruda); sin embargo, no es frecuente la realización de análisis coprológicos ya que a veces se considera que con la pauta antiparasitaria establecida el animal está protegido. La mayoría de los protocolos antiparasitarios para parásitos internos se basan en el uso de antihelmínticos; no obstante, el control adecuado de estos parásitos también está relacionado con la frecuencia a la que se establezca la desparasitación, que a su vez depende de los hábitos y hábitat en los que vive el animal1,2.
Es decir, el protocolo de desparasitación no debería ser el misma para un animal de caza o que vive en una finca o sale a pasear de manera no controlada pudiendo ingerir algún tipo de presa, que la de un animal cuya alimentación está basada únicamente en dieta seca y siempre pasea de forma controlada con correa no teniendo por tanto posibilidad de cazar1,2. En cualquier caso, los antiparasitarios que se emplean rutinariamente a la posología recomendada como medida de prevención frente a endoparásitos, no suelen proteger frente a protistas, y cabe destacar que en la actualidad el parásito más prevalente en perros y gatos es Giardia duodenalis.
La realización de un diagnóstico de parásitos a través de las heces de forma correcta debe incluir un análisis coprológico seriado (3-5 días) ya que muchas formas parásitas se eliminan de forma intermitente. Si las heces son recogidas del suelo se debe evitar la zona que contacta con el mismo, sobre todo si el suelo es arena o hierba ya que se pueden contaminar con larvas de nematodos de vida libre que podrían dificultar el diagnóstico.
Las heces, una vez recogidas, deben ser refrigeradas para evitar la evolución de las formas parásitas (p. ej., de huevo a larva de primer estadio en el caso de la familia Ancylostomatidae). No obstante, es conveniente que la última deposición no se refrigere para evitar que algunas formas parásitas que son muy lábiles no sobrevivan y se dificulte el diagnóstico (p. ej., trofozoítos de Tritrichomonas foetus).
Análisis macroscópico
El primer análisis que se debe realizar es un análisis macroscópico de las heces para evaluar las características organolépticas tales como consistencia, color, olor, así como la presencia de moco, sangre, restos vegetales o alguna forma parasitaria. Es frecuente asociar las parasitosis con heces diarreicas, sin embargo, la consistencia de las heces puede variar según la parasitosis, desde heces diarreicas, pastosas, normales, semisólidas hasta incluso la presencia de heces sólidas con signos de estreñimiento.
El color y el olor va asociado en muchas ocasiones a las alteraciones en la absorción de grasas ocasionadas por las lesiones que producen los parásitos a nivel intestinal3. La presencia de restos vegetales y/o arena confirma la ingestión de estos por el animal, lo que permite asociar un hábito en el animal (síndrome de pica) que favorece la ingestión de formas parasitas infectantes.
En cuanto a la presencia de formas parasitarias macroscópicas, en las heces de carnívoros nos podemos encontrar adultos de ascáridos y/o proglotis de cestodos.
Los ascáridos son vermes redondos (nematodos) de tamaño grande (entre 7 y 18 cm) de color blanquecino anacarado (Figura 1).

Éstos se encuentran en la luz del intestino delgado y presentan en su extremo anterior tres labios muy desarrollados, pero al no poseer ninguna estructura de fijación a la mucosa intestinal pueden avanzar, gracias al peristaltismo intestinal, y ser expulsados al exterior. La eliminación de los adultos de ascáridos tiene lugar cuando la intensidad de parasitación es elevada, lo cual suele ocurrir en cachorros y gatitos. Incluso en ocasiones, los animales parasitados pueden vomitar madejas de vermes. En los carnívoros, los ascáridos que nos encontramos con mayor frecuencia pertenecen a los géneros Toxocara y Toxascaris.
Los adultos del género Toxocara son de mayor tamaño (10-18 cm) que los del género Toxascaris (7-10 cm). En el género Toxocara se encuentran las especies Toxocara canis en el perro y Toxocara cati en el gato. Mientas que Toxascaris leonina puede detectarse en perro y gatos. Es importante diferenciar estas tres especies de ascáridos puesto que Toxocara spp. produce migraciones intraorgánicas mientras que Toxascaris leonina no. Así mismo, las especies del género Toxocara son responsables de importantes zoonosis (larva migrans visceral y/o ocular) mientras que Toxascaris no lo es.
A simple vista, a pesar de que el adulto de Toxascaris en un poco más pequeño que Toxocara, no es fácil diferenciarlos y tendríamos que recurrir a observarlos bajo el microscopio o la lupa. En el extremo anterior las tres especies presentan tres labios y a ambos lados se observa una prolongación de la cutícula denominada alas cervicales que permiten la diferenciación de las especies. T. cati presenta unas alas cervicales más anchas y convexas con aspecto de punta de flecha, mientras que T. canis tiene las alas largas y estrechas y, T. leonina largas. Además, en las especies del género Toxocara se observa una protuberancia (ventrículo) entre el esófago y el intestino y, los machos presentan un proceso digitiforme terminal (Figura 2)4,5.

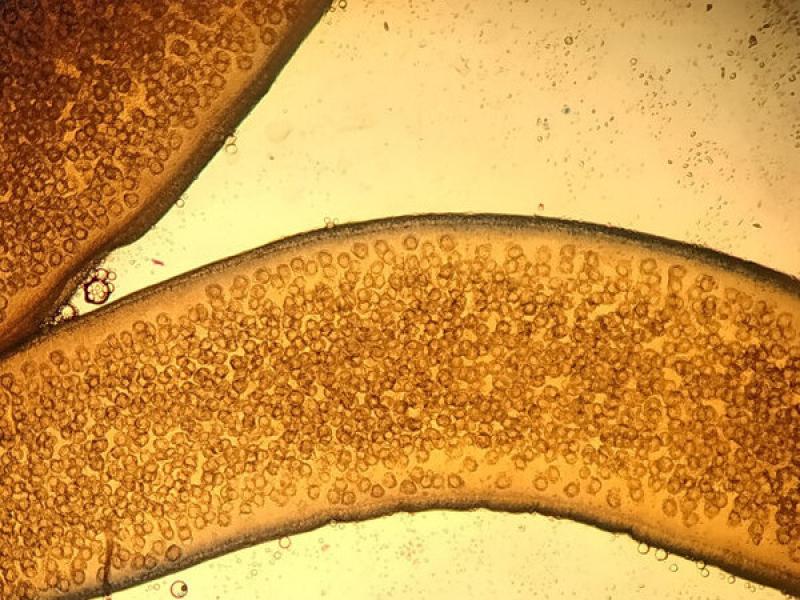
La otra forma parasitaria que podemos observar en un análisis macroscópico son las proglotis de cestodos. Los cestodos se fijan en el intestino delgado de los perros y/o gatos a través del escólex, a partir del cual se encuentra el cuello del que empieza a crecer el estróbilo formado por proglotis o anillos. Las proglotis cercanas al escólex son inmaduras, pero según van creciendo más anillos, van madurando, desarrollándose los órganos sexuales masculinos y femeninos, para más adelante formar las proglotis grávidas repletas de huevos. Son estas últimas proglotis las que se desprenden y avanzan por el tránsito intestinal hasta salir al medioambiente a través del esfínter anal.
Por lo que, en el análisis macroscópico de las heces, a veces, nos podemos encontrar esas proglotis o anillos grávidos. El ritmo de eliminación de proglotis es variable y depende de la especie de cestodo y de la intensidad de parasitación. Por lo que hay que tener en cuenta, que no todos los días se desprenden proglotis y que si no las encontramos en las heces no podemos asegurar que no tenga cestodos.
Además, aunque la salida de las heces barre las proglotis que se encuentren en esa porción del intestino favoreciendo su expulsión, en ocasiones, también se puede producir la salida de estos anillos independientemente de las heces, ya que poseen movimiento propio, observándolos en la región perianal. Esto es frecuente cuando el animal está dormido en su cama o bien, cuando está sedado en el quirófano durante una cirugía.
En estos casos, o bien en la cama o cuando retiremos al animal de la mesa del quirófano, podemos observar la presencia de estos anillos en estas zonas.
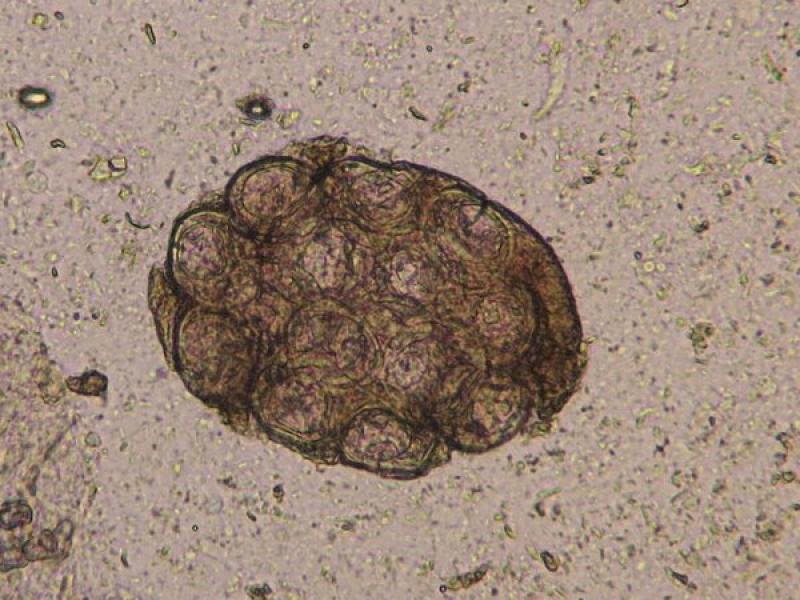
Estos anillos o proglotis grávidas suelen medir entre 1-2 cm y los que se encuentran con mayor frecuencia pertenecen a la familia Taenidae y a la familia Dipylididae, aunque en algunas ocasiones también se ha visto de la familia Mesocestoididae. Los anillos grávidos de estas familias son más alargados que anchos, y en su interior se puede visualizar un útero ramificado grávido con multitud de huevos esféricos en su interior en la familia Taenidae, mientras que en el caso de la Familia Dipylididae el útero es reemplazado por finas cápsulas ovígeras, con uno (Joyeuxiella o Diplopylidium) (Figura 3) o varios huevos en su interior (D. caninum).
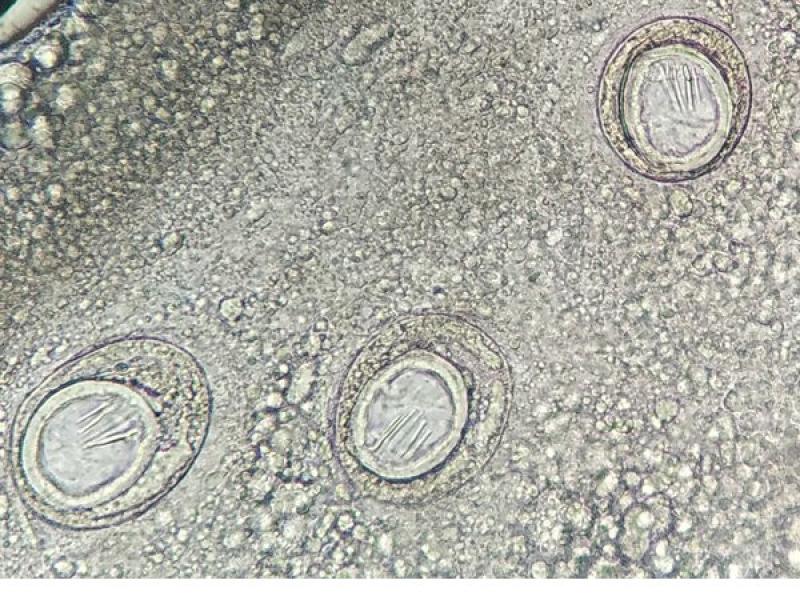
Los huevos de la familia Mesocestoididae son ligeramente ovalados de aproximadamente 27 a 35 μm de tamaño y se encuentran en los anillos grávidos en el interior del órgano parauterino, el cuál presenta unas paredes gruesas y no tiene abertura para la secreción al exterior, por eso estos huevos no se pueden observar en el análisis coprológico5- 7.
Es importante establecer un diagnóstico definitivo y determinar a que familia pertenecen estos anillos de cestodos para poder establecer un mejor tratamiento y control de la parasitosis, y evitar posibles reinfecciones, ya que en el caso de la Familia Taenidae se sabe que la infección se ha producido tras la ingestión de una presa o tejido de otro animal (p. ej., rumiante, cerdo, roedor, lagomorfo), mientras que en la familia Dipylididae, la infección va a depender del género; en el caso de Dipylidium (cuya especie es D. caninum) la infección se produce por la ingestión de pulgas (y a veces piojos), mientras que en los géneros Joyeuxiella y Diplopylidium, la infección se atribuye generalmente a la ingestión de pequeños reptiles aunque también se ha descrito la posible implicación de pequeños mamíferos y escarabajos coprófagos4, 6-9
Además, algunas de estas parasitosis pueden suponer un problema de salud pública, así el ser humano podría desarrollar una hidatidosis quística o alveolar tras la ingesta de heces contaminadas con huevos de Echinoccocus granulosus y E. multilocularis, respectivamente; y una cenurosis tras la ingestión de huevos de Taenia multiceps. Aunque Dipylidium caninum también se considera una potencial zoonosis, la infección en el ser humano (fundamentalmente en niños) es accidental tras la ingesta de pulgas y/o piojos4,10-12.
Por tanto, en caso de observar proglotis o anillos en las heces de perros y gatos debemos recogerlas y colocarlas en un portaobjetos. Posteriormente, con la ayuda de otro portaobjetos que colocaremos encima, las prensamos hasta que por transparencia podamos observar la morfología de los huevos que se encuentran en su interior (Figuras 4 y 5).
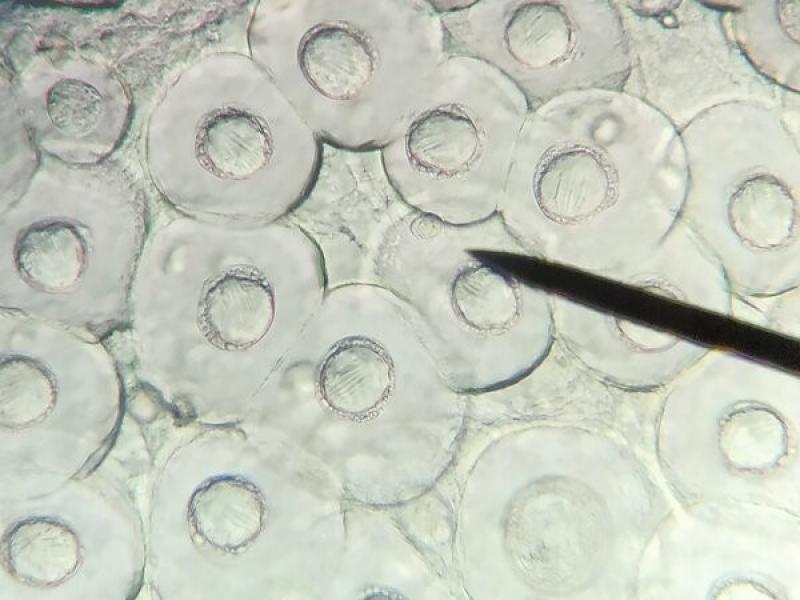
En el interior de los anillos grávidos de la Familia Taenidae podremos observar los huevos característicos de estos cestodos, mientras que los anillos de Dipylidium caninum así como los de Joyeuxiella spp, contienen cápsulas ovígeras microscópicas en su interior (Figura 5). No obstante, mientras que las cápsulas de D. caninum albergan entre cinco y treinta huevos cada una, las de Joyeuxiella spp. contienen un único huevo en el que se diferencia los tres pares de ganchos del embrión hexacanto u oncosfera (Figura 3).
Análisis microscópico
Tras la evaluación del análisis macroscópico, hay que realizar la observación microscópica que incluirá un análisis directo (principalmente indicado cuando las heces son diarreicas y no refrigeradas) seguido de técnicas de concentración.
Extensión directa de las heces
Tras la evaluación del análisis macroscópico, hay que realizar la observación microscópica directa de una extensión en fresco de heces, que consiste en suspender en un portaobjetos una pequeña cantidad de heces mezclada con una gota de agua o solución salina fisiológica.
Si las heces son diarreicas se puede tomar una pequeña cantidad con la mano enguantada y extenderlo directamente sobre el portaobjetos. A continuación, se coloca un cubreobjetos y se observa al microscopio óptico. Esta técnica resulta especialmente útil cuando se está eliminando una elevada carga de formas parásitas con las heces.
Durante la observación microscópica directa también podemos observar la presencia de bacterias en las heces, pudiendo así evaluar la carga bacteriana. Se aconseja realizar esta técnica con la muestra de heces fresca no refrigerada, ya que de esta forma podemos observar las formas parasitas más lábiles como los trofozoítos (Figuras 6 y 7).
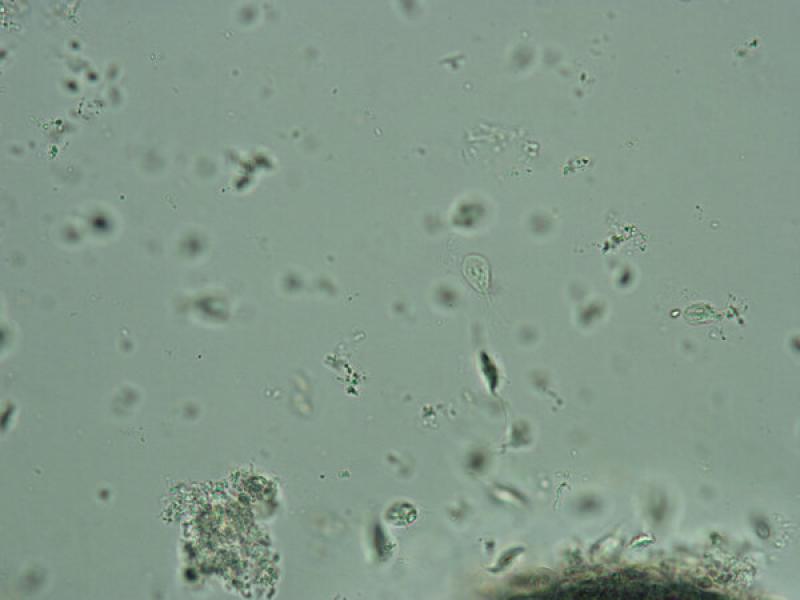
En caso de observar trofozoítos con forma piriforme, tenemos que diferenciar Giardia de otros protistas flagelados como las tricomonas. Los trofozoítos de Tritrichomonas foetus presentan una motilidad progresiva mientras que el movimiento de Giardia se asemeja al de una hoja cayendo al suelo. No obstante, la diferenciación de estos trofozoítos se debe realizar mediante otras técnicas de diagnóstico específicas.
Métodos de concentración
Los métodos de concentración incrementan la sensibilidad del análisis coprológico y se deben realizar con todas las muestras fecales seriadas. Todas las heces deben ser evaluadas mediante estos métodos de concentración, aunque el análisis macroscópico o extensión fecal directa haya sido positivo, ya que un animal puede tener una infección mixta por varios parásitos diferentes y algunos pueden ser eliminados con una menor carga parasitaria por lo que necesitamos técnicas de concentración, en las que utilizamos más cantidad de muestra, para aumentar así la sensibilidad del análisis coprológico y poder observarlas.
En carnívoros se utilizan las técnicas de Telemann modificado para la visualización de ooquistes de protistas y huevos de helmintos; la técnica de MIF (mertiolato-iodine-formalina) para la detección de los quistes de Giardia y la técnica de Baermann-Wetzel o migración larvaria para la detección de larvas de nematodos13.
Método de Telemann modificado
El método de Telemann modificado es una de las técnicas que se realiza de forma rutinaria en los análisis coprológicos de carnívoros, y conlleva una sedimentación y flotación. Para la realización de esta técnica es necesario concentrar las heces mediante la homogenización de 3-5 gr de heces con un volumen de 20 ml ácido acético (5%) y posterior filtrado por colador y doble gasa.
El filtrado se pasa a dos tubos de ensayo previamente rotulados. Se iguala el contenido de los dos tubos. De forma opcional a este filtrado se le puede añadir unos dos mililitros de éter no anestésico a cada tubo y agitar con cuidado. Este paso permite disgregar la grasa de las heces, lo cual resulta especialmente útil si las heces son esteatorreicas; sin embargo, el éter es una sustancia volátil, altamente inflamable por lo que este paso debe realizarse en una habitación con extractor o cabina de flujo laminar.
A continuación, ambos tubos se deben centrifugar durante 3-5 minutos a 1500 rpm. Una vez centrifugados los dos tubos, se debe eliminar el sobrenadante y homogeneizar el sedimento resultante.Uno de los tubos se utiliza para:
- Leer el sedimento: se deposita una gotita de sedimento sobre un portaobjetos, y se mezcla con una gota de agua. A continuación, se coloca un cubreobjetos y se lee en el microscopio.
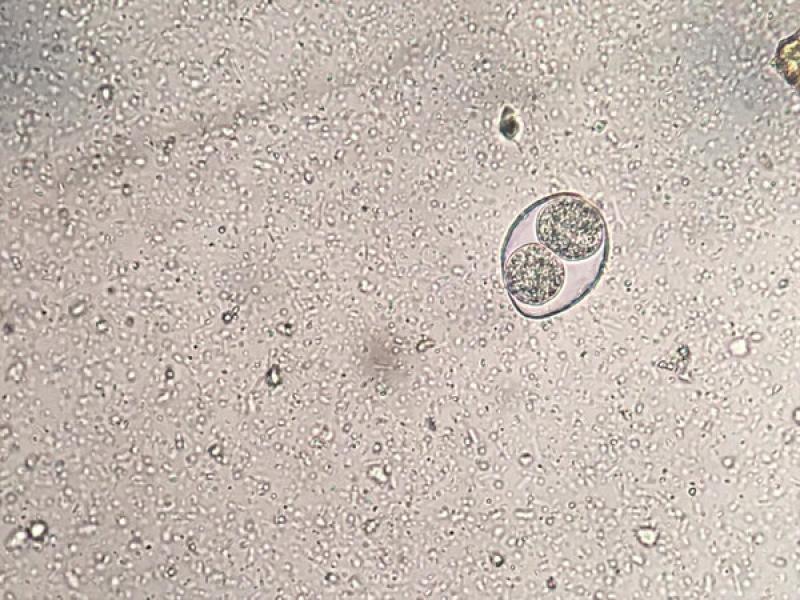
- Leer la flotación: se añade una solución densa (ej. sulfato de zinc, solución salina saturada) hasta crear un menisco en el tubo, se coloca un cubreobjetos y se deja flotar durante 15-20 min. Pasado este tiempo se retira el cubreobjetos, se pone sobre un portaobjetos y se procede a su lectura en el microscopio. Esta técnica de flotación resulta muy útil para la detección de ooquistes de coccidios (Figura 8).
El método de Telemann modificado permite la observación de las formas parasitas, pero este no es un método cuantitativo. Para cuantificar las formas parasitas se pueden realizar otras técnicas como el método de McMaster modificado para carnívoros o las técnicas de FLOTAC y Mini-FLOTAC.
Estas técnicas se realizan a partir del tubo del sedimento, una vez eliminado el sobrenadante. A este sedimento se le añade una solución de flotación y a continuación se rellena la cámara de mini-FLOTAC, FLOTAC o Mc Master según la técnica que se esté realizando14 y se procede a su lectura con el microscopio.
Para diferenciar las formas parasitarias y evitar confundirnos con artefactos debemos prestar especial atención a la morfología y al tamaño de las mismas15. La medición precisa de las etapas de diagnóstico de los parásitos requiere la calibración del microscopio, para ello se necesitan dos escalas: una en el micrométrico en el ocular del microscopio que es un disco de vidrio con una escala de 50 a 100 divisiones y el micrómetro de la platina. La mayoría de los microscopios con oculares de x10 tendrán factores de conversión similares o aproximados a los que se indican a continuación:
- Objetivo X4 = cada línea de la regleta equivale a 25 µm
- Objetivo X10 = cada línea de la regleta equivale a 10 µm
- Objetivo X40 = cada línea de la regleta equivale a 2,5 µm
- Objetivo X100 = cada línea de la regleta equivale a 1 µm
Las formas parásitas que se detectan con mayor frecuencia mediante el método Telemann modificado son:
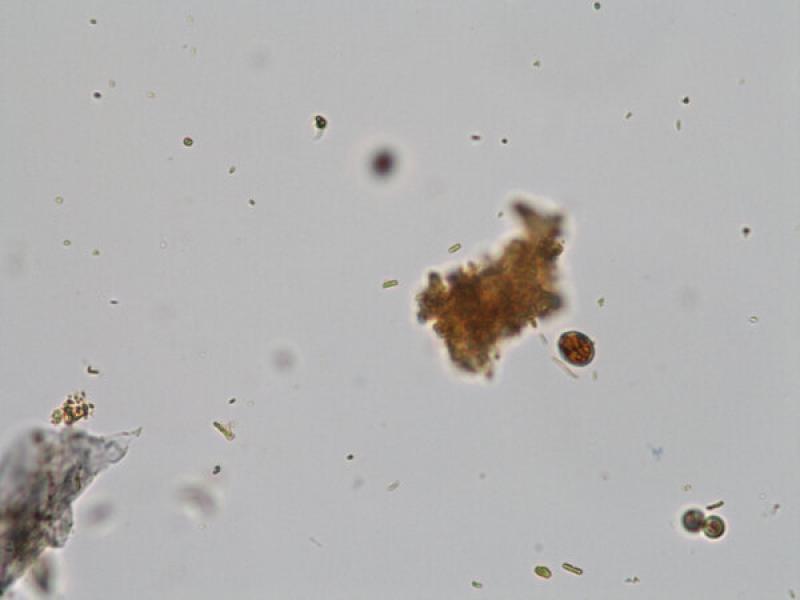
- Ooquistes de Cystoisospora sp.: son ovoides o subesféricos, transparentes y con una cubierta fina. Los ooquistes de Cystoisospora salen con las heces sin esporular por lo que en su interior visualizaremos una única célula. No obstante, si las heces no son recientes, pueden esporular en el medio y encontrar ooquistes esporulados con dos esporoquistes que contienen cuatro esporozoitos cada uno en su interior (Figura 8). Los ooquistes de C. canis y C. felis son más grandes y miden entre 30-40 x 28-32μm y 38-51 x 27-29μm respectivamente, mientras que el tamaño de los ooquistes de C. rivolta, C. ohiensis, C. burrowsi y C. neorivolta es más pequeño y el tamaño es de 20-27 x 15- 24 μm.
- Existen otros ooquistes de tamaño inferior (9-11 x 11-13 μm) a los del género Cystoisospora, son los ooquistes de Toxoplasma gondii, Neospora caninum, Hammondia spp. y Besnoitia sp., siendo necesario la diferenciación mediante técnicas de esporulación in vitro o técnicas de diagnóstico molecular.
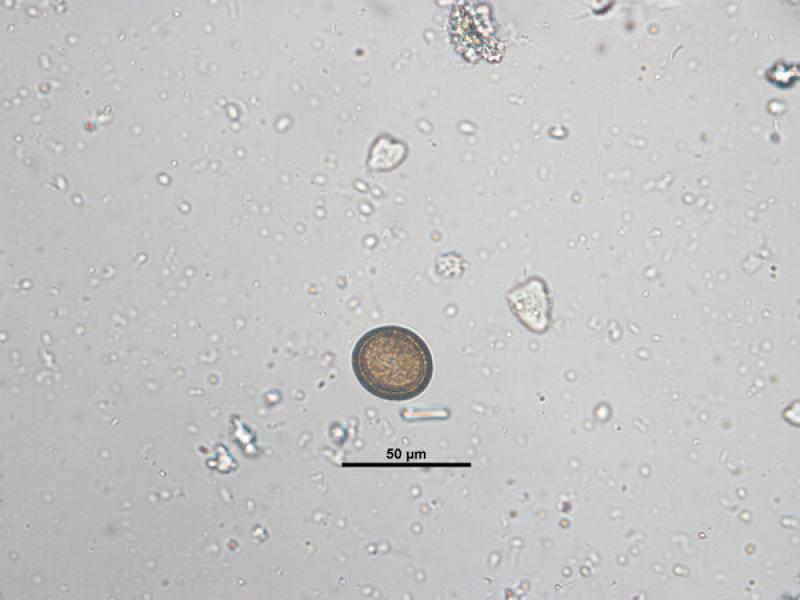
- Huevos de la familia Taenidae (37 x 30 μm), los huevos del género Taenia y del género Echinococcus son morfológicamente indistinguibles, se caracterizan por ser esféricos con una cubierta gruesa (embrióforo) de color marrón formada por la unión de 54 células poligonales unidas por una sustancia proteica que confiere protección al embrión hexacanto u oncosfera que hay en su interior (Figura 9).
- Cápsulas ovígeras (120-200 μm) y huevos de la familia Dipylididae (45x45 μm). Cómo describimos en el apartado 1 al examinar las proglotis grávidas, las cápsulas ovígeras de Dipylidium caninum presentan grupos de huevos en su interior, mientras que en los géneros Joyeuxiella y Diplopylidium sólo hay un huevo en cada cápsula. Los huevos que hay dentro de las cápsulas son similares a los de la familia Taenidae con un embrión hexacanto en su interior, aunque su cubierta es transparente (Figura 10).
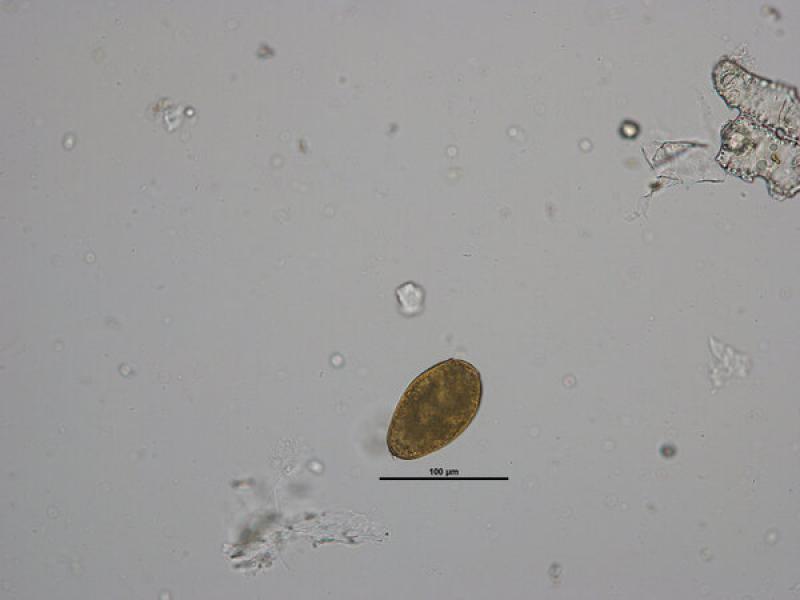
- Huevos de Toxocara canis/ cati (75-80 x 65-70 μm), presentan una forma subesférica con una cubierta gruesa y rugosa de color amarillo parduzco. En su interior en el momento de ser excretados con las heces presentan una única célula sin dividir que ocupa toda la cavidad del huevo (Figura 11 y 12).
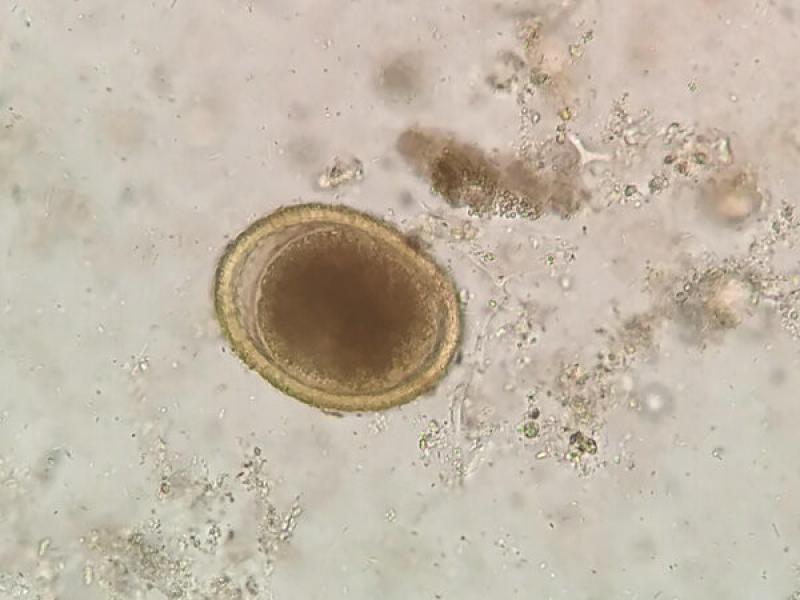
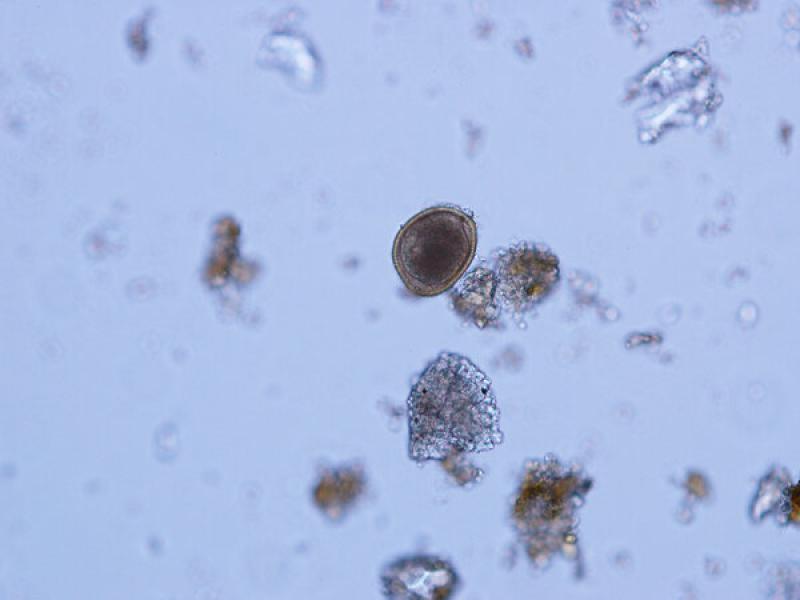
- Huevos de Toxascaris leonina son huevos subesféricos con una cubierta lisa y brillante (80 x 70 μm). La célula que se encuentra en su interior en el momento de la puesta deja una porción libre en el interior de la cámara del huevo, aunque debido al rápido desarrollo de estos huevos es frecuente observarlos en división celular a pesar de que las heces sean recientes (Figuras 13, 14 y 15).
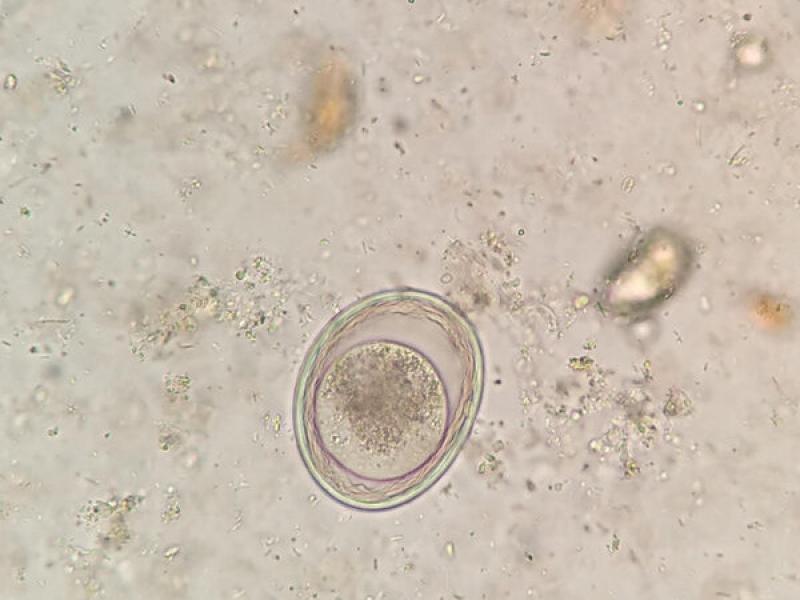
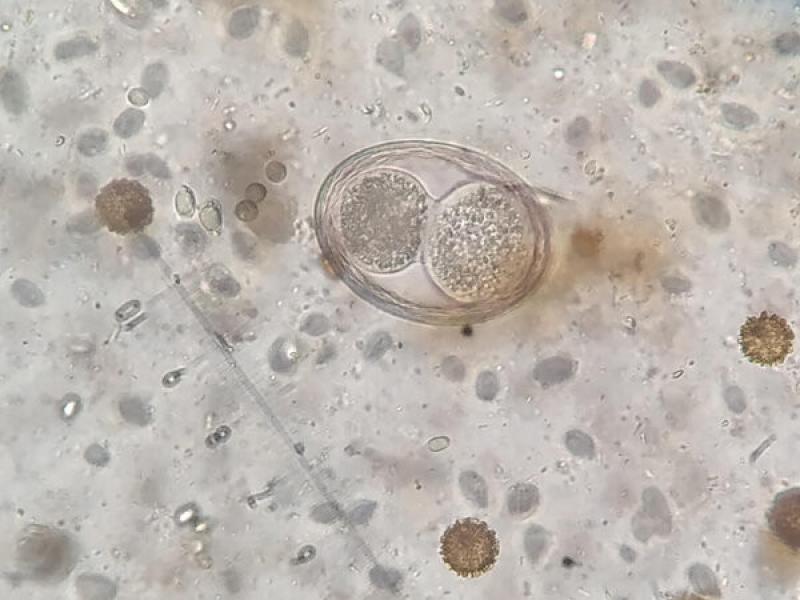
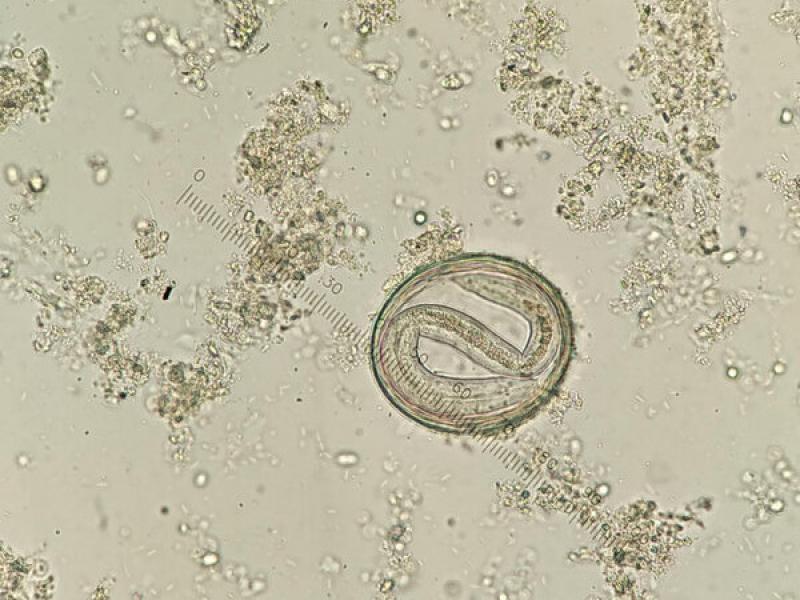
- Huevos de ancilostómidos (60-70 x 40-45 μm), presentan una forma ovoide con una cubierta fina y uniforme. En el momento de la puesta presentan blastómeros en su interior, pero si las heces no son recientes podremos observar una larva en su interior (Figura 16).
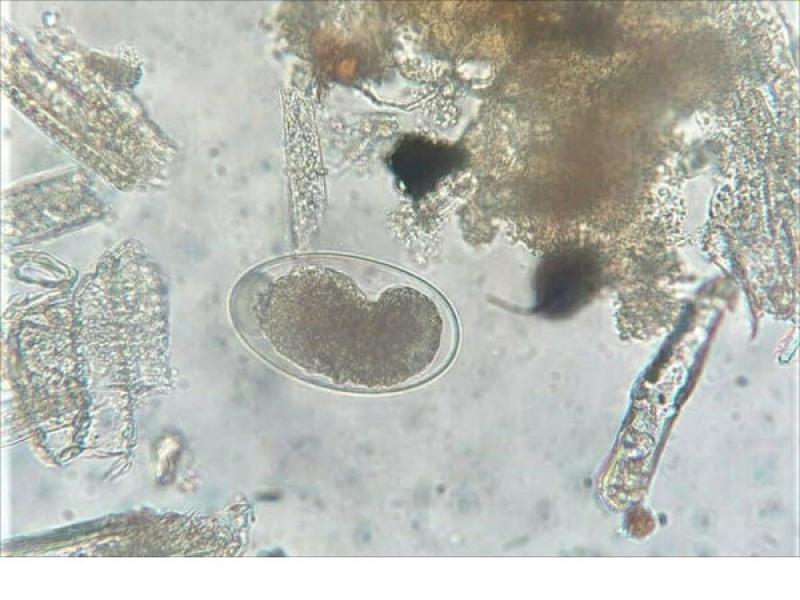
- Huevos de Trichuris vulpis (70-80 x 30 µm), son de color marrón, tienen forma de limón con tapones polares hialinos en los extremos, una cubierta gruesa y el contenido es granular, sin blastómeros en su interior (Figura 17).
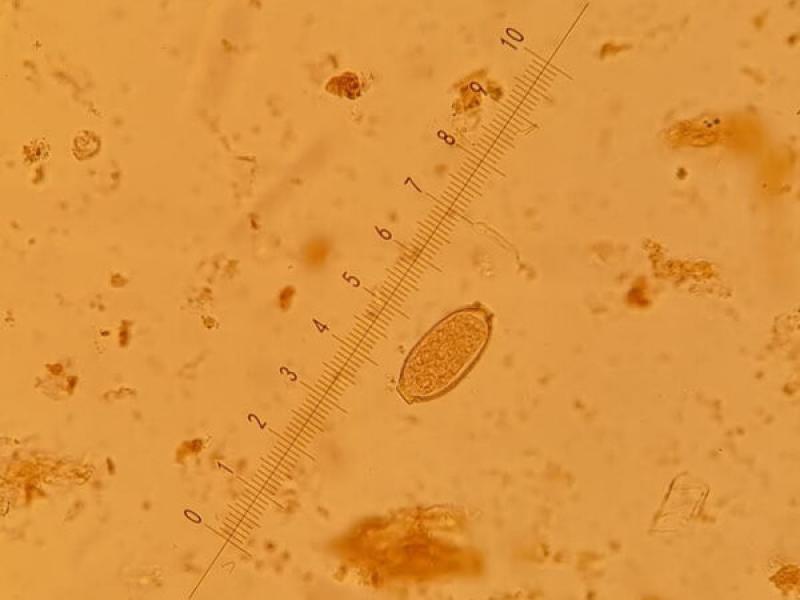
- Huevos de Capilaria aerophila (70 x 35 μm), son huevos parecidos a los de T. vulpis, con dos tapones hialinos en sus extremos, pero algo más achatados por los polos y con la cubierta ligeramente rugosa (Figura 18).
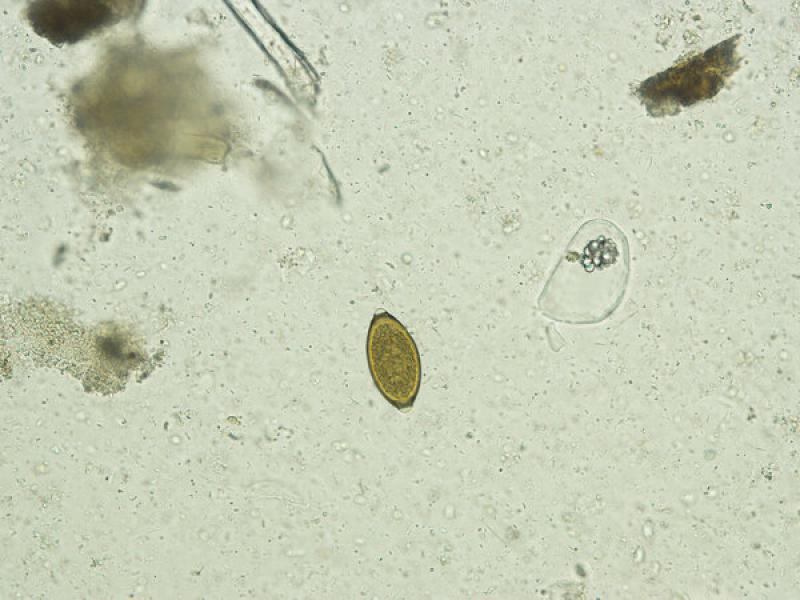
- Huevos de Strongyloides stercoralis (40-55 x 20-35 µm), son de forma ovalada y con cubierta fina y contienen una larva en su interior, sin embargo, la eclosión de las larvas ocurre en pocas horas por lo que se recomienda realizar métodos de concentración de larvas como la técnica de Baermann-Wetzel para recuperar las L1 y su identificación posterior.
Las formas parásitas descritas anteriormente son las que se observan habitualmente tras realizar un análisis coprológico a perros y gatos que se encuentran en nuestras latitudes. Sin embargo, debemos tener en cuenta que también se pueden observar la presencia de otras formas parásitas como por ejemplo huevos de Alaria alata, Diphylobotrium latum, Opistorchis tenuicollis y Spirocerca lupi (Figura 19).
Método de MIF
La técnica de MIF (Mertiolato-Iodine-Formalina) está indicada para la detección de quistes y trofozoítos de G. duodenalis (Figuras 18 y 19). Para ello, al sedimento del tubo resultante del apartado 2.2.1. o bien a un gramo de heces diarreicas se le añade la solución de MIF (4 ml de MIF A: 52% de agua destilada, 42% de thimerosal a dilución 1:1000, 5% de formaldehido y 1% de glicerina y 1 ml de MIF B: 87% de agua destilada, 9% de ioduro potásico y 4% de cristales de yodo).
Una vez añadidas ambas diluciones se homogeniza y tras reposar entre 6 y 24 horas se produce la sedimentación de las partículas más pesadas, quedando en el tubo de ensayo un sedimento y sobrenadante. A continuación, con ayuda de una pipeta Pasteur se obtiene una pequeña cantidad de muestra de la interfase, y se observa al microscopio entre porta y cubreobjetos14.
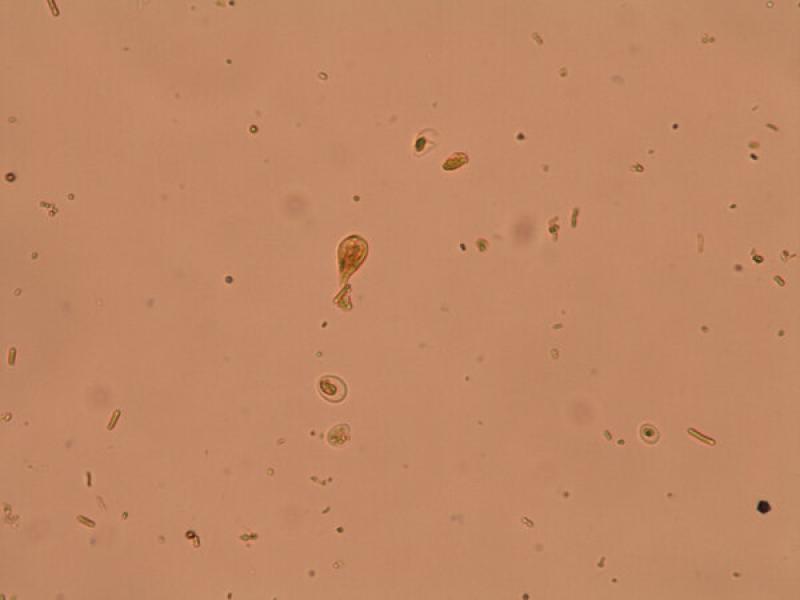
Los quistes de Giardia duodenalis (8-15 x 7-10 μm) son ovoides y presentan cuatro núcleos en su interior y una pared lisa y robusta que los protege del exterior. Aunque los quistes son la forma de resistencia y por lo tanto la forma que suele salir con las heces, en ocasiones, sobre todo en heces diarreicas, podemos observar trofozoítos. Los trofozoítos (9-21 x 5-12 μm) son piriformes con dos núcleos, un disco suctor y ocho flagelos; dos anteriores, dos posteriores y dos a cada lado. El método de MIF facilita la observación tanto de los quistes como de los trofozoítos tiñéndolos de un color amarillo anaranjado (Figuras 20 y 21).
Método de Baermann-Wetzel o migración larvaria
La técnica de Baermann-Wetzel o migración larvaria es el método de elección utilizado para la detección de larvas de nematodos pulmonares14. Para la realización de la técnica se necesita una cantidad mínima de muestra de 2-10 gramos de heces.
Esta muestra se deposita en un filtro compuesto por cuatro gasas superpuestas, anudadas a modo de bolsa y en suspensión dentro de un embudo. En el extremo final del embudo se coloca una pinza y se llena de agua tibia, de manera que la muestra de heces esté en contacto con el agua. Por último, se añade una gota de solución jabonosa para romper la tensión superficial y se deja en reposo durante 24 horas.
Pasado este tiempo se retira la pinza del embudo, recogiendo los primeros 10 ml de agua en un tubo de ensayo. El tubo se centrifuga a 1500 rpm durante 10 minutos, y a continuación se desecha el sobrenadante. Posteriormente, se añade una gota de lugol o de la solución MIF B al sedimento con el objetivo de matar y teñir las posibles larvas facilitando así su identificación. Se deposita una gota del sedimento teñido entre porta y cubreobjetos, procediendo a su visualización en el microscopio.
En las heces procedentes de perro podemos detectar larvas pulmonares de Angiostrongylus varorum, Crenosoma vulpis y Oslerus osleri. Mientras que en las heces de gato las larvas pulmonares que se pueden observar son de Aelurostrongylus abstrusus, Trogostrongylus spp. y Oslerus rostratus. Además, tanto en felinos como en cánidos podemos observar las larvas de primer estadio de Strongyloides stercoralis, siendo por lo tanto este método de migración larvaria el análisis coprológico de elección para la observación de este parásito.
Las larvas de primer estadio de cada uno de los agentes etiológicos presentan las siguientes características:
- Angiostrongylus vasorum miden entre 310-390 μm de largo y 15 μm de ancho, con un botón cefálico en la parte anterior y en la parte dorsal de la cola también presentan una muesca prominente y una espina, así como una muesca menos prominente en su parte ventral (Figura 22).
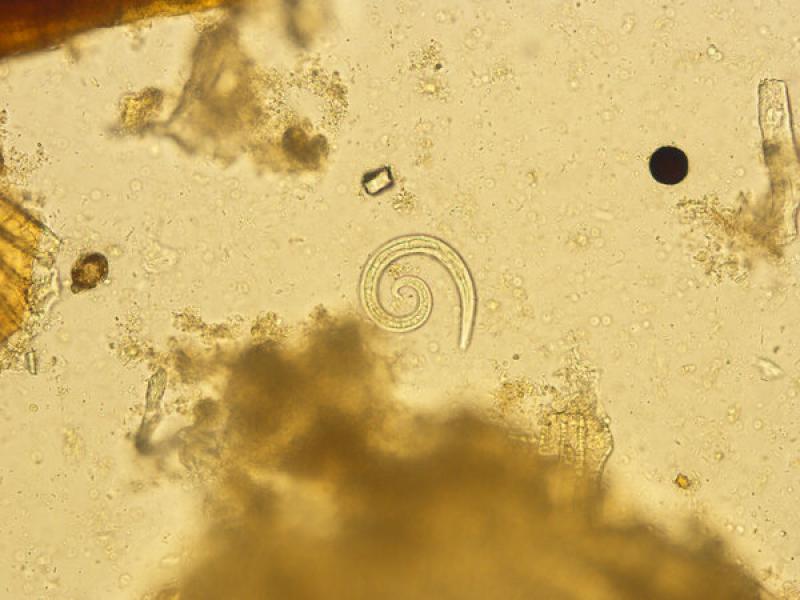
- Crenosoma vulpis mide unos 240-340 µm y 16-22 µm de ancho, la boca se abre de forma oblicua en el extremo anterior y presenta un esófago filiforme y un botón cefálico muy llamativo en su parte anterior y la cola finaliza en forma acuminada16.
- Oslerus (Filaroides) osleri mide 233-267μm de largo, presenta un esófago largo (1/2 longitud del cuerpo) y un pliegue distintivo antes de la punta de la cola17,18.
- Aelurostrongylus abstrusus miden 300-390 μm y el extremo distal está enroscado en forma de uña con una pequeña espícula dorsal2.
- Trogostrongylus spp. miden entre 269-357 μm, según la especie implicada, con botón cefálico, esófago rabditoide y una cola puntiaguda con una espina dorsal cuticular y una ventral típicas18,19.
- Oslerus rostratus (330–410 μm) con apertura bucal central rodeada por un anillo cuticular con prominencias dorsal y ventral. El extremo distal presente una constricción anterior al final y la punta con una apariencia retorcida18.
- Las larvas 1 de Strongyloides stercoralis miden 180-380 μm de largo y 14-20 μm de ancho, presentan un canal bucal corto, un esófago rabditiforme que se extiende 1/3 de la longitud del cuerpo, y un primordio genital prominente. Sin embargo, estas larvas evolucionan rápidamente y si las heces tienen más de 48 horas ya se puede observar la larva de tercer estadio que mide 490-630 mm de longitud y 16 μm de ancho, y presenta un esófago filariforme con una proporción respecto al intestino de 1:1 y un extremo distal en el que se observa una hendidura o ranura característica20,21.
Aunque la técnica de Baermann se considera el actual gold standard para el diagnóstico de la infección por vermes pulmonares, presenta limitaciones: el procedimiento requiere 12-24 horas y personal cualificado, y solo se puede realizar en heces frescas (difícil en gatos con acceso al exterior). Además, no detecta infecciones en el periodo de prepatencia y cuando no hay eliminación de larvas. La excreción de larvas puede ser intermitente; por lo que los métodos de diagnóstico serológicos pueden ser de gran utilidad22.
Otras técnicas de diagnóstico
Tinciones específicas
Los métodos de diagnóstico coprológico convencionales (método de sedimentación y flotación) que se suelen emplear para la detección de otros parásitos, no resultan útiles en el diagnóstico de la criptosporidiosis ya que el tamaño pequeño de los ooquistes (4-5 μm) dificulta su visualización y resulta fácil confundirlos con levaduras.
Existen técnicas de tinción que facilitan su identificación, son técnicas de bajo coste y fáciles de realizar, pero presentan el inconveniente de poseer una baja sensibilidad23. La técnica de tinción indicada es la de Ziehl-Neelsen, mediante la cual los ooquistes se tiñen de rosa fucsia sobre un fondo verde. Existen otras técnicas como la tinción de Heine, donde los ooquistes aparecen como formas esféricas perladas de gran refringencia al microscopio óptico2.
Inmunodiagnóstico
Las técnicas de inmundiagnóstico basadas en la unión de antígeno con anticuerpos se utilizan en el diagnóstico de las diferentes enfermedades parasitarias. En el caso de los análisis coprológicos estás técnicas se utilizan de forma rutinaria para la detección de ooquistes de Cryptosporidium spp. y quistes y trofozoítos de
Las técnicas inmunológicas que se utilizan con mayor frecuencia en la clínica veterinaria es la técnica de inmunocromatografía comercial rápida para la detección de Cryptosporidium spp. y G. duodenalis, esta técnica presenta la ventaja de ofrecer un diagnóstico rápido y poder realizarse por personal no especializado, sin embargo, en casos dudosos los resultados deberían confirmarse por otras técnicas de mayor sensibilidad como la PCR e IFD24-26.
Las recomendaciones de la Companion Animal Parasite Council (CAPC, www.capcvet.org), fuente de guías de control de enfermedades parasitarias en Estados Unidos, indican que la flotación con centrifugación debería usarse junto con una técnica de inmunodiagnóstico para aumentar la sensibilidad en el diagnóstico de infecciones por G. duodenalis en veterinaria. Por lo tanto, cuando se sospecha de infección por G. duodenalis, es altamente recomendable realizar más de una técnica diagnóstica25-26.
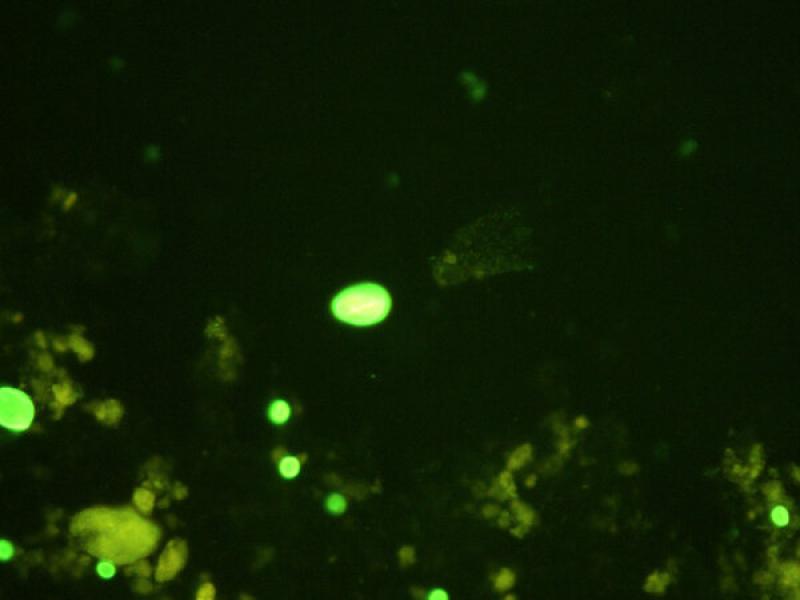
La técnica de inmunofluorescencia directa (IFD) se considera la técnica de elección para el diagnóstico de Giardia; se realiza utilizando anticuerpos monoclonales marcados con isotiocianato de fluoresceína específicos frente a la pared de los quistes de G. duodenalis y ooquistes de Cryptosporidium presentes en la muestra de heces; por lo que si la muestra es positiva las formas parásitas se verán de color verde fluorescente tras su examen bajo el microscopio de fluorescencia (Figura 23). Esta técnica es sencilla, pero debe realizarse en laboratorios especializados que dispongan de microscopio de fluorescencia.
Otras técnicas inmunológicas que se utilizan son las técnicas serológicas que permiten la detección de antígenos y anticuerpos de algunos parásitos como en el caso de Angiostrongylus vasorum, habiéndose observado una buena sensibilidad y elevada especificidad (la detección de anticuerpos indica exposición al parásito mientras que la detección de antígeno circulante indica infección actual).
Sin embargo, es necesario una correcta interpretación de los resultados ya que los anticuerpos frente a A. vasorum pueden detectarse a partir de las tres semanas post-infección mientras que el antígeno no es detectable hasta cinco semanas post-infección. Y, una vez tratado el animal, la detección de antígeno será negativa a los 16-34 días post-tratamiento, mientras que los anticuerpos persisten hasta el día 63 post-tratamiento27.
Cultivo celular
Las técnicas de cultivo resultan especialmente útiles para la detección de T. foetus que se puede aislar en medios de cultivo específicos o comerciales (InPouch TF-feline®, Biomed Diagnostics), en los que no crecen otros protozoos como Giardia, permitiendo su diferenciación28-29.
Diagnóstico molecular
La técnica de amplificación de ADN por la reacción en cadena de la polimerasa (Polimerase Chain Reaction o PCR) está siendo utilizada para el diagnóstico de enfermedades parasitarias en las que el aislamiento del patógeno resulta complicado.
Dado el potencial de la PCR se han desarrollado variantes como la PCR anidada o nested- PCR y PCR en tiempo real. Así mismo, otras técnicas de diagnóstico molecular como la técnica de PCR-RFLP (o la secuenciación) permiten la caracterización de los aislados.
Estás técnicas de diagnóstico molecular incrementan la sensibilidad del diagnóstico, y suelen utilizarse de forma rutinaria para el diagnóstico de la infección por Tritrichomonas foetus.
Además, en el diagnóstico de otras protozoosis digestivas, estas técnicas, permiten identificar la especie, e incluso caracterizar el aislado, lo cual resulta muy útil en estudios epidemiológicos que permiten la caracterización de los diferentes aislados como en el caso de Cryptosporidium y Giardia, mientras que con el resto de las técnicas de diagnóstico descritas anteriormente no pueden diferenciarse. Sin embargo, en la actualidad, en medicina veterinaria su utilización se limita a estudios para determinar los diferentes genotipos que existen y que pueden ser compartidos entre los seres humanos y los animales.
Así, se ha demostrado que existen diferentes genotipos de Giardia duodenalis, que tienen afinidad por distintos hospedadores. Los genotipos A y B se encuentran frecuentemente en el ser humano, pero también se han detectado en otros animales (entre ellos perros y gatos), mientras que los genotipos C y D son específicos de los cánidos; el genotipo E en animales de abasto, y el genotipo F en gatos, G en roedores y el H, en mamíferos marinos30-32.
Las técnicas de diagnóstico molecular también resultan de gran utilidad para la detección de otros protozoos como Neospora caninum en perros y Toxoplasma gondii en gatos.
Las técnicas de diagnóstico molecular también resultan de gran utilidad para la detección de otros protozoos como Neospora caninum en perros y gatos.
En el diagnóstico de las helmintosis, las técnicas de diagnóstico molecular permiten el diagnóstico de Strongyloides stercoralis, así como la diferenciación de especies del Gº Echinococcus y Gº Taenia. Además, en los últimos años se han desarrollado técnicas de biología molecular para el diagnóstico de nematodosis pulmonares como la aelurostrongilosis en gatos, pudiéndose detectar la presencia del parásito en muestras fecales así como hisopos faríngeos, siendo esta última la muestra de elección puesto22. En el caso de Angiostrongylus vasorum en perros, las técnicas de diagnóstico molecular se han optimizado y pueden realizarse en tejido (pulmón, cerebro), sangre, lavado traqueal y bronco alveolar (BAL) y heces.
Un resultado de PCR positivo en sangre es un indicador temprano de infección, aunque presenta baja sensibilidad, por lo que en estos casos se recomienda realizar conjuntamente la técnica de ELISA para la detección de antígenos circulantes. Y, en aquellos casos en los que el cuadro clínico del animal indique una infección por A. vasorum pero las técnica de Baermann y detección de antígenos sean negativos, está altamente recomendado realizar otras técnicas como la detección de anticuerpos o PCR33.
Bibliografía
- McNamara J, Drake J, Wiseman S, Wright I. 2018. Survey of European pet owners quantifying endoparasitic infection risk and implications for deworming recommendations. Parasit Vectors. 1;11(1):571.
- Miró G, Gálvez R, Montoya A, Delgado B, Drake J. 2020. Survey of Spanish pet owners about endoparasite infection risk and deworming frequencies. Parasites Vectors. 26;13(1):101.
- Purina 2020. https://www.purina.co.uk/dogs/health-and-nutrition/symptoms-to-watch-out-for/guide-to-dog-poop
- Deplazes P, Eckert J, Mathis A, von Samson-Himmelstjerna G, Zahner H. Parasitology in Veterinary Medicine. 2016. Wageningen Academic Publishers.
- Saari S, Näreaho A, Nikander S. 2019. Canine parasites and parasitic diseases. Academic Press Elsevier.
- Matevosyan EM. 1963. Principles of Cestodology. Vol. III. Dilepidoidea, Tapeworms of Domestic and Wild Animals. Moscow, USSR: Izdatel’stvo Akademii Nauk SSSR, 687 pp.
- Khalil LF, Jones A, Bray RA. 1994. Keys to the cestodes parasites of vertebrates. International Institute of Parasitology an Institute of CAB INTERNATIONAL.
- Schuster RK, Montag A. 2000. Joyeuxiella pasqualei - An unusual tapeworm in an indigenous domestic cat. Kleintierpraxis. 45:867-70.
- Schuster RK. Thomas K, Sivakumar S, O'donovan D. 2009. The parasite fauna of stray domestic cats (Felis catus) in Dubai, United Arab Emirates. Parasitol, Res, 105: 125-134.
- Bartsocas CS, von Graevenitz A, Blodgett F. 1966. Dipylidium infection in a 6-month-old infant. J Pediatr., 69(5):814-5.
- Neira OP, Jofré ML, Muñoz SN. 2009. Dipylidium caninum infection in a 2 year old infant: case report and literature review. Rev Chilena Infectol., 25(6):465-71.
- Cabello RR, Ruiz AC, Feregrino RR, Romero LC, Feregrino RR, Zavala JT. 2011. Dipylidium caninum infection. BMJ Case Rep.
- Thienpont D, Rochette F, Vanparijs F., 1979. Diagnostic de verminose par examen coprologique. Beerse: Janssen Research Foundation, p 205.
- Cringoli G, Rinaldi L, Albonico M, Bergquist R, Utzinger J., 2013. Geospatial(s) tools: integration of advanced epidemiological sampling and novel diagnostics. Geospat Health (2):399-404.
- Foreyt, W. Vetrinary parasitology. 2001. Reference manual. 5ª Edition. Iowa State University Press. Blackwell publishing
- Zajac AM, Conboy GA. Chapter 1. In: Veterinary clinical parasitology. 7th Edition. Ames (IA): Blackwell; 2006. p. 3–148.
- Urquhart GM, Jarrett FH, O’Sullivan JG. Canine tracheo-bronchitis due to infection with Filaroides osleri. Vet Rec 1954;66:143–5.
- Skiszel S, Mónika Gyurkovszky M , Solymosi N, Farkas R. 2019. Survey of lungworm infection of domestic cats In Hungary. Acta Veterinaria Hungarica 67 (3), pp. 407–417
- Brianti E, Gaglio G, Giannetto, S. et al. Troglostrongylus brevior and Troglostrongylus subcrenatus (Strongylida: Crenosomatidae) as agents of broncho-pulmonary infestation in domestic cats. Parasites Vectors 5, 178 (2012).
- Ash LR, Orihel T. 2007. Atlas de parasitología humana. Editorial Medica Panamericana.
- Martínez-Vázquez C, González Mediero G, Núñez M, Pérez S, García-Fernández J.M, Gimena B. 2003. Strongyloides stercoralis en el sur de Galicia. An. Med. Interna (Madrid) vol.20 no.9
- Elsheikha HM, Schnyder M, Traversa D, Di Cesare A, Wright I, Lacher DW. 2016. Parasites Vectors 9:389
- Ramírez NE, Ward LA, Sreevatsan S. 2004. A review of the biology and epidemiology of cryptosporidiosis in humans and animals. Microbes Infect 6, 773-785.
- Gutiérrez-Cisneros MJ, Martínez-Ruiz R, Subirats M, Merino FJ, Millán R, Fuentes I. [Assessment of two commercially available immunochromatographic assays for a rapid diagnosis of Giardia duodenalis and Cryptosporidium spp. in human fecal specimens]. Enferm Infecc Microbiol Clin. 2011 Mar;29(3):201-3. doi: 10.1016/j.eimc.2010.09.005. Epub 2011
- Uiterwijk M, Rolf Nijsse R, Kooyman F.N.J, Wagenaar J.A, Mughini-Gras L, et al. 2018. Comparing four diagnostic tests for Giardia duodenalis in dogs using latent class analysis. Parasites Vectors. 11:439
- Saleh MN, Heptinstall JR, Eileen M, Johnson EM, Ballweber LR, Lindsay DS, et al. 2019. Comparison of diagnostic techniques for detection of Giardia duodenalis in dogs and cats J Vet Intern Med. 33:1272-1277
- Di Cesare A and Traversa D. 2014. Canine angiostrongylosis: recent advances in diagnosis, prevention, and treatment. Veterinary Medicine: Research and Reports :5 181-192
- Gookin JL, Foster DM, Poore MF, Stebbins ME, Levy MG. 2003. Use of a commercially available culture system for diagnosis of Tritrichomonas foetus infection in cats. J Am Vet Med Assoc. 15;222(10):1376-9.
- Bastos BF, de Almeida FM, Brener B. 2019. What is known about Tritrichomonas foetus infection in cats? Rev. Bras. Parasitol. Vet. 28(1):1-11.
- Caccio SM, Beck R, Lalle M, Marinculic A, Pozio E. 2008. Multilocus genotyping of Giardia duodenalis reveals striking differences between assemblages A and B. Int J Parasitol.
- Monis PT, Thompson RC. 2003. Cryptosporidium and Giardia-zoonoses: fact or fiction? Infect Genet Evol 3, 233-244.
- Yang R, Lee J, Ng J, Ryan U. 2009. High prevalence Giardia duodenalis assemblage B and potentially zoonotic subtypes in sporadic human cases in Western Australia. Int J Parasitol.
- Morgane Canonne A, Billen F, Losson B, Peters I, Schnyder M, Clercx C. 2018. Angiostrongylosis in dogs with negative fecal and in-clinic rapid serological tests: 7 Cases (2013-2017). J Vet Intern Med. 32:951-955
 by Multimédica
by Multimédica