Los análisis coprológicos como piedra angular de la desparasitación equina
Resumen breve
La distribución cosmopolita de los endoparásitos digestivos y sus posibles consecuencias clínicas en los équidos, hacen que sea imprescindible establecer medidas de control que permitan disminuir su presencia.Sin embargo, para realizar un control antiparasitario correcto, es imprescindible conocer qué agentes etiológicos están presentes en cada explotación, y más aún, en cada uno de sus équidos.
Índice de contenidos
Resumen
La distribución cosmopolita de los endoparásitos digestivos y sus posibles consecuencias clínicas en los équidos, hacen que sea imprescindible establecer medidas de control que permitan disminuir su presencia.
Sin embargo, para realizar un control antiparasitario correcto, es imprescindible conocer qué agentes etiológicos están presentes en cada explotación, y más aún, en cada uno de sus équidos.
Los métodos coprológicos son técnicas muy eficaces para la detección e identificación de estos parásitos. De hecho, el McMaster modificado que se utiliza como técnica coprológica de rutina para la detección de endoparásitos digestivos en los caballos permite la detección de la mayoría de los parásitos equinos, aunque en ocasiones el uso de otras técnicas como la flotación simple o la copa de sedimentación entre otras, es necesario.
Este trabajo, se realizó recogiendo y analizando muestras fecales de caballos Pura Raza Árabe o cruce con distintas técnicas coprológicas de una explotación de cría de Cáceres. Además, se desarrolló un programa de control selectivo valorando la eficacia de los tratamientos antihelmínticos utilizados.
Los resultados confirmaron la utilidad del método coprológico rutinario realizado individualmente para la detección de endoparásitos digestivos y la implantación de un control selectivo, si es preciso, analizando los resultados laboratoriales.
Introducción
Los caballos pueden verse afectados por distintos endoparásitos digestivos, incluyéndose bajo esta denominación cualquier parásito que, atravesando el sistema digestivo y en patencia, puede detectarse mediante técnicas coprológicas.
De toda la población parásita que puede albergar un caballo en su digestivo, los denominados estrongilados o estrongílidos representan más del 75%1 y, dentro de ellos, los ciatostominos son los más incidentes.
Estos ciatostominos, son capaces de producir signos clínicos que varían desde pérdida de la condición corporal, diarreas crónicas a cuadros de ciatostominosis larvaria, donde el 50% de los équidos que lo sufren acaban muriendo2. Debido a su distribución cosmopolita y su poder patógeno, el control antiparasitario actual en équidos se basa en su control3.
Sin embargo, otros helmintos digestivos se detectan también con bastante frecuencia en équidos, aunque su incidencia es menor que la de los estrongilados. Dentro de estos parásitos cabe destacar a Parascaris equorum, Parascaris univalens y Oxyuris equi4.
Para la detección de estos parásitos, en caballos, la técnica coprológica rutinaria, es el McMaster modificado que permite la cuantificación de las formas parásitas en las heces, también denominada carga parasitaria. Aunque actualmente, existen otros métodos para la detección y cuantificación de parásitos en heces, como pueden ser: el miniFLOTAC, el FECPAK, inicialmente desarrollado para rumiantes5 o incluso, métodos automatizados que utilizan un smartphone capaz de calcular cargas parasitarias mediante un algoritmo que analiza la presencia de estrongilados realizando mediciones de partículas presentes en la muestra6.

Debido a que la sensibilidad de ningún método coprológico es del 100% y que distintos factores dependientes del hospedador y del medio ambiente hacen variables las excreciones de formas parásitas en las heces, se deben realizar coprologías individuales a los caballos de cada explotación equina que se desee controlar.
En este trabajo, se han analizado los resultados coprológicos obtenidos de 22 caballos muestreados individual y mensualmente, que permanecían en régimen extensivo en una zona de dehesa con clima de tipo mediterráneo de la provincia de Cáceres.
Como métodos coprológicos se utilizaron siempre, el análisis macroscópico, el McMaster modificado y la flotación simple, además se realizaron un coprocultivo y migración larvaria para identificación de estrongilados presentes en la explotación equina.
Para concluir con la importancia de la coprología en el control de endoparásitos digestivos y en particular, su relevancia en el control selectivo, que es el que se recomienda para control de estrongilados, en la actualidad.
De hecho, tras constatar la presencia de estrongilados, se realizó un plan de desparasitación con los principios activos que con más frecuencia se utilizan en el control antiparasitario en équidos verificando la eficacia de los tratamientos utilizando la coprología como método diagnóstico.
Material y Métodos
Para la realización del estudio, se llevaron a cabo un total de 6 recogidas de muestras fecales mensualmente, entre octubre de 2019 y marzo del 2020 en una explotación equina localizada en una zona de dehesa de clima mediterráneo en la provincia de Cáceres.
Un total de 22 équidos formaron parte del estudio. De ellos, 12, fueron animales jóvenes y 10 adultos. Se consideraron jóvenes, animales menores de 2 años, siendo el 72,7% (16) hembras, ya que se trataba de una explotación de cría caballar de raza árabe y cruce.
Las muestras fecales utilizadas para el estudio se recogieron directamente de recto en los casos que fue posible, cuando no, del suelo recuperándose la parte central de la muestra para evitar la contaminación con parásitos de vida libre. La cantidad recogida osciló entre los 200 y 500 gramos en todos los casos. Una vez hecha la toma de cada muestra en guante de palpación rectal, se extrajo el aire de forma manual, se cerró e identificó adecuadamente para su traslado al laboratorio, manteniéndose en todos los casos a temperaturas entre los 15 y 20 ºC.
En todos los muestreos se observó a los caballos buscando presencia de signos clínicos compatibles con la presencia de endoparásitos digestivos.
En el laboratorio, se realizó un análisis macroscópico de cada una de las muestras anotándose datos relacionados con consistencia fecal, presencia de parásitos macroscópicos y principales características organolépticas. Tras este primer examen fecal, se llevó a cabo el análisis microscópico, para el que es emplearon dos técnicas coprológicas: el McMaster modificado y la flotación simple7, utilizando 5 gramos de heces y solución salina saturada con densidad de 1,2.
Tras la realización del McMaster modificado y cálculo de la carga parasitaria, se realizaron coprocultivos y migraciones larvarias con las muestras en las que los recuentos de huevos por gramo de heces (hpg) de estrongilados fueron elevados (> 200 hpg) para la identificación etiológica o de grupo de los mismos, utilizando claves de identificación de larvas 3 de estrongilados12.
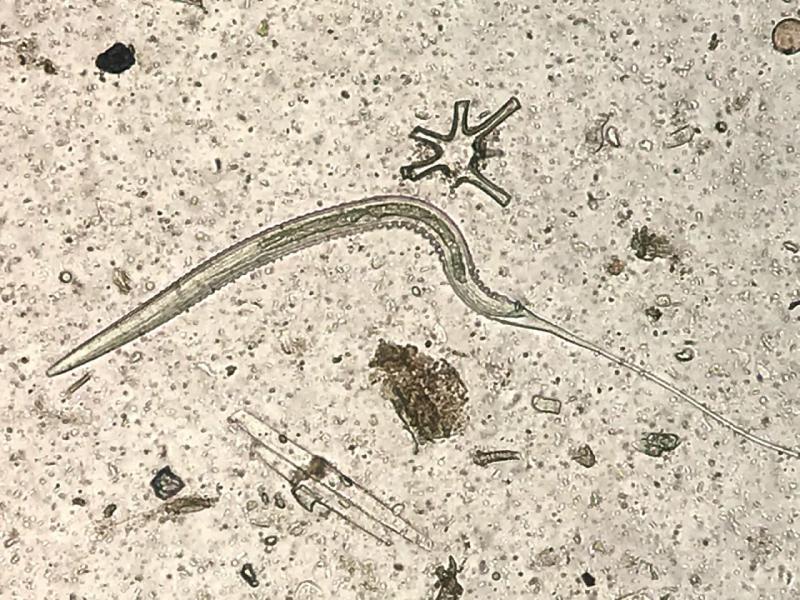
Una vez confirmada la presencia de estrongilados en la explotación, se formaron 5 grupos de animales para realizar una desparasitación selectiva con moxidectina, ivermectina, pamoato de pirantel y fenbendazol, dejando un grupo control sin tratar de 4 animales, y tomándose como valor umbral para la desparasitación cargas parasitarias iguales o superiores a 200 hpg de estrongilados. En la Tabla 1 se detallan los animales que formaron parte de cada uno de los grupos (Tabla 1).
| Tabla 1. Número animales desparasitados y principio activo por sexo y edad . |
| Tratamiento antiparasitario (principio activo) | |||||||||
| Sexo y edad | Control | Ivermectina | Moxidectina | Pirantel | Fenbendazol | Total | |||
| Hembra < 2 años | 1 | 1 | 0 | 2 | 2 | 6 | |||
| Hembra > 2 años | 1 | 0 | 3 | 3 | 3 | 10 | |||
| Macho | 2 | 2 | 1 | 1 | 0 | 6 | |||
| Total | 4 | 3 | 4 | 6 | 5 | 22 | |||
Tras dicha desparasitación a los 15 días post tratamiento, se recogieron muestras fecales de cada animal para comprobar la eficacia del tratamiento antihelmíntico administrado3.
Resultados
Endoparásitos digestivos detectados y técnica coprológica utilizada
Se analizaron un total de 132 muestras fecales, habiéndose recogido muestras individuales de cada uno de los 22 animales que formaron parte del estudio en cada uno de los 6 muestreos realizados.
En los resultados obtenidos mediante análisis coprológicos, cabe recordar, que tras el tercer muestreo se realizaron 5 grupos de caballos que fueron desparasitados con moxidectina, ivermectina, fenbendazol o pirantel, dejándose un grupo de 4 caballos sin desparasitar como grupo control.
En todos los muestreos realizados se detectó la presencia de estrongilados y en (4/6) 66,7% de los muestreos Oxyuris equi. Sin embargo, la presencia de caballos positivos a estrongilados o/y oxiúridos, varió dependiendo del muestreo y la técnica coprológica utilizada. Además, cuando se utilizó el McMaster modificado, que permite establecer la carga parasitaria, en este caso, huevos por gramo de heces, los resultados también fueron distintos (hpg).
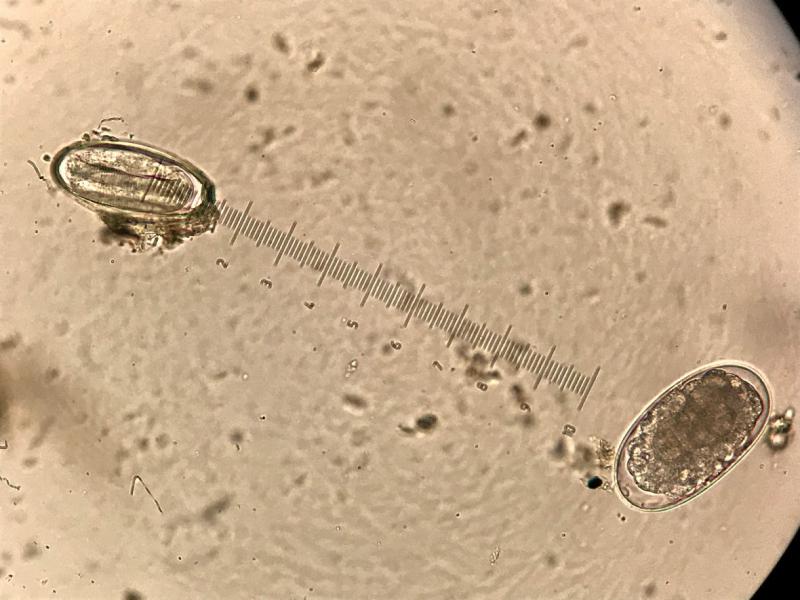
Si se tiene en cuenta la técnica coprológica utilizada, tan solo en un caso, el análisis coprológico macroscópico detectó un O. equi, en el resto de los casos no se detectaron formas parásitas macroscópicas en heces.

Como técnicas coprológicas microscópicas se llevaron a cabo el McMaster modificado y la flotación simple en todas las muestras. Si se tiene en cuenta el número de muestras fecales positivas en cada muestreo, podemos observar que los resultados varían dependiendo del número de muestreo y el parásito detectado.
En el caso de la detección de estrongilados, la incidencia osciló entre el 50% de positivos en el muestreo 5 al 95,5% en el muestreo 3, utilizando cualquiera de las dos técnicas coprológicas microscópicas. Mientras que la incidencia de Oxyuris equi varió entre el 4,5% en los muestreos 1, 5 y 6 al 13,6% del muestreo 3 (Tabla 2).
| Tabla 2. Número muestras positivas/muestreo y técnica coprológica microscópica utilizada. |
| Estrongilaados | Estrongilaados | Oxyuris equi | Oxyuris equi | |
| Número muestreo | McMaster modificado | Flotación simple | McMaster modificado | Flotación simple |
| 1 | 20 | 20 | 1 | 1 |
| 2 | 20 | 20 | 0 | 0 |
| 3 | 21 | 21 | 2 | 3 |
| 4 | 11 | 11 | 0 | 0 |
| 5 | 12 | 12 | 1 | 1 |
| 6 | 19 | 18 | 1 | 1 |
El 78,03% (103/132) de las muestras analizadas a lo largo del estudio fueron positivas a estrongilados, independientemente de la técnica coprológica microscópica utilizada. De ellas el 3,9% (4/103), tuvieron una infección mixta con O. equi. Detectándose en el 95,1% (98/103) de los casos solo parasitaciones por estrongilados y una única muestra solo con presencia de O. equi.
Utilizando el McMaster modificado se obtuvieron cargas parasitarias comprendidas entre 9 y 5085 hpg que se obtuvo en el segundo muestreo en un équido, mientras que en el caso de la detección de O. equi, el rango fue mucho menor desde los 18 a los 207 hpg; teniendo en cuenta únicamente las muestras positivas. Los detalles de los rangos obtenidos para cada parásito detectado se adjuntan en la tabla siguiente (Tabla 3).
| Tabla 3. Rango hpg/muestreo utilizando McMaster modificado. |
| Rango hpg | |||||||||
| Número muestreo | estrongilados | O. equi | |||||||
| 1 | 9-3285 | 27 | |||||||
| 2 | 27-5085 | 0 | |||||||
| 3 | 63-2286 | 18-207 | |||||||
| 4 | 9-1305 | 0 | |||||||
| 5 | 9-1467 | 18 | |||||||
| 6 | 9-5310 | 18 | |||||||
Sin embargo, la eliminación de hpg en estrongilados debe dividirse entre los animales con bajas cargas parasitarias y altas debido al impacto medioambiental3. En la Tabla adjunta se puede observar como en todos los muestreos más de la mitad de las muestras fecales individuales (12/22) recogidas mostraron eliminaciones superiores a los 200hpg (Tabla 4).
| Tabla 4. Número animales eliminaciones superiores e inferiores a 200hpg de strongilados. |
| Rango hpg estrongilados | |||||||||
| Número muestreo | < 200 hpg | > 200 hpg | |||||||
| 1 | 8 | 12 | |||||||
| 2 | 4 | 18 | |||||||
| 3 | 5 | 17 | |||||||
| 4 | 6 | 16 | |||||||
| 5 | 5 | 17 | |||||||
| 6 | 8 | 12 | |||||||
En relación a O. equi, como se ha detallado con anterioridad su detección y las cargas parasitarias detectadas fueron muy inferiores a las constatadas en el caso de los estrongilados.
Endoparásitos digestivos detectados por edad, sexo
Si se tiene en cuenta la edad y el sexo de los équidos, en el estudio se consideraron jóvenes los menores de dos años y adultos los de edad superior, siendo el 54,5% de los caballos, menores de dos años. La mitad de ellos machos y la mitad hembras. En relación a los adultos o mayores de dos años, solo había yeguas en la explotación, como se detalla a continuación en la Tabla (Tabla 5).
| Tabla 5. Número équidos, sexo y edad de la yeguada. |
| Edad | Sexo | Número équidos |
| ≤ 2 años | Macho | 6 |
| ≤ 2 años | Hembra | 6 |
| > 2 años | Macho | 0 |
| > 2 años | Hembra | 10 |
| Total | - | 22 |
Teniendo en cuenta la edad y el sexo, tanto en hembras de cualquier rango de edad, como en los machos jóvenes se detectaron infecciones solo por estrongilados y presencia de infecciones mixtas por estrongilados y oxiúridos. Habiéndose detectado un único caso, hembra joven parasitada solo por O. equi.
En las Tablas 6 y 7 se adjuntan el número de hembras jóvenes positivas a estrongilados y oxiúridos en relación a la técnica microscópica utilizada y muestreo, así como el rango de hpg detectado en este grupo en cada muestreo (Tabla 6 y Tabla 7).
| Tabla 6. Número hembras menores de dos años positivas a parásitos detectados en función de técnica coprológica microscópica. |
| estrongilados | Oxyuris equi | |||
| Número muestreo | McMaster modificado | Flotación simple | McMaster modificado | Flotación simple |
| 1 | 6 | 6 | 0 | 0 |
| 2 | 6 | 6 | 0 | 0 |
| 3 | 6 | 6 | 2 | 2 |
| 4 | 3 | 3 | 0 | 0 |
| 5 | 5 | 5 | 1 | 1 |
| 6 | 6 | 6 | 0 | 0 |
| Tabla 7. Rango hpg estrongilados hembras menores de dos años. |
| Rango hpg | |||||||||
| Número muestreo | estrongilados | O. equi | |||||||
| 1 | 18-2727 | 0 | |||||||
| 2 | 108-1296 | 0 | |||||||
| 3 | 63-1539 | 18-207 | |||||||
| 4 | 0-522 | 0 | |||||||
| 5 | 0-1467 | 18 | |||||||
| 6 | 54-1062 | 0 | |||||||
Teniendo en cuenta la edad y el sexo, las infecciones en las que solo se detectaron estrongilados representaron el 66.6% en hembras jóvenes, habiéndose detectado solo dos animales con presencia de infección mixta (estrongilados y oxiúridos), lo que supone 33,4% del total de este grupo (6).
En el caso de los machos jóvenes solo uno, que supone el 16,6% del total de este grupo animal (1/6) presentó una infección mixta de estrongilados con O. equi en el muestreo 1. Presentando el resto, infecciones mixtas con los dos parásitos detectados en el estudio 83,4% (5/6). En las Tablas 8 y 9 se adjuntan el número de positivos a cada parásito detectado en función de la técnica coprológica y el rango de hpg detectado (Tabla 8 y Tabla 9).
| Tabla 8. Rango hpg estrongilados machos menores de dos años. |
| Rango hpg | |||||||||
| Número muestreo | estrongilados | O. equi | |||||||
| 1 | 0-3285 | 27 | |||||||
| 2 | 0-3285 | 0 | |||||||
| 3 | 0-2142 | 0 | |||||||
| 4 | 0-1305 | 0 | |||||||
| 5 | 0-1350 | 0 | |||||||
| 6 | 0-5310 | 0 | |||||||
| Tabla 9. Número machos menores de dos años positivas a parásitos detectados en función de técnica coprológica microscópica. |
| Estrongilados | Oxyuris equi | |||
| Número muestreo | McMaster modificado | Flotación simple | McMaster modificado | Flotación simple |
| 1 | 4 | 4 | 1 | 1 |
| 2 | 4 | 4 | 0 | 0 |
| 3 | 5 | 5 | 0 | 0 |
| 4 | 2 | 2 | 0 | 0 |
| 5 | 2 | 2 | 0 | 0 |
| 6 | 6 | 6 | 0 | 0 |
En las hembras adultas (10), solo en el muestreo 3 en un animal y en el muestreo 6 en otro, se detectó la presencia de infección mixta por estrongilados y oxiúridos, en el resto de los casos, con las técnicas coprológicas microscópicas utilizadas, solo se detectaron estrongilados (Tabla 10).
| Tabla 10. Número hembras mayores de dos años positivas a parásitos detectados en función de técnica coprológica microscópica. |
| Estrongilados | Oxyuris equi | |||
| Número muestreo | McMaster modificado | Flotación simple | McMaster modificado | Flotación simple |
| 1 | 10 | 10 | 0 | 0 |
| 2 | 10 | 10 | 0 | 0 |
| 3 | 10 | 10 | 0 | 0 |
| 4 | 6 | 6 | 0 | 0 |
| 5 | 5 | 5 | 0 | 0 |
| 6 | 7 | 6 | 1 | 1 |
Si se tiene en cuenta el rango de hpg en este grupo de edad y sexo, el límite superior en todos los muestreos es elevado, mientras que en el caso de la detección de O. equi, solo se detectaron 18 hpg (Tabla 11).
| Tabla 11. Rango hpg estrongilados hembras mayores de dos años. |
| Rango hpg | ||
| Número muestreo | estrongilados | O. equi |
| 1 | 9-1161 | 0 |
| 2 | 27-5085 | 0 |
| 3 | 99-2286 | 0 |
| 4 | 0-684 | 0 |
| 5 | 0-1143 | 0 |
| 6 | 0-630 | 18 |
Por otra parte, en el análisis de los équidos positivos a estrongilados y con eliminaciones altas o bajas, teniendo en cuenta el muestreo, la edad y su sexo, se puede observar cómo antes de la aplicación del tratamiento antiparasitario el 83,3% de las hembras jóvenes (5/6) presentaron cargas superiores a los 200hpg, además de detectar que al final del estudio todas estas hembras contaminan el medio, aunque solo el 33,3% (2/6) presentaron cargas superiores a 200hpg.
El 100% de las hembras adultas (10/10) tenían infecciones patentes al inicio del estudio y entre el 80% (8/10) en el muestreo 2 y el 90% (9/10) excretaban gran cantidad de huevos al medio antes de la desparasitación (>200 hpg).
En el caso de los machos solo el 66,6% (4/6) fueron positivos a estrongilados en los dos primeros muestreos realizados, observándose en todos ellos elevadas cargas parasitarias. Al final del estudio todos tenían infecciones patentes, aunque solo el 33,3% (2/6) eliminaban gran cantidad de huevos al medio.
En la Tabla 12 se detallan todos los resultados mencionados anteriormente (Tabla 12).
| Tabla 12. Número équidos positivos estrongilados por muestreo según rango de excreción, sexo y edad. |
| Hembra≤ 2 años | Hembra > 2 años | Macho | ||||
| Número muestreo | < 200 hpg | > 200 hpg | < 200 hpg | > 200 hpg | < 200 hpg | > 200 hpg |
| 1 | 2 | 4 | 4 | 6 | 0 | 4 |
| 2 | 1 | 5 | 2 | 8 | 1 | 4 |
| 3 | 1 | 5 | 2 | 8 | 1 | 4 |
| 4 | 1 | 2 | 4 | 2 | 0 | 2 |
| 5 | 3 | 2 | 2 | 3 | 0 | 2 |
| 6 | 4 | 2 | 4 | 3 | 4 | 2 |
Ausencia de signos clínicos
Durante todo el estudio, se confirmó la ausencia de signos clínicos y no se detectó por parte del personal responsable ningún síndrome abdominal agudo a lo largo de la duración del mismo.
Control selectivo: uso de la coprología para controlar su eficacia
Tras la realización de los 3 primeros muestreos y constatarse la parasitación equina por estrongilados, se llevó a cabo la división animal por grupos de edad y sexo, para poder establecer distintos protocolos antiparasitarios y valorar los resultados obtenidos, como se ha detallado en material y métodos.
Todos los équidos presentaban infecciones patentes por estrongilados en el momento de la desparasitación. Tras la desparasitación de los animales y la recogida posterior de muestras individuales a los 15 días post tratamiento para la confirmación de la eficacia del tratamiento antiparasitario ejercido, los resultados coprológicos variaron dependiendo del principio activo utilizado.
De los animales desparasitados con ivermectina el 100% presentaron coprologías negativas tanto utilizando el McMaster modificado como la flotación simple. Cuando se utilizó moxidectina, exceptuando una hembra adulta en la que se detectó una carga parasitaria de 36 hpg, en el resto de los animales no se detectó ninguna infección patente. No se observó que el pirantel fuera eficaz.
Cuando se administró fenbendazol, se debe tener en cuenta que en los machos no se desparasitó ningún animal con este principio activo, por eso en la Tabla 13 se observa sin dato (SD) y en hembras adultas un animal presentó una eliminación de 126 hpg de estrongilados (Tabla 13).
| Tabla 13. Porcentaje animales positivos por sexo y edad 15 días tras desparasitación y principio activo administrado. |
| Sexo y edad | Control | Ivermectina | Moxidectina | Pirantel | Fenbendazol |
| Hembra ≤ 2 años | 100 | 0 | 0 | 100 | 0 |
| Hembra > 2 años | 100 | 0 | 33,3 | 100 | 33,3 |
| Macho | 50 | 0 | 0 | 100 | SD |
Los animales en los que se detectaron infecciones patentes, fueron identificados tanto utilizando el McMaster modificado como la flotación simple.
Sin embargo, si se analizan los resultados tras realizar los análisis coprológicos en los muestreos 5 y 6, se puede observar que en el caso del uso de ivermectina (IV) el 100% de los animales en el último muestreo vuelven a presentar infecciones patentes. Todos los desparasitados con fenbendazol (FBZ) vuelven a presentar parasitaciones por estrongilados detectadas por coprología, exceptuando dos hembras en el muestreo 5 y una hembra adulta en el muestreo 6.
Cuando se utilizó la moxidectina (MOX), un macho joven y una hembra adulta presentaron infecciones patentes con cargas de 9 y 18 hpg respectivamente solo en el último muestreo. Y los análisis coprológicos de los équidos desparasitados con pirantel fueron positivos en el resto de los muestreos, al igual que las coprologías de los équidos que se dejaron como grupo control (C) (Tabla 14).
| Tabla 14. Porcentaje animales positivos por sexo y edad; muestreos 5 y 6 y principio activo administrado.. |
| Hembra≤ 2 años | Hembra > 2 años | Macho | |||||||||||||
| Número muestreo | C | IV | MOX | PIR | FBZ | C | IV | MOX | PIR | FBZ | C | IV | MOX | PIR | FBZ |
| 5 | 100 | 0 | SD | 100 | 100 | 100 | 0 | 0 | 100 | 33,3 | 50 | 0 | 0 | 100 | SD |
| Hembra > 6 | 100 | 100 | SD | 100 | 100 | 100 | SD | 33,3 | 100 | 66,6 | 100 | 100 | 100 | 100 | SD |
De los équidos cuyos resultados coprológicos fueron positivos el rango de eliminación de estrongilados osciló entre los 9-1467 hpg en el muestreo 5 y los 9-1323 hpg en el muestreo 6. Sin embargo, el número de animales en los que se detectaron altas cargas parasitarias varió dependiendo del muestreo post tratamiento y del principio activo utilizado, pudiéndose observar que tanto en el muestreo 5 como en el 6, el 50% de los animales que recibieron pirantel eliminaban al medio ambiente más de 200 hpg (Tabla 15).
| Tabla 15. Número animales positivos por sexo y edad 15 días tras desparasitación y principio activo administrado y porcentaje del total del grupo. |
| Número de Muestreo 5 | Número de Muestreo 6 | |||||||||
| Sexo y edad | C | IV | MOX | PIR | FBZ | C | IV | MOX | PIR | FBZ |
| Hembra ≤ 2 años | 1 | 0 | SD | 1 | 0 | 1 | 0 | SD | 1 | 0 |
| Hembra > Hembra > 2 años | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 1 | 1 |
| Macho | 1 | 0 | 0 | 1 | SD | 1 | 0 | 0 | 1 | SD |
| % Total | 75 | 0 | 0 | 50 | 20 | 75 | 0 | 0 | 50 | 20 |
Discusión
Incidencia de endoparásitos digestivos en équidos
La distribución de endoparásitos digestivos en el medio ambiente, es cosmopolita. Sin embargo, no todos ellos presentan la misma incidencia, ya que su presencia en los animales depende, no solo de factores del parásito y del hospedador, sino también de distintos factores bióticos y abióticos del medio ambiente. De todos ellos los más frecuentes son los estrongilados, ascáridos, oxiúridos, cestodos y nematodos broncopulmonares 8.
Los estrongilados son los más detectados a nivel mundial3, y dentro de este grupo de nematodos, son los ciatostominos los más incidentes9,10. Aunque más de 50 especies distintas forman parte de la Subfamilia Cyathostominae, no todas las especies están presentes en los équidos, habiéndose identificado como más frecuentes, 13 especies en Italia, Alemania y Reino Unido11. Por lo que, si bien todos los caballos presentan infecciones mixtas por estrongilados, no todas las especies están presentes en los caballos infectados.

En este estudio, los estrongilados también fueron los parásitos más incidentes, habiéndose detectado en el 78% de las muestras analizadas con el McMaster modificado y en el 77,3% de las mismas utilizando la flotación simple. Estas incidencias son inferiores al 85,9% detectado en un estudio realizado en el noreste de España4.
En relación a los estrongilados detectados, el 99% de ellos pertenecieron al grupo de los ciatostominos y el 1% se identificó como S. equinus utilizando claves de identificación de L312, obtenidas tras realizar un coprocultivo y migración larvaria. No se llegó a establecer la especie de ciatostomino, ya que se considera que todas tienen similar poder patógeno; sin embargo, debido al distinto tamaño medido en su identificación, se pudo conocer que no todas pertenecían al mismo género12.
El único oxiúrido detectado fue Oxyuris equi en el 3,9% de las muestras, incidencia similar al 3% detectado en un estudio realizado en el noreste de España4, aunque en otros países como Polonia es un parásito más frecuente con una incidencia del 38,7%13.
Importancia y diferencias de los análisis coprológicos: análisis macroscópico y análisis microscópico
Siempre que un endoparásito digestivo esté en patencia, puede detectarse analizando muestras fecales; sin embargo, no siempre deben utilizarse las mismas, ni todas ellas son igualmente sensibles en la detección de los distintos parásitos englobados bajo esta denominación.
Algunos de los endoparásitos digestivos más frecuentes en équidos, pueden observarse macroscópicamente, que es la técnica coprológica que debe emplearse en primer lugar cuando se realiza cualquier análisis coprológico12. Los parásitos detectados en este estudio pueden detectarse macroscópicamente en heces, si bien, en este caso solo se detectó una hembra de Oxyuris equi utilizando esta técnica.
Aunque parezca que la incidencia con la que se detectan parásitos macroscópicamente es baja, este análisis aporta otros datos relevantes como son: las características organolépticas de las heces, presencia de sangre o fibrina, que ayudan a enfocar el diagnóstico14.
Sin embargo, debido a que la sensibilidad del análisis macroscópico es muy baja, se utilizan técnicas microscópicas más sensibles, como el McMaster modificado, que es una de las dos técnicas recomendadas para detectar y cuantificar huevos de estrongilados, que como se ha mencionado con anterioridad, son los parásitos más frecuentes de los équidos a nivel mundial3.
Recordando que, en todos los casos, como se hizo a lo largo del trabajo, deben leerse las dos hemicámaras que forman la cámara de McMaster que se utiliza para el recuento de formas microscópicas en heces, ya que, si se leyese solo una, se ha demostrado una disminución en la precisión del valor obtenido15.
En este estudio, se ha utilizado además del McMaster modificado la flotación simple, técnica coprológica microscópica cualitativa que no permite establecer la carga parasitaria, pero que, cuando las cargas parasitarias son bajas, puede arrojar resultados positivos, mientras que el McMaster modificado no, ya que, aunque es una técnica con una sensibilidad del 100%, con cargas mayores de 200hpg para estrongilados, cuando la excreción es menor, disminuye16.
El uso de la flotación simple además del McMaster modificado, tiene sentido si se tiene en cuenta la baja sensibilidad de la primera técnica en la detección de algunos endoparásitos digestivos como en el caso de los anoplocefálidos, ya que, solo detecta el 10% de los animales con infecciones patentes17.

Las cargas parasitarias de estrongilados obtenidas fueron iguales o superiores a 200hpg en el 51,5% de las muestras analizadas. Estas eliminaciones elevadas de huevos al ambiente, aumentan la sensibilidad del McMaster modificado que tiende a dar un resultado negativo cuando las cargas parasitarias son bajas. Debiendo tener en cuenta otras variables que afectan en los resultados coprológicos obtenidos; como son la distribución desigual de huevos en la muestra o factores biológicos como su posible agregación en una porción fecal18.
Los resultados en relación a la cantidad de muestras positivas y negativas si se comparan las dos técnicas coprológicas utilizadas: McMaster modificado y flotación simple, son similares, existiendo únicamente dos resultados distintos; uno en el muestreo 3, en el que el con el McMaster modificado no se observó ningún huevo de O. equi, mientras si se obtuvo un resultado positivo con la flotación simple, y un segundo resultado distinto en el muestro 6, donde con el McMaster modificado se observaron 9 hpg de estrongilados y la flotación fue negativa.
Estas diferencias además de por los motivos comentados anteriormente, pueden deberse en la detección de O. equi, a que ninguna de las dos técnicas coprológicas es la técnica de elección para la detección de este parásito, siendo la prueba del celo la que debería elegirse12.
En el caso del McMaster modificado se analiza una suspensión fecal de un mililitro, y con la flotación simple se analizan las formas parásitas que flotan en 10 ml, por lo que existe, cuando la carga parasitaria es baja, una mayor probabilidad de que la flotación simple sea positiva, Además de que, en el caso de parásitos como los anoplocefálidos con baja excreción de formas parásitas en heces, la flotación simple también sería más sensible, aunque en ningún caso es la técnica coprológica de elección19.
Más allá de la sensibilidad de las técnicas coprológicas, se debe recordar que las hembras de O. equi realizan la oviposición (entre 8.000/60.000 huevos) alrededor de la zona perianal secretando un fluido proteináceo que al contacto con el aire se seca y mantiene a los huevos unidos y pegados en dicha zona. Por este motivo, la probabilidad de detectarlos cuando la prueba de elección (prueba del celo) no se realiza a primera hora del día, o cuando se utilizan técnicas coprológicas para su detección, es baja, a pesar de que en este estudio se haya detectado en casi el 4% de las muestras20.
Existiendo también la posibilidad de que aparezcan huevos en heces, debido a que alguna hembra, en su camino a la zona perianal, haya estallado y liberado los huevos de su útero12.
Por estos motivos, aunque se haya detectado la presencia de O. equi en el análisis coprológico macroscópico y con técnicas coprológicas microscópicas, las cargas parasitarias obtenidas con el McMaster modificado, son bajas, si comparamos los 207 hpg detectados como máximo con la puesta de huevos de una única hembra de oxiúrido (8.000/60.000)20.
En la detección de estrongilados, se obtuvo un resultado diferente utilizando las técnicas microscópicas. Los 9 hpg obtenidos por McMaster modificado y el resultado negativo de la flotación simple, implica la detección de un único huevo en toda la muestra. Por lo que, si al procesar la muestra, la única carga parasitaria presente es un huevo de estrongilado, si aparece en el McMaster modificado, no puede aparecer en la flotación simple.
El hecho de que el McMaster modificado sea una de las dos técnicas coprológicas propuestas para la toma de decisiones en los tratamientos antiparasitarios frente estrongilados, se debe al hecho de que puede calcular la carga parasitaria3. Aunque se debe recordar realizar la técnica correctamente, ya que una falta de homogeinización de la mezcla de filtrado de heces con la solución densa utilizada, producirá una sobreestimación de la carga parasitaria5.
Esta carga parasitaria, permite en estrongilados, diferenciar équidos que contaminan mucho el medio ambiente (cargas iguales o superiores a 200 hpg) de los que contaminan poco (cargas menores a 200 hpg). Además, se conoce que la eliminación al medio de huevos de estrongilados por parte de cada équido, se mantiene constante en el tiempo21; a pesar de que existe un fenómeno de sobredispersión; es decir, de mayor variabilidad en los resultados coprológicos esperados, cuando la infectividad del pasto o cantidad de L3 de estrongilados o formas infectantes, es elevada22.
Si tenemos en cuenta, que el McMaster modificado permite la detección de los endoparásitos digestivos más incidentes destacando entre ellos los estrongilados, en los que además nos permite saber qué caballos contaminan más el medio ambiente, es lógico que sea la técnica coprológica rutinaria. Sin embargo, el tiempo dedicado a la lectura de la cámara de McMaster, así como leer las dos hemicámaras o la cámara completa son importantes, ya que lecturas rápidas o leer una sola hemicámara disminuyen la precisión de los resultados obtenidos15.
Sin olvidar la importancia de la solución densa elegida para llevar a cabo la técnica. Se recomienda solución salina saturada3, ya que otras como el nitrato de sodio, vuelve traslúcidos los huevos de estrongilados y subestima la carga parasitaria real de la muestra hasta en un 5%15.
Por otra parte, debido a la distribución no uniforme de parásitos en una población equina, el McMaster modificado sigue siendo una técnica coprológica muy útil.
Esta distribución también conocida como “regla del 20/8023” implica que el 20% de los caballos soportan el 80% de los parásitos y por lo tanto este porcentaje poblacional es el que presentará las mayores cargas parasitarias y será responsable de la contaminación del medio ambiente. Pudiendo detectarse a estos animales con el McMaster modificado, siempre y cuando se realicen coprologías individuales23.
Factores relacionados con los resultados coprológicos
La distribución cosmopolita de muchos endoparásitos digestivos, posibilita la incidencia elevada de infecciones parasitarias en équidos. Sin embargo, como se ha mencionado con anterioridad, la distribución de poblaciones parásitas en una explotación no es uniforme, como en el caso de los estrongilados, que se rigen por “la regla del 20/8023”.
Por este motivo, el conocimiento de otros factores epidemiológicos, ayuda en la interpretación de los resultados obtenidos en el laboratorio. Estos factores engloban aspectos relacionados con el parásito, con el caballo y por supuesto con el medio ambiente. Siendo los factores medioambientales más relevantes la humedad y temperatura, ya que permitirán un mayor o menor desarrollo y supervivencia de las formas preparásitas12.
Algunos de los factores más relevantes relacionados con los parásitos, se han mencionado previamente, como en el caso de los estrongilados, las numerosas especies que se engloban bajo esta denominación, o su prolificidad parasitaria, que en el caso de estrongilados migratorios asciende a los 5000 huevos, quedándose en el caso de los ciatostominos en 200 huevos12.
De los factores relacionados con los équidos, los más estudiados son la edad y el sexo. En muchos casos, los caballos por contacto controlado y prolongado con parásitos, van adquiriendo inmunidad adquirida parcial y son capaces de regular sus poblaciones parasitarias, siempre y cuando el terreno no esté muy contaminado. Por este motivo, es en los animales jóvenes en los que se suelen observar las mayores cargas parasitarias24, con la excepción de caballos de edades muy avanzadas en los que los recuentos en heces vuelven a aumentar25 o yeguas en periodo periparto12.
Debido a que muchos jóvenes están desarrollando su inmunidad adquirida parcial, es en ellos donde aparecen las enfermedades parasitarias, aunque a lo largo del estudio y a pesar de las cargas elevadas observadas, no se detectó ningún signo clínico. Sin olvidar que hay parásitos, como el estrongilado S. vulgaris que afecta más a caballos adultos por la necesidad de reinfecciones constantes12.
Tampoco, se hallaron diferencias teniendo en cuenta la edad, debido al tamaño muestral. Por otra parte debido a que las cargas parasitarias en más del 50% de los animales superaron valores de 200 hpg, la contaminación del medio ambiente se consideró elevada, por lo que cabría esperar sobredispersión en los resultados coprológicos obtenidos22.
A pesar de la elevada infectividad del terreno, en los muestreos realizados pretratamiento, se pudo observar que los caballos considerados contaminadores del medio ambiente, repetían cargas parasitarias elevadas en el caso de los estrongilados, en todos los grupos de edad21.
Teniendo en cuenta el sexo, debido a que la explotación estaba destinada a la cría, el 72,7% de los équidos eran hembras, por lo que no pudo establecer ninguna conclusión en relación con los resultados coprológicos obtenidos en machos. A pesar de que, en estudios previos, si se ha demostrado una mayor parasitación de las hembras en relación con los machos4.
Control selectivo
La elevada incidencia de estrongilados hace imprescindible establecer métodos de control eficaces que disminuyan su presencia en los équidos. Tradicionalmente el control antiparasitario se ha basado en el uso de distintos antihelmínticos sin tener en cuenta en muchos casos aspectos tan importantes como la presencia o no de inmunidad adquirida parcial en el hospedador, los agentes etiológicos presentes o el periodo de reaparición de huevos postratamiento específico de cada antihelmíntico.
El control selectivo, se realiza en los caballos para el control de ciatostominos, ejerciendo un control antiparasitario solo en aquellos animales cuyas cargas parasitarias sean iguales o superiores a 200 hpg. Lo que significa que el control antiparasitario para otros agentes etiológicos no sigue en ningún caso esta premisa.
Con estos tratamientos, no se pretende en ningún caso la erradicación parasitaria, sino minimizar el riesgo de parasitosis disminuyendo la intensidad de parasitación en los équidos y la contaminación del medio ambiente.
Gracias al estudio coprológico individualizado, se pudo aplicar un control selectivo con los principios activos administrados en caballos con mayor frecuencia, pudiendo confirmar los distintos periodos de reaparición de huevos de los distintos antiparasitarios o la falta total de eficacia del pirantel al mantenerse las cargas parasitarias similares antes y después del tratamiento. En relación a la carga parasitaria detectada cuando se desparasitó con fenbendazol podría deberse a que la acción ovicida de este antihelmíntico, es dosis dependiente, aunque la eficacia detectada del 80%, es similar a otros estudios26.
Por lo tanto, resumiendo los aspectos más relevantes del estudio; si bien existen métodos automáticos que establecen las cargas parasitarias, los métodos coprológicos realizados por personal especializado, son igualmente sensibles.
Los análisis coprológicos, entre ellos la técnica coprológica rutinaria, permiten la detección de los endoparásitos digestivos equinos más incidentes y por lo tanto facilitan la toma de decisiones en caso de necesitar realizarse algún control antiparasitario en la explotación, siendo el McMaster modificado, capaz de valorar la eficacia de los tratamientos antihelmínticos y de detectar presencia de resistencias antihelmínticas.
Aunque cabe recordar, que cuando la presencia de formas parásitas en heces es baja, otras técnicas como la flotación simple son más sensibles, por lo que se recomienda en todos los casos realizar dicha técnica además del McMaster modificado.
Sin embargo, la primera técnica coprológica que debe realizarse en todos los casos es el análisis macroscópico14, ya que aporta información diagnóstica útil y de existir, permite la detección de parásitos macroscópicos o en el caso de cestodos, de anillos grávidos19.
Bibliografía
- Bucknell D, Hoste H, Gasser RB, Beveridge I; The structure of the community of strongyloid nematodes of domestic equids; 1996;Journal of Helminthology.
- Reid SWJ, Mair TS, Hillyer MH, Love S; Epidemiological risk factors associated with a diagnosis of clinical cyathostomiasis in the horse; 1995 Equine Veterinary Journal.
- Nielsen MK, Mittel L, Grice A, Erskine M, Graves E, Vaala W, Tully RC, French DD, Bowman R, Kaplan RM. AAEP parasite control guidelines; 2019; American Association of Equine Practitioners. www.aaep.org.
- Francisco I, Arias M, Cortiñas FJ, Francisco R, Mochales E, Dacal V, Suárez JL, Uriarte J, Morrondo P, Sánchez-Andrade R, Díez-Baños P, Paz Silva A; intrinsic factors influencing the infection by helminth parasites in horses under an oceanic climate area (NW Spain)2009; Journal of Parasitology Research.
- Lester HE, Matthews JB; Faecal worm egg count análisis for targeting anthelmintic treatment in horses: points to consider; 2014; Equine Veterinary Journal.
- Slusarewicz P, Pagano S, Mills C, Popa C, Martin Chow K, Mendenhall M, Rodgers DW, Nielsen MK; Automated parasite faecal egg counting using fluorescence labelling, smartphone image capture and computational image análisis; 2016; Veterinary Parasitology.
- Great Britain Ministry of Agriculture, Fisheries and Food (MAFF); Manual of Veterinary Parasitological Laboratory Techniques; 1986; London; HM Stationery Office.
- O’Meara, Mulcahy G; A survey of helminth control practices in equine establishments in Ireland; 2002; Veterinary Parasitology.
- Collobert-Laugier C, Hoste H, Sevin C, Dorchies P; Prevalence, abundance and site distribution of equine small strongyles in Normandy, France: 2002; Veterinary Parasitology.
- Corning S; Equine cyathostomins: a review of biology, clinical signif cance and therapy; 2009; Parasites and Vectors.
- Traversa D, Milillo P, Brnes H, von Samson-Himmelstjerna G, Sxhurmann S, Demeler J, Otranto D, Lia RP, Perruci S, di Regalbono AF, Beraldo P, Amodie D, Rohn K, Cobb R, Boechh A; Distribution and species-specific occurrence of cyathostomins (Nematoda, Strongylida) in naturally infected horses from Italy, United Kingdom and Germany; 2010; Veterinary Parasitology.; Equine Veterinary Journal.
- Meana A, Rojo Vázquez FA. 87 Q&A sobre parasitología equina: libro de preguntas y respuestas; 2010; Zaragoza; Servet.
- Slivinska K, Kharchenko V, Wróblewski Z, Gawor J, Kuzmina T; Influence of age, sex and management strategies on the parasite Community; 2016; Helminthologia.
- Valcárcel F, Rojo Vázquez FA, Olmeda García AS, Arribas Novillo B, Márquez Sopeña L, Fernández Pato N; Atlas of ovine Parasitology; 2009; Zaragoza; Servet.
- Slusarewicz M, Slusarevwicz P, Nielsen MK; The effect of counting duration on quantitative fecal egg count test performance; 2019; Veterinary Parasitology.
- Bosco A, Maurelli MP, Ianniello D, Morgoglione ME, Amadesi A, Coles, Cringoli G, Rinaldi L; The recovery and added nematode eggs from horse and sheep faeces by three methods; 2018; Veterinary Reseach.
- Proudman CJ, Edwards GB; Validation of a centrifugation/flotation technique for the diagnosis of equine cestodiasis;1992; Veterinary Record.
- Cain JL, Slusarewixz P, Rutledge M, McVey MR; Wielgys KM, Zynda HM, Wehling LM, Scare JA, Steuer AE; Diagnostic performance of McMaster, Wisconsin and automated egg counting techniques for enumeration of equine strongyle eggs ein fecal samples; 2020; Veterinary Parasitology.
- Fernández Pato N. Anoplocefalosis equina: epidemiología de la infección en España y estudio de las lesiones producidas por Anoplocephala perfoliata; 2013; Tesis doctoral; Madrid.
- Reinemeyer CR, Nielsen MK; Review of the Biology and control of Oxyuris equi; 2014;Equine Veterinary Education
- Becher AM, Mahling M, Nielsen M, Pfister K; Selective anthelmintic therapy of horses in the Federal states of Bavaria (Germany) and Salzburg (Austria): an investigation into strongyle egg shedding consistency; 2010 Veterinary Parasitology.
- Lester HE, Spanton J, Stratford CH., Bartley DJ, Morgan E., Hodgkinson JE, Coumbe K, Mair T, Swan B, Lemon G, Cookson R; Matthews JB; Anthelmintic efficacy against cyathostomins in horses in Southern England;2013 Veterinary Parasitology.
- Kaplan RM, Nielsen MK; An evidence-based approach to equine parasite control:it ain´t the 60s anymore; 2010;Equine Veterinary Education.
- Kornás S, Sallé G, Skalska M,David I, Ricard A, Cabaret J; Estimation of genetic parameters for resistance to gastrointestinal nematodes in pure blood Arabian horses; 2015; International Journal for Parasitology.
- Adams AA, Betancourt A, Barker VD; Comparison of the immunologic response to anthelmintic treatment in old versus middle-aged horses; 2015; Journal Equine Veterinary Science.
- Bellaw JL, Krebs K, Reinemeyer CR, Norris JK, Scare JA, Pagano S, Nielsen MK; Anthelmintic therapy of equine cyathostomin nematodes – larvicidal efficacy, egg reappearance period, and drug resistance; 2018; International Journal for Parasitology.
 by Multimédica
by Multimédica