Manejo y cuidado de aves en la clinica veterinaria
Resumen breve
El objetivo principal de este artículo es saber elegir entre los diferentes tipos de cateterización que podemos encontrar en animales, dependiendo del uso que se le vaya a dar.El papel del ATV es fundamental tanto en la colocación como en el cuidado y manejo de los catéteres, ya que suele ser el personal de enfermería el encargado de los procesos anteriormente dichos.Índice de contenidos
Introducción
La tenencia de aves como animales de compañía es tan común en la sociedad como la de perros y gatos; no tanto era así sus visitas al veterinario. Cada vez es más frecuente la presencia de este tipo de animales en la clínica veterinaria.
El objetivo de este artículo es dar pautas de actuación para este tipo de especies en la consulta: cómo manejarlas, su alimentación, la sujeción adecuada para realizar las pruebas diagnósticas y cuáles son sus necesidades para poder proporcionar la atención precisa y por tanto, un servicio de calidad.
En la mayoría de los casos, las aves que acuden a la consulta tienen condición de presa en la naturaleza. Eso supone que intentan esconder su verdadero estado de salud para protegerse de los depredadores. Por ello, cuando muestran signos evidentes de debilidad o enfermedad se puede estar ante un caso crítico, por lo que hay que actuar con rapidez y reducir al máximo el contacto con el animal ya que el simple hecho de explorarlo puede suponer la muerte del paciente.
Muchos pacientes son remitidos de otras clínicas veterinarias especializadas en perro y gato, donde no están familiarizados con aves y llegan a la clínica sin ser estabilizados previamente. La actuación debe ser rápida y metódica.
Cómo actuar cuando recibimos un ave en la clínica
Se debe tener en cuenta la aceptación por parte del ave del contacto con humanos a la hora del manejo en consulta, ya que para un ave criada a papilla el contacto con la persona no supone un estrés, mientras que para un ave que ha sido criada por sus padres, el estrés del manejo puede suponer un riesgo elevado y más si el estado en el que ingresa es delicado. En este caso, debemos actuar con cuidado y rapidez para que el contacto sea el menor posible.
Cuando recibimos un ave con signos de debilidad o postrado en el fondo de la jaula se debe proporcionar una fuente de calor, preferiblemente una incubadora a 30 grados y conectada a una fuente de oxígeno. En pacientes en estado crítico, se realizará una exploración rápida en el traspaso de la jaula a la incubadora. Muchos pacientes presentan deshidratación; una vez se ha evaluado el estado general, se recomienda suministrar una dosis de fluidoterapia (3ml/100g de peso vivo) para hidratarlo y estabilizarlo por vía subcutánea, intravenosa o intraósea. Una vez estabilizado se comenzará con las pruebas diagnósticas.
Es importante adaptar la incubadora o jaula al ave en concreto y a su estado de salud, proporcionándole perchas donde posarse adecuadas a su tamaño. En caso de que el ave esté demasiado débil como para mantenerse en una percha, se pondrá en el suelo un papel suave de celulosa, empapador o similar para evitar que desarrolle una pododermatitis (inflamación de las plantas de los pies).
El propietario debe informar de la dieta que sigue su animal para ofrecerle algo que vaya a aceptar, ya que la prioridad en ese momento es que se alimente.
Alimentación
La mayoría de las aves psitácidas, ya sea por desconocimiento del propietario o por comodidad, son alimentadas a base de mezclas de semillas o pipas, dieta poco recomendable ya que tienen un alto contenido en grasas y deficiencias nutricionales. Este tipo de alimentación repercute en el estado de salud de las aves con posibles problemas hepáticos, puesta crónica de huevos en las hembras, deficiencias de vitamina A, etc. Para una correcta alimentación a base de semillas, esta mezcla debe contener entre 10 y 12 tipos diferentes de semillas y debe constituir el 60% de la alimentación, siendo el 40% restante a base de frutas, verduras y legumbres. Los beneficios del pienso frente a las semillas se basan en que aporta todos los nutrientes necesarios de manera equilibrada y completa. Su composición y aspecto homogéneo impide al ave seleccionar, por lo que se asegura una nutrición correcta.
Existen diversos tipos de pienso extrusionado y de diferentes tamaños para adaptarlo a cada especie, al igual que su composición, adecuándolo según necesidades específicas del individuo o época del año (p. ej., temporada de cría).
Tanto si el animal se alimenta de semillas como de pienso extrusionado, es recomendable complementar la dieta con frutas, legumbres y verduras y a modo de premio, con frutos secos. En animales que viven en el exterior, se puede añadir un aporte extra de frutos secos durante el invierno. En el caso de aves alimentadas con pienso será a modo de enriquecimiento ambiental. En aves alimentadas con semillas, esto es necesario para conseguir una dieta completa y equilibrada.
El cambio de alimentación en un ave acostumbrada a la mixtura se debe realizar de manera progresiva, sustituyendo un pequeño porcentaje de semillas por el pienso y aumentando progresivamente este porcentaje hasta conseguir eliminar las semillas de su dieta.
Especies más frecuentes y su manejo
Las aves que acuden con mayor frecuencia a consulta son pequeñas psitácidas como periquitos (Melopsittacus undulatus), agapornis (Agaporni spp) y ninfas (Nymphicus hollandicus) y psitácidas más grandes como yacos (Psittacus erithacus). Entre las paseriformes encontramos al canario (Serinus canaria), diamante mandarín (Taenopygia guttata) y columbiformes como las palomas (Columba livia).
El manejo de pequeñas especies es sencillo, ya que se pueden manipular con una mano y explorarlo/medicarlo con la otra mano. Cuando el ave es de mayor tamaño, sirve de ayuda envolverlo con una toalla para inmovilizarlo, y sujetar su cabeza con firmeza para evitar posibles daños y lesiones.
Inmovilización
El objetivo en el manejo de aves es inmovilizar las alas y controlar las extremidades posteriores y la cabeza en aves con picos y garras potentes, como puede ser grandes psitácidas o rapaces. Un buen manejo evitará posibles lesiones.

El uso de guantes de cuero está contraindicado en la sujeción de aves ya que no permite tener un control fiable de la fuerza que se está ejerciendo en el paciente. El uso de toallas proporciona cierta protección sin perder la sensibilidad de la fuerza que se ejerce. Esto es importante ya que las aves no tienen diafragma y dependen exclusivamente del movimiento de sus costillas para inspirar. Un agarre demasiado fuerte puede ser fatal. Envolver toda el ave con la toalla evita la lucha excesiva y posibles traumas de las alas.
En el caso de aves de gran tamaño, la cabeza se sujetará con una mano y el cuerpo quedará envuelto con la toalla bloqueando alas y extremidades posteriores.
Las aves más pequeñas se sujetarán por la cabeza con dos dedos, pulgar e índice o índice y corazón. El cuerpo del animal quedará en la palma de la mano controlando alas y extremidades posteriores. En lugar de una toalla se puede usar un papel o servilleta para inmovilizarlo (Figura 1).
Paseriformes más grandes o columbiformes como las palomas, se pueden sujetar con las dos manos alrededor de las alas y sujetando sus extremidades posteriores a la vez.
Pruebas diagnósticas
Se pueden realizar una gran variedad de pruebas diagnósticas, pero se deben tener en cuenta las limitaciones que presentan el tamaño reducido de algunos de los pacientes.
Extracción de sangre
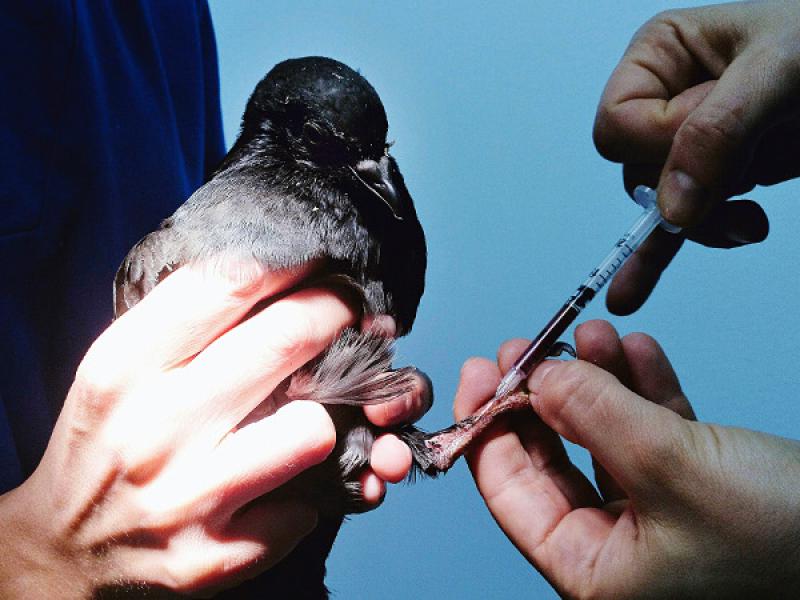
Para la obtención de sangre es muy importante inmovilizar bien al animal para evitar dañar el vaso sanguíneo y producir hematomas.
En aves de gran tamaño, debido a su fuerza, es recomendable la anestesia o sedación para evitar posibles lesiones en el paciente e incluso en el veterinario.
El volumen total de sangre de un ave es de aproximadamente el 10% de su peso corporal y se puede extraer con seguridad en un ave sana hasta el 10% de su volumen total de sangre, es decir, el 1% de su peso vivo. Por ejemplo, un ave de 50 g tiene aproximadamente 5 ml de sangre, se podría extraer hasta 0,5 ml sin efectos negativos.
Para la obtención de sangre se debe tener en cuenta la especie del ave. Para psitácidas y rapaces se extraerá de la vena yugular derecha. Otros puntos de extracción son la vena cubital o la vena metatarsiana medial (Figura 2). Esta última es la mejor opción en palomas (presencia de un plexo venoso que imposibilita el acceso a la vena yugular) gallináceas y aves acuáticas. En el caso de extracción de vena yugular, se inmoviliza al ave en posición lateral y se humedece la zona con alcohol para dejar una zona libre de plumas. Se ejerce presión en la entrada del tórax para que la vena se ingurgite. Una vez extraída la muestra es importante presionar la zona de inyección para evitar la formación de hematomas, sobre todo en especies de pequeño tamaño.
Las agujas empleadas para la extracción de sangre deben ser de 25G y jeringas de 1 o 2 ml. En psitácidas o paseriformes de pequeño tamaño se emplearán agujas de 27G.
Es importante tener preparado todo el material necesario para el procesamiento de la muestra sanguínea para evitar que se coagule o se estropee debido a la imposibilidad de repetir la extracción.
Obtención de muestras (buche, coana, cloaca)
El procedimiento es muy sencillo y se puede realizar sin sedación. En el caso de aves con picos potentes como psitácidas o rapaces es necesario ayudarse de un abrebocas que facilite la obtención de la muestra sin lesionar al paciente ya que podrían partir el hisopo.
Estas muestras son necesarias para la realización de cultivos fúngicos y bacterianos, citologías o pruebas de biología molecular (PCR). La toma de muestras se realiza con hisopos humedecidos previamente con suero estéril.
Para la toma de muestras se deben realizar giros suaves en ambos sentidos siguiendo un orden. Primero la mucosa conjuntival, coana y por último en el interior de la cloaca.
Análisis coprológico
El análisis de heces es un procedimiento muy habitual en medicina aviar que permite detectar la presencia de flagelados, megabacterias, coccidios y huevos de helmintos. Se debe realizar un estudio directo, una tinción Gram y una flotación. La flora de un ave sana granívora o frugívora está compuesta principalmente por bacterias gram positivas. El aumento de bacterias gram negativas y levaduras indica un problema gastrointestinal. En el caso de aves rapaces, al ser carnívoras, el predominio es la flora gram negativa.
Diagnóstico por imagen
Radiografía
Es fundamental una sujeción adecuada para realizar una radiografía de calidad. La inmovilización puede resultar muy estresante para el ave lo que puede empeorar su trastorno, incluso sufrir luxaciones o fracturas. La anestesia con anestesia inhalatoria (isoflurano, sevoflurano) y oxígeno mediante una mascarilla facial es el método más seguro. También se puede simplemente sedar al ave con midazolam intramuscular o intranasal, que permite una relajación del paciente suficiente para la manipulación.
Proyeccion ventrodorsal

- Se coloca al ave en posición decúbito dorsal.
- La quilla y la columna vertebral deben superponerse.
- Las alas se extienden ligeramente hacia los lados.
- Las extremidades posteriores se extienden y se colocan simétricamente.
- El haz primario se centra en el paciente en el punto del esternón (Figura 3).
Proyección laterolateral
- Se coloca al ave en decúbito lateral.
- Las articulaciones de los hombros y la cadera deben superponerse.
- Las alas deben extenderse dorsalmente. Se debe poner unas gasas o algún objeto que mantenga la separación entre las alas para no forzar la posición en exceso.
- Las extremidades posteriores se extienden caudalmente o extender la extremidad posterior dependiente cranealmente (Figura 4).
Proyección craneocaudal
Sirve para evaluar fracturas del ala.
- Se extiende completamente el ala afectada procurando que quede bien apoyada contra la mesa, quedando el cuerpo fuera del haz (Figura 5).


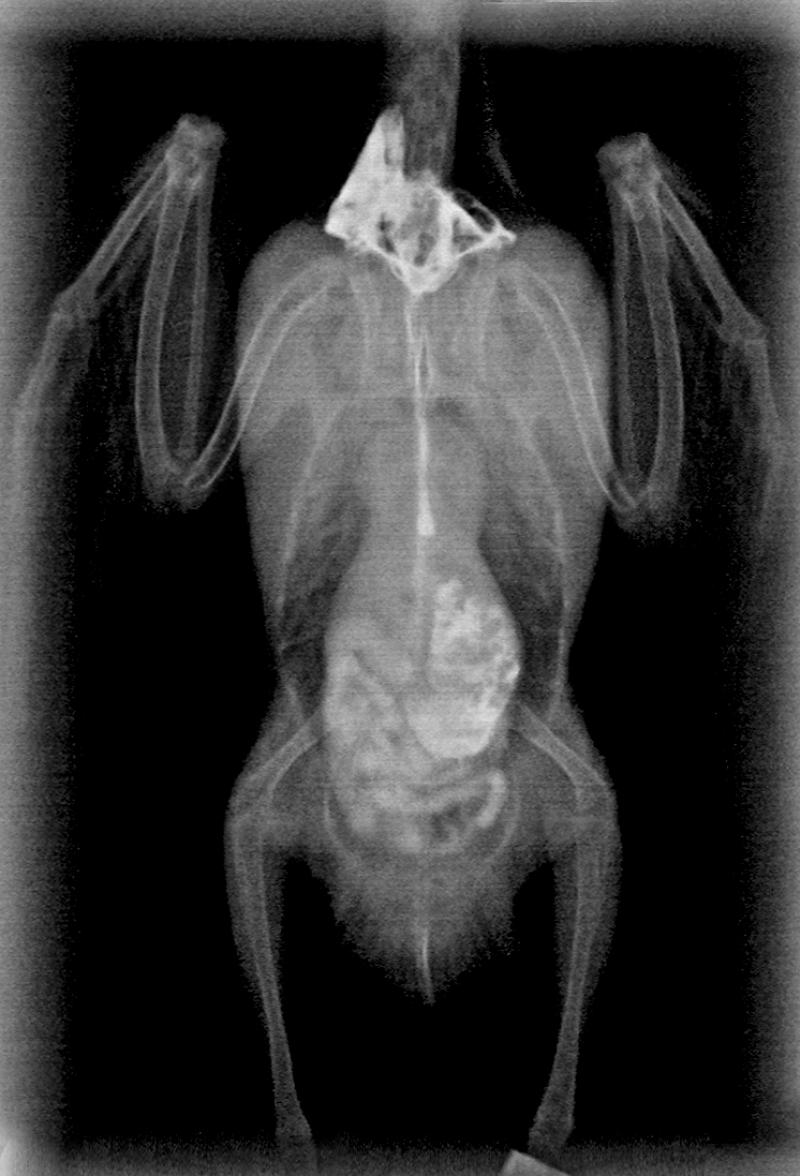
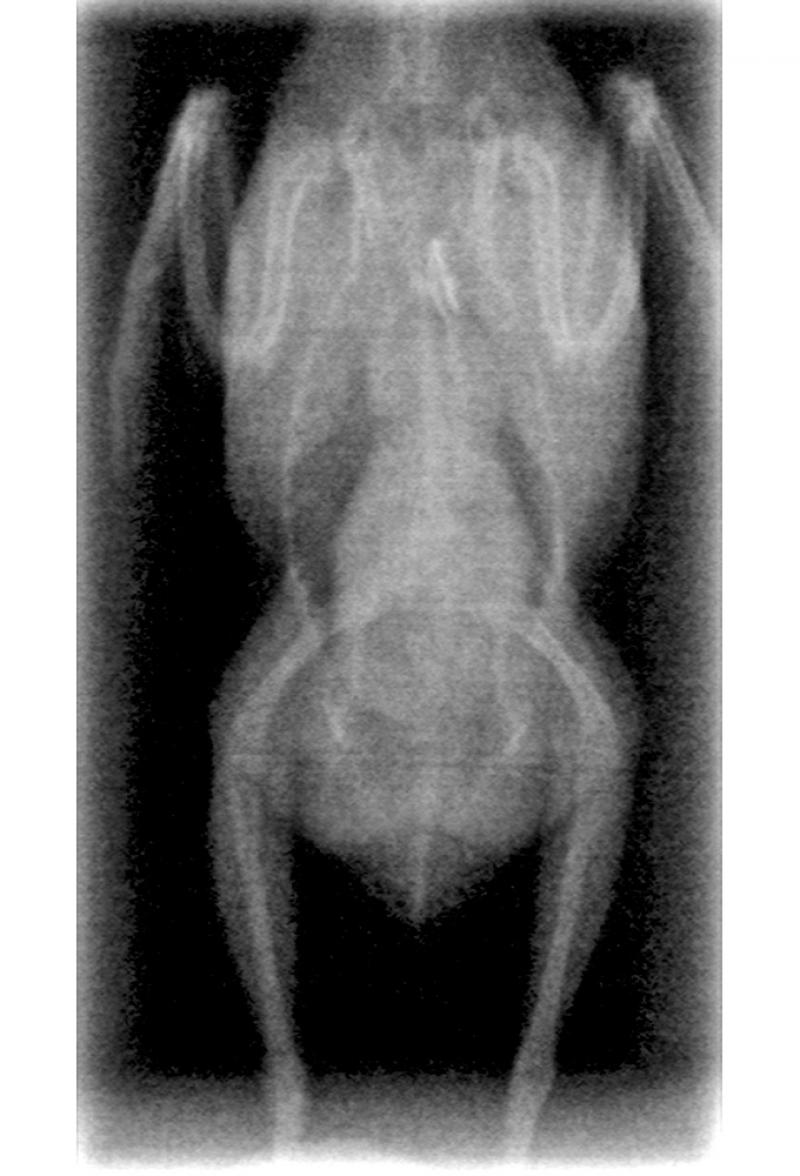
Estudio radiológico de contraste digestivo
Los estudios de contraste se realizan con sulfato de bario y sirve para determinar lo siguiente:
- Tamaño, forma y posición de los órganos.
- Contenidos anormales.
- Contorno de los órganos (Figura 6-7).
Ecografía
La ecografía presenta ciertas limitaciones en aves debido a su pequeño tamaño, presencia de sacos aéreos y escasas ventanas acústicas. Sin embargo, esta técnica está indicada para el diagnóstico de huevos no calcificados, la etiología de la dilatación del abdomen y en aves con sospecha de dilatación del proventrículo.
Vías de administración
Existen varios tipos de vías para la administración de fármacos y en función del tratamiento que se quiera administrar y del tamaño del ave, se debe elegir el más indicado para cada caso.
Vía subcutánea
Se pueden administrar fluidos templados para evitar una bajada de temperatura, en el pliegue inguinal, axilar o interescapular en una dosis de 20ml/kg como máximo. Esta vía no es recomendable en pacientes muy deshidratados ya que no se absorben bien, siendo entonces más adecuada la vía intravenosa o intraósea. (Figura 8)
Vía intramuscular
La medicación inyectada se puede administrar en la musculatura pectoral siempre tratando con volúmenes pequeños y fármacos no irritantes para evitar hematomas y dolor innecesario en el paciente (Figura 9).


Vía intravenosa
La administración de medicación mediante bolos se puede realizar en la vena yugular derecha, cubital o metatarsiana medial.
En la vena yugular la fijación del catéter es más complicada y requiere suturarla a la piel y protegerla con un vendaje.
La vena cubital se encuentra fácilmente en la cara interna del ala. La sujeción requiere de un vendaje en ocho del ala para inmovilizarla. Esta zona está menos indicada debido a la facilidad de formación de hematomas.
La vena metatarsiana medial permite una fijación muy firme. Indicada en aves a partir de 150–200 gramos.
Vía intraósea
Este tipo de cateterización presenta ciertas ventajas respecto al resto: en caso de que el paciente se extraiga el catéter la hemorragia es menor, sujeción más firme y resulta de fácil aplicación en aves de pequeño tamaño.
Una vía de acceso es la tuberosidad dorsal de la epífisis distal del cúbito.
También se puede insertar en la cresta tibial y dirigirse a lo largo del tibiotarso, doblando la rodilla del ave. Mediante radiografía se comprobará la correcta colocación del catéter.
Para la cateterización intraósea se usarán agujas hipodérmicas de 25G o menores o agujas espinales cortas de entre 20 y 22G.
Vía oral

Aunque es tentadora la administración de fármacos a través del agua de bebida o la comida, pocas veces resulta eficaz, ya que hay aves que beben muy poco o no beben. Algunos rechazan la comida o el agua si notan un cambio en el sabor o el olor y en caso de animales en estado grave es posible que no se alimenten por si solos.
Lo más eficaz para la administración de medicación por vía oral o realizar un apoyo nutricional es a través de una sonda que se introduce directamente en el buche. La sonda puede ser rígida metálica o de silicona existiendo varios tamaños y diámetros (Figura 10).
El ave debe mantenerse recta, con la cabeza sujeta con firmeza entre los dedos y con el cuello totalmente extendido. La sonda se introduce en la cavidad oral por el lateral izquierdo dirigiéndola hacia el lateral derecho del cuello, hacia el esófago, y se introduce hasta el buche sin ejercer presión. Se retira la sonda con cuidado para evitar regurgitaciones. Las aves que requieren apoyo nutricional serán sondadas entre 2 y 6 veces al día. Esto y la cantidad de alimento en cada toma variará en función de la especie (Tabla 1).
| Tabla 1. Volumen y frecuencia de alimentación enteral en aves. |
| Especie | Volumen en ml | Frecuencia por día |
| Canario | 0,1 - 0,3 | 6 |
| Periquito | 1 - 2 | 4 |
| Agaporni | 2 - 3 | 4 |
| Ninfa | 3 - 4 | 4 |
| Cotorra | 4 - 7 | 3 - 4 |
| Paloma | 12 - 15 | 3 |
| Yaco, Amazonas | 15 - 20 | 2 - 3 |
| Guacamayo | 35 - 50 | 2 |
Vía aérea
Se utiliza para la administración de fármacos en las vías respiratorias superiores permitiendo que penetre en los sacos aéreos. El nebulizador debe producir partículas muy pequeñas (3µm de diámetro) para que penetre en los sacos aéreos y los pulmones. Con este método se consiguen resultados eficaces en el tratamiento con antibióticos y antifúngicos y cuenta con la ventaja de ser menos estresante para el animal.
Conclusiones
Estos consejos básicos pueden ser útiles para la atención de aves en clínicas, incluso en las no especializadas, o para una debida preparación del paciente para su posterior traslado a una clínica especializada.
Es importante saber cómo manejar a este tipo de animales debido a su reducido tamaño y en muchos casos, a su poca tolerancia frente al manejo y contacto con humanos, por lo que se debe actuar de forma rápida y metódica para evitar un exceso de estrés en el paciente.
Bibliografía
- Jaime Samour; Medicina aviaria, segunda edición; Técnicas clínicas y diagnósticas, Intervenciones médicas; Elsevier Mosby; 2010; Barcelona
- Simon Girling; Veterinary nursing of exotics pets; Avian species, Avian handling and chemical restraint, Avian nutrition; Blackwell publishing; 2003; UK
- Maria-Elisabet Krautwals-Junghanns, Michael Pees, Sven Reese, Thomas Tully; Diagnostic imaging of exotics pets; General principles, radiographic investigation; schlütersche; 2011; Hannover
- Dirk Van den Abeele; Agapornis, segunda edición;Alimentación;Hispano Europea; 2011; Barcelona
- Javier Bermúdez Álvarez, Elisabet Giraldos Gil; Journal report nº 6; Urgencias y cuidados intensivos en medicina aviar; Merial; 2012; Barcelona
- Javier Bermúdez Álvarez, Elisabet Giraldos Gil, Xavier Valls Badia; Journal report nº 7; Procedimientos clínicos en medicina aviar; Merial;2013; Barcelona
 by Multimédica
by Multimédica